La enfermedad del injerto contra el huésped aguda (GvHD) es una complicación potencialmente letal tras el trasplante de células madre hematopoyéticas alogénicas, o de órganos sólidos1. Discriminar la GvHD cutánea de grado IV y el síndrome de Stevens–Johnson/necrólisis epidérmica tóxica (SJS/TEN) es difícil, debido a la similitud de las características clínicas e histopatológicas que comparten ambas entidades2. Sin embargo, la distinción entre los dos diagnósticos es importante, dado que el manejo de dichas condiciones no es igual1,3.
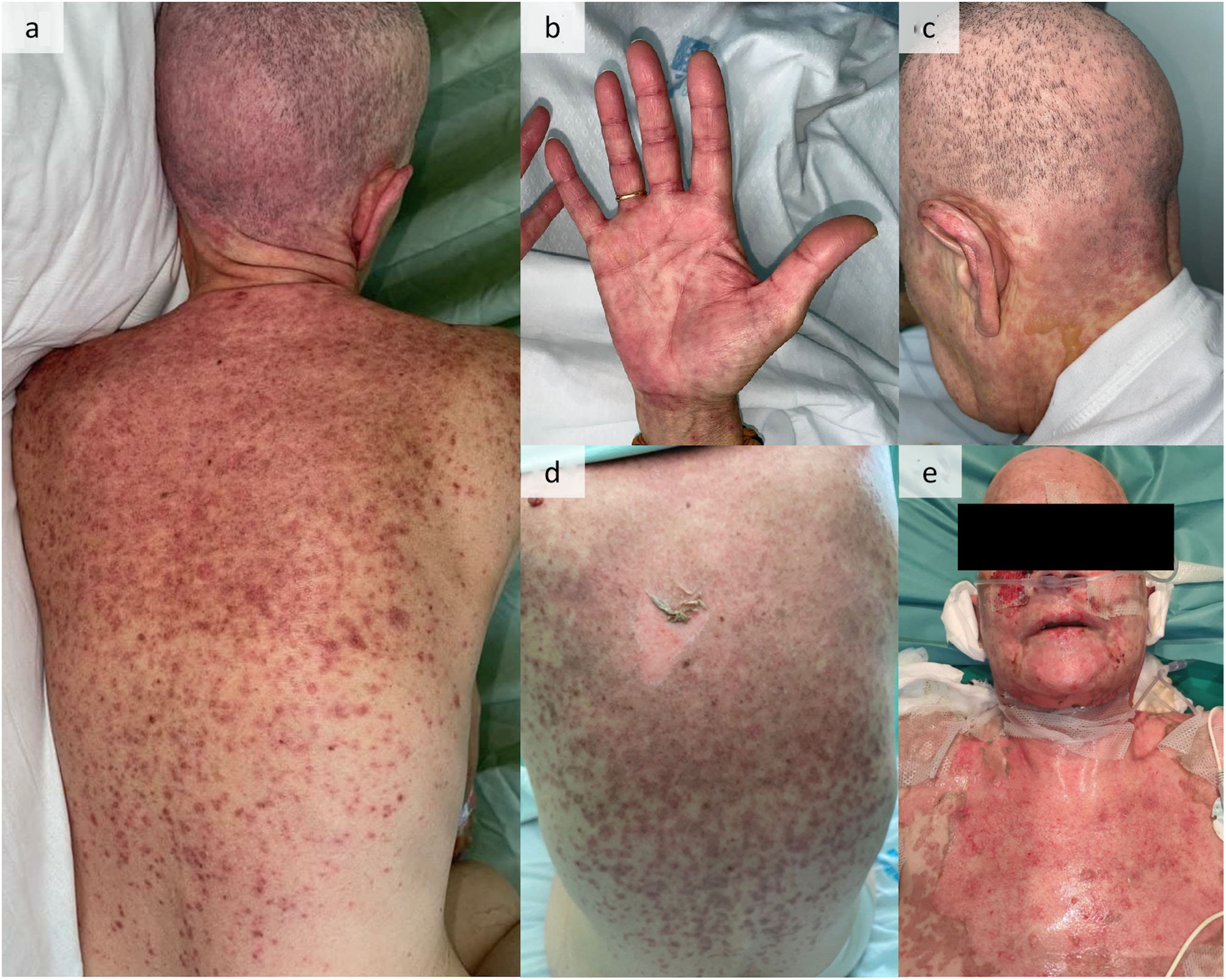
Reportamos el caso de una mujer de 61 años con síndrome mielodisplásico con exceso de blastos tipo 2 que recibió trasplante de células madre alogénico. El día anterior a la intervención, se inició profilaxis de GvHD con ciclosporina A. Se administraron a la paciente múltiples fármacos al ingresar, incluyendo antibióticos, tales como beta-lactamos, trimetoprima/sulfametoxazol y vancomicina. Transcurrido un mes, apareció un sarpullido maculopapular amplio con desprendimiento de la piel y signo de Nikolsky positivo en el tronco, cuero cabelludo (incluyendo la región retroauricular), palmas y plantas (fig. 1). Además, también se vieron afectadas las membranas mucosas orales, genitales y oculares. No existieron signos de compromiso GI ni hepático. Se consideró el diagnóstico clínico de GvDH frente a SJS/TEN. La biopsia cutánea confirmó la presencia de epidermis completamente necrótica desprendida de la dermis, lo cual fue consistente con ambos diagnósticos. Por tanto, la paciente fue ingresada en la UCI, se retiraron los fármacos sospechosos, y se inició tratamiento con prednisona (1mg/kg/12h) e inmunoglobulina (1mg/kg/día). Sin embargo, las lesiones cutáneas no mejoraron transcurridas 48h.
Actualmente no existen biomarcadores establecidos que diagnostiquen fiablemente la GvHD. De acuerdo con un estudio piloto, un panel de biomarcadores compuestos que incluye elafina, factor α-3 regenerador derivado de células de los islotes, y subunidad α del receptor soluble de interleucina-2 pueden ser útiles para diferenciar al inicio los pacientes con GvHD aguda y los que no la padecen, con tasas de especificidad y sensibilidad del 100 y el 55,6%, respectivamente4. Sin embargo, dichos biomarcadores no están disponibles de manera amplia, por lo que no se pudo realizar este análisis.
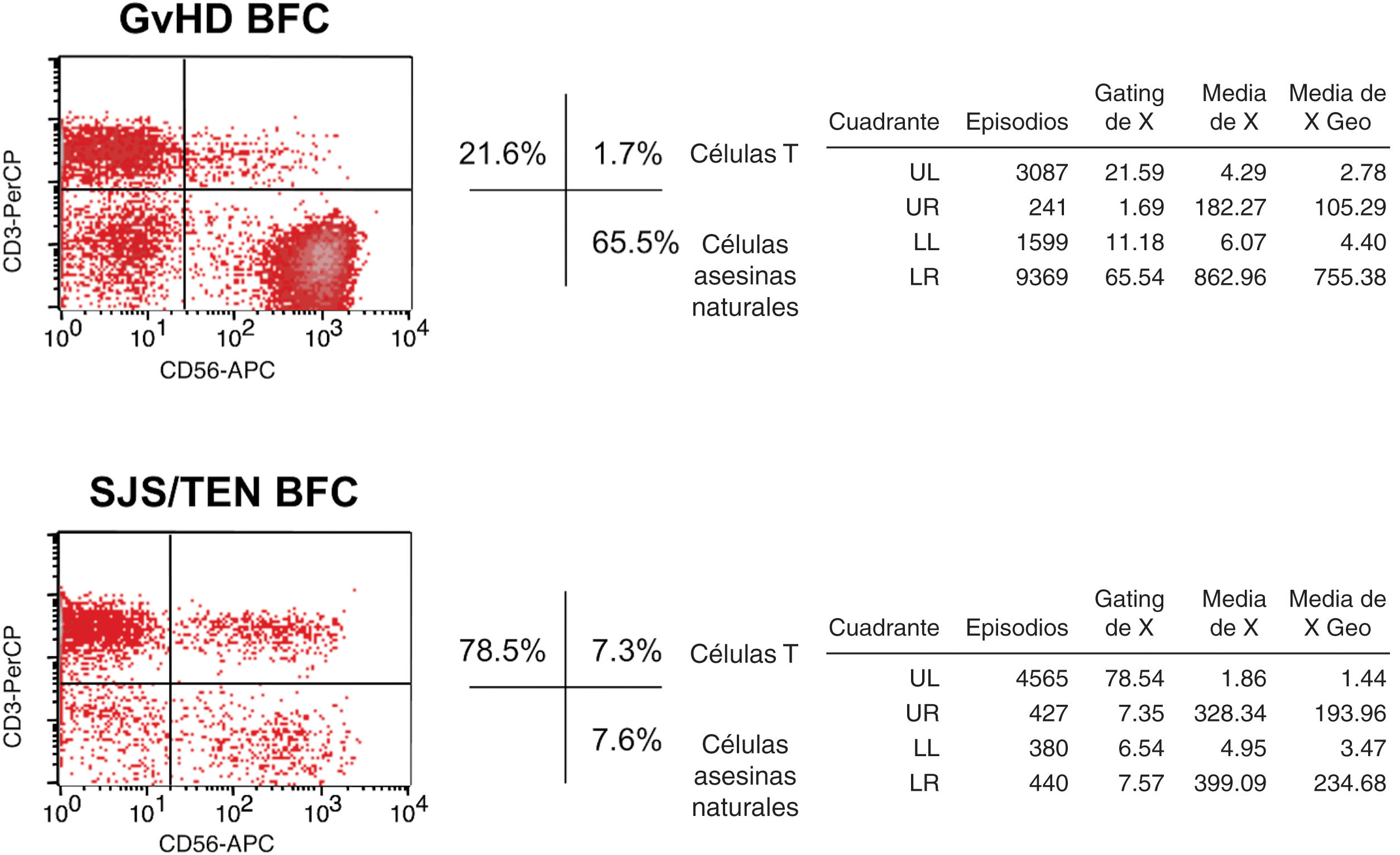
Se realizó el análisis citométrico de flujo de las células del líquido de las ampollas cutáneas (BFC), disponiéndose de los resultados en <1h. El ratio CD8+/CD4+ entre las células T CD3+ T encontrado en nuestro análisis fue de 2:1, representando las células natural killer (NK) (linfocitos CD3-CD56+) alrededor del 65,5% de la población linfocítica total (fig. 2). En nuestro centro, esta evaluación se realiza siempre con BFC disponible de los casos de SJS/TEN, siguiendo los protocolos establecidos por el consorcio PIELenRed, una plataforma interdisciplinar española para la investigación de reacciones cutáneas graves por fármacos5. El ratio medio CD8+/CD4+ en las diez muestras de SJS/TEN analizadas fue de 5,5 (rango, 2,3–12,4), siendo el porcentaje medio de las células NK del 11,5% (rango, 3–18%). A nuestro saber, ningún estudio ha comparado nunca la cantidad de CD8+, CD4+ y células NK contenida en los líquidos de las ampollas de GvHD y SJS/TEN. Sin embargo, conforme a Naik et al., el ratio CD8+/CD4+ en el análisis histopatológico de las biopsias cutáneas de la GvHD de grado IV fue menor en comparación con SJS/TEN (1,78 frente a 7,33)6. Además, Wegner et al. reportaron un incremento del número de células NK en las muestras cutáneas de GvHD con respecto a SJS/TEN7. Por tanto, los estudios inmunohistoquímicos de las biopsias cutáneas y los análisis citométricos de flujo del líquido de las ampollas pueden tener resultados paralelos. De hecho, los hallazgos de nuestro caso respaldan el diagnóstico de GvHD.
Gráficas de puntos que representan el porcentaje de tipos celulares encontrados en el líquido de las ampollas cutáneas mediante análisis citométrico de flujo. El cuadrado LR (CD3− CD56+) ilustra las células NK. El primer diagrama muestra los datos de nuestra paciente, con un 65,5% de células NK. El diagrama inferior es un ejemplo de un caso de SJS/TEN, con sólo un 7,6% de células NK.
GvHD: enfermedad del injerto frente al huésped; BFC: células del líquido de las ampollas; SJS/TEN: síndrome de Stevens–Johnson/necrólisis epidérmica tóxica; Células NK: células asesinas naturales; UL: superior-izquierdo; UR: superior-derecho; LL: inferior-izquierdo; LR: inferior-derecho.
Por último, teniendo en cuenta los antecedentes y signos clínicos y datos de la citometría de flujo de la paciente, se consideró más probable el diagnóstico de GvHD, iniciándose tratamiento focalizado con ruxolitinib y fotoféresis, mejorando rápidamente las lesiones cutáneas. Lamentablemente, la paciente desarrolló complicaciones infecciosas y hemorrágicas conducentes a su muerte el día +57.
Uno de los motivos más importantes para la realización de análisis citométrico de flujo del BFC en lugar de una única biopsia convencional es contribuir al diagnóstico diferencial de dos entidades, cuyos hallazgos histopatológicos se solapan a menudo, originando un dilema diagnóstico2,6,7. Además, debemos destacar que los resultados de esta prueba pueden obtenerse muy rápidamente: en <1h en nuestro centro. Ello puede ser esencial para tomar de decisiones e iniciar rápidamente el tratamiento.
Aunque el análisis citométrico de flujo del BFC no es una técnica validada actualmente, es probable que los resultados discurran en paralelo a los encontrados en los estudios inmunohistoquímicos. En el futuro, esta prueba puede ser una herramienta rápida y segura para diferenciar la GvHD de grado IV y SJS/TEN, lo cual merece la investigación futura.
FinanciaciónEste estudio fue respaldado por una beca de Instituto de Salud Carlos III, Madrid, España (Ministerio de Economía y Competitividad de España)FIS PI18/00718 (y cofinanciado por FEDER) TB.
Conflicto de interesesLos autores declaran la ausencia de conflicto de intereses.