El antimoniato de meglumina (AM)(Glucantime®, Sanofi-Aventis, S.A., España) es el tratamiento de primera elección en la leishmaniasis cutánea (LC)1–4. Se utiliza tanto por vía intramuscular (i.m.) como intralesional (i.l.) y se considera un medicamento eficaz y seguro. La vía i.l. se utiliza en lesiones únicas menores de 3-4 cm y la vía i.m. se reserva para las lesiones múltiples, complicadas o con datos de diseminación linfática1,3,4. La dosis recomendada para la vía i.m. es 10-20 mg/kg/d de antimonio (75 mg/kg/d de AM) en ciclos de 10 días3,5–7. Por vía i.l. se utilizan dosis mucho más bajas de entre 0,2 y 1 mL/lesión en pautas variables, cada 0,5-1-2 semanas1,3,8. Es bien conocido que su uso por vía sistémica puede producir alteraciones electrocardiográficas3.
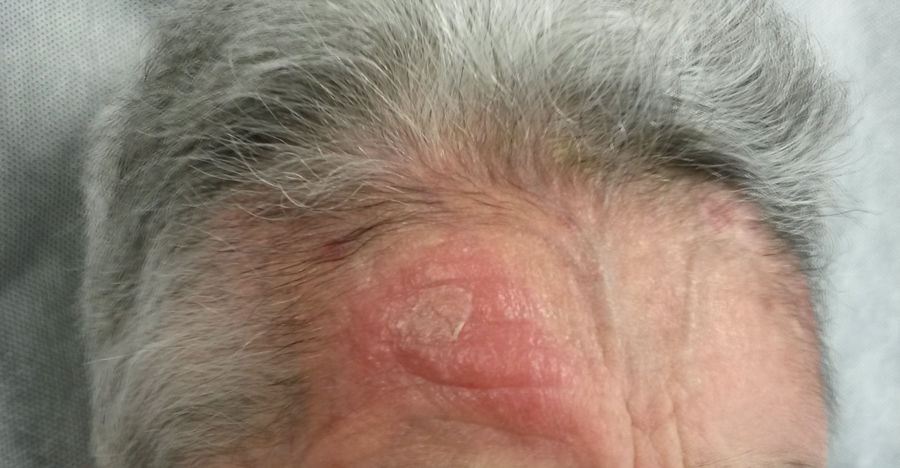
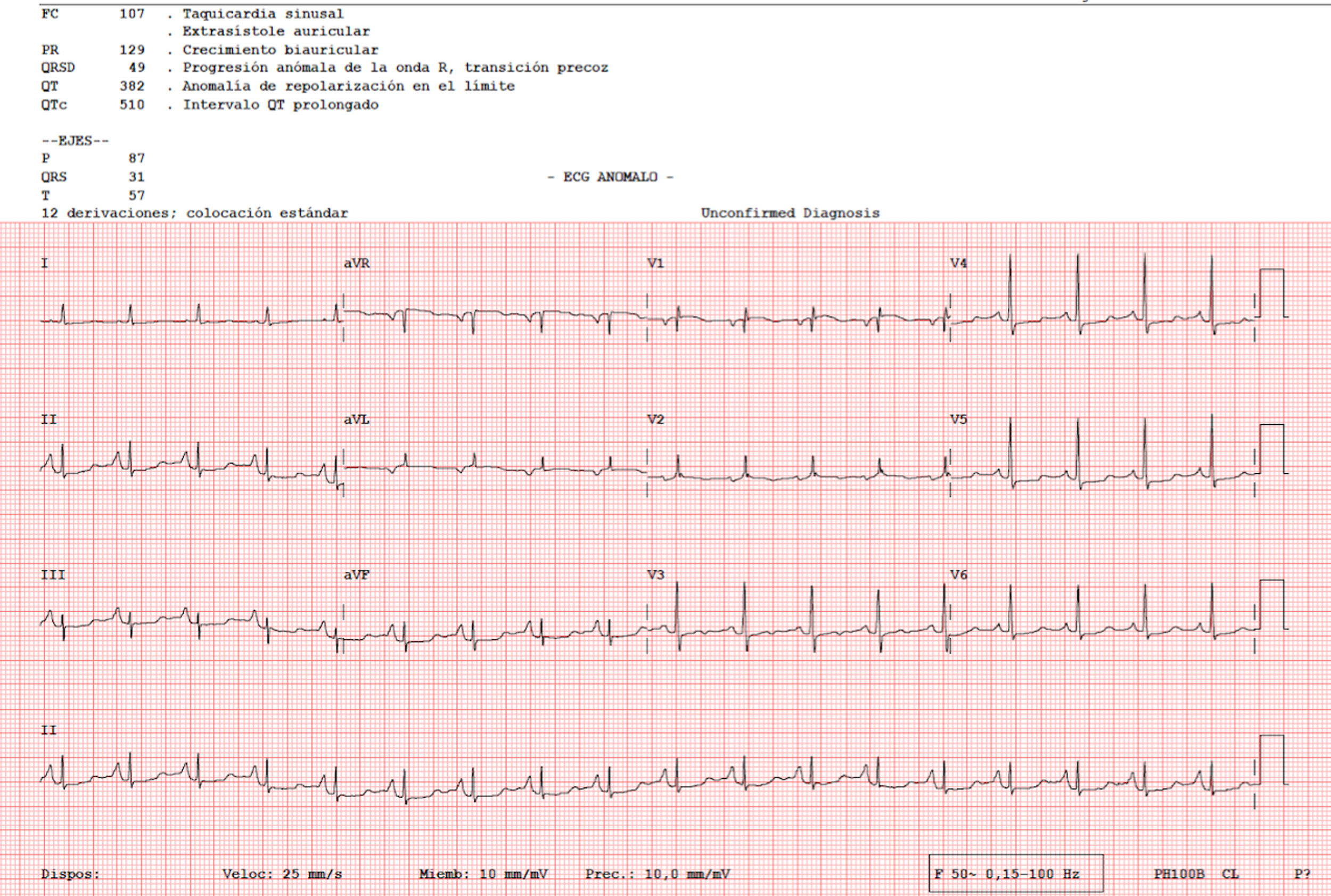
Una mujer de 82 años consultó por una placa eritemato-edematosa e infiltrada de 3,5 cm, sin ulceración ni costra, localizada en la frente, persistente y de meses de evolución (fig. 1). Como antecedentes, la paciente padecía una artritis reumatoide, en tratamiento con etanercept y prednisona, osteoporosis, escoliosis, anemia leve, dermatitis seborreica, que trataba con corticoides tópicos, y una delgadez severa (IMC 15 kg/m2). Una biopsia cutánea de la lesión objetivó una dermatitis granulomatosa con la presencia de amastigotes, por lo que se diagnosticó de leishmaniasis. La paciente no había viajado fuera de España. Se decidió tratar con itraconazol oral durante seis semanas, con una buena tolerancia clínica y analítica, pero sin mejoría. Una semana después se administró AM intralesional, con una dosis de 0,6-1 mL en los días 0, 7 y 21, previa administración de lidocaína/pilocaína. Desde el momento del diagnóstico se retiraron los corticoides tópicos y etanercept. En un electrocardiograma (ECG) realizado tras la tercera dosis se detectó una prolongación del intervalo QT (QTc 510 ms), un descenso no significativo del segmento ST y un crecimiento de la onda P (fig. 2), por lo que se suspendió el tratamiento. La paciente no refería síncopes. Un control del ECG, realizado por cardiología tres semanas después, estaba en el rango de la normalidad. El cuadro cutáneo se resolvió con las tres dosis ya administradas.
Se han descrito múltiples efectos adversos del AM usado de forma sistémica: mialgias, artralgias, alteraciones gastrointestinales (náuseas, dolor abdominal), cefalea, elevación de enzimas hepáticas y pancreáticas, leucopenia, alteraciones del ECG y arritmias graves3,5. El uso intralesional de AM, al utilizar dosis más bajas y espaciadas, produce unos efectos secundarios leves y generalmente locales (dolor, edema, prurito y eritema transitorio en la zona de inyección)2,4,5,7–10. Se han descrito por esta vía también efectos adversos sistémicos como náuseas, vómitos, disnea, mareo, urticaria, mialgias, artralgias, cefalea e incluso shock anafiláctico10. Con respecto a la cardiotoxicidad por antimoniales sistémicos, se trata de un efecto adverso bien conocido que en la ficha técnica se indica que puede aparecer cuando se utilizan a dosis altas y durante periodos prolongados. Puede producir una prolongación del intervalo QT en el ECG, con el desarrollo potencial de una arritmia grave, que puede tener un desenlace mortal. Los cambios en el ECG generalmente son dosis-dependiente y habitualmente reversibles. En la mayoría de los casos, las alteraciones como la inversión de la onda T y la prolongación del intervalo QT preceden a la aparición de arritmias graves y alertan de su posible aparición. Se recomienda la realización de un ECG basal y de seguimiento cada 7-10 días y suspender el tratamiento si el intervalo QTc > 450 ms5,6,9. Ribeiro et al. demostraron la presencia de cambios en el ECG (prolongación del QT) también con la terapia sistémica i.m. a dosis bajas (10 mg/kg) y en tratamientos cortos (10 días) con implicaciones potenciales graves, por lo que sugieren monitorizar a estos pacientes mediante un ECG6. Con respecto a la terapia intralesional, un estudio clínico brasileño reciente de 53 pacientes, a los que se realizó ECG semanalmente, encontró una prolongación del intervalo QT sin repercusión clínica en el 25% de los casos10. Este efecto se encontró asociado al tabaquismo10. Sin embargo, se trata de un efecto adverso poco documentado al no realizarse habitualmente ECG en el seguimiento clínico de la terapia intralesional. En este ensayo se utilizaban dosis semanales muy superiores a las utilizadas en nuestro caso. El hecho de haber detectado esta alteración en una paciente sin criterios de riesgo cardiológico en tratamiento con AM intralesional a dosis bajas nos hace reflexionar sobre la conveniencia de monitorizar el ECG también en estos pacientes.
En conclusión, antes de iniciar la terapia con antimoniales en cualquier modalidad, se debe preguntar por antecedentes personales de enfermedad cardiaca (infarto, bradicardia, palpitaciones o síncopes...) y de muerte súbita en familiares. Se deben vigilar y corregir factores que puedan favorecen la prolongación del QT, tales como desequilibrios electrolíticos, y evitar su asociación con otros fármacos que también puedan prolongar el QT (www.qtdrugs.org) (antiarrítmicos, antidepresivos tricíclicos, eritromicina, tetracicilinas, trimetropina/sulfametoxazol, antipsicóticos...)6. Parece recomendable monitorizar a los pacientes de alto riesgo y vigilar la aparición de prolongación del intervalo QT.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.