La alopecia es un efecto generalmente transitorio del tratamiento con citostáticos, generador de una importante repercusión emocional en el tratamiento contra el cáncer, muchas veces responsable de rechazo de distintas maniobras terapéuticas. Si bien en la mayoría de los casos es reversible, esto puede involucrar meses, amplificando el impacto, sobre todo psicológico, de los tratamientos. En los últimos años han surgido estrategias con gorras de frío, o «scalp cooling system» que buscan prevenir, o al menos limitar, este efecto adverso, con resultados que se han mostrado promisorios. El objetivo de esta revisión es analizar la evidencia con la que contamos respecto a los efectos y eficacia de este tipo de técnicas que han empezado a inmiscuirse dentro de nuestra práctica clínica diaria.
Chemotherapy-induced hair loss in cancer is usually temporary but can take a significant emotional toll on patients and lead to treatment refusal in many cases. Although hair loss is usually reversible, regrowth can take months, causing greater psychological distress. Recent years have seen the emergence of cold caps, or scalp cooling systems, designed to prevent or at least reduce chemotherapy-induced hair loss. The results to date are encouraging. We review the evidence on the effects and effectiveness of these systems, which are making their way into routine clinical practice.
La alopecia genera importantes efectos psicosociales en las personas que reciben tratamiento con quimioterapia. Se estima que en un 47-58% es de los aspectos que más preocupa respecto al tratamiento, y que hasta en un 8% influye en la elección del mismo1. Si bien no todos los tratamientos son alopeciantes, y el riesgo varía con los distintos agentes, la alopecia suele comenzar a las 1-2 semanas del inicio, completándose en el primer-segundo mes2. La mayoría de las veces es reversible, pero no en todos los casos, y muchas veces el pelo presenta cambios en su forma, color, cantidad3. Si bien en los últimos años se han estudiado e implementado algunas estrategias, como el uso de gorras de frío o «scalp cooling system», en la práctica diaria aún hay dudas respecto a su eficacia o incluso se plantea la posibilidad de que se generen efectos nocivos con su uso. El objetivo de esta revisión es analizar la evidencia con la que contamos respecto a los efectos, eficacia y seguridad de este tipo de técnicas.
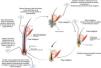
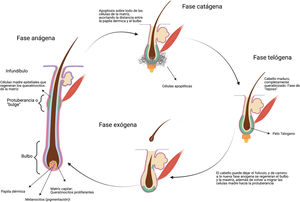
Quimioterapia y alopeciaEl pelo es un apéndice cutáneo con múltiples funciones (termorregulación, protección)4. Cada cabello está compuesto por 3 capas (médula, corteza y cutícula), siendo el producto del folículo piloso. La base del folículo piloso se compone por el bulbo capilar, integrado por la papila dérmica y la matriz capilar. La papila dérmica controla el número de queratinocitos de la matriz, que es lo que determina el tamaño de la fibra capilar5. El daño en esta porción del pelo genera alopecias no cicatrizales. En la matriz de la protuberancia o «bulge» del folículo piloso (en la porción media del folículo) residen las células madre epiteliales, y el daño de esta estructura puede generar alopecia irreversible (fig. 1).
Después de formados, los folículos pilosos se someten a ciclos de vida caracterizados por periodos de crecimiento (anágeno), regresión (catágeno) y descanso (telógeno) tras lo cual el cabello se desprende (exógeno). El 80-90% de los cabellos en un momento dado se encuentran en periodo anágeno5. Durante este, las células de la matriz mitóticamente activas en el bulbo piloso se diferencian y dividen, lo que resulta en una tasa de crecimiento del cabello de aproximadamente 0,35mm por día en el caso de cuero cabelludo, durando el periodo de 2 a 6 años. El 1 al 3% está en catágeno, la fase de involución, donde el crecimiento se detiene y el folículo regresa con programas de apoptosis. Aproximadamente del 5 al 10% de los folículos restantes están en telógeno, durante el cual se detiene toda la actividad mitótica y el cabello adquiere un aspecto característico de la fase, completamente queratinizado, listo para desprenderse6 (fig. 1).
El término alopecia se refiere a la ausencia parcial o total de cabello en cualquier área de crecimiento normal del cabello. La alopecia inducida por quimioterapia es más prominente en el cuero cabelludo, con predilección por las áreas con baja densidad total de cabello, en particular la corona y las áreas frontales, donde la recuperación del cabello es más lenta7.
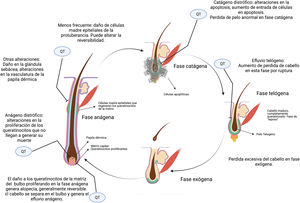
La quimioterapia citotóxica genera muerte por apoptosis en las células que se encuentran en división mitótica, y esto incluye a las células queratinocíticas proliferantes del bulbo piloso2. Esto genera alopecia por dos mecanismos fundamentalmente (fig. 2).
Si la proliferación de los queratinocitos de la matriz del folículo piloso se inhibe severamente, el cabello puede separarse en el bulbo y desprenderse, un proceso denominado efluvio anágeno, que representa la pérdida abrupta del pelo que está en fase de crecimiento. Menos frecuentemente se da un efluvio anágeno distrófico, en el cual la alopecia es menor, y lo que se da fundamentalmente es un retraso en el crecimiento del cabello por retraso en la proliferación de los queratinocitos2,8 (fig. 2).
Por otra parte, pueden darse constricciones que resulten en rotura del tallo del cabello en el orificio folicular durante la fase de reposo o telógeno, conocido como efluvio telógeno2. El daño no letal en los queratinocitos proliferantes puede generar respuestas proliferativas como mecanismo de defensa en algunos sectores, lo cual explica la alopecia «parcheada» o desigual que puede verse en algunos casos.
La reversibilidad de la alopecia va a depender del grado de daño de las células madre de la protuberancia o «bulge». Dado que la mayoría se encuentra en estado quiescente mientras se aplica el tratamiento, las mismas no se ven afectadas en su totalidad, por lo que la alopecia inducida por quimioterapia suele ser reversible. El folículo piloso reanuda el ciclo normal con los queratinocitos supervivientes después de la interrupción del tratamiento, y el crecimiento del cabello se hace evidente en tres a seis meses. Este cabello frecuentemente tiene características diferentes al original. El 65% experimenta un efecto de encanecimiento, rizado o alisado, probablemente debido a los efectos diferenciales de la quimioterapia sobre los melanocitos del folículo y el epitelio de la vaina radicular interna, y estos efectos a menudo se resuelven con el tiempo9. Se han reportado algunas alopecias prolongadas e incluso irreversibles con algunos agentes como taxanos10,11.
El riesgo de alopecia inducido por los distintos agentes de quimioterapia es variable, y muchas veces depende del esquema y la dosis (tabla 1).
Asociación entre distintos agentes de quimioterapia y riesgo de alopecia
| Tabla 1 | Severa | Moderada | Leve |
|---|---|---|---|
| Frecuente | - Doxorrubicina> 40mg/m2 (100%)- Epirrubicina> 30 mg/m2 (70-96%)- Paclitaxel cada 3 semanas (83-93%)- Docetaxel (76-85%)- Ifosfamida (1-83%)- Ciclofosfamida iv (>300m/m2) (40-60%)- Etopósido (8-66%) | - Metrotexate (1-10%)- Carboplatino AUC 5-6 (2-3%)- Paclitaxel semanal (10-15%) | - Bleomicina |
| Infrecuente | - Vincristina- Vinblastina | - Oxaliplatino | - Fluoracilo- Capecitabine- Carboplatino semanal- Cisplatino |
Fuente: Chon et al.7, http://www.bccancer.bc.ca/drug-database-site.
Varios estudios han evaluado intervenciones farmacológicas con el intento de prevenir el daño por quimioterapia del folículo piloso, pero hasta ahora ninguna ha sido aprobada por las agencias reguladoras. El minoxidil tópico es conocido por su uso para la alopecia androgénica, pero estudios que lo han evaluado en prevención de alopecia por quimioterapia aplicando solución al 2% 2 veces al día no mostró una prevención de la alopecia grave12. Otros fármacos como finasteride, espironolactona, calcitriol tópico no han mostrado tampoco resultados satisfactorios, además de que es preocupante su seguridad, por elevar el nivel de estrógenos en muchos casos (que como sabemos es perjudicial para las células del cáncer de mama, donde más se utilizan estas estrategias)13.
Prevención de la alopecia con gorras de fríoAnte la ausencia de estrategias farmacológicas, se intentaron diseñar enfoques terapéuticos con la intención de disminuir físicamente la cantidad de fármaco administrado al bulbo piloso. Uno de estos, fue la generación de hipotermia del cuero cabelludo, a través de distintas estrategias.
El mecanismo de acción de la hipotermia del cuero cabelludo incluye la vasoconstricción local de los vasos sanguíneos, lo que resulta en una reducción de la llegada de los citostáticos al cuero cabelludo, una disminución de la tasa metabólica de las células del folículo y por ende una menor absorción celular de las drogas14.
Se han utilizado distintas modalidades de terapia de frío o hipotermia de cuero cabelludo en varios escenarios, y ante varios esquemas de quimioterapia. El uso de este sistema de gorras de frío se recomienda tanto en las guías de la NCCN con un nivel de evidencia IIA15 como en las nuevas guías de manejo de efectos adversos cutáneos de ESMO, con un nivel de evidencia IIB16.
Hay dos dispositivos automáticos aprobados por la FDA para tratamiento con PQT en tumores sólidos, en base a ensayos clínicos prospectivos en pacientes con cáncer de mama. La eficacia es variable y depende del tipo y la intensidad de la quimioterapia, con una conservación del cabello significativamente menor en pacientes que reciben antraciclinas en comparación con los regímenes no basados en antraciclinas.
Los dispositivos automáticos regulados utilizan una unidad de enfriamiento portátil que hace circular un refrigerante para que la temperatura se mantenga dentro de un rango estrecho. Por otro lado, existen otros dispositivos no regulados (ejemplo gorras de gel congeladas) que se postula que alcanzarían temperaturas mayores que los dispositivos automáticos, y se cambian a medida que pierden frío una vez colocadas.
Independientemente del dispositivo específico que se use, se debe colocar aproximadamente 30-45 min antes de que comience la infusión de quimioterapia para permitir el enfriamiento gradual del cuero cabelludo. El enfriamiento se mantiene durante un período de tiempo después del final de la infusión, generalmente al menos 90 min, dependiendo del esquema y la droga16.
Varios estudios prospectivos han evaluado dispositivos automáticos de hipotermia del cuero cabelludo en mujeres con cáncer de mama en estadios precoces. No contamos con estudios prospectivos que evalúen la eficacia de los dispositivos no automáticos, o en otros tipos tumorales.
En un estudio de cohorte prospectivo multicéntrico publicado en JAMA 201717, se compararon 101 pacientes con cáncer de mama precoz que recibieron quimioterapia basada en taxanos sin antraciclina que usaron el dispositivo DigniCap® con 16 controles. La alopecia menor al 50% fue del 66,3% en el grupo de intervención en comparación con ninguno del grupo control (p <0,001). Además mejoró la percepción de la pérdida del cabello, sentirse molesto por la pérdida del cabello y sentirse menos atractivo físicamente. La toxicidad primaria fue cefalea leve, y tres pacientes dejaron de utilizar el dispositivo por sensación de frío.
Un segundo estudio randomizado publicado también en JAMA en 2017 (the SCALP trial18) aleatorizó 182 pacientes 2 a 1 para el uso del dispositivo Paxman® o nada durante la quimioterapia para cáncer de mama. El 36% recibió quimioterapia basada en antraciclina, mientras que el resto recibió un taxano monodroga o en combinación con carboplatino, ciclofosfamida, pertuzumab y/o trastuzumab. La tasa de éxito se definió como pérdida de cabello menor al 50%, de que no requiere una peluca, y fue determinado por un médico que desconocía la randomización, después de finalizada la quimioterapia. El dispositivo se consideró como exitoso en el 50,5% de los pacientes y en 0% en el grupo control (p=0,0061). Los eventos adversos fueron todos grado 1 y 2, principalmente cefalea y sensación de frío. Un análisis exploratorio post hoc indicó que solo el 16% de los pacientes que recibieron quimioterapia basada en antraciclina tuvieron eficacia, en comparación con el 59% de los que recibieron taxanos, aunque los intervalos de confianza fueron muy amplios. Se considera por tanto, generador de hipótesis que con antracíclicos la eficacia es menor. Un estudio japonés utilizó el mismo dispositivo y reportó resultados similares19.
El estudio COOLHAIR también evaluó DigniCap® en 79 pacientes con cáncer de mama precoz20. Se observó preservación del cabello en el 39,3% de los pacientes en el grupo que utilizó gorros fríos frente al 0% en el grupo control (p <0,001). El uso de peluca fue significativamente menos frecuente (40,7% vs. 95,5%, p<0,001). En 2019 se publicó un cuarto estudio21, que evaluó el dispositivo DigniCap® en 139 pacientes con cáncer de mama precoz que recibieron quimioterapia. La mayoría (95%) recibió al menos cuatro ciclos de quimioterapia basada en antraciclina, y luego taxanos secuenciales. Cuando se pudo utilizar el dispositivo en todos los ciclos de quimioterapia, 43% perdió menos del 50% de su cabello. Nueve pacientes interrumpieron el tratamiento por eventos adversos. En 202022 se evaluó DigniCap® en 135 pacientes con cáncer de mama precoz (adyuvante en un 74%). La tasa de éxito en la prevención de la alopecia fue del 60% (81/135) a las 3 semanas de finalizado el tratamiento. Se informaron tasas de éxito más altas con los regímenes sin antraciclina (taxano más ciclofosfamida) (71%) en comparación con los regímenes con antraciclina (54%; P <0,001).
Un metaanálisis en 2015 incluyó tres ensayos randomizados previos23, concluyó que la hipotermia del cuero cabelludo fue la única intervención que redujo significativamente el riesgo de alopecia inducida por quimioterapia (RR de 0,38, IC 95% 0,32- 0,45). No se informaron eventos adversos significativos asociados, aunque los estudios no siempre realizaron un seguimiento de la toxicidad a largo plazo. Un análisis de subgrupos sugirió un grado similar de eficacia para la hipotermia independientemente del tipo de tumor, pero la mayoría de los pacientes incluidos tenían cáncer de mama y los datos de los pacientes sin este tumor no estaban detallados. Otro metaanálisis en 201824 con un total de 654 pacientes (66% cáncer de mama) concluyó, con calidad de evidencia moderada, que las gorras frías pueden prevenir la alopecia de forma significativa (mayor al 50%) (RR de 0,57 IC 95% 0,45-0,72) en comparación con el control (I2=11%; P<0,00001).
Los eventos adversos de la hipotermia del cuero cabelludo son generalmente leves e incluyen molestias para el paciente como sensación de frío, dolor de cabeza, náuseas, piel seca y claustrofobia23–25.
Se describe en la literatura preocupación sobre la posibilidad de aumentar el riesgo de metástasis en el cuero cabelludo con el uso de estos dispositivos. La incidencia de estas metástasis se ha estudiado mejor en el cáncer de mama, donde el riesgo ha mostrado ser muy bajo. Los estudios que mencionamos no han mostrado asociación significativa. En una revisión sistemática y metaanálisis en 201725, dentro de las 1959 pacientes que usaron gorros fríos, con un seguimiento de 43,1 meses mostraron una tasa de incidencia de metástasis del cuero cabelludo de 0,61% (IC 95% 0,32-1,1) versus 0,41% en el grupo control (1238 pacientes) (IC 95% 0,13-0,94); p=0,43. En el estudio prospectivo DigniCap descrito anteriormente, ningún paciente ha desarrollado metástasis en el cuero cabelludo en una mediana de seguimiento de cuatro años17.
Como hemos analizado, la principal evidencia proviene de pacientes con cáncer de mama tratadas con antraciclinas y taxanos en estadios localizados, pero se ha trasladado a otros regímenes de quimioterapia y otros tumores, además de pacientes con tratamientos paliativos, en quienes la alopecia afecta de forma importante la calidad de vida3.
Es importante tener en cuenta que no es una estrategia para todos los casos. No se recomienda en pacientes pediátricos, dado que no ha sido evaluado en dicha población. No se plantean como buenos candidatos los que reciben infusiones continuas por 24h (no se ha evaluado) o más, así como tampoco aquellos que reciben radioterapia encefálica26. Estaría contraindicado en pacientes con enfermedad por crioaglutininas, crioglobulinemia y distrofia postraumática por frío, así como también no se recomienda su uso en pacientes con neoplasias hematológicas, incluidas leucemia y algunas formas de linfoma, y en aquellos que se someten a un trasplante de médula ósea o de células madre con dosis mielosupresoras de quimioterapia y/o radioterapia. Es importante considerar que no hay datos de seguridad respecto a las metástasis en cuero cabelludo en algunas patologías que tienen elevada tendencia las metástasis cutáneas (como algunos tumores de pulmón o de piel)27.
Recientemente ambos dispositivos aprobados (DigniCap® y Paxman®) se encuentran disponibles en varios centros oncológicos de Europa, incluyendo España.
ConclusionesEl uso de gorras de frío automatizadas es una opción aprobada y generalmente bien tolerada para prevenir la alopecia, fundamentalmente en el tratamiento adyuvante para el cáncer de mama, aunque se ha extrapolado a otros tumores y escenarios con ciertas salvedades. No hay estudios prospectivos con otro tipo de gorros fríos (ejemplo de gel), por lo que se desconoce si pueden extrapolarse los resultados. En regímenes con antraciclinas las tasas de éxito son más bajas. La técnica no parece aumentar el riesgo de metástasis cutáneas en el cuero cabelludo en pacientes con cáncer de mama en estadio temprano, ni parece comprometer los resultados oncológicos (aunque hace falta mayor seguimiento).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.