El desarrollo del actual arsenal terapéutico fundamentado en las terapias biológicas, la experiencia acumulada en ensayos clínicos y en práctica clínica real y los nuevos conocimientos sobre la patogénesis en psoriasis permiten posibilidades de individualización y hace adecuada una actualización de las recomendaciones en cuanto a la gestión del riesgo en pacientes tratados con estos fármacos.
El Grupo de Psoriasis de la Academia Española de Dermatología y Venereología (GPS) trabaja desde su creación en la actualización continua de las recomendaciones para el tratamiento de la psoriasis, basándose en la mejor evidencia disponible e incorporando propuestas orientadas desde y para la práctica clínica.
MetodologíaPara la elaboración del consenso se siguió la metodología de grupos nominales, con ayuda de una scoping review. Tras designar a un coordinador, se seleccionó un grupo de trabajo constituido por integrantes del GPS con base en su experiencia y conocimiento en psoriasis. El coordinador definió los objetivos y puntos clave del documento y con ayuda de un documentalista se realizó una scoping review incluyendo datos de Medline, Embase y Cochrane Library (hasta enero del 2021). Se seleccionaron revisiones sistemáticas, metaanálisis y ensayos clínicos no incluidos en las mismas, guías de práctica clínica y documentos de consenso nacionales e internacionales, así como estudios de calidad en vida real. El coordinador generó las recomendaciones preliminares que fueron evaluadas y modificadas en una reunión de grupo nominal. Tras varios procesos de revisión, que incluyeron la revisión externa por parte de los miembros del GPS, se redactó el documento definitivo.
ResultadosSe presentan en este documento recomendaciones prácticas y actualizadas relativas a la toma de decisiones terapéuticas con el uso de las terapias biológicas en pacientes que pertenecen a poblaciones especiales (ancianos, edad pediátrica, mujeres embarazadas o con deseo gestacional) o que presentan comorbilidades (obesidad, artritis psoriásica, enfermedad inflamatoria intestinal, depresión, cáncer, síndrome metabólico, diabetes, hígado graso no alcohólico, enfermedad cardiovascular, insuficiencia cardiaca y enfermedad renal o neurológica). Se aborda también la gestión del riesgo con el uso de terapias biológicas, analizando los riesgos potenciales previos al tratamiento y durante el mismo, así como los acontecimientos adversos más frecuentes, todo ello desde una orientación práctica y adaptada a la práctica clínica habitual.
Since its inception, the Psoriasis Group (GPs) of the Spanish Academy of Dermatology and Venereology (AEDV) has worked to continuously update recommendations for the treatment of psoriasis based on the best available evidence and incorporating proposals arising from and aimed at clinical practice. An updated GPs consensus document on the treatment of moderate to severe psoriasis was needed because of changes in the treatment paradigm and the approval in recent years of a large number of new biologic agents.
MethodologyThe consensus document was developed using the nominal group technique complemented by a scoping review. First, a designated coordinator selected a group of GPs members for the panel based on their experience and knowledge of psoriasis. The coordinator defined the objectives and key points for the document and, with the help of a documentalist, conducted a scoping review of articles in Medline, Embase, and the Cochrane Library up to January 2021. The review included systematic reviews and meta-analyses as well as clinical trials not included in those studies and high-quality real-world studies. National and international clinical practice guidelines and consensus documents on the management of moderate to severe psoriasis were also reviewed. The coordinator then drew up a set of proposed recommendations, which were discussed and modified in a nominal group meeting. After several review processes, including external review by other GPs members, the final document was drafted.
ResultsThe present guidelines include updated recommendations on assessing the severity of psoriasis and criteria for the indication of systemic treatment. They also include general principles for the treatment of patients with moderate to severe psoriasis and define treatment goals for these patients as well as criteria for the indication and selection of initial and subsequent therapies Practical issues, such as treatment failure and maintenance of response, are also addressed.
En la práctica clínica diaria, la toma de decisiones terapéuticas con terapias biológicas en pacientes con psoriasis integra no solo variables relativas a la eficacia de estos fármacos y relacionadas con la propia psoriasis (gravedad o impacto), sino también factores relacionados con el paciente como su edad, el deseo gestacional o la presencia de comorbilidades que pueden condicionar la elección del tratamiento1,2.
Esta actualización incorpora una serie de cambios y novedades con respecto a propuestas previas en relación al manejo de poblaciones especiales, la presencia de comorbilidad y en cuanto a la gestión del riesgo con el uso de terapias biológicas en la psoriasis moderada-grave3–6.
MétodosLa metodología de este proyecto promovido por el Grupo de Psoriasis de la Academia Española de Dermatología y Venereología (GPS) se describió en la primera publicación (Parte 1)7. En resumen, para la elaboración del consenso se siguió la metodología de grupos nominales, con ayuda de una scoping review, todo ello bajo supervisión metodológica.
Tras la designación del coordinador se seleccionó un grupo de integrantes del GPS con base en su experiencia y conocimiento en psoriasis. El coordinador, con ayuda metodológica, definió los objetivos, alcance, usuarios y apartados del documento. Finalmente, teniendo en cuenta el volumen de publicaciones sobre la eficacia y seguridad de las terapias biológicas incluyendo los biosimilares y moléculas sintéticas de nueva generación en la psoriasis moderada-grave se decidió realizar una scoping review. Se contó con la ayuda de una experta documentalista que diseñó diferentes estrategias de búsqueda que incluyeron términos Mesh y términos en texto libres para las principales bases de datos bibliográficas (Medline, Emabse y la Cochrane Library) hasta enero del 2021. Se seleccionaron revisiones sistemáticas de la literatura y meta-análisis así como ensayos clínicos aleatorizados (ECA) no incluidos en las mismas y estudios de calidad en vida real. Igualmente, se revisaron otras guías de práctica clínica y documentos de consenso nacionales e internacionales sobre el manejo de la psoriasis moderada-grave.
Con esta información, el coordinador generó una serie de recomendaciones preliminares y texto de los distintos apartados que fueron evaluadas, discutidas y modificadas en una reunión de grupo nominal. Tras varios procesos de revisión, que incluyeron la revisión externa por parte de los miembros del GPS, se redactó el documento definitivo.
El proyecto se efectuó en plena conformidad con los principios establecidos en la Declaración de Helsinki, referente a la investigación médica en seres humanos, en su última versión, y de acuerdo con la normativa aplicable sobre Buena Práctica Clínica.
ResultadosToma de decisiones terapéuticas en poblaciones especiales.
Mayores de 65 añosLa experiencia acumulada con el uso de terapias biológicas es limitada en este grupo poblacional. La coexistencia de comorbilidades y/o requisitos de distinta índole de los ECA hacen que esta población esté escasamente representada en estos estudios, con independencia de los límites de edad existentes en algunos ECA.
En una revisión sistemática reciente se analizaron los resultados de 18 trabajos8 (tres sub-análisis de ECA, cinco estudios de cohortes y 10 series de casos) sobre el uso de terapias biológicas en pacientes con psoriasis moderada-grave mayores de 65 años. En general, la eficacia en este sub-grupo poblacional es muy similar a la encontrada en la población más joven. Sin embargo, en algunos de estos estudios se ha objetivado un incremento del riesgo para acontecimientos adversos (incluyendo los graves) en pacientes con más de 65 años, que sin embargo se ve superado por el del tratamiento sistémico clásico en esta población9,10. En la tabla 1 se resumen los principales resultados de los estudios analizados.
Eficacia y seguridad de los tratamientos biológicos en pacientes con psoriasis moderada-grave de más de 65 años
| Fármaco | Diseño | n | Eficacia | Seguridad |
|---|---|---|---|---|
| Infliximab 11 | Series de casos | 27 | -Semana 12PASI 75 80%Reducción PASI medio (p< 0,001) | -n=15 interrupción (5 por AA) |
| Etanercept 12 | Sub-análisis ECA | 77 | -PASI 75 Sin diferencias con pacientes jóvenes | -Sin diferencias con pacientes jóvenes en discontinuación y reacciones en inyección-Significativamente más AA graves en ancianos (sin relación con ETN) |
| Adalimumab13 | Retrospectivo | 16 | -Sin diferencias con pacientes jóvenes | -Sin diferencias-Discontinuación sin relación con edad OR=0,94 (IC 95% 0,29-3,07) |
| Adalimumab14 | Sub-análisis ECA | 54 | - PASI 75≥ 65 menor 61%40-64 años 70%< 40 años 74% | - |
| Etanercept y adalimumab15 | Series de casos | 89 | -Semana 156PASI 75 ETN 83,6%PASI 75 ADA 71,4%Reducción PASI medio (p< 0,001), sin diferencias con jóvenes (ETN) | -n = 26 discontinuación por AA |
| Secukinumab16 | Sub-análisis ECA | 67 | -Semana 16 (>65 vs. jóvenes)PASI 75 86,4% vs. 89%PASI 90 72,7% vs. 74,3%PASI 100 40,9% vs. 40,9%-Semana 52 (>65 vs. jóvenes)PASI 75 81.1% vs.79,4%-Tiempo hasta inicio respuesta similar | - > 65 vs. jóvenes:AA 14,9% vs. 8,2%AA graves (relación con secukinumab 4,5% vs. 1,8%Discontinuación por AA 7,5% vs. 1,8%Tasa de infección similar |
| Ustekinumab17 | Series de casos | 22 | -Semana 28 /52 / 100PASI 75 63,6% / 86,4% / 90,9% | -n = 0 AA graves-n = 2 AA |
| Ustekinumab18 | Series de casos | 24 | -Semana 16 /28 / 52PASI 75 56,5% / 59,1% / 60% | -n = 0 AA graves-n = 2 discontinuación |
| Guselkumab | Series de casos | 20 | -Semana 4 / 28 / 40-44PASI 90 30% / 65% / 75%PASI 100 10% / 30% / 55% | -n = 2 discontinuación |
| Brodalumab19 | Sub-análisis ECA | 224 | -Semana 52PASI 75 94,6%PASI 100 52,7%-Semana 120PASI 75 91,4%PASI 100 56,9% | -AA por 100 paciente-año 308,2-AA grave por 100 pacientes-año 13,1 |
| Adalimumab, ustekinumab20 | Series de casos | 27 | -Semana 16 /24 / 52PASI 75 76,9% / 88% /90,5% | -n = 7 discontinuación |
| Tildrakizumab, etanercept21 | Sub-análisis ECA | 161 | - | -Incidencia TIL100 mg/TIL200 mg/ETNAA graves 2,51/1,76/6,83Infecciones graves 3,76/2,34/6,83 |
| Risankizumab22,23 | Sub-análisis ECA | 64 | -Sem 16 / 52PASI 90 - / 81,3%PASI 100 42,2% / 60,9% | - |
| Varios*24 | Series de casos | 266 | -Δ PASI medio:Semana 0 16,5Semana 16 3,7Semana 28 1,6Semana 52 1,2 | -n = 25 (9,4%) AA, más frecuentes infecciones-n = 4 cáncer (3 piel no melanoma)-Discontinuación:Semana 16 3%Semana 28 5%Semana 52 9% |
| Varios†25 | Retrospectivo | 48 | -Ancianos más tratamiento tópico y menos biológicos que jóvenes-Ancianos tendencia a mejores resultados con biológicos que con sistémicos convencionales-Sin diferencias con jóvenes en la mejoría del S-MAPA en semana 12 | -Sin diferencias con jóvenes en porcentaje de AA o infecciones con biológicos-Mayor porcentaje de AA con sintéticos clásicos que biológicos en ancianos-IFX el que más infecciones reportó, ETN el que menos en todos los grupos de edad |
| Varios‡26 | Series de casos | 187 | -Semana 12 PASI 75PASI 75 ETN 64%PASI 75 ADA 65%PASI 75 IFX 93%PASI 75 UST 100% | -AA 0,11, 0,35, 0,19, y 0,26 paciente-año con ETN, ADA, IFX y UST-ADA más AA vs. ETN (p< 0,050)-n = 2 AA graves (neumonía con IFX y ETN) |
| Varios§27 | Retrospectivo | 65 | -Ancianos menos biológicos que jóvenes aunque el % aumentó del 7,75% en 2008 al 11,7% en 2012 | -Discontinuación (>65 años vs. jóvenes) 18,2% vs.12%-AA totales >65 años HR = 1.09 (IC 95% 0,9-1,3)-AA graves >65 años HR = 3,2 (IC 95% 2,0-5,1) |
| Varios**28 | Retrospectivo | 31 | -29,8% de los pacientes con tratamiento sistémico no serían candidatos a ECA | -AA grave ≥ 70 años HR = 3,4 (IC 95% 1,6-7,1) |
ECA:ensayo clínico aleatorizado; PASI:Psoriasis Area and Severity Index; ETN:etanercept; ADA:adalimumab; IFX:infliximab; UST:ustekinumab; TIL:tildrakizumab; AA:acontecimiento adverso; OR:odds ratio; HR:hazard ratio; IC:intervalo de confianza; S-MAPA:Simple-Measure for Assessing Psoriasis Activity.
El GPS considera que los objetivos terapéuticos en los pacientes mayores de 65 años deben ser los mismos que los propuestos para la población general (consultar la Parte 1 del consenso). Lo mismo debe considerarse para la indicación y selección de las terapias biológicas, aunque se prestará especial atención a la gestión del riesgo.
Pacientes pediátricosActualmente, tienen indicación para el tratamiento de la psoriasis pediátrica etanercept, adalimumab, ustekinumab, ixekizumab y secukinumab (tabla 2)29–33. Los objetivos terapéuticos en pacientes pediátricos deben ser idénticos a los establecidos para población adulta, por lo que esta población debería poder beneficiarse, al igual que los adultos, de la terapia biológica sin demora, en especial teniendo en cuenta la ausencia de indicación aprobada de tratamientos no biológicos en la población pediátrica. En la elección terapéutica se debe tener muy en cuenta la conveniencia de la administración (frecuencia, número y dolor de las inyecciones), ya que puede ser determinante en la adherencia al tratamiento.
Indicaciones en ficha técnica y principales resultados de los ensayos clínicos aleatorizados de las terapias biológicas aprobadas para la psoriasis en pacientes pediátricos
| Fármaco | Indicación ficha técnica | Resultados ECA |
|---|---|---|
| Etanercept 29 | -Psoriasis en placas crónica grave en niños ≥ 6 años y adolescentes con respuesta inadecuada o que son intolerantes a otras terapias sistémicas o fototerapia | -Sem 12 etanercept vs. placeboPASI 75 57% vs. 11% (p < 0,001)PASI 90 27% vs.7% (p < 0,001)PGA 0/1 53% vs. 13% (p < 0,001)-Sem 36 etanerceptPASI 75 65%-68% |
| Adalimumab 30 | -Psoriasis crónica en placas grave en niños y adolescentes (≥ 4 años) con respuesta inadecuada o que no sean candidatos apropiados para tratamiento tópico y fototerapia | -Sem 16 adalimumab vs. metotrexatoPASI 75 58%-44% vs. 32%PhGA 0/1 61%-41% vs. 41%-Sem 36 adalimumabTodos respuesta adecuada |
| Ustekinumab 31 | -Psoriasis en placas de moderada a grave en adolescentes (≥ 12 años) con respuesta inadecuada, o que son intolerantes a otras terapias sistémicas o fototerapias | -Sem 12 ustekinumab (dependiendo de la dosis) vs. placeboPASI 75 80,6%-78,4% vs. 10,8% (p < 0,001)PASI 90 61,1%-54,1% vs. 5,4% (p < 0,001)PhGA 0/1 69,4%-67,6% vs. 5,4% (p < 0,001)-Sem 52 ustekinumabRespuestas PASI mantenidas |
| Ixekizumab32 | -Psoriasis en placas de moderada a grave en niños ≥ 6 años y con un peso corporal de al menos 25 kg y en adolescentes que son candidatos a tratamientos sistémicos | -Sem 12 ixekizumab vs. placeboPASI 75 89% vs. 25% (p < 0,001)PASI 90 78% vs. 5% (p < 0,001)PhGA 0/1 81% vs. 11% (p < 0,001)-Sem 48 ixekizumabRespuestas PASI mantenidas |
| Secukinumab 33 | -Psoriasis en placas de moderada a grave en niños y adolescentes (≥ 6 años) candidatos a tratamientos sistémicos | -Sem 12 secukinumab (dependiendo de la dosis) vs. placeboPASI 75 77,5%-80% vs. 14,6% (p < 0,001)PASI 90 76,5%-72,5% vs. 2,4% (p < 0,001)IGA mod 2011 60%-70% vs. 4,9% (p < 0,001)-Sem 52 secukinumabPASI 75 72,2%-85%PASI 90 75%-81,3%IGA mod 2011 72,2%-85% |
ECA:ensayo clínico aleatorizado; PASI:Psoriasis Area and Severity Index; PGA:Physician Global Assessment; sem: semana.
Recientemente se ha publicado un ECA fase III con secukinumab con buenos resultados hasta la semana 5233 y el fármaco está aprobado para su uso para pacientes a partir de 6 años. Se están realizando ECA en población pediátrica con psoriasis con guselkumab, brodalumab, tildrakizumab, certolizumab pegol, bimekizumab y risankizumab. Existen publicaciones de series de casos y estudios abiertos en pacientes pediátricos con infliximab34–36 y guselkumab37.
En el año 2020, el GPS publicó un documento de consenso sobre el manejo de pacientes con psoriasis durante la edad fértil, embarazo, postparto y lactancia2. Las tablas 3 y 4 resumen las indicaciones de las fichas técnicas sobre el uso de terapias biológicas y otros datos relacionados en el embarazo y lactancia.
Recomendaciones de ficha técnica sobre el embarazo y el uso de terapias biológicas incluyendo biosimilares y moléculas sintéticas de nueva generación
| Fármaco | Ficha técnica | Otros datos publicados |
|---|---|---|
| Infliximab49,58 | Usar si el beneficio supera el riesgo | No hay datos que demuestren asociación con teratogenicidad ni malos resultados del embarazo. Sin evidencia de daño en animales |
| Adalimumab49,59 | Usar si el beneficio supera el riesgo | No hay datos que demuestren asociación con teratogenicidad ni malos resultados del embarazo. Sin evidencia de daño en animales |
| Etanercept50 | Usar si el beneficio supera el riesgo | No hay datos que demuestren asociación con teratogenicidad ni malos resultados del embarazo. Sin evidencia de daño en animales |
| Certolizumab pegol46,47,59,60 | Usar durante el embarazo si es clínicamente necesario | Resultados similares a la población general |
| Brodalumab59 | Preferible evitar su uso | Escasez de datos en humanos. Sin evidencia de daño en animales |
| Ixekizumab59,61 | Preferible evitar su uso | Escasez de datos en humanos. Los datos en animales sugieren la posibilidad de muerte neonatales |
| Secukinumab53 | Preferible evitar su uso | No hay datos que demuestren asociación con teratogenicidad ni malos resultados del embarazo. Sin evidencia de daño en animales |
| Bimekizumab | Preferible evitar su uso | No hay datos que demuestren asociación con teratogenicidad ni malos resultados del embarazo. Sin evidencia de daño en animales |
| Guselkumab62,63 | Preferible evitar su uso | Escasez de datos en humanos. |
| Risankizumab6 | Preferible evitar su uso | Escasez de datos en humanos. Los estudios en animales no sugieren efectos perjudiciales directos ni indirectos en términos de toxicidad para la reproducción |
| Ustekinumab 41,54–56 | Preferible evitar su uso | Escasez de datos en humanos |
| Tildrakizumab57 | Preferible evitar su uso | Escasez de datos en humanos. |
Recomendaciones de ficha técnica y otros datos sobre la lactancia y el uso de terapias biológicas incluyendo biosimilares y moléculas sintéticas de nueva generación2
| Fármacos | Lactancia |
|---|---|
| Infliximab58 | -Generalmente no se detecta en leche materna o se detecta a dosis bajas-AEMPS: Como las inmunoglobulinas humanas se excretan en el leche, las mujeres no deben dar el pecho durante al menos 6 meses después del tratamiento |
| Adalimumab 59,64 | -Generalmente no se detecta en leche materna o se detecta a dosis muy bajas; se detecta en leche humana a concentraciones correspondientes al 0,1% – 1% del nivel sérico materno-AEMPS: Puede utilizarse durante la lactancia |
| Etanercept65 | -Generalmente no se detecta en leche materna o se detecta a dosis bajas-AEMPS: Se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento con etanercept, tras considerar el beneficio de la lactancia para el niño y el beneficio del tratamiento para la madre |
| Certolizumab pegol66 | -Generalmente no se detecta en leche materna o se detecta a dosis bajas-Aprobado su uso en la lactancia por EMA |
| Brodalumab59 | -Se desconoce su paso a la leche materna-AEMPS: Se debe decidir si es necesario interrumpir la lactancia o interrumpir / no iniciar el tratamiento con brodalumab tras considerar el beneficio de la lactancia para el niño y el beneficio del tratamiento para la madre |
| Ixekizumab59 | -No hay datos en humanos-AEMPS: Se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento con ixekizumab tras considerar el beneficio de la lactancia para el niño y el beneficio del tratamiento para la madre |
| Secukinumab59 | -Generalmente no se detecta en leche materna o se detecta a dosis bajas.-AEMPS: Se debe decidir si interrumpir la lactancia durante el tratamiento y hasta 20 semanas después del tratamiento o interrumpir el tratamiento, teniendo en cuenta el beneficio de la lactancia para el niño o el beneficio del tratamiento para la mujer |
| Bimekizumab 67 | -Se desconoce su paso a la leche materna-AEMPS: Se debe decidir si es necesario interrumpir la lactancia o interrumpir / no iniciar el tratamiento con bimekizumab tras considerar el beneficio de la lactancia para el niño y el beneficio del tratamiento para la madre |
| Guselkumab 62,63 | -No hay datos en humanos-AEMPS: Se debe decidir si es necesario interrumpir la lactancia materna durante el tratamiento y hasta 12 semanas después de la última dosis o suspender el tratamiento, tras considerar el beneficio de la lactancia y del tratamiento con para la madre |
| Risankizumab6 | -Se desconoce su paso a la leche materna-AEMPS: Se debe decidir si es necesario interrumpir la lactancia o interrumpir / no iniciar el tratamiento con risankizumab tras considerar el beneficio de la lactancia para el niño y el beneficio del tratamiento para la madre |
| Ustekinumab 41,56 | -No hay datos en humanos-AEMPS: La decisión de interrumpir la lactancia materna durante el tratamiento y hasta 15 semanas después del tratamiento o suspender el tratamiento debe adoptarse valorando los efectos beneficiosos de la lactancia materna para el niño y los beneficios del tratamiento con ustekinumab para la mujer |
| Tildrakizumab 68 | -Se desconoce su paso a la leche materna-En macacos tildrakizumab se excreta en la leche en concentraciones insignificantes el día 28 posnatal-AEMPS: Se debe decidir si es necesario interrumpir la lactancia o interrumpir / no iniciar el tratamiento con tildrankizumab tras considerar el beneficio de la lactancia para el niño y el beneficio del tratamiento para la madre |
Actualizado con permiso de Belinchon et al.2.
AEMPS:Agencia Española del Medicamentos y Productos Sanitarios; EMA:European Medicines Agency.
El paso transplacentario de madre a hijo de los anticuerpos inmunoglobulina G (IgG) se produce a partir del 3° trimestre mediante la unión de su fragmento cristalizable a los receptores neonatales para Fc de inmunoglobulinas (FcRn) en la placenta38. Sin embargo, no todos los anticuerpos monoclonales demuestran la misma afinidad para unirse a estos receptores, por lo que su paso trasplacentario puede ser distinto. Las IgG1 (adalimumab, infliximab, secukinumab, ustekinumab, guselkumab, tildrakizumab, risankizumab), IgG2 (brodalumab) e IgG4 (ixekizumab) probablemente atraviesen la placenta de un modo similar39–42. Se han detectado niveles de infliximab y adalimumab en recién nacidos hasta seis meses después del nacimiento43. Por otra parte, se ha descrito que etanercept tiene una menor afinidad por los FcRn44,45. Certolizumab pegol (que carece de Fc)46–48, ha demostrado bajo o nulo paso transplacentario.
La experiencia acumulada con el uso de anti-TNFα no ha encontrado un incremento de riesgo de teratogénesis o un impacto negativo en el pronóstico del embarazo (incluyendo infecciones maternas)49,50. Estudios prospectivos con certolizumab pegol que incluyeron a más de 1.300 mujeres embarazadas no detectaron un aumento en el riesgo de malformaciones o muerte fetal51,52. Estos datos han justificado la aprobación por parte de la European Medicines Agency (EMA) del mantenimiento de certolizumab pegol durante el embarazo y la lactancia cuando resulte clínicamente necesario.
En mujeres gestantes en tratamiento con fármacos biológicos, el GPS recomienda valorar la posibilidad de mantenerlos durante el 1° y 2° trimestre y evaluar con la paciente los riesgos y beneficios de continuar con ellos durante el 3° trimestre. Las pacientes tratadas con certolizumab pegol podrían usarlo durante todo el embarazo, si se considera clínicamente necesario.
Actualmente, ante la escasez de datos sobre brodalumab, ixekizumab, secukinumab53, guselkumab, risankizumab, ustekinumab41,54–56, bimekizumab y tildrakizumab57, se recomienda plantear otras alternativas en las pacientes gestantes. En caso de haberse agotado dichas alternativas o considerarse más apropiado el uso o mantenimiento de estos fármacos, se decidirá de forma individualizada y consensuada con la paciente, teniendo en cuenta el balance riesgo/beneficio.
El deseo gestacional también debe tenerse en cuenta en la toma de decisiones con el uso de terapias biológicas. Idealmente, las mujeres con psoriasis moderada-grave deberían planear el embarazo cuando estén en remisión y sin medicación o tomando la dosis mínima efectiva de medicamentos que tengan un buen perfil de seguridad gestacional.
Toma de decisiones terapéuticas en pacientes con comorbilidadEl GPS quiere señalar que la presencia de determinadas comorbilidades puede influir o condicionar la elección de la terapia biológica atendiendo a criterios de seguridad o potenciales efectos de clase. La tabla 5 resume los principales hallazgos y recomendaciones.
Resumen del impacto de las principales comorbilidades con el uso de terapias biológicas y recomendaciones prácticas del GPS y de la ficha técnica
| Comorbilidad | Resultados de estudios | Recomendaciones prácticas |
|---|---|---|
| Obesidad14,69–76 | -Disminución de la eficacia a mayor peso (especialmente en obesos) | -Derivar a atención primaria u otro especialista para control de peso |
| APs77–80 | -Eficacia varía dependiendo del fármaco y dominio de la APs evaluado (artritis, entesitis, afectación axial, dactilitis, etc.) | -Evaluar la afectación de cada uno de los dominios relacionados con la APs-Decisiones terapéuticas consensuadas con reumatólogo |
| EII81–86 | -Con los inhibidores de la IL-17 la aparición de nuevos casos de EII es muy baja-Los ECA con secukinumab y brodalumab en EII se suspendieron por ineficacia o empeoramiento | -Priorizar terapias diferentes a los inhibidores de la IL-17-Decisiones terapéuticas consensuadas con gastroenterólogos-Especial precaución en pacientes con antecedentes familiares de EII, espondiloartritis o que presenten clínica digestiva que pueda ser compatible con EII. |
| Depresión5,87–90 | -Alta prevalencia, sobre todo en formas graves de psoriasis-Se detectaron algunos casos de suicidio en algunos ECA con brodalumab en pacientes con antecedentes de trastornos psiquiátricos | -Evaluar rutinariamente la comorbilidad psico-psiquiátrica, y solicitar valoración especializada si trastorno subyacente-Valorar riesgo/beneficio con brodalumab si historia de depresión o ideación suicida |
| Cáncer91–97 | -No existe evidencia que asocie el uso de terapias biológicas con la aparición de cáncer de novo o recurrencia de cánceres previos | -Decisiones terapéuticas consensuadas con pacientes y oncólogos |
| Síndrome metabólico1 | -Alta prevalencia, sobre todo en formas graves de psoriasis-Sin evidencia sobre una posible influencia con el uso de terapia biológica | -Ninguna actuación específica más allá de la necesidad de abordaje por atención primaria o del especialista que se considere |
| DM98–103 | -Resultados discordantes con anti-TNFα-Datos no concluyentes con otros biológicos | -Valorar en pacientes con DM avanzada la priorización de los inhibidores de la IL-17, ustekinumab o inhibidores de la IL-23 |
| Hígado graso no alcohólico102,104–108 | -Alta prevalencia-Los anti TNF-α han demostrado mejorar los parámetros metabólicos y hepáticos- Efectos beneficiosos de anti IL17 en modelos animales. | -Ninguna actuación específica en el momento actual |
| Enfermedad y riesgo cardiovascular109 | -Potencial efecto beneficioso con el uso de terapias biológicas | -Ninguna actuación específica en el momento actual |
| IC110,111 | -Empeoramiento de la IC con el uso de anti-TNFα, en particular adalimumab e infliximab, sobre todo en estadios avanzados (III/IV)-No señales de riesgo con otras terapias biológicas | -Contraindicados los anti-TNFα en pacientes con IC en estadios III/IV, y se recomienda prudencia en estadios I/II |
| Enfermedad renal112–115 | -No existe evidencia que permita sospechar el impacto negativo de ninguna de las terapias biológicas | -Ninguna actuación específica en el momento actual |
| Enfermedad neurológica116–118. | -Riesgo (bajo) de desarrollo o agravamiento de enfermedad desmielinizante con los anti-TNFα-No señales de riesgo con otras terapias biológicas | -Contraindicados los anti-TNFα en pacientes con enfermedad desmielinizante |
APs:artritis psoriásica; EII:enfermedad inflamatoria intestinal; IL:interleukina; ECA:ensayo clínico aleatorizado; DM:diabetes Mellitus; IC:insuficiencia cardiaca.
El sobrepeso/obesidad puede influir negativamente en la eficacia de los fármacos para la psoriasis. La disminución de la eficacia en relación con el peso se ha descrito, en mayor o menor medida, para todos los biológicos, y afecta a los objetivos terapéuticos óptimos14,69,71–75,119.
En relación a los anti-TNFα administrados a dosis fijas, distintos estudios han puesto de manifiesto que su eficacia puede disminuir al aumentar el peso (especialmente en obesos)14,69–71. Para el resto de terapias se ha objetivado que a mayor peso la eficacia del fármaco disminuye, aunque en menor medida72,73. Un estudio con ustekinumab mostró que el peso, el sexo femenino y la presencia de diabetes mellitus (DM) influyen en el aclaramiento y volumen de distribución del fármaco74. Por otro lado, secukinumab en un ECA fase II, mostró respuestas numéricamente superiores en pacientes con normopeso en comparación con los obesos, pero en ambos casos fue eficaz75, igual que brodalumab en dos ECA fase III75,120. Para ixekizumab se ha observado una disminución numérica en la eficacia (PASI [Psoriasis Area and Severity Index] 75, 90 y 100) en pacientes con mayor peso76. En la ficha técnica de bimekizumab se afirma que en los pacientes con un peso corporal ≥120 kg que no hayan logrado un aclaramiento completo de la piel en la semana 16, la administración de 320 mg cada cuatro semanas después de la semana 16 podría seguir mejorando la respuesta al tratamiento. La eficacia de guselkumab (datos agregados de 2 ECA fase III) es numéricamente menor en pacientes con más peso72. Lo mismo ocurre con risankizumab (datos agregados de dos ECA fase III)22 y tildrakizumab (datos agregados de un ECA fase IIb y dos ECA fase III)73. Por otro lado, es importante recordar que la dosis de infliximab y ustekinumab se puede ajustar al peso del paciente; en el caso de ustekinumab la eficacia de 45 mg en los pacientes con peso comprendido entre 90 y 100 kg es subóptima, por lo que en estos se recomienda la dosis de 90 mg121.
La ficha técnica de los anti-TNFα recoge la posibilidad de aumento de peso con el tratamiento en algunos casos. Sin embargo, el impacto debe ser evaluado de forma individual.
Artritis psoriásicaEn los pacientes con psoriasis y artritis psoriásica (APs) se debe evaluar la afectación de cada uno de los dominios relacionados con la APs (articular periférica, axial, entesitis, dactilitis, uñas y piel). Se recomienda tomar una decisión consensuada con el reumatólogo en función de la gravedad en cada dominio y de su impacto en el paciente77,122. Diversos fármacos aprobados en psoriasis lo están también en la APs: anti-TNFα (adalimumab, infliximab, etanercept, certolizumab), anti IL-17 (secukinumab, ixekizumab), anti p40 (ustekinumab) y anti IL-23 (guselkumab, risankizumab).
Bimekizumab es un fármaco anti IL-17 A y anti IL-17 F. Los ensayos fase IIb muestran que las dosis de 16 mg y 160 mg (con o sin una dosis de carga de 320 mg) se asociaron con mejoras significativas en ACR50 en comparación con placebo, con un perfil de seguridad aceptable123.
Igualmente se han publicado datos de tildrakizumab de ensayos de fase IIb, en los que la mejoría en el dominio articular fue significativamente superior al placebo124. En el caso de brodalumab, un fármaco anti IL-17RA, se han desarrollado estudios de fase III que no se completaron.
En el momento de redactar este documento se encuentran en marcha estudios de fase III tanto con bimekizumab como con tildrakizumab que permitirán evaluar su aprobación en la APs.
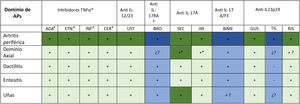
La figura 1 resume gráficamente la eficacia observada en los ECA fase III de las distintas terapias biológicas, incluyendo biosimilares, y moléculas sintéticas de nueva generación80,122.
Eficacia de las terapias biológicas, incluyendo biosimilares, y moléculas sintéticas de nueva generación según los ensayos clínicos aleatorizados fase III en la artritis psoriásica (80).
Abreviaturas: APs:artritis psoriásica; ADA:adalimumab; ETN:etanercept; INF:infliximab; CER:certolizumab pegol; UST:ustekinumab; BRO:brodalumab; SEC:secukinumab; IXE:ixekizumab; GUS:guselkumab; TIL:tildrakizumab; RIS:risankizumab; TNF:factor de necrosis tumoral; IL:interleuquina.
Colores: verde oscuro significa que ese dominio es la variable principal de un estudio de fase III finalizado y diseñado para evaluar ese dominio; verde claro significa que el dominio ha sido estudiado como variable secundaria en el fase III finalizado; azul oscuro significa que ese dominio es la variable principal de un estudio de fase III en marcha y se dan resultados del fase II; azul claro significa que el dominio está siendo estudiado como variable secundaria en un estudio de fase III en marcha y se dan resultados del fase II.
+ Es eficaz; - no es eficaz; + ? Datos escasos o no publicados en revistas indexadas; ¿? Datos no disponibles.
*Aprobados en espondiloartritis axial (espondilitis anquilosante/ espondiloartitis axial no radiográfica)125.
†No aprobado en APs; desarrollo clínico en fase III detenido por el promotor.
‡No aprobado en APs, desarrollo clínico fase III en marcha.
Diversos meta-análisis demuestran que todos los fármacos aprobados en PsA (Artritis psoriásica) son superiores a placebo sin diferencias significativas entre ellos para esta indicación. En su conjunto algunos de estos estudios indican una posible superioridad sobre ustekinumab del resto de biológicos aprobados126,127.
Sin embargo, deben tenerse en cuenta las diferencias en el tiempo de evaluación, el hecho de que la respuesta articular tiende a ser más rápida con anti-TNFα y anti-IL-17, y la necesidad de considerar otros factores (farmacoeconómicos, efecto sobre psoriasis, antecedentes de fracaso a otros biológicos) en la decisión de prescripción128.
Los meta-análisis muestran que todos los fármacos biológicos aprobados presentan efecto frente a la dactilitis y entesitis, sin diferencias significativas entre ellos129,130.
Los agentes biológicos pueden retrasar la progresión radiográfica en pacientes con PsA en términos de erosión ósea y estrechamiento del espacio articular en comparación con placebo, sin que metotrexato desempeñe ningún efecto añadido en esta variable. El tratamiento previo anti-TNFα parece no influir en la eficacia como inhibidores de la progresión radiográfica de los inhibidores de interleucinas131.
Enfermedad inflamatoria intestinalLa incidencia y prevalencia de enfermedad inflamatoria intestinal (EII) está incrementada en la psoriasis, tanto para la enfermedad de Crohn (EC) como para la colitis ulcerosa (CU)81. De este modo, la EII puede ser un elemento relevante en la elección de la terapia biológica. No está bien establecido, sin embargo, el peso de los antecedentes familiares de EII.
Infliximab, adalimumab y ustekinumab están aprobados para el tratamiento de la EC y la CU, así como certolizumab pegol en la EC, por lo que estos biológicos podrían priorizarse en pacientes con psoriasis moderada-grave y EII82.
Aunque no está aprobado su uso en EII, existe evidencia positiva de la eficacia de guselkumab y risankizumab en ECA fase II/III, por lo que representan una opción aceptable si se consideran oportunos también para el tratamiento de la psoriasis. Se han publicado buenos resultados con guselkumab y risankizumab tanto en la inducción como en el mantenimiento de la respuesta en la EC83. No existe experiencia publicada con tildrakizumab más allá de la opinión de expertos132.
Con respecto a los inhibidores de la IL-17, la incidencia de nuevos casos de EII durante el tratamiento en general es baja y no supera el riesgo esperado en la población psoriásica86. Sin embargo, se han descrito algunos casos de EII en pacientes tratados con este grupo farmacológico y los estudios con secukinumab y brodalumab en EII fueron suspendidos por ausencia de respuesta y empeoramiento en algunos casos6,84,85. Al igual que con los pacientes con APs, el GPS recomienda consensuar las decisiones terapéuticas con los gastroenterólogos.
DepresiónLa presencia de comorbilidades relacionadas con la salud mental, como la ansiedad, depresión e incluso la ideación y comportamiento suicida son frecuentes en la psoriasis, en particular en los pacientes con las formas más graves de la enfermedad. La relación entre los trastornos psicológicos y psiquiátricos y la psoriasis es bidireccional, pudiendo existir mecanismos patogénicos comunes87.
En su conjunto, los ECA con adalimumab, etanercept, ustekinumab, ixekizumab, secukinumab, guselkumab han objetivado una mejoría de los síntomas de depresión asociados a la psoriasis. En el desarrollo clínico de brodalumab (en dos de tres ECA de fase III) se detectaron algunos casos de suicidio en pacientes con antecedentes de trastornos psiquiátricos o desencadenantes de estrés, sin que se haya establecido una relación causal entre brodalumab y el aumento del riesgo de conducta e ideación suicida. En el resto de pacientes con clínica psiquiátrica, esta mejoró durante el tratamiento con brodalumab88. Sin embargo, la ficha técnica de brodalumab recoge la necesidad de evaluar el riesgo frente al beneficio del fármaco en pacientes con historia de depresión o ideación suicida. Se debe suspender brodalumab si aparecen síntomas de depresión o ideación suicida o si se agravan los síntomas previos89.
El GPS recomienda evaluar de forma rutinaria las comorbilidades psiquiátricas de los pacientes con psoriasis moderada-grave con terapias biológicas y solicitar seguimiento y valoración especializados en el caso de identificar trastornos subyacentes5.
Dada la complejidad de los factores psicosociales de la psoriasis, los dermatólogos y los profesionales sanitarios deberían facilitar a los pacientes estrategias para afrontar el impacto de la enfermedad en su bienestar físico, psicológico y social5,90.
CáncerLos pacientes con psoriasis y APs presentan un discreto incremento de riesgo de determinadas variantes de cáncer, fundamentalmente cutáneos (no melanoma) y linfoma91.
Por un lado, la evidencia sobre el uso de terapias biológicas en pacientes con psoriasis e historia previa de cáncer se basa generalmente en registros o series de casos o a partir de propuestas teóricas fundamentadas en el mecanismo de acción. Por otro, se ha cuestionado si la inmunomodulación secundaria a la terapia biológica puede influir en la incidencia de cáncer sin que se haya podido demostrar de forma robusta ninguna asociación. Hay que tener presente además la existencia de escenarios muy heterogéneos en función del tipo de cáncer, el tiempo desde el diagnóstico o la remisión (que condiciona el riesgo de recurrencia) u otros factores concomitantes del propio paciente (edad, tabaquismo, etc.) que impiden generar recomendaciones globales en pacientes con psoriasis e historia previa de cáncer. La información disponible actualmente tampoco ha mostrado que exista un riesgo mayor de recurrencias de cáncer con el uso de anti-TNFα en pacientes con otras enfermedades inflamatorias crónicas como la artritis reumatoide o la EII, salvo en casos de combinación con fármacos inmunosupresores92,93.
El riesgo de aparición de cáncer de novo asociado a estas terapias ha sido objeto de estudio, controversia y numerosas publicaciones. Aunque en revisiones sistemáticas y estudios observacionales se ha descrito un incremento en el riesgo de cáncer cutáneo no melanoma en pacientes tratados con anti TNFα, es probable que existan factores de confusión relacionados con la exposición a radiación ultravioleta o dosis altas de PUVA previas95. Por otro lado, en la mayoría de los estudios realizados no se ha encontrado relación entre le exposición a fármacos anti-TNFα y el riesgo incidental de cáncer en pacientes con psoriasis97.
En una revisión sistemática de 71 ECA que incluyeron 23.458 pacientes con psoriasis, APs y otros trastornos inflamatorios expuestos a adalimumab, no se encontró un aumento significativo en la tasa de incidencia de cáncer en su conjunto (0,96 por 100 pacientes-año, IC 95% 0,65-1,36) ni de linfoma (0,63, IC 95% 0,01- 3,49)94. Sin embargo, sí se observó un aumento en la tasa de incidencia de cáncer cutáneo no melanoma (1,76, IC 95% 1,26-2,39).
En un meta-análisis de 20 ECA que analizó 6.810 pacientes con psoriasis y anti-TNFα, a corto plazo no se encontró aumento en la incidencia de cáncer para ningún fármaco del grupo96.
Con respecto a ustekinumab, no se ha observado un aumento del riesgo de cáncer. En un sub-análisis de un ECA fase II y tres ECA de fase III, las tasas de cáncer en los pacientes tratados con ustekinumab fueron similares a las de la población general de EE. UU. Datos agregados de dos ECA fase II, que analizaron 3.117 pacientes con psoriasis y ustekinumab durante un máximo de tres años, mostraron un perfil de seguridad favorable133. La tasa de incidencia por 100 pacientes-año de cualquier tipo de cáncer, excluyendo el cáncer cutáneo no melanoma fue de 0,98 (IC 95% 0,74-1,29), distribuidos de la siguiente manera: melanoma 1,42 (IC 95% 0,52-3,09), cáncer de próstata 1,21 (IC 95% 0,66-2,04), cáncer colorrectal 0,99 (IC 95% 0,32-2,31), cáncer de mama 0,62 (IC 95% 0,17-1,58) y linfoma 0,80 (IC 95% 0,10-2,91). Estas cifras son comparables a las de otros biológicos utilizados para tratar la psoriasis moderada-grave134.
En relación a tildrakizumab, datos agregados de dos ECA fase III y más de 1.500 pacientes, a cinco años, han mostrado una tasa de incidencia por 100 pacientes-año de cualquier tipo de cáncer excluyendo el cáncer cutáneo no melanoma de 0,6-0,7 (dependiendo de la dosis), y de 0,1 en el caso del melanoma (IC 95% 0-0,3)135.
Datos a cinco años de un ECA fase III con guselkumab han mostrado una incidencia de cáncer cutáneo no melanoma de 0,34/100PY y de neoplasias distintas al cáncer cutáneo no melanom de 0,45/100PY136.
Para el resto de terapias la información actualmente disponible es muy escasa.
En la EuroGuiDerm Guideline se sugiere, con bajo nivel de evidencia, que tanto los anti-TNFα como ustekinumab o los inhibidores de la IL-17 y de la IL-23 pueden ser empleados en pacientes con psoriasis moderada-grave e historia de cáncer previo (valorando los tiempos de remisión), siempre de forma individualizada, evaluando caso por caso y asumiendo las limitaciones en cuanto a la evidencia disponible137.
El GPS considera, en línea con la propuesta de la EuroGuiDerm Guideline, que el antecedente de cáncer en remisión clínica o incluso cáncer activo no contraindica, a priori, el uso de terapias biológicas. Sin embargo, ante la falta de evidencia firme, la toma de decisiones debe realizarse de acuerdo con el oncólogo y, en particular, con el paciente. De este modo, la indicación de tratamiento biológico debe valorarse de forma individualizada ponderando la voluntad informada del paciente, el impacto negativo en la calidad de vida y las alternativas disponibles.
Síndrome metabólicoLa comorbilidad metabólica, incluyendo obesidad, DM, dislipemia e hígado graso no alcohólico ocurre de forma frecuente en los pacientes con psoriasis, en particular en las formas más graves. La asociación tiene que ver tanto con un nexo patogenético común, la participación de la inflamación en el desarrollo de resistencia periférica a la insulina, como con hábitos poco saludables frecuentes en los pacientes con psoriasis1.
La ficha técnica de los anti-TNFα recoge la posibilidad de dislipemia en algunos casos. Sin embargo, el impacto debe ser evaluado en cada caso y esta comorbilidad no representa, a priori, una contraindicación para su empleo.
El GPS no considera, en el contexto de la evidencia actual, que la presencia de síndrome metabólico justifique en sí misma la elección de una terapia biológica concreta.
Diabetes mellitusExisten resultados discordantes con respecto al uso de anti-TNFα en el metabolismo de la glucosa y sensibilidad a la insulina. Etanercept puede mejorar tanto los niveles de glucosa en plasma como la resistencia a la insulina98 y los pacientes con psoriasis que reciben un anti-TNFα presentan un menor riesgo de DM tipo 2 de nueva aparición frente a los que reciben otros tratamientos no biológicos99. En un ECA a doble ciego de 12 pacientes con psoriasis con alto riesgo de desarrollar DM tipo 2, no se encontró ningún efecto significativo sobre la secreción y la sensibilidad a la insulina tras dos semanas de tratamiento con etanercept100. Tampoco se observaron cambios significativos en los niveles de glucosa en ayunas ni en la sensibilidad a la insulina en nueve pacientes con psoriasis tras 12 semanas con adalimumab101. En un análisis agrupado de ECA de fase III, no se observó ningún efecto significativo de secukinumab con respecto al metabolismo de la glucosa102. Por otro lado, los pacientes con DM mostraron una respuesta inferior a ustekinumab y secukinumab en ECA de fase III103.
En definitiva, la información disponible no permite recomendar uno u otro tratamiento biológico en función de la presencia o no de DM. Sin embargo, la presencia de DM avanzada podría justificar la priorización de los inhibidores de la IL-17, ustekinumab o inhibidores de la IL-23.
Hígado graso no alcohólicoLa enfermedad por hígado graso no alcohólico (HGNA) está considerada la primera causa de hepatopatía crónica en los países occidentales, y puede progresar desde la esteatosis hacia diferentes estadios de inflamación, fibrosis y cirrosis (esteatohepatitis no alcohólica, EHNA). Numerosos estudios epidemiológicos permiten confirmar la mayor prevalencia de HGNA (alrededor del 50%) en la psoriasis (104). Asimismo, los pacientes con psoriasis parecen tener un mayor riesgo de progresión a formas avanzadas de HGNA. Y viceversa, los pacientes con HGNA presentan mayor gravedad de la psoriasis105.
La relación patogénica entre el HGNA y la psoriasis es compleja y probablemente multifactorial. Algunas comorbilidades frecuentes en la psoriasis, como la obesidad, la dislipemia o la DM tipo 2, son también causa de HGNA; un estado de inflamación crónica persistente y la resistencia periférica a la insulina parecen ser el vínculo patogénico entre ellas.
La elevada prevalencia de HGNA en pacientes con psoriasis puede condicionar la estrategia terapéutica. Debido a sus posibles efectos sobre la inflamación sistémica, la terapia biológica podría ejercer un impacto favorable en la evolución del HGNA. Así, el uso de anti TNF-α ha demostrado mejorar los parámetros metabólicos y hepáticos en pacientes con HGNA y psoriasis138. Recientemente, se ha implicado a la IL-17 en la patogénesis de la psoriasis y el HGNA, y en la evolución de esta última enfermedad106.
Por el momento no existen o son escasos los datos clínicos demostrables del efecto de los anti-IL17 o anti-IL23 en la evolución del HGNA102,107,108.
Enfermedad y riesgo cardiovascularLos pacientes con psoriasis presentan un mayor riesgo de eventos cardiovasculares como infarto de miocardio o accidente cerebro-vascular, en relación con la gravedad de la enfermedad. Esta incidencia incrementada se relaciona tanto con la naturaleza inflamatoria de la enfermedad cardiovascular como la coexistencia de elementos del síndrome metabólico/factores de riesgo cardiovascular o la presencia de APs139. La detección, monitorización y prevención de los factores de riesgo cardiovascular forman parte de las recomendaciones habituales en los pacientes con psoriasis1.
No existe evidencia que demuestre un impacto negativo de ninguna de las terapias biológicas disponibles sobre la morbilidad cardiovascular. El tratamiento con anti-TNFα (en particular adalimumab) y ustekinumab puede mejorar los parámetros de riesgo cardiovascular en los pacientes con psoriasis137,140–142.
González-Cantero et al., en una revisión sistemática, no encontraron una reducción significativa de la inflamación vascular aórtica en los pacientes tratados con adalimumab en comparación con los que recibieron placebo en las semanas 12-16. Tampoco encontraron ningún efecto beneficioso sobre los biomarcadores de imagen (inflamación vascular aórtica o dilatación mediada por flujo) del riesgo de enfermedad cardiovascular en pacientes expuestos a terapias biológicas (adalimumab y secukinumab) en comparación con aquellos expuestos a placebo excepto para ustekinumab, en el que se describe una reducción en la inflamación vascular aórtica en la semana 12 pero no en la semana 52. La reducción de mayor relevancia de los biomarcadores de riesgo cardiometabólico en sangre se observó con adalimumab (PCR [reacción en cadena de la polimerasa], TNF-α, IL-6 y GlycA) y fototerapia (PCR e IL-6) en comparación con placebo143.
Distintos estudios observacionales en pacientes con psoriasis han objetivado mediante coronariografía computadorizada y otras técnicas un efecto positivo de la terapia biológica en las placas de ateroma vasculares, especialmente en pacientes con psoriasis grave142,144.
En una cohorte prospectiva observacional de pacientes con bajo riesgo cardiovascular según el índice de Framingham y psoriasis moderada-grave se comprobó, después de un año de terapia biológica, un 6% de reducción de la carga de placa no calcificada (p = 0,005) con reducción del núcleo necrótico (p = 0,03), en comparación con la progresión lenta de la placa en tratamiento no biológico (cambio de -0,07 mm2 vs. 0,06 mm2; p = 0,02)142. En la misma línea, se ha comprobado en un perfil similar de pacientes una reducción del índice de atenuación grasa perivascular que, por el contrario, no varió en los pacientes no tratados con terapia biológica142.
La evidencia publicada sugiere la ausencia de efectos perjudiciales e incluso un potencial efecto beneficioso en la comorbilidad cardiovascular con el uso de terapias biológicas, que podría ser incluso evidente en individuos con todavía escaso riesgo cardiovascular. Y, en este sentido, favorecer un mejor pronóstico de la comorbilidad cardiovascular a largo plazo. Sin embargo, es insuficiente para justificar, en función de la comorbilidad cardiovascular, la indicación de terapia biológica en la psoriasis moderada-grave o, en el momento actual, la priorización de una opción en particular. La aparición de nuevas evidencias puede modificar estas consideraciones en el futuro.
Insuficiencia cardíaca congestivaEs conocida la contraindicación de los anti-TNFα, en particular adalimumab e infliximab en pacientes con insuficiencia cardíaca (IC) en estadios III/IV, y se recomienda prudencia en estadios I/II110. No hay contraindicaciones establecidas con ustekinumab, inhibidores de la IL-17 o de la IL-23 en pacientes con IC111.
Enfermedad renalLa incidencia de enfermedad renal crónica en pacientes con psoriasis está aumentada y se ha relacionado con el incremento de comorbilidades del ámbito cardio-metabólico112. Un estudio encontró un aumento importante del riesgo de muerte por enfermedad renal no hipertensiva en pacientes con psoriasis grave114. Otro estudio de cohortes también detectó un aumento en el riesgo de muerte por causa renal, incluso en pacientes con psoriasis leve113.
No existe evidencia que demuestre un impacto negativo de ninguna de las terapias biológicas disponibles sobre la función renal. De hecho, el tratamiento biológico sería preferible a fármacos convencionales con efecto potencialmente nefrotóxico como metotrexato o ciclosporina. Además, el aclaramiento de los fármacos biológicos no se ve modificado por la insuficiencia renal o la diálisis.
Por todo ello el GPS considera que la enfermedad renal no es un impedimento para el uso de estas terapias en pacientes con psoriasis moderada-grave e incluso podría ser motivo de priorización de estos fármacos frente a otras posibilidades.
Enfermedad neurológicaEn pacientes con psoriasis y enfermedades desmielinizantes, como la esclerosis múltiple (EM) o el síndrome de Guillain-Barré, pueden utilizarse diversos tratamientos, aunque con evidencia escasa.
En pacientes con enfermedades desmielinizantes se podría utilizar un inhibidor de la IL-12/23, en virtud de los datos publicados116. Hay datos que apoyan el uso de los inhibidores de la IL-17 en la EM; estudios de resonancia magnética indican que secukinumab puede reducir la actividad de las lesiones en estos pacientes117.
Se ha descrito el desarrollo o agravamiento de enfermedad desmielinizante en pacientes tratados con anti-TNFα; aunque infrecuente, es una contraindicación en caso de enfermedad activa118. En algunos casos los efectos de la enfermedad permanecerán aún después de suspender el fármaco. No existe, con la evidencia disponible, contraindicación para el resto de grupos terapéuticos en pacientes con enfermedad neurológica previa.
La tabla 6 resume las posibilidades de tratamiento según las distintas comorbilidades.
Consideraciones sobre el uso de terapias biológicas incluyendo biosimilares y moléculas sintéticas de nueva generación según la comorbilidad de base
EII: enfermedad inflamatoria intestinal; IC: insuficiencia cardiaca; ER: enfermedad renal; EM: esclerosis múltiple.
++ Significa que es una terapia preferida en estos pacientes; + uso adecuado de esta terapia; +/- información con resultados dispares o no concluyentes; ? no se dispone de suficiente información; -: no es eficaz; P significa uso con precaución; NR: no recomendado; C: contraindicado.
El tratamiento con terapias biológicas se asocia, en su conjunto, con una seguridad aceptable en la mayoría de los pacientes con psoriasis moderada-grave y ello representa, de hecho, una de las principales ventajas de su uso. Sin embargo, deben llevarse a cabo una serie de actuaciones especialmente encaminadas a la detección precoz de acontecimientos adversos (tabla 7).
Gestión del riesgo pre-tratamiento, durante el tratamiento y acontecimientos adversos más frecuentes con el uso de terapias biológicas para pacientes con psoriasis moderada y grave
| Fármaco | Pre- tratamiento | Durante el tratamiento | AA más frecuentes/ Suspensiones |
|---|---|---|---|
| Anti- TNFαInfliximabAdalimumabEtanerceptCertolizumab pegol | a) Aspectos clínicos:-Descartar infección activa (incluyendo TBC), cáncer, IC, citopenia, enfermedad desmielinizante, comorbilidad relevante-Descartar contactos recientes con pacientes con TBC-Identificar deseo gestacional y test embarazo si necesario-Evitar embarazo (excepto para certolizumab pegol)b) Pruebas complementarias:-Hemograma, bioquímica-Serología VHA, VHB, VHC, VIH, lúes-Rx de tórax-Mantoux/IGRAsc) Otras actuaciones:-Vacuna antineumocócica y antigripal-Valorar vacuna VHB- Valorar Vacuna varicela-zoster recombinante-Evitar vacunas con microorganismos atenuados o vivos | a) Aspectos clínicos:-Aparición de infecciones (incluyendo TBC), citopenia grave, enfermedad desmielinizante, neuritis óptica, cáncer-Aparición o empeoramiento de IC y de neumopatíab) Pruebas complementarias:-Hemograma y bioquímica general a los 4-6 meses del inicio del tratamiento, y posteriormente en función de las características del pacientec) Otras actuaciones:-En función de la evolución del paciente | -AA más frecuentes(≥ 1/100 a < 1/10)Infecciones (sobretodo respiratorias)LeucopeniaIncremento lípidosCefaleaNauseas, vómitosIncrementos enzimas hepáticosReacciones lugar inyecciónDolor musculoesquelético-Valorar suspensión:Si aparición de cáncer, enfermedad desmielinizante o neuritis óptica, citopenia grave, neumopatía intersticial nueva o agravamiento de previa, u otros eventos graves relacionados con el fármacoTemporal si infecciónSi embarazo/lactancia (excepto certolizumab pegol), cirugía con riesgo para infección. |
| Inhibidores IL-17BimekizumabBrodalumabIxekizumabSecukinumab | a) Aspectos clínicos-Descartar infección activa (incluyendo TBC), cáncer, citopenia (especialmente vigilancia al nivel de neutrófilos), comorbilidad relevante-No se recomienda en pacientes con EII-Valorar el riesgo beneficio si antecedentes de depresión y/o conducta o ideación suicida (según tabla 6)-Descartar contactos recientes con pacientes con TBC-Evitar embarazob) Pruebas complementarias (similar a anti-TNFα)c) Otras actuaciones (similar a anti-TNFα) | a) Aspectos clínicos-Aparición de infecciones (incluyendo TBC), citopenia grave u otras relacionadas con el fármacob) Pruebas complementarias:-Hemograma y bioquímica general a los 4-6 meses del inicio del tratamiento, y posteriormente en función de las características del pacientec) Otras actuaciones:-En función de la evolución del paciente | -AA más frecuentes (≥ 1/100 a < 1/10):Infecciones: infecciones por Candida, Influenza, tiña, herpes simple, pie de atletaCefaleaDolor orofaríngeoRinorreaTrastornos gastrointestinales: diarrea y náuseasTrastornos musculoequeléticosTrastornos generales: fatiga, reacciones en la zona de inyección, incluyendo eritema, dolor, prurito, hematomas y hemorragia en la zona de inyección-Valorar suspensión:Si aparición de cáncer, citopenia grave u otros eventos graves relacionados con el fármacoTemporal si infecciónSi embarazo/lactancia, cirugía |
| Inhibidores IL 23GuselkumabRisankizumabTildrakizumabInhibidores IL 12 / 23Ustekinumab | a) Aspectos clínicos-Descartar infección activa (incluyendo TBC), cáncer, citopenia, comorbilidad relevanteEn el desarrollo clínico de risankizumab, algunos pacientes con TBC latente no recibieron tratamiento específico antituberculoso y no presentaron reactivación de la enfermedad, aunque estos datos no modificaron la indicación de profilaxis en su ficha técnica.-Evitar embarazob) Pruebas complementarias (similar a anti-TNFα)c) Otras actuaciones (similar a anti-TNFα) | a) Aspectos clínicos:-Aparición de infecciones (incluyendo TBC), citopenia grave u otras relacionadas con el fármacob) Pruebas complementarias:-Hemograma y bioquímica general a los 4-6 meses del inicio del tratamiento, y posteriormente en función de las características del pacientec) Otras actuaciones:-En función de la evolución del paciente | -AA más frecuentes (≥ 1/100 a < 1/10):Infecciones: respiratorias, gastroenteritis, herpes simple, tiña, nasofaringitis, sinusitisCefaleaDiarrea, náusea y vómitosArtralgias, dolor de espalda, mialgiasDolor orofaríngeoPruritoFatigaEritema y dolor en el lugar de inyección-Valorar suspensión:Si aparición de cáncer, citopenia grave u otros AA graves relacionados con el fármacoTemporal si infecciónSi embarazo/lactancia, cirugía |
AA: acontecimientos adversos; EII: enfermedad inflamatoria intestinal; IC: insuficiencia cardiaca; IGRAs: interferon gamma releasing assays; RM: resonancia magnética; Rx: radiografía; TBC: tuberculosis; TNF: factor de necrosis tumoral; VHA: virus de hepatitis A; VHB: virus de hepatitis B; VHC: virus de hepatitis C.
Los requisitos de cribado recomendados antes de iniciar la terapia biológica deberían ser comunes para todos los fármacos sistémicos, permitiendo una valoración global del perfil de seguridad del paciente que permita iniciar cualquier opción disponible a lo largo del recorrido terapéutico del paciente.
Teniendo en cuenta la escasa sensibilidad de la monitorización analítica para la detección de la mayor parte de acontecimientos adversos relacionados con el tratamiento, se recomienda realizar analíticas periódicas solo en aquellos pacientes en los que por el tratamiento o con determinadas comorbilidades o por la clínica de los mismos, se considere necesario (salvo que la ficha técnica refleje otras recomendaciones) (tabla 7).
A continuación resumimos algunos aspectos de especial consideración en la gestión del riesgo de pacientes tratados con terapias biológicas.
NeurotoxicidadEn principio, los fármacos anti-TNFα se desaconsejan en pacientes con psoriasis y esclerosis múltiple, por facilitar el desarrollo de la enfermedad o por empeoramiento de los síntomas pre-existentes. Además, se debe considerar la interrupción del tratamiento si se desarrolla alguno de estos trastornos o se produce empeoramiento de la enfermedad neurológica pre-existente145.
No se han descrito casos o alertas en relación a posible neurotoxicidad con otras terapias biológicas116,117.
TuberculosisEl cribado de tuberculosis (TBC) activa o latente forma parte de las recomendaciones habituales para realizar antes y durante el tratamiento con terapias biológicas. Antes de iniciar el tratamiento se recomienda una anamnesis específica, destinada a descartar historia presente o pasada de TBC, una radiografía de tórax, y una prueba cutánea y/o serológica. En el caso de detectar TBC latente, debe llevarse a cabo una profilaxis siguiendo las pautas y recomendaciones locales. Sin embargo, debe tenerse en cuenta que la profilaxis secundaria de la TBC no está exenta de efectos secundarios.
Está ampliamente documentado el incremento de riesgo de reactivación de TBC con el uso de los anti-TNFα146. Una revisión sistemática de ECA con inhibidores de la IL-23 e IL-17 no encontró un incremento del riesgo de TBC con respecto a la población general. En el desarrollo clínico de risankizumab, algunos pacientes con TBC latente no recibieron tratamiento específico antituberculoso y no presentaron reactivación de la enfermedad147. Sin embargo, esto no modificó la indicación de profilaxis en su ficha técnica.
El GPS considera que en aquellos pacientes con TBC latente en los que esté contraindicada (o suponga un gran riesgo) realizar la profilaxis anti-tuberculosa, risankizumab podría ser una opción aceptable. No existe experiencia en este sentido en otros fármacos del mismo grupo terapéutico (guselkumab y tildrakizumab), aunque existe semejanza en el mecanismo de acción. Se requieren datos a largo plazo de vida real con los nuevos grupos farmacológicos para poder emitir recomendaciones robustas.
Incluso en caso de negatividad de las pruebas realizadas en el cribado, el paciente puede presentar una primoinfección durante el tratamiento. No está bien establecido si debe llevarse a cabo un re-test y con qué frecuencia. Este debería realizarse de forma personalizada, en función del perfil de riesgo epidemiológico y de la presencia de síntomas sugestivos148. En la tabla 8 se resume el riesgo de reactivación de TBC con el uso de las terapias biológicas incluyendo biosimilares y moléculas sintéticas de nueva generación.
Riesgo de reactivación de tuberculosis con el uso de terapias biológicas incluyendo biosimilares en pacientes con psoriasis moderada-grave
| Fármaco/s | Riesgo de desarrollo de tuberculosis |
|---|---|
| Anti-TNFα | Riesgo incrementado en ECA y vida real146,149 |
| Ustekinumab | Riesgo incierto (casos descritos) en ECA134,150 |
| Secukinumab | Sin incremento de riesgo en ECAl151,152 |
| Ixekizumab | Sin incremento de riesgo en ECA149,152 |
| Brodalumab | Sin incremento de riesgo en ECA149,152 |
| Guselkumab | Sin incremento de riesgo en ECA149,153 |
| Tildrakizumab | Sin incremento de riesgo en ECA149,154 |
| Risankizumab | Sin incremento de riesgo en ECA149,155 |
ECA: ensayo clínico aleatorizado.
Las determinaciones serológicas frente al virus de la hepatitis B (VHB) forman parte de las actuaciones habituales a realizar de forma previa al inicio de terapias biológicas (tabla 9). En la EuroGuiDerm Guideline137, se recomienda el cribado para la hepatitis B (HBsAg, anti-HBs, anti-HBc) y C tanto de forma previa al inicio de terapias convencionales como de terapias biológicas. Sin embargo, también se aconseja, con evidencia firme, no incluir la serología de la hepatitis A de forma rutinaria en el cribado.
Interpretación de la serología para el VHB
| HBsAganti-HBcanti-HBs | NegativoNegativoNegativo | No infectado ni vacunado |
| HBsAganti-HBcanti-HBs | NegativoPositivoPositivo | Inmune por infección natural |
| HBsAganti-HBcanti-HBs | NegativoNegativoPositivo | Inmune por vacuna contra el VHB |
| HBsAganti-HBcIgM anti-HBcanti-HBs | PositivoPositivoPositivoNegativo | Infección aguda por VHB |
| HBsAganti-HBcIgM anti-HBcanti-HBs | PositivoPositivoNegativoNegativo | Infección crónica por VHB |
| HBsAganti-HBcanti-HBs | NegativoPositivoNegativo | Interpretación poco clara, 4 posibilidades:Infección resuelta (lo más común)Anti-HBc falso positivoInfección crónica de «bajo nivel»Infección aguda en resolución |
VHB: virus hepatitis B; HBsAg: antígeno de superficie del virus de la hepatitis B; antiHBc: anticuerpo del núcleo del virus de la hepatitis B; anti-HBs: anticuerpo de superficie del virus de la hepatitis B.
Una vez conocido el estado de inmunización, se podría valorar en los pacientes HBsAg/Anti HBc negativos la conveniencia de administrar la primera dosis (o dosis de refuerzo si fuese necesario) antes del inicio del tratamiento biológico. El resto de dosis pueden ser administradas con seguridad, incluso bajo un tratamiento con anti-TNFα en curso156,157. Los pacientes con antiHBc positivo y HBsAg positivo deben considerarse como portadores de una infección activa y deberían ser referidos y evaluados por un hepatólogo antes de iniciar tratamiento biológico.
El grupo más complejo viene definido por aquellos pacientes con anti-HBc positivo y HBsAg negativo. En estos pacientes se debería llevar a cabo una determinación de ADN para el VHB. Si es negativo, podría iniciarse un tratamiento con estas terapias con las consideraciones de seguimiento locales que se acordasen con el referente de Hepatología, siendo preferible iniciar el tratamiento con ustekinumab, inhibidores de la IL-17 o IL-23. Hasta la fecha no se han descrito casos de reactivación de hepatitis B para ixekizumab, brodalumab, guselkumab, tildrakizumab y risankizumab158.
Los pacientes con infección activa por el VHB (HBsAg positivo), requieren un control por parte del hepatólogo y tratamiento antivírico antes de iniciar la terapia de la psoriasis con biológicos, metotrexato o ciclosporina.
Una revisión de la literatura muestra un riesgo escaso de reactivación de infección por virus de la hepatitis C (VHC) en pacientes con psoriasis tratados con terapia biológica159. Existe experiencia en el tratamiento de la psoriasis con etanercept en pacientes con infección por VHC, e incluso ese fármaco se empleó como adyuvante de interferón y rivabirina, con un mayor porcentaje de pacientes con ausencia de (ácido ribonucleico del virus de la hepatitis C) y mayor regresión de la fibrosis hepática en comparación con el grupo placebo. El uso de infliximab es controvertido, por la posibilidad de toxicidad hepática, y la experiencia con certolizumab y golimumab muy limitada. Existe experiencia restringida a casos aislados en relación con ustekinumab con resultados controvertidos, así como unos pocos pacientes tratados con secukinumab sin reactivación de la infección vírica ni empeoramiento del perfil de transaminasas149.
En su conjunto, la experiencia acumulada permite sugerir que el tratamiento biológico en pacientes con psoriasis e infección por el VHC puede llevarse a cabo, en coordinación con el hepátologo y con seguimiento clínico, analítico y virológico. La existencia de tratamiento curativo de la infección por VHC hace probable que esta enfermedad deje de ser prevalente en muchos ámbitos y, por lo tanto, también se minimice el riesgo de interferencia con el tratamiento de la psoriasis en la práctica diaria.
Infección por VIHAunque la experiencia es limitada, existen publicaciones que muestran ausencia de alteración y buen control de la infección por virus de la inmunodeficiencia humana (VIH) en combinación con fármacos antirretrovirales en pacientes con psoriasis tratados con etanercept, infliximab, adalimumab y ustekinumab. En el registro prospectivo BIOBADADERM no se detectaron signos de reactivación de la infección por VIH en pacientes tratados con terapias biológicas en la práctica clínica real160.
Se considera que, aunque la evidencia es escasa, puede realizarse tratamiento concomitante con terapia biológica en pacientes con psoriasis e infección por VIH en coordinación con el infectólogo, combinado con terapia antiviral adecuada y con seguimiento clínico y analítico periódico. No existe experiencia con fármacos anti IL-17 o anti IL-23, aunque no hay evidencia de impacto sobre la enfermedad infecciosa en el caso de otras virasis crónicas.
VacunaciónEn su conjunto, las terapias biológicas actúan a través de una inmunosupresión selectiva que no parece interferir de forma significativa en la producción de anticuerpos, preservando la respuesta humoral de las vacunas161. En la tabla 10, se resumen las principales características de las vacunas disponibles y en la tabla 11, las recomendaciones del Advisory Committee for Immunization Practices157, que podría servir de guía de uso en consulta.
Principales características de algunas de las vacunas disponibles en España y su recomendación en caso de uso de terapia biológica incluyendo biosimilares y pequeñas moléculas
| Vacuna | Clasificación microbiológica | Principio activo | Recomendación |
|---|---|---|---|
| Varicela | Microorganismo vivo atenuadoRecombinante | Virus varicela atenuados, cepa OkaGlicoproteína E del virus varicela zoster | ContraindicadaPosible |
| Parotiditis, rubéola, sarampión | Microorganismo vivo atenuado | Virus parotiditis atenuados, virus rubéola atenuados, virus sarampión atenuados | Contraindicada |
| Fiebre amarilla | Microorganismo vivo atenuado | Virus fiebre amarilla, cepa 17D-2004 | Contraindicada |
| Fiebre tifoidea | Microorganismo vivo atenuado | Salmonella typhi atenuados, cepa Ty21a | Contraindicada |
| Polisacáridos simples | Polisacáridos simples Salmonella typhi, PSC Vi | Posible | |
| Poliomielitis | Microorganismos inactivados | Poliovirus inactivados 1,2,3 | Posible |
| Gripe | Microorganismos fraccionados | Virus (V) gripe fraccionados | Recomendada |
| Subunidades | Ags superficie H y N del v gripal | Recomendada | |
| Gripe A (H1N1) | Subunidades | Virus gripe Ags superficie | Recomendada |
| Haemofilus influenza B | Conjugada | PRP-TT | Posible |
| Hepatitis A | Microorganismos inactivados | Virus hepatitis A inactivados | Recomendada |
| Virosomas | Virus hepatitis A inactivados | Recomendada | |
| Hepatitis B | Recombinante | HBsAg recombinante | Recomendada |
| Papilomavirus humano | Recombinante | Proteínas L1 del VPH | Posible |
| Meningococo C | Conjugada | PSC de-O-acetilado MC | Posible |
| Neumococo | Polisacáridos simples | PSC neumococo 23-V | Recomendada |
| Conjugada | Sacáridos neumococo-CRM197 | Recomendada | |
| Conjugada | Proteina D, PSC neumococos | Recomendada | |
| Difteria | Toxoide | Toxoide diftérico tipo adulto | Posible |
| Tétanos | Toxoide | Toxoide tetánico | Posible |
| Tos ferina | Toxoide | Toxoide pertúsico | Posible |
| COVID | ARNVectores víticos | ARNmMaterial genético | Recomendada |
ARN: ácido ribonucleico; ARNm: ácido ribonucleico mensajero; HBsAg:antígeno de superficie del virus de la hepatitis B; MC:;PSC:; PRP-TT:; VPH: virus del papiloma humano.
Recomendaciones del Advisory Committee for Immunization Practices157
| Vacuna | Recomendación |
|---|---|
| Gripe | -Vacunación anual |
| Parotiditis, rubéola, sarampión | -1 ó 2 dosis, en pacientes nacidos después de 1957 que hayan perdido inmunidad |
| Varicela | -Adultos sin datos de enfermedad previa, deben someterse a test de inmunidad; si no, estarían indicadas dos dosis; si se recibió una dosis con anterioridad, con un recuerdo sería suficiente |
| Herpes zoster | -1 dosis para adultos mayores de 60 años |
| Neumococo | -1 dosis para adultos mayores de 65 años |
| Difteria y tétanos | -Recuerdo cada 10 años y en heridas de alto riesgo |
| Papilomavirus humano | -Recomendada para mujeres no vacunadas hasta los 26 años y para hombres hasta los 21 años |
| Hepatitis A, hepatitis B, Haemophilus influenzae tipo B y meningococo | -Según calendario vacunal o situaciones de riesgo individuales |
Se recomienda seguir de forma estricta todas las medidas preventivas y de salud públicas emitidas para la COVID-19. De este modo, se sugiere la realización de una prueba diagnóstica en caso de contacto estrecho con diagnóstico de COVID-19 positivo aunque el paciente con psoriasis esté asintomático.
Salvo contraindicación, se recomienda la vacuna contra la COVID-19 siempre bajo la supervisión del dermatólogo responsable del paciente, dado que en determinados casos debe (o puede) establecer el mejor momento o pauta de administración de la vacuna en relación con el tratamiento que recibe (resumen a continuación en la tabla 12)162.
Posicionamiento del GPS en relación con las vacunas contra COVID-19162
| # | Comentarios/recomendaciones |
|---|---|
| 1 | En el momento actual, no existe evidencia alguna de que la administración de las vacunas tenga efectos negativos en el curso de la psoriasis |
| 2 | Las vacunas disponibles en la actualidad están basadas en tecnologías que no suponen ningún riesgo de activación de la infección |
| 3 | Las vacunas disponibles en la actualidad NO SON vacunas de virus vivos atenuados, que son las que están contraindicadas en pacientes que reciben tratamiento inmunosupresor |
| 4 | La información disponible refleja que la seguridad a corto plazo es favorable, con efectos secundarios similares a otras vacunas habituales. El efecto secundario más común es el dolor en el lugar de la inyección. Cierta sensación de cansancio o debilidad, fatiga y dolor de cabeza son otros efectos secundarios relativamente comunes, mientras que es infrecuente que aparezca fiebre alta. Estos efectos secundarios generalmente se resuelven en un par de días y responden a paracetamol o a fármacos antiinflamatorios no esteroideos como el ibuprofeno |
| 5 | No se recomiendan en personas que han sufrido reacciones alérgicas a sus componentes |
| 6 | No se espera que la toma de fármacos sistémicos convencionales o biológicos se asocie a ninguna complicación adicional con las vacunas para COVID-19 |
| 7 | -Metotrexato y ciclosporina A disminuyen la respuesta inmune frente a algunas vacunas, y se puede considerar la suspensión transitoria de estos tratamientos antes y después de la vacunación teniendo en cuenta la semivida de estos fármacos-En su conjunto hay evidéncia de que los tratamientos biológicos de la psoriasis pueden reducir la respuesta inmune celular, que no la humoral, frente a la vacuna, sin que se haya demostrado que disminuyan la protección proporcionada por la vacuna COVID.- Los anti-TNFα pueden disminuir la tasa de anticuerpos inducida por algunas vacunas, pero sin efecto significativo sobre la protección conferida-Ustekinumab, secukinumab e ixekizumab no disminuyen la inmunogenicidad de las vacunas y no existen datos sobre los fármacos de más reciente introducción, aunque cabe suponer que se comportarán como los de su clase correspondiente-En cualquier caso, siempre deberá considerarse como opción preferible la vacunación si no pueden llevarse a cabo modificaciones individualizadas del tratamiento |
La leishmaniasis es una enfermedad infecciosa crónica causada por protozoos del género Leishmania y transmitida al ser humano por la picadura de flebótomos. En Europa, los países mediterráneos son las zonas más afectadas. La especie infectante de Leishmania es muy importante para determinar las manifestaciones clínicas, y la respuesta inmunitaria del huésped para determinar el resultado clínico de la infección. De este modo, se ha notificado la presencia de leishmaniasis asociada al uso de diversos fármacos inmunosupresores.
Se ha descrito una mayor prevalencia de leishmaniasis subclínica en pacientes con enfermedades reumáticas inflamatorias que recibían fármacos biológicos que en los tratados con otros inmunosupresores163. Estos tratamientos pueden provocar manifestaciones atípicas de leishmaniasis con lesiones extendidas a grandes áreas cutáneas y asociadas a una posible afectación de las mucosas. Sería conveniente una anamnesis guiada en zonas endémicas antes de iniciar el tratamiento con terapias biológicas.
La enfermedad de Chagas es cada vez más prevalente en nuestro medio en población procedente de áreas endémicas, probablemente debido a un mejor acceso a la atención sanitaria y a la disponibilidad de tratamientos inmunosupresores más potentes. Es por ello que convendría considerar el cribado en los pacientes de riesgo, antes de iniciar la inmunosupresión, y de ser necesario un tratamiento precoz con benznidazol y un seguimiento estrecho para prevenir la reactivación clínica164.
InmunogenicidadEl desarrollo de anticuerpos contra el fármaco (inmunogenicidad) es un fenómeno relativamente frecuente con el uso de las terapias biológicas incluyendo biosimilares. Sin embargo, desde el punto de vista de la seguridad, no se ha demostrado que estén implicados en una mayor toxicidad165.
En algunos casos el desarrollo de anticuerpos contra el fármaco puede producir una disminución en la respuesta terapéutica, ya sea porque los anticuerpos sean neutralizantes (impidan la unión a la diana) o porque formen inmunocomplejos y aumenten el aclaramiento del fármaco biológico. Los anticuerpos son específicos de fármaco, y presentan reacción cruzada con los correspondientes biosimilares. Aunque están descritos en todos los fármacos biológicos, en el caso de los anti-TNFα pueden tener un impacto negativo en su eficacia. La repercusión clínica de los anticuerpos contra ustekinumab, inhibidores de la IL-17 y la IL-23 es muy baja o inexistente166. En la tabla 13, se resume la prevalencia de anticuerpos contra el fármaco y su efecto en la eficacia y seguridad.
Prevalencia de anticuerpos contra el fármaco en estudios de psoriasis
| Estudio | Prevalencia anticuerpos y anticuerpos neutralizantes contra el fármaco | Problemas eficacia | Problemas seguridad |
|---|---|---|---|
| Adalimumab | |||
| Blauvelt 2018 167 | -Semana 0-17: 34%-Semana 17-51: 45% | No | No |
| Papp 2017168 | -Semana 16: 64% (14% neutralizantes)-Semana 20: 60% (11% neutralizantes) | No se analiza | No se analiza |
| Menter 2008 169 | -Semana 52: 9% | Sí (reducción de eficacia en algunos casos) | No se analiza |
| Brodalumab | |||
| Lebwohl 2015 170 | -Semana 52: 2% (0% neutralizantes) | No | No |
| Certolizumab pegol | |||
| Análisis agregado CIMPASI-1, y 2 171 | -Semana 48 (200 mg): 19%-Semana 48 (400 mg): 8% | Sí (reducción de eficacia en algunos casos) | No se analiza |
| Etanercept | |||
| Griffiths 2017 172 | -Semana 12: 2% (0% neutralizantes) | No | No |
| Gerdes 2018 173 | -Semana 12-30: 0% (0% neutralizantes) | No mostrada | |
| Tyring 2007 174 | -Semana 96: 18% (0% neutralizantes) | No | No |
| Guselkumab | |||
| Zhu 2019175 | -Semana 100: 9% | No | No |
| Langley 2018 121 | -Semana 60: 9% | No se analiza | No se analiza |
| Infliximab | |||
| Reich 2005176 | -Semana 46: 22%-Semana 66: 19% | Sí (reducción de eficacia en algunos casos) | No |
| Ixekizumab | |||
| Reich 2018177 | -Semana 60: 17% (3,5% neutralizantes) | Sí (reducción de eficacia en algunos casos) | No se analiza |
| Gordon 2016 119 | -Semana 12: 9% | Sí (reducción de eficacia en algunos casos) | No se analiza |
| Risankizumab | |||
| Ficha técnica6 | -Semana 52: 24% | Sí (reducción de eficacia en algunos casos) | Aumento de reacciones locales (leves y transitorias) |
| Secukinumab | |||
| Reich 2017178 | -Semana 60: < 0,4% | No | No |
| Tildrakizumab | |||
| Kimball 2020 179 | -Semana 52/64 (100 mg): 7%-Semana 52/64 (100 mg): 8% | Sí (reducción de eficacia en algunos casos) | No |
| Ustekinumab | |||
| Langley 2018 121 | -Semana 60: 15% | No se analiza | No se analiza |
| Tsai 2011180 | -Semana 36: 4% | Sí (reducción de eficacia en algunos casos) | No se analiza |
| Griffiths 2010 181 | -Semana 64: 4% | No se analiza | No |
| Leonardi 2008 182 | -Semana 76: 5% | No se analiza | No |
| Papp 2008183 | -Semana 52: 5% | Sí (reducción de eficacia en algunos casos) | |
mg: miligramos.
La evidencia de que exista un riesgo aumentado de infección u otras complicaciones con el uso de terapias biológicas en pacientes con psoriasis moderada-grave sometidos a cirugía es escasa156. En casos de cirugía electiva se recomienda hacer una valoración previa de otros factores de riesgo de infecciones (por ejemplo, pacientes diabéticos mal controlados o con uso de corticoides), el tipo de cirugía, y el estado de la psoriasis antes de tomar una decisión, y solo llevar a cabo acciones proactivas – por ejemplo ajuste de los intervalos de administración de la terapia o suspensión transitoria – en los casos de riesgo de infección (prótesis, colecistectomía, cataratas, implantes, etc.). Este ajuste resulta más conveniente en aquellos fármacos con intervalos de administración prolongados.
Conclusiones finalesEl conocimiento acumulado en terapia biológica, tanto procedente de los ensayos clínicos como en práctica clínica real, en el contexto de la exigencia de efectividad, seguridad y de eficiencia, obliga a tener en cuenta las distintas situaciones clínicas evaluadas en esta actualización.
La gestión del riesgo, esencial en el contexto del uso de fármacos inmunomoduladores destinados a un uso a largo plazo, debe ser cambiante y adaptarse al conocimiento disponible y también a la evolución en el mecanismo de acción de la terapia biológica. De este modo, debe encontrarse un equilibrio entre una garantía razonable para los pacientes en tratamiento con el uso y unas indicaciones racionales de monitorización en función de la evidencia disponible.
FinanciaciónEste trabajo ha sido financiado en su totalidad a través de recursos propios de la Academia Española de Dermatología y Venereología (AEDV).
Conflicto de interesesJosé Manuel Carrascosa ha participado como IP/SI y/o recibido honorarios como ponente y/o miembro de comité de expertos o steering comitee para Abbvie, Novartis, Janssen, Lilly, Sandoz, Amgen, Almirall, BMS, Boehringer ingelheim, Biogen, UCB.
Laura Salgado-Boquete ha participado como IP/SI y/o recibido honorarios como ponente y/o miembro de comité de expertos o asesor científico para Abbvie, Celgene, Leo Pharma, Novartis, Janssen, Lilly, Sandoz, Amgen, Almirall, UCB, Pfizer y MSD.
Lluis Puig ha participado como IP/SI y/o recibido honorarios como ponente y/o miembro de comité de expertos o asesor científico para Abbvie, Almirall, Amgen, Baxalta, Biogen, Boehringer Ingelheim, Celgene, Gebro, Janssen, JS BIOCAD, Leo-Pharma, Lilly, Merck-Serono, MSD, Mylan, Novartis, Pfizer, Regeneron, Roche, Sandoz, Samsung-Bioepis, Sanofi y UCB.
Elena del Alcázar ha participado como IP/SI y/o recibido honorarios como ponente para Abbvie, Almirall, Amgen, Celgene, Janssen, Leo-Pharma, Lilly,Novartis, Sanofi y UCB.
Isabel Belinchón ha participado como IP/SI y/o recibido honorarios como ponente y/o miembro de comité de expertos o asesor científico para Abbvie, Almirall, Amgen, BMS, Clegene, Janssen, Lilly, Leo-Pharma, Novartis, UCB.
Pablo de la Cueva ha participado como investigador y/o asesor y/o ponente con los siguientes laboratorios farmacéuticos: Abbvie, Almirall, Amgen, Astellas, Biogen, BMS, Boehringer, Celgene, Gebro, Janssen, LEO Pharma, Lilly, MSD, Novartis, Pfizer, Sandoz, Sanofi y UCB.
David Moreno ha sido investigador principal y co-investigador en ensayos clínicos promovidos por las compañías Lilly, Novartis, Amgen, Almirall, Boehringer y Leo-Pharma.
Juan José Andrés Lencina ha participado como IP/SI y/o recibido honorarios como ponente y/o miembro de comité de expertos o asesor científico para Abbvie, Leo Pharma, Novartis, Janssen y UCB.
Los autores quieren agradecer a los miembros del GPS por sus contribuciones al documento: Mª Teresa Abalde Pintos, Ignacio Alonso García, María Luisa Alonso Pacheco, Alsina Gibert Mercé, Gloria Aparicio Español, Mariano Ara Martín, Susana Armesto Alonso, Antoni Azón Masoliver, Ferrán Ballescá López, Ofelia Baniandres Rodríguez, Didac Barco Nebreda, Alvaro Barranquero Fernández, Ana Batalla Cebey, Isabel Bielsa Marsol, Xavier Bordas Orpinell, Leopoldo Borrego Hernando, Rafael Botella Estrada, Jesús María Careaga Alzaga, Rafael Carmena Ramón, Gregorio Carretero Hernández, Ana María Carrizosa Esquivel, Jose Manuel Casanova Seuma, Alberto Conde Taboada, Marisol Contreras Stelys, Pablo Coto Segura, Esteban Daudén Tello, Carlos De La Torre Fraga, Rubén Del Río Gil, Aleisandre Docampo Simón, Noemí Eiris Salvado, Juan Escalas Taberner, Esther Eusebio Murillo, Jose Manuel Fernandez Armenteros, Emilia Fernandez López, Mª Luisa Fernández Díaz, Almudena Fernández Orland, Carlos Ferrándiz Foraster, Marta Ferrán Farrés, Lara Ferrándiz Pulido, Eduardo Fonseca Capdevila, Manuel Galán Gutiérrez, Francisco Javier Garcia Latasa De Araníbar, Ptableilar Garcia Muret, Vicente Garcia-patos Briones, Marta García Bustínduy, Ignacio García Doval, Rosa García Felipe, Alicia L. González Quesada, Beatriz González Sixto, Alfonso González Morán, Teresa Gárate Ayastui, Francisco José Gómez García, Jose Manuel Hernanz Hermosa, Mª Isabel Hernández García, Pedro Herranz Pinto, Enrique Herrera Ceballos, Marta Herrera Sánchez, Rafael Jesús Jiménez Puya, Enrique Jorquera Barquero, Rosario De Fátima Lafuente Urrez, Salvador V.Laguarda Porter, Mónica Larrea Garcia, Mª Del Mar Llamas Velasco, Anna López Ferrer, Jesús Luelmo Aguilar, Pablo Lázaro Ochaita, Jose Luis López Estebaranz, María Marcellán Fernández, Amparo Marquina Vila, Eugenio Marrón Moya Servando, Trinidad Martin González, Antonio Martorell Calatayud, Francisco Javier Mataix Díaz, Almudena Mateu Puchades, Carolina Medina Gil, Mª Victoria Mendiola Fernández, Miren Josune Michelena Eceiza, Jordi Mollet Sánchez, José Carlos Moreno Giménez, Carlos Muñoz Santos, Antoni Nadal Nadal, Belén Navajas Pinedo, Jaime Notario Rosa, Francisco Peral Rubio, Narciso Perez Oliva, Celia Posada García, Josep A. Pujol Montcusi, Conrado Pujol Marco, Silvia Pérez Barrio, Amparo Pérez Ferriols, Beatriz Pérez Suárez, Trinidad Repiso Montero, Miquel Ribera Pibernat, Raquel Rivera Díaz, Vicente Rocamora Durán, Jesús Rodero Garrido, Sabela Rodríguez Blanco, Mª del Carmen Rodríguez Cerdeira, Lourdes Rodríguez Fernández – Freire, Manuel Ángel Rodríguez Prieto, Jorge Romani De Gabriel, Alberto Romero Maté, Mónica Roncero Riesco, Cristina Rubio Flores, José Carlos Ruiz Carrascosa, Diana Patricia Ruiz Genao, Ricardo Ruiz Villaverde, Montserrat Salleras Redonnet, Jorge Santos-Juanes Jiménez, María José Seoane Pose, Patricia Serrano Grau, Estrella Simal Gil, Caridad Soria Martínez, José Luis Sánchez Carazo, Manuel Sánchez Regaña, Mª Dolores Sánchez-Aguilar Rojas, Rosa Taberner Ferrer, Lucía Tomás Aragonés, Francisco Valverde Blanco, Ricardo Valverde Garrido, Francisco Vanaclocha Sebastián, Manel Velasco Pastor, Diana Velázquez Tarjuelo, Asunción Vicente Villa, David Vidal Sarró, Jaime Vilar Alejo, Eva Vilarrasa Rull, Marta Vilavella Riu, Rosario Vives Nadal, Hugo Alberto Vázquez Veiga, Juan Ignacio Yanguas Bayona, Ander Zulaica Garate y a Estibaliz Loza (INMUSC) por el apoyo como documentalista en el proyecto.