El síndrome de Birt-Hogg-Dubé (SBHD) es una rara genodermatosis de herencia autosómica dominante caracterizada esencialmente por la presencia de fibrofoliculomas y/o tricodiscomas, quistes pulmonares, neumotórax espontáneos y cánceres renales, siendo los tipos histológicos más frecuentes las formas híbridas de oncocitoma y carcinoma cromófobo o formas puras de carcinoma cromófobo, oncocítico, de células claras o papilar. El gen implicado en este síndrome, FLCN, codifica la foliculina, que se expresa preferentemente a nivel cutáneo, renal y pulmonar. Este síndrome puede presentarse con una gran variabilidad clínica, y las lesiones cutáneas que son el signo de alarma para los dermatólogos pueden estar ausentes hasta en un 70% de los casos. Así, aunque las lesiones cutáneas son, junto con las mutaciones del gen FLCN, los criterios mayores para el diagnóstico del SBHD, este diagnóstico es posible incluso cuando no existe confirmación histológica de fibrofoliculomas o tricodiscomas, por las mencionadas manifestaciones extracutáneas, con o sin antecedentes familiares conocidos.
Birt-Hogg-Dubé syndrome is a rare autosomal dominant genodermatosis that is characterized by the presence of fibrofolliculomas and/or trichodiscomas, pulmonary cysts, spontaneous pneumothorax, and renal tumors. The most common histological types found in renal tumors from patients with the syndrome are oncocytoma-chromophobe carcinoma hybrids and pure forms of chromophobe carcinoma, oncocytic carcinoma, and clear cell or papillary cell carcinoma. The syndrome is linked to mutations in the FLCN gene, which encodes folliculin and is preferentially expressed in the skin, kidney, and lung. The syndrome can exhibit a high degree of clinical variability, and the skin lesions that are a warning sign for dermatologists may be absent in up to 70% of cases. Consequently, although skin lesions and mutations in FLCN are the main diagnostic criteria for Birt-Hogg-Dubé syndrome, a diagnosis can be made based on noncutaneous manifestations, with or without known family history of the syndrome, even in the absence of histological confirmation of fibrofolliculomas or trichodiscomas.
En 1977 Birt et al. describieron por primera vez la presencia, en una serie de pacientes, de múltiples lesiones papulosas del color de la piel, de aspecto cupuliforme, localizadas en la cara, el cuello y el tronco1. Estas lesiones correspondían histológicamente a fibrofoliculomas, tricodiscomas y fibromas blandos. Esta asociación se definió como síndrome Birt-Hogg-Dubé, una genodermatosis de herencia autosómica dominante caracterizada por la presencia de lesiones cutáneas características, confirmándose más de 20 años después su asociación a cánceres renales y/o lesiones pulmonares2.
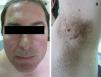
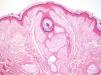
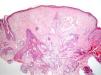
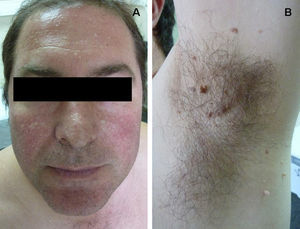
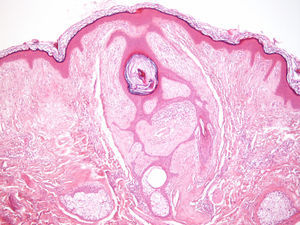
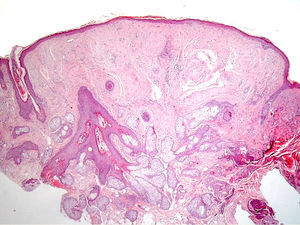
ClínicaManifestaciones cutáneasClínicamente, en la piel, el síndrome Birt-Hogg-Dubé se caracteriza esencialmente por la presencia de fibrofoliculomas y/o tricodiscomas que suelen presentarse alrededor de la tercera y cuarta décadas de la vida. Parece ser que los tricofoliculomas, tricodiscomas y acrocordones descritos clásicamente como la «tríada» característica del síndrome Birt-Hogg-Dubé formarían parte de un mismo espectro histopatológico y clínico, el fibrofoliculoma. Clínicamente, estas lesiones son prácticamente indistinguibles y se presentan como múltiples pápulas blanquecinas, de aspecto cupuliforme, de escasos milímetros de diámetro localizadas principalmente en la nariz, la frente y las mejillas, aunque también pueden localizarse en el cuello y el tronco3 (fig. 1). Histológicamente, el fibrofoliculoma es una lesión típicamente vertical o perpendicular a la epidermis, ya que está centrada en el folículo piloso. Se caracteriza por la presencia de largas y delgadas proyecciones epiteliales, del tipo del manto folicular, que en ocasiones terminan en glándulas sebáceas maduras, y que están típicamente rodeadas por un estroma fibrovascular con variable componente mixoide (fig. 2). El tricodiscoma es, a diferencia del anterior, una lesión orientada horizontalmente, es decir, paralela a la epidermis, constituida exclusivamente por un estroma idéntico al fibrofoliculoma, rodeado en la base por unidades folículo-sebáceas (fig. 3). Se considera que el tricodiscoma es una forma tardía de fibrofoliculoma4.
Junto a estas lesiones clásicas del síndrome se ha descrito ocasionalmente la presencia de múltiples angiofibromas faciales y la afectación de la mucosa oral a modo de múltiples pápulas en los labios, mucosa yugal y gingival5. Se ha observado que los fibrofoliculomas y los tricodiscomas del síndrome Birt-Hogg-Dubé y los angiofibromas del complejo esclerosis tuberosa presentan rasgos comunes. Histológicamente, la presencia de un estroma con haces de colágeno más gruesos, junto a fibroblastos estrellados, así como la ausencia del componente epitelial, son útiles para diferenciar los angiofibromas de los fibrofoliculomas. La inmunorreactividad para CK15, CD34 y el factor XIIIa no es muy útil, ya que pueden estar presentes en los dos tipos de lesiones. En el síndrome Birt-Hogg-Dubé una mutación en el gen FLCN provocaría el desarrollo de múltiples fibrofoliculomas y tricodiscomas, mientras que en el complejo esclerosis tuberosa sería la alteración en los genes TS-1 y TS-2 la causante de la aparición de los angiofibromas. Recientes investigaciones ponen de manifiesto que ambas proteínas podrían formar parte de una misma vía, la mTOR, a través de la cual se desarrollarían las lesiones cutáneas características de dichos síndromes4. De hecho, se ha descrito excepcionalmente la presencia de fibrofoliculomas en pacientes con esclerosis tuberosa, y de angiofibromas en pacientes con síndrome Birt-Hogg-Dubé5. Además, tanto los pacientes con síndrome Birt-Hogg-Dubé como con esclerosis tuberosa pueden presentar patología pulmonar y renal. Estas similitudes en la clínica, y la existencia de características histológicas comunes en las lesiones cutáneas, refuerzan la idea de que las alteraciones genéticas se produzcan en una vía común. De hecho, en un estudio realizado en Schizosaccharomyces pombe, un hongo unicelular eucariota, se ha observado que una inhibición inapropiada de la vía mTOR o una activación inapropiada en esta misma vía serían las responsables de producir los tumores renales, cutáneos y la clínica pulmonar característicos del síndrome Birt-Hogg-Dubé y de la esclerosis tuberosa, respectivamente6.
Manifestaciones extracutáneasAdemás de las lesiones cutáneas, los pacientes con síndrome Birt-Hogg-Dubé pueden presentar una serie de lesiones extracutáneas7. En los últimos años se ha visto que estos pacientes presentan un mayor riesgo de desarrollar neoplasias renales, así como neumotórax espontáneos8–11. En 1993 Roth et al. describieron el primer caso de cáncer renal en un paciente con síndrome Birt-Hogg-Dubé9. Toro et al., con posterioridad, describieron el síndrome Birt-Hogg-Dubé como un marcador de neoplasia renal2. Tras esta publicación se han ido añadiendo nuevos estudios que confirman este hecho7,11–14. Así, se ha observado que los pacientes con síndrome Birt-Hogg-Dubé presentan un riesgo 7 veces superior de neoplasias renales, con una predilección por el sexo masculino y una edad de presentación comprendida entre los 20-55 años14. Se han descrito 7 síndromes de herencia autosómica dominante asociados a neoplasias renales15, pero a diferencia de lo que ocurre en el resto, en el síndrome Birt-Hogg-Dubé la presentación de las lesiones renales suele ser bilateral y multifocal, con unos determinados tipos histológicos entre los que se incluirían 5: formas híbridas de oncocitoma y carcinoma cromófobo (50%) o formas puras de carcinoma cromófobo (34%), oncocítico (5%), de células claras (3%) o papilar (2%)11,14. La prevalencia de tumores renales en pacientes con mutación en línea germinal del gen FLCN varía según los estudios de un 6,5 a un 34%11. En cuanto al riesgo de metástasis, hasta la fecha tan solo se han descrito 5 casos de cánceres renales con metástasis a distancia11. El estudio anatomopatológico de los tumores renales de estos pacientes demostró que correspondían a tumores de células claras, túbulo-papilares y/o papilares, subtipos histológicos minoritarios en el síndrome Birt-Hogg-Dubé.
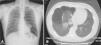
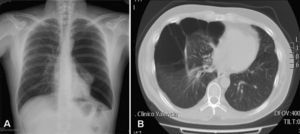
Hasta un 80% de los pacientes con síndrome Birt-Hogg-Dubé presentan quistes pulmonares, que pueden ser asintomáticos durante años9,11,14–16. El número y tamaño de las lesiones varía de un paciente a otro, oscilando desde quistes de pequeño tamaño a bullas de varios centímetros, localizadas sobre todo en las bases pulmonares y a nivel subpleural9 (fig. 4). Se ha visto una relación entre el tamaño y volumen de los quistes y el riesgo de desarrollar neumotórax; así, cuanto mayor volumen ocupan, mayor es el riesgo de desarrollarlo. La edad media de presentación es de 38 años y la predilección por sexo no está clara. Algunos estudios señalan el sexo masculino como un factor de riesgo de neumotórax espontáneo17, mientras que en otros no existe tal diferencia9. Entre los pacientes que presentan quistes pulmonares aproximadamente un 20-30% presentan historia de neumotórax, siendo el número medio de dos episodios9. Además, cuando se estudian los pacientes con historia de neumotórax la gran mayoría presentan quistes pulmonares múltiples. El pulmón más afectado suele ser el derecho, aunque pueden afectarse ambos hasta en un 23% de los casos9. En pacientes con síndrome Birt-Hogg-Dubé el riesgo de desarrollar neumotórax es 50 veces superior al de la población normal16. La mutación más frecuente en pacientes con historia de neumotórax y/o lesiones pulmonares y síndrome Birt-Hogg-Dubé es la c.1733ins/delC localizada en el exón 119. Se ha visto que pacientes con determinadas mutaciones presentan un riesgo de desarrollar lesiones quísticas de mayor tamaño y en mayor número. Así, la mutación en el exón 9 confiere un riesgo de desarrollar mayor número de quistes, y mutaciones en el exón 9 y 12 quistes de mayores dimensiones9. La fisiopatología de los quistes pulmonares es desconocida, pero podría ser que la haploinsuficiencia, al igual que ocurre en los tumores cutáneos, fuera suficiente para el desarrollo de estas lesiones. Además de las asociaciones características ya descritas, en los pacientes con el síndrome Birt-Hogg-Dubé se han descrito adenomas y pólipos colorrectales, oncocitomas parotídeos, oncocitomas paratiroideos, tumores neurales, tricoblastomas, lipomas, angiolipomas, anomalías del tejido conectivo, coriorretinopatía y neoplasias malignas no renales, como el cáncer de mama, colorrectal, amigdalar y pulmonar, pero también cánceres cutáneos como el melanoma, el carcinoma basocelular, el carcinoma de células escamosas, el dermatofibrosarcoma y el leiomiosarcoma18. A pesar de ello, hasta la fecha no se ha demostrado una asociación significativa entre el síndrome de Birt-Hogg-Dubé y estas neoplasias, siendo necesarios más estudios que permitan esclarecer este aspecto19. Algunos autores defienden que los portadores de la mutación c.1285dupC presentan un mayor riesgo de cáncer de colon19.
Bases genéticasEn el año 2002 se identificó el gen FLCN asociado a este síndrome12. Este gen, localizado en el cromosoma 17p11.2 y compuesto de 14 exones codifica una proteína de 64kDa, la foliculina, que se expresa en la mayor parte de los tejidos incluyendo la piel y sus anejos, el pulmón (neumocitos tipo 1) y el riñón (nefrona distal). Hasta la fecha se desconoce con exactitud la función de esta proteína, pero parece estar implicada en la vía AMPK y mTOR13,20.
Las mutaciones del gen FLCN pueden afectar a cualquier parte de este, incluyendo exones e intrones21. Sin embargo, hasta la fecha el 50% de las mutaciones descritas consisten en inserciones o deleciones en un punto caliente mutacional en el nucleótido citosina 8 del exón 11 del gen, que provocan un cambio en la lectura de los nucleótidos21,22. Las mutaciones c.1285dupC (descrita previamente como c.1733insC, c.1740dupC o c.1277insC) y la c.1285delC (descrita también como c.1733delC) son las que se han descrito con mayor frecuencia en pacientes y familiares afectos por el síndrome Birt-Hogg-Dubé. Del tipo de mutación producida (por sustitución de bases, por deleción o inserción de nucleótidos o porque interfieren con el splicing del ARN mensajero) van a depender las repercusiones en la transcripción proteica. En la tabla 1 se detallan las mutaciones descritas hasta la fecha en el gen FLCN12,16,21–24. La asociación de la pérdida de la expresión del gen FLCN en casi todos los subtipos histológicos de carcinoma renal sugiere su implicación en la patogénesis de este tipo de tumores y refuerza la idea de su función como gen supresor de tumores24. Para el desarrollo de cánceres renales en pacientes con el SBHD sería necesaria una segunda mutación somática que conlleva la pérdida de la expresión de ARNm de FLCN en estos tumores12,15,23.
Mutaciones en línea germinal descritas en el síndrome Birt-Hogg-Dubé
| Exón | Mutación | |||
| 1 | c.-487G>C | c.-302G>A | c.-299C>T | |
| 1i | c.-228+1368G>T | c.229+994A>G | ||
| 3 | c.-90A>G | |||
| 3i | c.-25+100C>G | c.1-64A>G | ||
| 4 | c.1A>Gc.3delG | c.3G>Ac.59delT | c.147delAc.235_238del | c.240delC |
| 4i | c.250-2A>G | c.250-1G>A | ||
| 5 | c.252delCc.296delA | c.347dupAc.323G>T | c.328C>Tc.340dupC | c.319_320delGTinsCACc.394G>A |
| 5i | c.396+59T>Cc.397-14C>T | c.397-13G>A | c.397-7_399del | c.397-10_397-2del |
| 6 | c.404delCc.420delC | c.443_459delc.469_471del | c.583G>Tc.584delG | c.564_565dup;566_577delc.510C>A |
| 6i | c.618+2T>A | c.619-66C>T | c.619-1G>A | |
| 7 | c.637delTc.649C>Tc.655dupG | c.671_672delc.632_633delAGinsCc.689dupT | c.715C>Tc.726A>Tc.769_771del | c.779G>Ac.1087delAGinsC |
| 7i | c.779+1G>T | c.779+113C>T | ||
| 8 | c.836_839del | |||
| 8i | c.871+3_c.871+4delGAinsTCCAGATc.871+13T>Cc.871+16T>A | c.871+36G>Ac.871+204A>G | c.871+684G>Ac.871+226G>A | |
| 9 | c.887C>Ac.890_893del | c.923_950dupc.943G>T | c.997_998dupc.1013delG | c.1021delCc.1378_1405dup |
| 9i | c.1062+1G>Ac.1062+2T>Gc.1062+5G>A | c.1062+6C>Tc.1062+47G>A | c.1063-172C>Gc.1063-117C>T | c.1063-10_1065delc.1063-2A>G |
| 10 | c.1063_1065delc.1063-2A>G | c.1076delC | c.1127G>A | c.1156_1175del |
| 10i | c.1176+31G>Ac.1176+39G>A | c.1176+68G>Cc.1176+134G>C | c.1176+179A>Gc.1177-165C>T | c.1177-5_1177-3delc.1177-2A>G |
| 11 | c.1198G>Ac.1215C>Gc.1252delC | c.1269C>Tc.1278C>Tc.1285delC | c.1285dupCc.1285C>Tc.1286dupA | c.1300G>Ac.1300G>Cc.1300G>T |
| 11i | c.1301-59C>T | |||
| 12 | c.1301-7_1304del11c.1305delTc.1318_1334dupc.1323delCinsGA | c.1333G>Ac.1337_1343dupc.1340_1346dupc.1347_1353dup | c.1372dupc.1379_1380delc.1389C>G c.1408_1418del | c.1426dupGc.1429C>Tc.1844C>G |
| 12i | c.1432+1G>A | c.1433-38A>G | c.1433-1G>T | |
| 13 | c.1433-1G>Tc.1487_1490dup | c.1522_1524delc.1523A>G | c.1528_1530delc.1533G>A | c.1533_1536del |
| 13i | c.1538+121C>T | |||
| 14 | c.1539_1740delc.1557delT | c.1579C>T | c.1597C>T | c.1597_1598del |
No se sabe bien la causa, pero a diferencia de lo que ocurre en los tumores renales, cuando se analizan las lesiones cutáneas no se detecta esa pérdida de heterocigosidad y el nivel de expresión de ARNm de FLCN es alto24. Estos hallazgos sugieren que los mecanismos implicados en el desarrollo de tumores cutáneos y renales difieren. Por tanto, son necesarios más estudios que permitan explicar con exactitud los mecanismos implicados en el desarrollo de las lesiones cutáneas.
Hasta la fecha, no se ha podido establecer una correlación geno-fenotípica y son necesarios más estudios que permitan clarificar este punto. Sin embargo, algunos autores han observado una mayor frecuencia de mutaciones en el exón 11 en aquellos pacientes con historia de neumotórax, así como una relación entre mutaciones en el exón 9 o 12 y el número y tamaño de los quistes pulmonares respectivamente9. Otros autores sugieren que los pacientes con una mutación c.1285delC presentan un riesgo menor de desarrollar cáncer renal, pero son necesarios más estudios11.
DiagnósticoEn la tabla 2 se muestran los criterios diagnósticos actualmente propuestos por el Consorcio Europeo para el estudio del síndrome Birt-Hogg-Dubé25. Cabe destacar que a pesar de que las lesiones cutáneas son el signo de alerta para el dermatólogo, no todos los pacientes con síndrome Birt-Hogg-Dubé las presentan. De hecho, no todos los pacientes se presentan con la tríada clásica de afectación cutánea, renal y pulmonar16. Kunogi et al. observaron que hasta un 70% de pacientes con síndrome Birt-Hogg-Dubé y neumotórax no presentaban lesiones cutáneas ni alteraciones renales16. Por ello, dada la variabilidad clínica de este síndrome el diagnóstico de sospecha no debería plantearse solamente en aquellos pacientes con las lesiones cutáneas características, sino también en pacientes con lesiones extracutáneas, como las descritas con anterioridad.
Criterios propuestos por el Consorcio Europeo para el diagnóstico del síndrome Birt-Hogg-Dubé
| Criterios mayores |
| Al menos 5 fibrofoliculomas o tricodiscomas de inicio en la edad adulta con al menos una lesión confirmada histológicamente |
| Mutación patogénica en línea germinal del gen FLCN |
| Criterios menores |
| Múltiples quistes pulmonares: localizados en la zona basal, sin causa evidente asociados o no a neumotórax espontáneo |
| Cáncer renal: de inicio temprano (< 50 años), multifocal, bilateral y/o con formas histológicas características (forma híbrida de oncocitoma y cromófobo) |
| Familiar de primer grado con síndrome de Birt-Hogg-Dubé |
Para el diagnóstico de síndrome Birt-Hogg-Dubé el paciente debe presentar un criterio mayor o dos menores.
Así, el Consorcio Europeo del síndrome Birt-Hogg-Dubé ha propuesto una serie de criterios que representarían una indicación para la solicitud del estudio genético, entre los que se encuentran aquellos pacientes con carcinoma renal de inicio temprano (< 50 años), particularmente si es multifocal y/o bilateral, y con una histología característica (cromófoba, oncocítica o híbrida) y pacientes con enfermedad pulmonar quística inexplicable y/o neumotórax espontáneo, especialmente si la afectación es bilateral y los quistes se localizan en la zona basal25. Además, deberían considerarse aquellos pacientes con historia familiar de enfermedad pulmonar quística, neumotórax espontáneo, carcinoma renal o una combinación de estos25 (tabla 3). De este modo, en aquellos pacientes cuya única manifestación sea la afectación pulmonar o renal, la detección de una mutación germinal de FLCN nos ayudaría a confirmar el diagnóstico y poder realizar consejo genético. Existen Unidades de Consejo Genético en prácticamente todas las comunidades autónomas, y es a estas a las que se puede consultar para solicitar los estudios genéticos26.
Criterios para la solicitud del estudio genético según el Consorcio Europeo Birt-Hogg-Dubé
| Lesiones cutáneas características (fibrofoliculomas y/o tricodiscomas) |
| Enfermedad pulmonar quística sin causa evidente |
| Neumotórax espontáneo primario |
| Cáncer renal: de inicio temprano (< 50 años), multifocal, bilateral y/o con formas histológicas características (forma híbrida de oncocitoma y cromófobo o formas puras) |
| Familiar de primer grado con alguna de las características previas |
El diagnóstico diferencial ante un paciente con lesiones papulosas faciales debe establecerse con otros síndromes, entre los que encontramos la enfermedad de Cowden, el síndrome de Brooke-Spiegler, el síndrome Rombo, la esclerosis tuberosa o el síndrome de hamartomas foliculares basaloides25,27–33. El diagnóstico puede realizarse gracias a las características clínicas y el estudio histológico. La tabla 4 muestra las principales características de cada uno de ellos.
Diagnóstico diferencial ante un paciente con lesiones papulosas en la cara
| Enfermedad | Patrón de herencia | Etiología | Edad de inicio | Clínica | Asociación a cáncer | |
| Cutánea | Extracutánea | |||||
| Enfermedad de Cowden25 | HAD | Gen PTEN | 20-30 años | Tricolemomas faciales (alrededor de la boca, nariz y orejas)Lesiones papilomatosas con aspecto empedrado en la cavidad oral y los labiosQueratosis acrasFibromas escleróticos | MacrocefaliaRetraso mental | Mama: Adenocarcinoma, fibroadenoma y enfermedad fibroquísticaCarcinoma tiroideoPólipos hamartomatosos en TGI (más frecuentes en colon) |
| Esclerosis tuberosa26 | HAD (50-70%)Mutaciones nuevas | Gen TSC1 (hamartina) y TSC2 (tuberina) | Infancia | Angiofibromas facialesPlaca fibrosa de la frenteMáculas hipomelanóticas lanceoladas, poligonales, en confetiPlaca de piel chagrínFibromas periunguealesManchas café con leche | Endocrinas: pubertad precoz, hipotiroidismoOculares: hamartomas retinianos, placas retinianas acrómicasEsqueléticasDentalesPulmonaresRenales: quistesNeurológicasCardíacas | Rabdomioma cardíacoAngiomiolipomas múltiples bilaterales renales |
| Síndrome. Brooke-Spiegler y síndrome Rombo27–29 | HAD | Gen CYLD1 (síndrome Brooke-Spiegler) | Infancia | Síndrome Brooke-Spiegler: Tricoepiteliomas, cilindromas y espiroadenomas ecrinosSíndrome Rombo: atrofoderma vermiculada, milia, hipertricosis, telangiectasias, eritema acral, tricoepiteliomas, carcinomas basocelulares | Ninguna | Carcinoma basocelular |
| Síndrome de hamartomas foliculares30 basaloides | HAD | Gen PTCH | Nacimiento-infancia | Hamartomas foliculares basaloidesAlopecia difusa (síndrome Brown-Crounse) | Marcador de miastenia gravis | Ninguno |
| Síndrome Birt-Hogg-Dubé | HAD | FLCN (foliculina) | A partir de los 25 años | TricofoliculomasTricodiscomasAcrocordonesAngiofibromas facialesPápulas en mucosa oral | Quistes pulmonaresNeumotórax | Cáncer renal |
HAD: herencia autosómica dominante; TGI: tracto gastrointestinal.
Los neumotórax espontáneos familiares pueden presentarse en diferentes procesos hereditarios. Así, cuando nos encontramos ante un paciente con historia familiar de neumotórax espontáneo y quistes pulmonares el diagnóstico diferencial debe plantearse con otras entidades que pueden presentarse con cambios quísticos en el parénquima pulmonar9. Entre ellos, el déficit de α1-antitripsina, el síndrome de Marfan, el síndrome de Ehlers-Danlos, la linfangioleiomiomatosis, la esclerosis tuberosa, la histiocitosis de células de Langerhans o la fibrosis quística. La fibrosis pulmonar idiopática, la infección por Pneumocystis jiroveci, la neumonía intersticial linfocítica o el embolismo séptico también deberían incluirse en el diagnóstico diferencial. La localización de los quistes pulmonares, el antecedente de historia familiar, así como la presencia de otras lesiones acompañantes, sobre todo dermatológicas, nos orientan al diagnóstico.
Manejo del pacienteComo hemos visto, la clínica del síndrome Birt-Hogg-Dubé no sólo se limita al ámbito dermatológico, sino que también se manifiesta en otros niveles. De ahí que el manejo de estos pacientes deba realizarse de manera multidisciplinar y con la colaboración de distintos especialistas. El diagnóstico de las lesiones cutáneas asociadas a este síndrome se basa en las características clínicas e histológicas. Por ello, debe realizarse una correcta exploración cutánea junto a la extirpación de alguna de las lesiones sospechosas. El tratamiento debería considerarse por motivos estéticos. Así, además del tratamiento quirúrgico, se ha descrito el uso de isotretinoína oral, láser CO2 y láser erbium:YAG27,34,35. El láser ablativo es útil en el tratamiento de otros tumores anexiales. Así, Gambichler et al. describieron el tratamiento con láser erbio:YAG (spot 1,5mm, fluencia 5 J/cm2, energía de pulso 340 Mj) de un paciente con síndrome Birt-Hogg-Dubé y lesiones cutáneas34. Posteriormente, en el año 2001, Jacob et al. utilizaron la combinación de láser CO2 y erbio:YAG para el tratamiento de un paciente con lesiones similares35. En la actualidad van Steensel M et al. están llevando a cabo un ensayo clínico a doble ciego en fase III para valorar la eficacia del tratamiento con rapamicina tópica (0,25ml dos veces al día de rapamicina 1mg/ml en solución oral) en el manejo de estas lesiones, por lo que en un futuro próximo podremos disponer de los resultados de este tratamiento36.
Como hemos comentado previamente, los pacientes con síndrome Birt-Hogg-Dubé tienen un riesgo aumentado de desarrollar cáncer renal. Por ello deberían vigilarse aquellos pacientes portadores de la mutación en línea germinal en el gen FLCN o en pacientes de riesgo. No existen unas guías establecidas que definan a qué edad comenzar, el mejor método de cribado ni con qué periodicidad realizarlo. Se ha visto que la edad en la que se desarrolla cáncer renal está comprendida entre los 25-75 años, por lo que la edad de inicio podría establecerse en los 20 años27. Como prueba de imagen se puede emplear la ecografía, la tomografía axial computarizada (TAC) o la resonancia magnética nuclear. Algunos autores defienden realizar una ecografía renal y/o TAC abdominal en el momento del diagnóstico y posteriormente cada 3 o 5 años18. El estadiaje en caso de diagnóstico de cáncer renal no difiere de aquellos pacientes sin síndrome asociado. Una vez diagnosticado, el tratamiento es en la mayor parte de los casos quirúrgico, pero intentando preservar, en la medida de lo posible, la mayor cantidad de parénquima renal, empleando la cirugía conservadora de nefronas en lugar de la nefrectomía radical37. En casos metastásicos se podría considerar el uso de análogos de la rapamicina, dada la implicación del gen FLCN en la regulación de la vía mTOR, aunque todavía son necesarios más estudios que demuestren su beneficio27.
En cuanto al manejo de la afectación pulmonar los pacientes con síndrome Birt-Hogg-Dubé pueden presentar mayor riesgo de neumotórax cuando se someten a cambios de presión, como viajes en avión o actividades acuáticas como el buceo. No está clara la necesidad de limitar o desaconsejar este tipo de actividades, pero se debe informar al paciente de este riesgo, así como educarle sobre la sintomatología y signos con los que se puede manifestar. En lo referente al hábito tabáquico no existen suficientes datos que avalen una clara asociación, pero sí que se ha observado una mayor prevalencia de cáncer renal y neumotórax en pacientes fumadores, por lo que debe desaconsejarse su consumo9. Aquellos pacientes con historia de neumotórax de repetición o con enfermedad pulmonar sintomática deberían ser derivados a un especialista. La realización de una radiografía de tórax o una TAC sería útil para el diagnóstico de los quistes pulmonares, aunque no existen protocolos universalmente aceptados para el seguimiento de estas lesiones. El tratamiento es similar al de aquellos pacientes que presentan un neumotórax espontáneo no asociado al síndrome.
Referente a la asociación, por parte de algunos autores, del síndrome Birt-Hogg-Dubé y el cáncer de colon, no se ha descrito una indicación específica de colonoscopia en estos pacientes, siendo la recomendación la misma que para la población general19. Algunos autores defienden que este hallazgo puede ser meramente casual dada la frecuencia del cáncer de colon en la población general19,38.
ConclusiónEn conclusión, a pesar de que los signos de alerta para el dermatólogo son las lesiones cutáneas histológicamente confirmadas como fibrofoliculomas o tricodiscomas, es frecuente que estos estén ausentes, y son entonces las manifestaciones extracutáneas, como la presentación de neumotórax espontáneos de repetición y/o quistes pulmonares basales, así como determinados cánceres renales, los que pueden permitir establecer, junto con el estudio genético, el diagnóstico de síndrome Birt-Hogg-Dubé.
FinanciaciónEste trabajo ha sido realizado gracias a una Beca (AP-088/11) para proyectos de investigación en materia sanitaria de la Conselleria de Sanidad de la Generalitat Valenciana.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.