La deficiencia de vitamina D (VD) se ha relacionado con diferentes tumores. La asociación entre la VD y el cáncer cutáneo es controvertida. Para el cáncer cutáneo no melanoma, niveles adecuados o incluso elevados de VD podrían asociarse a un mayor riesgo tumoral, aunque este hecho podría estar sesgado por la asociación directa entre exposición solar y niveles de VD. En cuanto al melanoma, hay resultados contradictorios. La mayoría de los estudios analizados reportan que niveles más altos de VD podrían disminuir el riesgo de melanoma, podrían asociarse a melanomas con mejor pronóstico y podrían correlacionarse con una mejor respuesta antitumoral y un menor perfil de efectos adversos en la inmunoterapia del melanoma. Sin embargo, son necesarios estudios prospectivos de adecuada calidad metodológica que evalúen la asociación de los niveles de VD y su suplementación, y el desarrollo y pronóstico del cáncer cutáneo.
Vitamin D (VD) deficiency has been associated with various tumors. However, the association between VD and skin cancer is controversial. Although in non-melanoma skin cancer, adequate or even high levels of VD can be associated with a higher risk of developing tumors, this could be biased by the direct association between sun exposure and VD levels. Regarding melanoma, results are contradictory. Most studies analyzed state that higher levels of VD could reduce the risk of melanoma, be associated with melanomas with better prognosis and with an enhanced antitumor response, and also with fewer adverse events associated with melanoma immunotherapy. However, prospective studies of adequate methodological quality are still needed to assess the association between VD levels and its supplementation and development/prognosis in skin cancer.
La vitamina D (VD) es una prohormona que se obtiene principalmente de la exposición a la radiación ultravioletaB (UVB) y la dieta (fig. 1)1. La VD desempeña un papel vital en la salud ósea y en la inmunidad. Además, tiene un efecto antineoplásico al regular la proliferación, la diferenciación, la migración y la apoptosis celular (tabla 1)2,3. Se ha asociado con un menor riesgo de cáncer colorrectal, de mama y de próstata4. Esta asociación es controvertida en el caso del cáncer cutáneo (CC)5,6.
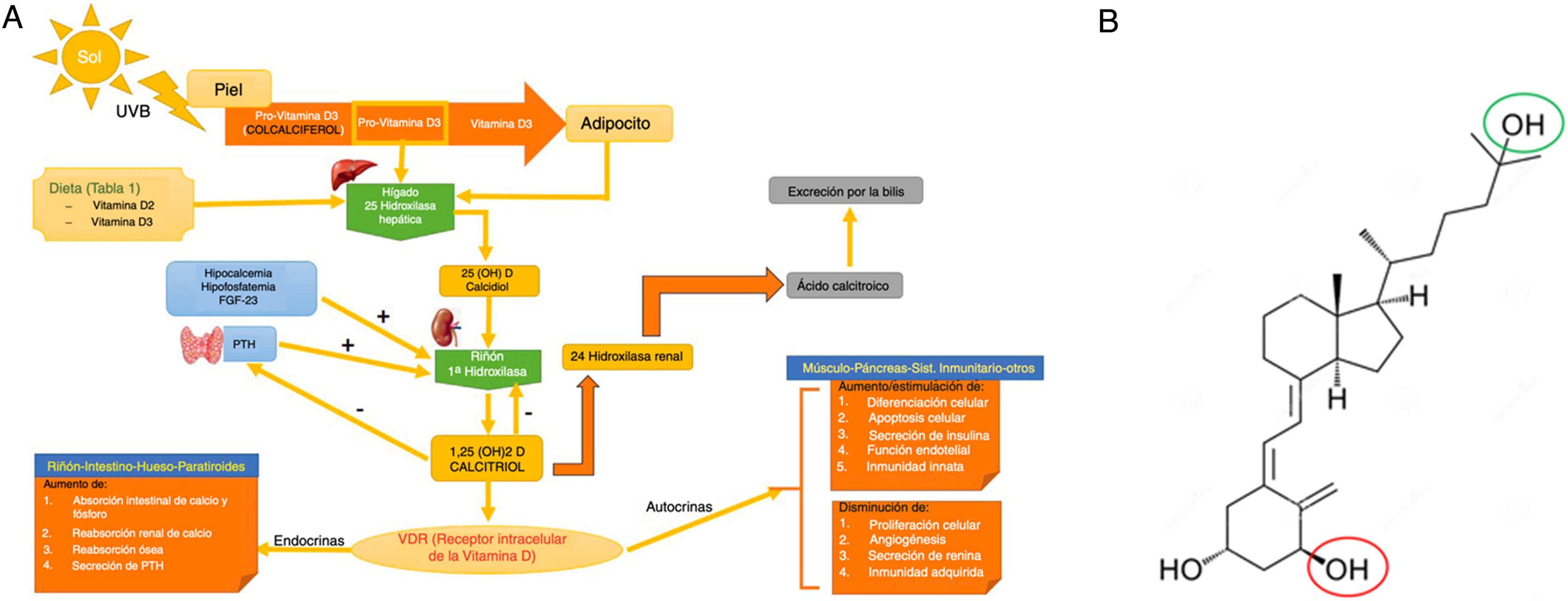
Metabolismo de la vitaminaD (panel A) y estructura de la vitaminaD activada (calcitriol o 1,25-dihidroxicolecalciferol; C27H44O3) (panel B).
Panel A. Metabolismo de la vitaminaD. La vitaminaD puede adquirirse a través de la dieta, o bien por la conversión cutánea a través de la UVB que transforma la provitaminaD3 (sintetizada a nivel cutáneo) a previtaminaD3. El primer paso hepático la transforma a calcidiol o 25-hidroxivitaminaD mediante la 25-hidroxilasa hepática. El segundo paso a nivel renal la convierte en el metabolito activo, 1,25-dihidroxicolecalciferol o calcitriol a través de la 1-hidroxilasa renal. Este mecanismo está regulado, entre otros, por los niveles séricos de calcio, fósforo y por la paratohormona. El calcitriol actúa a través de los receptores de vitaminaD (VDR) intracelulares, los cuales activan el proceso de transcripción y traslación del ARN mensajero con la síntesis de proteínas dependientes de vitaminaD, con su correspondiente actividad en función de la célula diana. La excreción de la vitaminaD a través de la bilis está mediada por la actividad de la 24-hidroxilasa renal, que convierte el calcitriol en ácido calcitroico.
Panel B. Estructura de la vitaminaD activada. Nótese que la vitaminaD, para activarse, debe someterse a dos hidroxilaciones: la primera (círculo verde) en el hígado formando 25-hidroxicolecalciferol o calcidiol y la segunda (círculo rojo) en el riñón formando 1,25-dihidroxicolecalciferol o calcitriol, que es la forma activa.
Fuente: elaboración propia y tomando datos con permiso de Navarro-Triviño et al.5.
Papel de la vitaminaD en la inmunovigilancia e inmunosenescencia
| Acción bioquímica de la vitaminaD | Implicación a nivel bioquímico | Posibles implicaciones a nivel clínico del déficit de vitaminaD |
|---|---|---|
| Inhibición de la expresión y señalización de TLR2, 4 y 9 | Regulación del sistema inmune innato | - Incremento en la frecuencia de enfermedades autoinmunes- Aumento en la gravedad de enfermedades autoinmunes- Incremento en la frecuencia de determinados procesos infecciosos- Desarrollo de enfermedad cardiovascular precoz: obesidad y arteriosclerosis- Envejecimiento más precoz y acusado (dermatoporosis acelerada, sarcopenia, etc.) |
| Reducción de la producción de TNF-α, IL-1, IL-6 e IL-23 | Reducción de algunas de las citocinas que potencian la actividad de los linfocitosT, sobre todo los T CD4+ | |
| Incremento en la producción de IL-4, IL-5, IL-10 y CCL2 | Aumento de la producción de citocinas antiinflamatorias, regulando la actividad de los linfocitosT, sobre todo Th17 y potenciando la actividad Th2 | |
| Inhibición de la producción de IL-6 | Reducción en la actividad Th17 | |
| Inhibición de la producción de IL-33 | Reducción en la actividad de linfocitosT y células dendríticas en algunas enfermedades autoinmunes, como el síndrome de Guillain-Barré, la psoriasis o la artritis reumatoide | |
| Incremento en la producción de linfocitos T reguladores Fox P3+ | Reducción de la actividad de linfocitosT autoinmunes | |
| Incremento en la coestimulación linfocitaria a través de la molécula CD-28 | Potencial actividad de los linfocitosT citotóxicos y activación de linfocitosB ante circunstancias precisas | |
| Reducción en la generación de autoanticuerpos y de ROS | Disminución de las cascadas autoinmunes y control de la inflamación | |
| Incremento de niveles de catelicidina LL-37 y proteína catiónica AMP-18 | Reducción de las infecciones y control precoz y adecuado de las mismas | |
| Activación correcta de respuesta TLR1, 2 y 8 | Reducción de las infecciones y control precoz y adecuado de las mismas | |
| Incremento controlado de IL-1β y defensina, disminución de acortamiento de telómeros, incremento de niveles de Nrf2, disminución de vía NF-kβ, disminución de niveles de NLRP-3, disminución de daño en ADN, incremento de la biogénesis mitocondrial | Regulación del envejecimiento cutáneo y sistémico, prevención del envejecimiento precoz y acelerado | |
| Reducción de la inflamación (especialmente de la respuestaT), disminución de la activación del SRAA y de la generación de ROS, y control de los niveles plasmáticos de LDL | Prevención de arteriosclerosis, obesidad, síndrome metabólico y enfermedad cardiovascular temprana |
CCL: chemokine (C-C motif) ligand; CD: cluster de diferenciación; IL: interleucina; NLRP-3: nucleotide-binding domain, leucine-rich-containing family, pyrin domain-containing-3; ROS: radicales libres oxigenados; Th: linfocito T helper (colaborador); TLR: toll-like receptor; TNF: tumoral necrosis factor.
Fuente: Fantini et al.3.
Desde el año 2009 se cuantifica la 25-hidroxivitaminaD o colecalciferol (25VD) para el reconocimiento de niveles de VD. Según la Academia Nacional de Medicina (NAM), niveles de 25VD superiores a 20ng/ml son suficientes para una salud óptima, mientras que para la American Endocrine Society (AES) se requerirían valores superiores a 30ng/ml; serían niveles insuficientes niveles entre 20 y 30ng/ml, y deficitarios aquellos menores a 20ng/ml5. En los últimos años se ha considerado el déficit y la insuficiencia de VD como una «pandemia». Hasta el 70% de la población europea presentaría niveles insuficientes, incluso en países con gran exposición solar, como los mediterráneos7. Hay autores que atribuyen este fenómeno a la menor exposición solar y/o a dietas con insuficiente consumo de alimentos ricos en VD8. Sin embargo, otros autores consideran que el punto de corte de 20 o 30ng/ml es excesivamente alto, y explicaría que la mayoría de la población europea presenta niveles bajos de VD sin ninguna clínica acompañante8. Recientemente, la Fuerza de Trabajo Norteamericana para la Prevención de Salud (US Preventive Services Task Force), considerando la evidencia contradictoria sobre la utilidad de medir y suplementar VD, ha recomendado no medir los niveles de VD en individuos sanos y realizarlo solo en pacientes con riesgo de osteoporosis o de fracturas.9
Como se ha señalado anteriormente, la relación entre VD y CC es controvertida y la evidencia es en muchos casos, contradictoria5,6. En este artículo revisaremos la asociación entre la VD y el desarrollo y pronóstico del CC.
Material y métodosSe realizó una revisión narrativa de la literatura. Durante septiembre y octubre de 2023 se realizaron búsquedas en castellano y en inglés en Medline y Google Scholar con los términos «vitaminaD», «calcitriol», «colecalciferol», «cáncer cutáneo», «melanoma», «carcinoma de células escamosas», «carcinoma basocelular», «inmunoterapia», «suplementación», «respuesta a terapia dirigida» y «respuesta a inmunoterapia». La búsqueda incluyó artículos desde el 1 de enero de 2000 hasta el 1 de septiembre de 2023. Se incluyeron estudios prospectivos y retrospectivos con ≥10 pacientes, así como revisiones sistemáticas (RS) y metaanálisis (MA). Los artículos se cribaron según su resumen y se seleccionaron según su relevancia. Dos autores (MMP y DMC) realizaron la búsqueda y selección de los artículos.
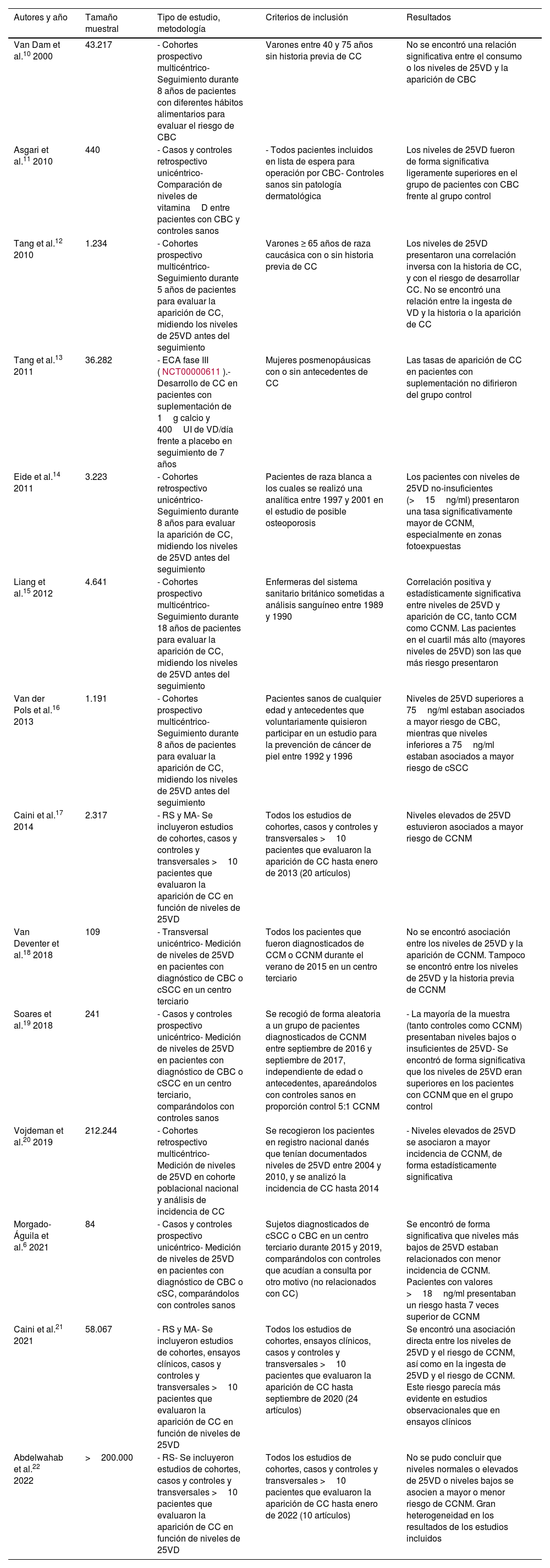
ResultadosA. Vitamina D y cáncer cutáneo no melanomaDesarrollo de cáncer cutáneo no melanomaMúltiples estudios han intentado esclarecer la relación entre los niveles de 25VD o la suplementación con VD y el cáncer cutáneo no melanoma (CCNM) (tabla 2)6,10-22. La mayoría encontraron que niveles suficientes de VD (≥20ng/ml o ≥30ng/ml en función de los estudios) se asociaban a mayor riesgo de CCNM, especialmente de carcinoma basocelular (CBC). Dos RS recientes aportaron resultados contradictorios. En 2021, Caini et al. publicaron una RS y un MA que incluyó 24 estudios: 3 prospectivos y 21 retrospectivos (58.067 pacientes en total). Encontraron una asociación directa entre los niveles de 25VD y el riesgo de CCNM, así como con la ingesta mayor de 25VD y el riesgo de CCNM. Este riesgo parecía más evidente en estudios observacionales que en ensayos clínicos21. Sin embargo, en 2022, Abdelwahab et al., en otra RS que incluyó 10 estudios y 204.000 pacientes, afirmaron que no se podía concluir que existiera una relación entre los niveles de 25VD y la aparición de CBC. Además, reportaban que esta inconsistencia era secundaria a la ausencia de homogeneidad de los estudios incluidos22.
Principales estudios sobre la asociación de vitaminaD y cáncer cutáneo no melanoma
| Autores y año | Tamaño muestral | Tipo de estudio, metodología | Criterios de inclusión | Resultados |
|---|---|---|---|---|
| Van Dam et al.10 2000 | 43.217 | - Cohortes prospectivo multicéntrico- Seguimiento durante 8 años de pacientes con diferentes hábitos alimentarios para evaluar el riesgo de CBC | Varones entre 40 y 75 años sin historia previa de CC | No se encontró una relación significativa entre el consumo o los niveles de 25VD y la aparición de CBC |
| Asgari et al.11 2010 | 440 | - Casos y controles retrospectivo unicéntrico- Comparación de niveles de vitaminaD entre pacientes con CBC y controles sanos | - Todos pacientes incluidos en lista de espera para operación por CBC- Controles sanos sin patología dermatológica | Los niveles de 25VD fueron de forma significativa ligeramente superiores en el grupo de pacientes con CBC frente al grupo control |
| Tang et al.12 2010 | 1.234 | - Cohortes prospectivo multicéntrico- Seguimiento durante 5 años de pacientes para evaluar la aparición de CC, midiendo los niveles de 25VD antes del seguimiento | Varones ≥ 65 años de raza caucásica con o sin historia previa de CC | Los niveles de 25VD presentaron una correlación inversa con la historia de CC, y con el riesgo de desarrollar CC. No se encontró una relación entre la ingesta de VD y la historia o la aparición de CC |
| Tang et al.13 2011 | 36.282 | - ECA fase III (NCT00000611).- Desarrollo de CC en pacientes con suplementación de 1g calcio y 400UI de VD/día frente a placebo en seguimiento de 7 años | Mujeres posmenopáusicas con o sin antecedentes de CC | Las tasas de aparición de CC en pacientes con suplementación no difirieron del grupo control |
| Eide et al.14 2011 | 3.223 | - Cohortes retrospectivo unicéntrico- Seguimiento durante 8 años para evaluar la aparición de CC, midiendo los niveles de 25VD antes del seguimiento | Pacientes de raza blanca a los cuales se realizó una analítica entre 1997 y 2001 en el estudio de posible osteoporosis | Los pacientes con niveles de 25VD no-insuficientes (>15ng/ml) presentaron una tasa significativamente mayor de CCNM, especialmente en zonas fotoexpuestas |
| Liang et al.15 2012 | 4.641 | - Cohortes prospectivo multicéntrico- Seguimiento durante 18 años de pacientes para evaluar la aparición de CC, midiendo los niveles de 25VD antes del seguimiento | Enfermeras del sistema sanitario británico sometidas a análisis sanguíneo entre 1989 y 1990 | Correlación positiva y estadísticamente significativa entre niveles de 25VD y aparición de CC, tanto CCM como CCNM. Las pacientes en el cuartil más alto (mayores niveles de 25VD) son las que más riesgo presentaron |
| Van der Pols et al.16 2013 | 1.191 | - Cohortes prospectivo multicéntrico- Seguimiento durante 8 años de pacientes para evaluar la aparición de CC, midiendo los niveles de 25VD antes del seguimiento | Pacientes sanos de cualquier edad y antecedentes que voluntariamente quisieron participar en un estudio para la prevención de cáncer de piel entre 1992 y 1996 | Niveles de 25VD superiores a 75ng/ml estaban asociados a mayor riesgo de CBC, mientras que niveles inferiores a 75ng/ml estaban asociados a mayor riesgo de cSCC |
| Caini et al.17 2014 | 2.317 | - RS y MA- Se incluyeron estudios de cohortes, casos y controles y transversales >10 pacientes que evaluaron la aparición de CC en función de niveles de 25VD | Todos los estudios de cohortes, casos y controles y transversales >10 pacientes que evaluaron la aparición de CC hasta enero de 2013 (20 artículos) | Niveles elevados de 25VD estuvieron asociados a mayor riesgo de CCNM |
| Van Deventer et al.18 2018 | 109 | - Transversal unicéntrico- Medición de niveles de 25VD en pacientes con diagnóstico de CBC o cSCC en un centro terciario | Todos los pacientes que fueron diagnosticados de CCM o CCNM durante el verano de 2015 en un centro terciario | No se encontró asociación entre los niveles de 25VD y la aparición de CCNM. Tampoco se encontró entre los niveles de 25VD y la historia previa de CCNM |
| Soares et al.19 2018 | 241 | - Casos y controles prospectivo unicéntrico- Medición de niveles de 25VD en pacientes con diagnóstico de CBC o cSCC en un centro terciario, comparándolos con controles sanos | Se recogió de forma aleatoria a un grupo de pacientes diagnosticados de CCNM entre septiembre de 2016 y septiembre de 2017, independiente de edad o antecedentes, apareándolos con controles sanos en proporción control 5:1 CCNM | - La mayoría de la muestra (tanto controles como CCNM) presentaban niveles bajos o insuficientes de 25VD- Se encontró de forma significativa que los niveles de 25VD eran superiores en los pacientes con CCNM que en el grupo control |
| Vojdeman et al.20 2019 | 212.244 | - Cohortes retrospectivo multicéntrico- Medición de niveles de 25VD en cohorte poblacional nacional y análisis de incidencia de CC | Se recogieron los pacientes en registro nacional danés que tenían documentados niveles de 25VD entre 2004 y 2010, y se analizó la incidencia de CC hasta 2014 | - Niveles elevados de 25VD se asociaron a mayor incidencia de CCNM, de forma estadísticamente significativa |
| Morgado-Águila et al.6 2021 | 84 | - Casos y controles prospectivo unicéntrico- Medición de niveles de 25VD en pacientes con diagnóstico de CBC o cSC, comparándolos con controles sanos | Sujetos diagnosticados de cSCC o CBC en un centro terciario durante 2015 y 2019, comparándolos con controles que acudían a consulta por otro motivo (no relacionados con CC) | Se encontró de forma significativa que niveles más bajos de 25VD estaban relacionados con menor incidencia de CCNM. Pacientes con valores >18ng/ml presentaban un riesgo hasta 7 veces superior de CCNM |
| Caini et al.21 2021 | 58.067 | - RS y MA- Se incluyeron estudios de cohortes, ensayos clínicos, casos y controles y transversales >10 pacientes que evaluaron la aparición de CC en función de niveles de 25VD | Todos los estudios de cohortes, ensayos clínicos, casos y controles y transversales >10 pacientes que evaluaron la aparición de CC hasta septiembre de 2020 (24 artículos) | Se encontró una asociación directa entre los niveles de 25VD y el riesgo de CCNM, así como en la ingesta de 25VD y el riesgo de CCNM. Este riesgo parecía más evidente en estudios observacionales que en ensayos clínicos |
| Abdelwahab et al.22 2022 | >200.000 | - RS- Se incluyeron estudios de cohortes, casos y controles y transversales >10 pacientes que evaluaron la aparición de CC en función de niveles de 25VD | Todos los estudios de cohortes, casos y controles y transversales >10 pacientes que evaluaron la aparición de CC hasta enero de 2022 (10 artículos) | No se pudo concluir que niveles normales o elevados de 25VD o niveles bajos se asocien a mayor o menor riesgo de CCNM. Gran heterogeneidad en los resultados de los estudios incluidos |
CBC: carcinoma basocelular; CC: cáncer cutáneo; CCM: cáncer cutáneo melanoma; CCNM: cáncer cutáneo no melanoma; cSCC: carcinoma de células escamosas cutáneo; ECA: ensayo clínico aleatorizado; MA: metaanálisis; RS: revisión sistemática; VD: vitaminaD (no especificación de subtipo); 25VD: 25-hidroxicolecalciferol.
Un ensayo clínico aleatorizado contra placebo (n=36.282) evaluó los efectos de la suplementación de 400UI de VD y 1.000mg de calcio en el riesgo de CCNM y melanoma en mujeres posmenopáusicas. La media de seguimiento fue de 7años. La suplementación no redujo la incidencia general de CCNM o melanoma. En un subanálisis, el grupo de mujeres con antecedentes de CCNM que recibieron suplementación tuvo un riesgo reducido de desarrollar melanoma (Hazard ratio: 0,43; IC95%: 0,21-0,90) frente al grupo placebo13. Un MA del año 2020 que incluyó solo estudios prospectivos (13 estudios con más de 200.000 pacientes en total) no reveló un mayor riesgo de carcinoma escamoso cutáneo ni de melanoma, pero sí un mayor riesgo de presentar carcinomas basocelulares en los individuos que tomaban suplementos de VD23. Resultados similares se observaron en la RS de Caini et al.21.
B. Vitamina D y melanomaDesarrollo de melanomaNumerosos estudios han implicado a la VD en el desarrollo o progresión del melanoma (tabla 3)13,16,17,20,24-44. Ciertos reportes relacionan niveles más bajos de VD con mayor incidencia de melanoma33-35,37,44,45. Una RS y un MA de 2023, donde se recogieron 14 estudios de casos y controles y cohortes prospectivos, con 6.111 pacientes en total, concluyó una mayor incidencia de melanoma y mayor índice de Breslow (IBr) en pacientes con insuficiencia de 25VD (≤30ng/ml)44. Sin embargo, hay otros estudios que no encontraron una relación entre los niveles de VD y la incidencia de melanoma13,17,36, como el reciente estudio de casos y controles multicéntrico de Stenehjem et al., con más de 1.000 pacientes, donde no se pudo concluir que niveles bajos o elevados de VD se asocien con la incidencia de melanoma, si bien postulan que la incidencia menor de melanoma posiblemente se sitúe en pacientes con niveles de VD entre 30 y 50ng/ml36. Por último, hay otros estudios que mostraron que niveles elevados de VD podrían relacionarse con mayor incidencia de melanoma20,42. Especialmente relevante es el estudio de Cai et al., que en un análisis de aleatorización mendeliana, con una muestra mayor a 500.000 pacientes, encontraron una posible asociación directa entre los niveles de VD y melanoma. Este análisis se confirmó tras realizar los test de pleiotropía y el análisis de sensibilidad42.
Principales estudios sobre la asociación de vitaminaD y melanoma
| Autores y año | Tamaño muestral | Tipo de estudio, metodología | Criterios de inclusión | Resultados |
|---|---|---|---|---|
| Asgari et al.24 2009 | 68.611 | - Cohortes retrospectivo multicéntrico- Pacientes seguidos en un estudio de suplementación con 25VD, a los que se analizó la incidencia de melanoma | Participación en estudio de cohortes Vitamins and Lifestyle cohort study que analizó la incidencia de diversos tumores en pacientes con diversas suplementaciones alimentarias | No se pudo concluir que la ingesta suplementaria de 25VD se asocie a una menor incidencia de melanoma |
| Newton-Bishop et al.25 2009 | 271 | - Casos y controles retrospectivo unicéntrico- Pacientes diagnosticados de melanoma en un centro terciario y comparados con cohorte control de pacientes sanos | Pacientes diagnosticados de melanoma en un centro terciario entre los años 2000 y 2005 y comparados, independiente de antecedentes. Comparados con cohorte control sana de un registro de melanoma | - No se encontró una reducción significativa del riesgo de melanoma en pacientes que tomaban suplementos de 25VD- Se encontró de forma significativa que niveles más altos de 25VD se asociaron a menor riesgo de melanoma y a un menor IBr |
| Tang et al.13 2011 | 36.282 | - ECA fase III (NCT00000611)- Desarrollo de CC en pacientes con suplementación de 1g calcio y 400UI de VD/día frente a placebo en seguimiento de 7 años | Mujeres posmenopáusicas con o sin antecedentes de CC | Las tasas de melanoma en pacientes con suplementación no difirieron del grupo control sin suplementación. Sin embargo, las pacientes con antecedentes de CCNM que fueron suplementadas presentaron un menor riesgo significativo de melanoma |
| Van der Pols et al.16 2013 | 1.191 | - Cohortes prospectivo multicéntrico- Seguimiento durante 8 años de pacientes para evaluar la aparición de CC, midiendo los niveles de 25VD antes del seguimiento | Pacientes sanos de cualquier edad y antecedentes que voluntariamente quisieron participar en un estudio para la prevención de cáncer de piel entre 1992 y 1996 | Niveles de 25VD superiores a 75ng/ml estaban asociados a mayor riesgo de melanoma |
| Gambichler et al.26 2013 | 764 | - Transversal unicéntrico- Medición de niveles de 25VD en pacientes al momento del diagnóstico de melanoma en un centro terciario | Todos los pacientes con diagnóstico de melanoma entre 2009 y 2012, comparando los niveles de 25VD y los parámetros histológicos y el estadio | Se encontró que niveles disminuidos de 25VD (≤30ng/ml) estaban asociados a mayor IBr y mayor estadio tumoral |
| Caini et al.17 2014 | 1.420 | - RS y MA- Se incluyeron estudios de cohortes, casos y controles y transversales >10 pacientes que evaluaron la aparición de CC en función de niveles de 25VD | Todos los estudios de cohortes, casos y controles y transversales >10 pacientes que evaluaron la aparición de CC hasta enero de 2013 (20 artículos) | No se hallaron resultados significativos que asociasen niveles de 25VD y melanoma. Sin embargo, se encontró significativamente que había una relación inversa entre el espesor del IBr y los niveles de 25VD |
| Bade et al.45 2014 | 465 | - Casos y controles retrospectivo unicéntrico- Medición de niveles de 25VD en pacientes con diagnóstico de melanoma y comparándolos con controles sanos | Pacientes con diagnóstico de melanoma en un centro terciario, que tenían registrados niveles de 25VD, comparados con grupo control sano entre 2010 y 2013 | - Fue más frecuente el déficit (≤20ng/ml) de 25VD en pacientes con melanoma que en controles- Niveles menores de 25VD estaban asociados a mayor IBr y menor supervivencia específica por melanoma |
| Newton-Bishop et al.27 2015 | 2.182 | - Cohortes prospectivo unicéntrico | Pacientes con diagnóstico de melanoma entre 2001 y 2003. Exclusión de pacientes con ganglios positivos y primario desconocido | Niveles más bajos de 25VD se asocian a melanoma de peor pronóstico (especialmente, más ulcerados) y con mayor mortalidad específica |
| Wyatt et al.28 2015 | 100 | - Transversal unicéntrico- Medición de niveles de 25VD en pacientes al momento del diagnóstico de melanoma | Todos los pacientes con diagnóstico de CCM entre julio de 2010 y julio de 2011, comparando los niveles de 25VD y los parámetros histológicos del melanoma | - Niveles ≤50ng/ml de 25VD estaban asociados a un IBr casi 4 veces superior, pero no a mayor número de mitosis- Los pacientes con niveles de 25VD ≥70ng/ml no presentaron menor incidencia de melanoma |
| Saiag et al.29 2015 | 1.171 | - Cohortes prospectivo unicéntrico- Medición de niveles de 25VD en pacientes al momento del diagnóstico de melanoma, y posteriormente mediciones sucesivas en seguimiento | Todos los pacientes con diagnóstico de melanoma entre 2003 y 2008 que aceptaron medición inicial y seriada de niveles de 25VD. Se realizó seguimiento hasta el 2013 | - Se encontraron valores inferiores de 25VD en pacientes con mayor IBr, ulceración o estadificación- El incremento de estos valores no mejoró el pronóstico específico por melanoma o la supervivencia global, sugiriendo que el valor inicial de los niveles de 25VD puede estar sesgado por factores confusores no detectados o analizados |
| Timerman et al.30 2017 | 252 | - Cohortes retrospectivo unicéntrico- Medición de niveles de 25VD en pacientes con diagnóstico de melanoma | Pacientes con CCM entre 2007 y 2013, a los que se midió niveles de 25VD hasta un año antes o un año después del diagnóstico | - El déficit (≤20ng/ml) de 25VD se asoció a mayor estadio, ulceración e índice mitótico del melanoma- En pacientes con estadioIV, este déficit se asoció a peor pronóstico específico por melanoma |
| Lim et al.31 2018 | 109 | - Transversal unicéntrico- Medición de niveles de 25VD en una cohorte de pacientes diagnosticados de melanoma | Pacientes diagnosticados de melanoma entre 2001 y 2013, con mediciones de niveles de 25VD hasta 6 meses posterior al diagnóstico | - Asociación directa entre niveles bajos de 25VD y mayor IBr, mayor ulceración, subtipo desmoplásico e índice de mitosis- No se encontró relación entre niveles de 25VD y metástasis por melanoma |
| Lipplaa et al.32 2018 | 341 | - Transversal multicéntrico- Medición de niveles de 25VD en una cohorte de pacientes diagnosticados de melanoma estadio IIB-IIIC | Pacientes con diagnóstico de melanoma IIB-IIIC que se encontraban en un ECA con bevacizumab | No se encontró relación entre los niveles de 25VD y el IBr, la supervivencia específica por melanoma o la supervivencia global |
| Vojdeman et al.20 2019 | 212.244 | - Cohortes retrospectivo multicéntrico- Medición de niveles de 25VD en cohorte poblacional nacional y análisis de incidencia de CC | Se recogieron los pacientes en registro nacional danés que tenían documentados niveles de 25VD entre 2004 y 2010 y se analizó la incidencia de CC hasta 2014 | Niveles elevados de 25VD se asociaron a mayor incidencia de CCM, de forma estadísticamente significativa |
| Cattaruza et al.33 2019 | 236 | - Casos y controles ambispectivo unicéntrico- Medición de niveles de 25VD en pacientes con diagnóstico de melanoma y comparándolos con controles sanos | Pacientes con diagnóstico de melanoma que tenían registrados niveles de 25VD, comparados con grupo control sano recogido posteriormente | Se encontró una asociación estadísticamente significativa entre niveles de 25VD insuficientes (20,01-30ng/ml) y deficientes (≤20ng/ml) en el desarrollo de CCM |
| Tsai et al.34 2020 | 11.166 | - RS y MA | Todos los estudios de cohortes, casos y controles y transversales con >20 pacientes hasta noviembre de 2018 y que evaluaban la relación entre melanoma y niveles de 25VD | - Los pacientes con déficit (≤20ng/ml) de 25VD presentaban mayor incidencia de melanoma- Correlación positiva entre el IBr y el déficit de 25VD- Los pacientes con déficit de 25VD presentaron mayor mortalidad por melanoma que los pacientes con melanoma y niveles >20ng/ml |
| Befon et al.35 2020 | 198 | - Estudio de casos y controles prospectivo unicéntrico- Medición de niveles de 25VD en cohorte de pacientes con melanoma comparados con cohorte sana | Pacientes diagnosticados de melanoma entre 2011 y 2014 a los que se solicitaron niveles de 25VD y comparados con un grupo control del mismo periodo | - Se encontró que los pacientes con melanoma tenían niveles de 25VD medios inferiores que el grupo control (25 vs. 21ng/ml, respectivamente)- No se encontró asociación entre niveles de 25VD y el IBr, la ulceración, el estadio o el tipo de melanoma |
| Stenehjem et al.36 2020 | 1416 | - Estudio de casos y controles prospectivo multicéntrico- Medición de niveles de 25VD en pacientes con diagnóstico de melanoma y comparándolos con controles sanos | Pacientes con diagnóstico de melanoma en una cohorte nacional noruega. Se aparearon con controles sanos de otra cohorte nacional del mismo país | No se pudo demostrar de forma estadísticamente significativa que niveles elevados o reducidos de 25VD se asocien a mayor o menor riesgo de melanoma, aunque los datos sugieren que probablemente el grupo de menor riesgo sea el de niveles entre 30 y 50ng/ml |
| Lombardo et al.37 2021 | 279 | - Estudio de casos y controles retrospectivo unicéntrico- Medición de niveles de 25VD en pacientes con diagnóstico de melanoma y comparándolos con controles sanos | Pacientes con diagnóstico de melanoma entre 2016 y 2019 comparándolos con controles sanos | - El desarrollo de melanoma fue más frecuente en pacientes con insuficiencia (≤30ng/ml) de 25VD- No se encontró asociación significativa entre niveles de 25VD y el IBr. Sin embargo, sí se describió que niveles más bajos de 25VD asociaban un mayor índice mitótico y un punto de corte de IBr>1mm |
| Johansson et al.38 2021 | 114 | - ECA unicéntrico- Análisis de la SLE en pacientes con melanoma faseII frente a placebo | Pacientes con melanoma estadioII entre 2011 y 2015. Se comparó la suplementación con 25VD frente a la no suplementación | - La suplementación con 25VD no reportó mejores tasas de SLE que la no suplementación- La combinación de niveles bajos de 25VD e IBr ≥3mm reportó menor SLE, no así los niveles inferiores de 25VD |
| Moro et al.39 2022 | 286 | - Estudio de cohortes retrospectivo unicéntrico- Análisis de la incidencia y características de melanoma en una cohorte en función de los niveles de 25VD | Pacientes con diagnóstico de melanoma, a los cuales se midieron niveles de 25VD entre 2011 y 2020 | Niveles de 25VD <9,25ng/ml se asociaron a mayor ulceración y en una menor supervivencia global |
| Gracia-Darder et al.40 2022 | 264 | - Estudio de cohortes retrospectivo unicéntrico- Análisis de la incidencia y características de melanoma en una cohorte en función de los niveles de 25VD | Pacientes con diagnóstico de melanoma y a los cuales se midieron niveles de 25VD entre 1998 y 2021 | Niveles bajos de 25VD estuvieron asociados a mayor IBr, menor supervivencia específica por melanoma y menor supervivencia global |
| Sha et al.41 2023 | 411.436 | - Estudio transversal multicéntrico- Análisis de la suplementación con VD y la disminución en riesgo de melanoma | Pacientes entre 40 y 69años incluidos en el registro nacional inglés | - Hasta un 21% de la población presentaba un déficit de VD (≤20) y un 34% una insuficiencia (≤30)- Se halló que la suplementación multivitamínica podría reducir el riesgo de melanoma |
| Cai et al.42 2023 | >500.000 | - Análisis de aleatorización mendeliana- Análisis de relación causal entre niveles de 25VD y melanoma, con análisis posterior de pleiotropía y de sensibilidad | Incluyeron los estudios presentes en la literatura hasta 2023 y en los cuales se pudo realizar un estudio a través de GWA | Posible asociación positiva entre niveles de 25VD y melanoma, aun tras realizar test de pleiotropía y análisis de sensibilidad |
| Kanasuo et al.43 2023 | 498 | - Cohortes prospectivo unicéntrico- Pacientes sanos que acudieron a visita dermatológica oncológica o no oncológica a los cuales se midieron los niveles de 25VD y, en un subgrupo, se suplementó con VD oral | Pacientes que acudieron a visita dermatológica entre 18 y 80años | - No se encontró relación entre los niveles de 25VD y el riesgo de melanoma- Sin embargo, la suplementación con 25VD se asoció a un menor riesgo de melanoma |
| Shellenberger et al.44 2023 | 6.111 | - RS y MA- Se incluyeron 14 estudios de casos y controles y cohortes prospectivos | Todos los estudios de cohortes y casos y controles prospectivos con >20 pacientes hasta julio de 2022 | Se encontró mayor incidencia de melanoma con insuficiencia de 25VD (≤30ng/ml) y un mayor IBr con niveles más bajos de 25VD |
CC: cáncer cutáneo; CCNM: cáncer cutáneo no melanoma; ECA: ensayo clínico aleatorizado; GWAS: Genome Wide Association Studies; IBr: índice de Breslow; MA: metaanálisis; RS: revisión sistemática; SLE: supervivencia libre de enfermedad; 25VD: 25-hidroxicolecalciferol.
Diversos estudios han descrito que niveles bajos de VD se relacionaron con melanomas de peor pronóstico (tabla 3)17,25-31,34,37-40,45,46. Por ejemplo, un estudio español de 2019 con 204 individuos con melanoma encontró que niveles inferiores de VD se asociaban con ulceración tumoral y un mayor índice mitótico46. Una RS y un MA de 2020, con más de 10.000 pacientes incluidos, evaluaron la relación entre los niveles de 25VD y el riesgo de melanoma, así como los factores pronósticos, y se concluyó que los pacientes con déficit de 25VD (≤20ng/ml) presentaban mayor incidencia y mayor mortalidad específica de melanoma. Igualmente, se encontró una correlación directa entre el IBr y el déficit de 25VD34.
En cuanto a la suplementación con VD, un ensayo clínico con 114 pacientes con melanoma estadioII (80% de ellos con niveles insuficientes de VD) reveló que la suplementación con VD no asociaba mayores tasas de supervivencia libre de enfermedad (SLE) que la no suplementación. A los 12meses de seguimiento, los pacientes con niveles bajos de 25VD e IBr ≥3mm presentaron una menor SLE, no así los individuos con niveles inferiores de 25VD aisladamente38.
Suplementación con VD y riesgo de melanomaMúltiples estudios han analizado la incidencia de melanoma en pacientes con suplementación con VD, mostrando resultados contradictorios24,25,38,41,43. Un estudio transversal reciente (n=498) reveló que los individuos con suplementación de VD oral tuvieron un menor riesgo de desarrollar melanoma (0,447 [p=0,016; IC95%: 0,231-0,862])43. Sin embargo, un ensayo clínico con más de 30.000 mujeres posmenopáusicas13 y un MA reciente23, ambos comentados previamente, no encontraron una disminución de las tasas de melanoma en pacientes que tomaban suplementos de VD.
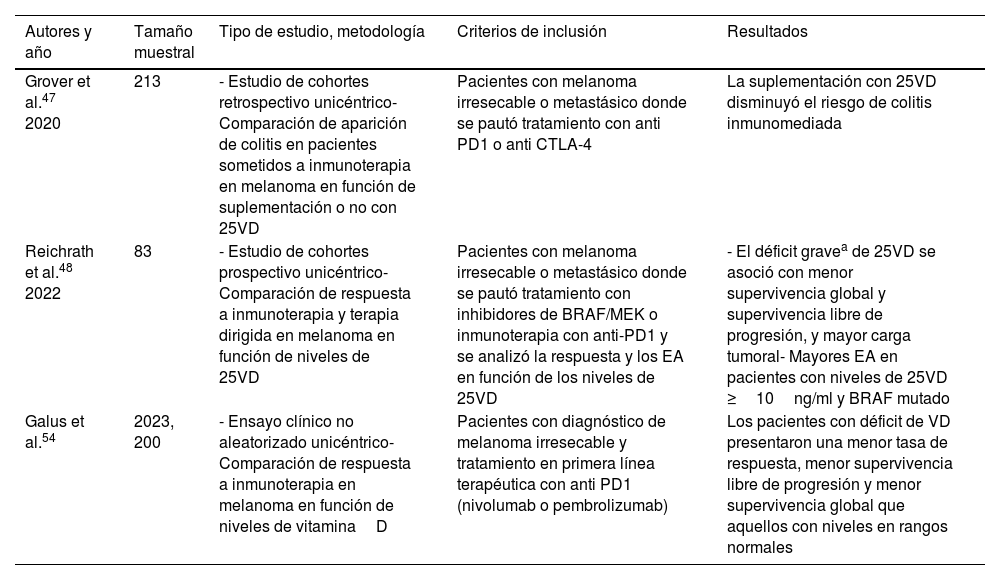
Vitamina D y respuesta a terapia avanzadaEn 2020, Grover et al. realizaron un estudio retrospectivo en pacientes con melanoma metastásico tratados con anti PD-1 o anti CTLA-4. El 17% de ellos desarrollaron colitis inmunomediada. La suplementación previa con VD mostró asociación significativa con menor riesgo de colitis. Estos resultados fueron comprobados posteriormente en una cohorte independiente (tabla 4)47. Un estudio prospectivo con 83 pacientes con melanoma metastásico y tratamiento con inhibidores de BRAF o de MEK, o sometidos a inmunoterapia, reveló que el déficit de 25VD (<10ng/ml) se asociaba a una supervivencia global y libre de progresión significativamente menor48. Recientemente, Galus et al. publicaron los resultados de un ensayo clínico (n=200), mostrando que los pacientes con déficit de 25VD sometidos a tratamiento anti PD-1 presentaban una menor tasa de respuesta objetiva (36,2%, versus 56,0%), menor supervivencia libre de enfermedad (5,75 versus 11,25 meses) y menor supervivencia global que aquellos con niveles normales de 25VD44.
Principales estudios sobre la vitaminaD y la respuesta a terapia avanzada en melanoma
| Autores y año | Tamaño muestral | Tipo de estudio, metodología | Criterios de inclusión | Resultados |
|---|---|---|---|---|
| Grover et al.47 2020 | 213 | - Estudio de cohortes retrospectivo unicéntrico- Comparación de aparición de colitis en pacientes sometidos a inmunoterapia en melanoma en función de suplementación o no con 25VD | Pacientes con melanoma irresecable o metastásico donde se pautó tratamiento con anti PD1 o anti CTLA-4 | La suplementación con 25VD disminuyó el riesgo de colitis inmunomediada |
| Reichrath et al.48 2022 | 83 | - Estudio de cohortes prospectivo unicéntrico- Comparación de respuesta a inmunoterapia y terapia dirigida en melanoma en función de niveles de 25VD | Pacientes con melanoma irresecable o metastásico donde se pautó tratamiento con inhibidores de BRAF/MEK o inmunoterapia con anti-PD1 y se analizó la respuesta y los EA en función de los niveles de 25VD | - El déficit gravea de 25VD se asoció con menor supervivencia global y supervivencia libre de progresión, y mayor carga tumoral- Mayores EA en pacientes con niveles de 25VD ≥10ng/ml y BRAF mutado |
| Galus et al.54 | 2023, 200 | - Ensayo clínico no aleatorizado unicéntrico- Comparación de respuesta a inmunoterapia en melanoma en función de niveles de vitaminaD | Pacientes con diagnóstico de melanoma irresecable y tratamiento en primera línea terapéutica con anti PD1 (nivolumab o pembrolizumab) | Los pacientes con déficit de VD presentaron una menor tasa de respuesta, menor supervivencia libre de progresión y menor supervivencia global que aquellos con niveles en rangos normales |
BRAF: B-rapidly accelerated fibrosarcoma; CTLA-4: cytotoxic T-lymphocyte-associated protein 4; EA: efectos adversos; MEK: mitogen-activated protein kinase kinase; PD: programmed cell death protein; 25VD: 25-hidroxicolecalciferol.
Se revisó igualmente la relación entre la utilización de fotoprotectores tópicos y su impacto en los niveles de VD. En este sentido, una RS de 2019 concluyó que el uso regular de fotoprotectores tópicos no produce un impacto en los niveles de VD en individuos sanos49. Así también, un estudio reciente con más de 3.000 pacientes no encontró una asociación entre el uso de medidas de fotoprotección, incluida la aplicación de fotoprotectores tópicos, y la disminución de la densidad de la masa ósea o un mayor riesgo de fracturas osteoporóticas50. En resumen, el uso regular de fotoprotectores tópicos no produce un impacto en los niveles de VD, ni en la densidad de la masa ósea, ni un mayor riesgo de fracturas osteoporóticas en individuos sanos49,50.
DiscusiónLa asociación entre los niveles de VD y CC cutáneo es controvertida, como también lo es la asociación entre suplementación con VD y disminución de CC, o su pronóstico. Actualmente no existen criterios establecidos ni recomendaciones en las principales guías de CC, y carecemos de recomendaciones estandarizadas en relación con la medición o suplementación de VD en pacientes con riesgo, o que padecen de CC.
En relación con el CCNM, numerosos estudios han descrito una asociación directa entre el CBC y los niveles de 25VD6,11,12,14-17,19-21. Esta relación también se ha reportado en el carcinoma escamoso cutáneo6,12,14,15,17,19-21. Este hecho es llamativo, dada la creciente evidencia que apoya la suplementación con VD frente a otros cánceres, como el cáncer colorrectal o el pulmonar51. Posiblemente se explique debido a la relación directa entre los niveles de 25VD y la exposición solar, factor de riesgo crucial para el desarrollo del CCNM21.
En cuanto a la asociación entre melanoma y los niveles de VD, los estudios analizados difieren sobre si existe una relación directa, inversa o si no hay asociación. A pesar de que la mayoría de los estudios reportan que niveles bajos de VD o la suplementación con VD podría reducir el riesgo de melanoma13,17,25-31,33-35,37-41,43-45, encontramos estudios no concluyentes24,32,36, e incluso algunos que correlaciona positivamente los niveles de VD y el riesgo de melanoma o de melanoma de peor pronóstico16,20,42.
El rol del receptor de la VD (VDR) y el melanoma ha sido estudiado recientemente: algunos trabajos sugieren que ciertos polimorfismos en el gen del VDR podrían estar asociados con mayor riesgo de melanoma52. Un estudio retrospectivo reciente (703 melanomas) describió que niveles más altos de expresión de VDR protegieron de forma independiente contra la muerte relacionada con el melanoma tanto primario como metastásico. Los tumores con altas tasas de expresión de VDR mostraron una mayor actividad inmune antitumoral y vías proliferativas reducidas, particularmente la señalización de Wnt-β-catenina. En este estudio, la deficiencia de VD se asoció con menor supervivencia en el melanoma primario, especialmente cuando los niveles de VDR eran bajos. Estos hallazgos sugieren una relación causal entre la señalización de VD-VDR y la supervivencia del melanoma53.
En referencia a la relación entre los niveles de VD o su suplementación y la inmunoterapia en melanoma, existen estudios que muestran que bajos niveles de VD se correlacionarían con una menor respuesta antitumoral de la inmunoterapia48,54 o incluso una mayor tasa de efectos adversos de esta47. Actualmente, la suplementación de VD en los pacientes con melanoma presenta un grado de recomendaciónB (recomendación probablemente efectiva), con un nivel de evidenciaIIb (estudios de cohortes y casos controles), aunque la evidencia actual es todavía escasa5. De hecho, la guía del National Comprehensive Cancer Network (NCCN) no se posiciona al respecto55, y tampoco la guía de la European Society for Medical Oncology (ESMO)56, ni la 8.a edición del American Joint Committee on Cancer (AJCC)57. Son necesarios nuevos estudios que evalúen el valor de la suplementación con VD en pacientes con melanoma.
Un reciente estudio retrospectivo con 663 pacientes evalúo si los pacientes con melanoma tenían más riesgo de desarrollar otros cánceres no cutáneos tras el diagnóstico previo de melanoma. Se encontraron 34 tumores no cutáneos, y en el análisis multivariante se concluyó que la edad superior a 60años (HR: 3,4; IC95%: 1,5-7,6) y el subtipo nodular de melanoma (HR: 2,2; IC95%: 1-4,8) estaban asociados directamente a la aparición de otros tumores no cutáneos, pero no los niveles de VD58.
LimitacionesNuestra revisión presenta múltiples limitaciones: es una revisión narrativa y no una revisión sistemática; muchos estudios incluidos son retrospectivos y/o emplean metodologías diversas en cuanto a la medición de variables y de resultados, dificultando la comparación de los datos. Estos factores entorpecen la generalización de los hallazgos y sus conclusiones, y subrayan la necesidad de contar con estudios prospectivos, diseñados adecuadamente y con seguimiento prolongado.
ConclusionesLa asociación entre la VD y el CC es compleja. Niveles adecuados o incluso elevados de VD podrían asociarse a un mayor riesgo de CCNM, especialmente de CBC. En cuanto al melanoma, la relación es incierta, con resultados contradictorios. Sin embargo, la mayoría de los estudios reportan que niveles más altos de VD o la suplementación con VD podrían disminuir el riesgo de melanoma, y podrían correlacionarse con melanomas de mejor pronóstico. Igualmente, niveles elevados de VD o la suplementación con VD podrían asociarse a mejor respuesta antitumoral y menores efectos adversos con la inmunoterapia del melanoma. En resumen, hasta la fecha no existiría evidencia suficiente para recomendar la suplementación de VD en pacientes con riesgo de CCNM o de melanoma. Sin embargo, niveles normales de VD podrían asociarse con mejores respuestas terapéuticas y mejor pronóstico en melanoma. Se requieren realizar estudios prospectivos de alta calidad metodológica para esclarecer el rol de la VD y su suplementación en CC, y poder elaborar guías clínicas al respecto.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al doctor Francisco José Navarro Triviño por la posibilidad de emplear su esquema relativo a la figura 1.