El carcinoma de células basales (CBC) es una de las neoplasias malignas más frecuentes, por lo que se ha convertido en una importante carga asistencial. Su incidencia se incrementa anualmente, especialmente en la población con mayor edad. A pesar de que generalmente está bien localizado, el CBC tiene la capacidad de destruir tejidos y evolucionar a un CBC localmente avanzado (CBCla) o incluso, aunque de forma más rara, a un CBC metastásico (CBCm). Las opciones terapéuticas convencionales en estos casos están bien establecidas, entre las cuales se incluyen la cirugía y la radioterapia. Sin embargo, no todos los casos son elegibles para realizar un tratamiento de tipo convencional. Recientemente, los tratamientos biológicos vienen ganando una mayor atención y son objeto de diversos estudios de investigación. De este modo se ha desarrollado una terapia dirigida utilizando los inhibidores de la vía de Hedgehog (IVH), teniendo en cuenta que se trata de una vía patogénica clave tanto en el CBCla como en el CBCm. En la actualidad, para poder tratar el CBCla y el CBCm no operables existen dos IVH aprobados: el vismodegib y el sonidegib. Esta revisión busca explorar la fisiopatología de la vía del Hedgehog responsable del desarrollo del CBC y hacer una actualización en cuanto a la eficacia, así como de las propiedades farmacocinéticas de los IVH, características que los convirtieron en la opción terapéutica ideal en el CBCla o en el CBCm, ya sea en forma de monoterapia o en combinación con alguno de los tratamientos convencionales.
As one of the most common malignancies, basal cell carcinoma (BCC) has evolved as a global burden with incidence annually rising, especially in the older population. Even though the condition is mostly localized, the nature of the disease is destructive and can evolve as either locally advanced BCC (laBCC) or even more rarely as metastatic BCC (mBCC). There are well-established conventional treatment options for these cases, including surgeries and radiotherapy. However, not all cases are eligible for conventional treatments. Recently, biologic treatment has gained a lot of attention and research. This has led to the development of targeted treatment involving the hedgehog pathway inhibitor (HPI), a key pathogenesis in laBCC and mBCC. There are currently two approved HPIs, vismodegib and sonidegib to treat inoperable laBCC and mBCC. This review seeks to explore the pathophysiology of hedgehog pathway behind the development of BCC, and the current update of the efficacy as well as pharmacokinetics properties of HPIs that led to the ideal treatment for laBCC or mBCC, either as monotherapy or in combination with other conventional therapies.
El carcinoma de células basales (CBC) es el cáncer cutáneo más común en la historia humana. Solo en los Estados Unidos (EE.UU.) llega a afectar anualmente a más de 2.000.000 de personas1,2. El CBC representa más del 80% de todos los cánceres de piel no melanoma (CPNM) y será más frecuente en personas de raza caucásica, con fototipos de Fitzpatrick I y II. Por otro lado, cada año se evidencia un incremento en el número de casos3,4. Actualmente, Australia lidera el mayor número de casos de CBC en el mundo, con una incidencia de 1531 por cada 100.000 habitantes5.
Por lo general, el CBC es una tumoración localizada, relativamente indolente que se caracteriza por ser una lesión de pequeño y mediano tamaño, con bordes bien definidos. Las opciones terapéuticas convencionales pueden ser quirúrgicas y no quirúrgicas. El tratamiento estándar de oro para el CBC es la cirugía, en particular la cirugía micrográfica de Mohs (MMS) con control de márgenes de seguridad. Los tratamientos tópicos como el imiquimod, el 5-fluorouracilo (5-FU) y el mebutato de ingenol suelen reservarse para casos de bajo riesgo como son el CBC superficial, el CBC pequeño (diámetro <1cm) o el CBC en áreas de bajo riesgo1,6. La terapia fotodinámica (TFD) es otra opción no quirúrgica para el CBC de bajo riesgo con una eficacia similar a los tratamientos tópicos. Según el NCCN (National Comprehensive Cancer Network), el CBC se puede clasificar en dos categorías, una de bajo riesgo y otra de alto riesgo (tabla 1).
CBC de bajo riesgo vs. CBC de alto riesgo
| Anamnesis y hallazgos clínicos | Bajo riesgo | Alto riesgo |
|---|---|---|
| Localización y tamaño | Área L<20mmÁrea M<10mmÁrea H<6mm | Área L≥20mmÁrea L≥10mmÁrea H≥6mm |
| Bordes | Bien definidos | Mal definidos |
| Primario vs. Recidiva | Primario | Recidiva |
| Inmunosupresión | (-) | (+) |
| Sitio de radioterapia previa | (-) | (+) |
| Anatomía patológica | ||
|---|---|---|
| Subtipo | Nodular, superficial | Patrón de crecimiento agresivo |
| Compromiso perineural | (-) | (+) |
Área H=«máscara» de la cara (área central, párpados, cejas, zona periorbitaria, nariz, labios [cutáneos y bermellón], mentón, mandíbula, piel/áreas preauriculares y postauriculares, sien, oído), genitales, manos y pies; Área L=tronco y extremidades (excluyendo zona pretibial, manos, pies, unidades ungueales y tobillos); Área M=mejillas, frente, cuero cabelludo, cuello y zona pretibial.
Fuente: Bichakjian et al.7.
A pesar de que a menudo está bien localizado, en casos raros el CBC puede progresar a un CBC localmente avanzado (CBCla) o incluso metastásico (CBCm), especialmente cuando el tratamiento no es oportuno. La definición de CBCla no se ha establecido de manera clara, sin embargo, este se considera cuando el tumor llega a infiltrar en profundidad tanto la piel como los tejidos circundantes1,3. La metástasis en el CBC es extremadamente rara, con una tasa de solo 0,0028-0,55% de todos los casos de CBC, siendo los huesos, el hígado y los pulmones las localizaciones afectadas con mayor frecuencia1,3. La mediana de la tasa de supervivencia de los pacientes con un CBCm está aproximadamente entre los 8 meses y los 7,3 años1. En los casos de CBCla y CBCm, las mutaciones localizadas en la vía de señalización del Hedgehog (Hh) serán más frecuentes si se comparan con el CBC clásico; estas mutaciones darán como resultado una proliferación celular descontrolada8. En estos casos, las opciones quirúrgicas no son factibles y, por lo tanto, se deben considerar enfoques terapéuticos no quirúrgicos.
La radioterapia ha sido durante mucho tiempo la opción terapéutica convencional en el CBC que no era operable, especialmente en aquellos pacientes con más de 60 años6. Si bien la radioterapia tendrá un resultado considerablemente bueno, este será menos eficaz si se compara con la CMM1. Sin embargo, existen algunas desventajas a tener en cuenta, desde el aspecto cosmético, el posible desarrollo de nuevos CBC inducidos por la radioterapia y la duración prolongada del tratamiento1. En un artículo de revisión de Dummer et al. se determinó que la cirugía y la radioterapia no eran los tratamientos más adecuados en algunas condiciones específicas: en pacientes con síndromes genéticos con >5 CBC, en CBC con un diámetro >10mm tras 2 cirugías y en CBC con una localización crítica, como en la región perioral/periocular, así como en CBC inoperables que infiltren el hueso y el cartílago, en CBC con múltiples recidivas tras cirugía/radioterapia, o finalmente en aquellos pacientes en los que la anestesia general esté contraindicada9. Otras técnicas sencillas y rentables en el tratamiento del CBC son la crioterapia y el curetaje. Estos métodos son menos invasivos y son alternativas terapéuticas en el CBC; así mismo, requerirán menos recursos en comparación con la radioterapia o la cirugía; sin embargo, su uso es limitado, especialmente cuando se realiza en áreas faciales; también se requerirá tener cierta experiencia y estar bien capacitados para poder evitar complicaciones, tales como son el sangrado, el daño de tejidos y la hipopigmentación postinflamatoria10. Por todo lo previamente comentado, se hizo evidente la necesidad de desarrollar nuevos enfoques terapéuticos, más avanzados y adecuados, que permitiesen tratar aquellos casos de CBC inoperables.
Los estudios de investigación acerca del uso de la terapia dirigida utilizando un tratamiento sistémico, como son los inhibidores de la vía de señalización del Hh, vismodegib y sonidegib, han ganado terreno en los últimos años. Tanto su eficacia como la tasa de respuesta (ORR) se han estudiado de manera amplia8,11. La determinación de la ORR se ha basado en los criterios RECIST (Response Evaluation Criteria in Solid Tumors), ya ampliamente aceptados. Estos criterios se establecieron por primera vez en el año 2000, y una versión actualizada de la guía, llamada RECIST modificada (mRECIST), se publicó en el año 2008; esta última con la principal finalidad de poder evaluar los cambios tumorales12.
Vía de señalización del HedhogEl Hedgehog (Hh) es una serie de proteínas secretadas que tienen su función en una vía de señalización entre la membrana y el núcleo celular, vía denominada «vía de señalización del Hedgehog (Hh)». El término «erizo» (Hedhog en inglés) se originó a partir del descubrimiento de dicha proteína, la cual fue observada por primera vez en las moscas de la fruta (Drosophila melanogaster) mediante un estudio genético, observándose en sus embriones la presencia de una estructura similar a la de un cabello, y que presentaban alelos nulos, los que recordaban las espinas de los erizos. Tras su descripción inicial, se describieron otros 3 tipos de ligandos Hh en mamíferos, los que se denominaron Hh sónico (SHH), Hh indio (IHH) y Hh del desierto (DHH)13,14. La vía del Hh jugará un papel integral durante la embriogénesis13,15.
Estas proteínas tienen un papel importante en el desarrollo humano precoz. Por ejemplo, el SHH participa en la formación de las extremidades, el desarrollo del sistema nervioso central, el desarrollo del tubo neural y la formación de los pulmones, de los dientes, de los intestinos y de los folículos pilosos; el IHH regula el desarrollo de los huesos y el cartílago, y el DHH tiene una función integral en el desarrollo de las células germinales y en la formación de la vaina de los nervios periféricos13. Después de la edad adulta, la actividad del Hh disminuirá en la gran mayoría de casos, pero incluso entonces tendrá un papel importante en la homeostasis y en la cicatrización de las heridas15.
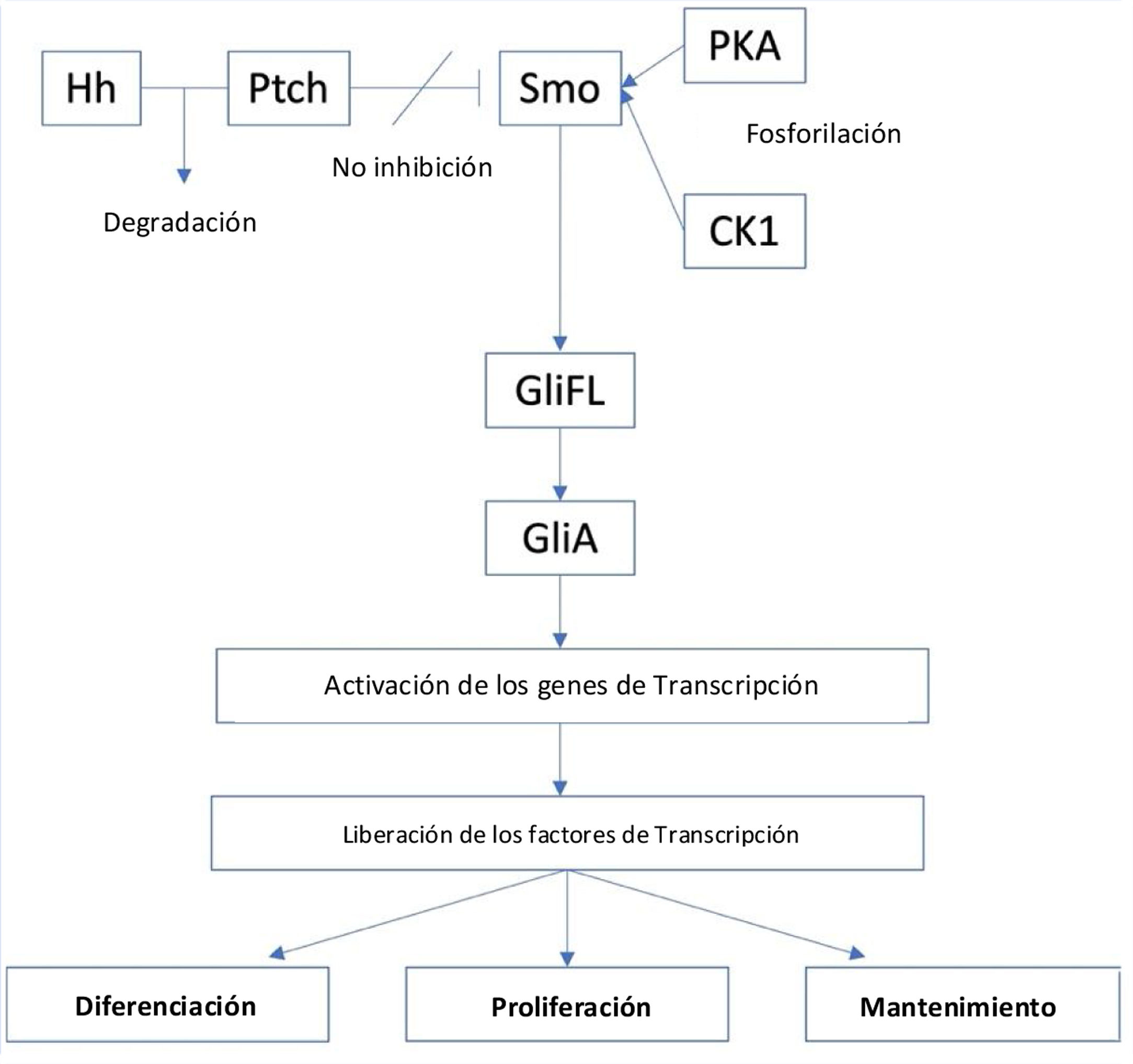
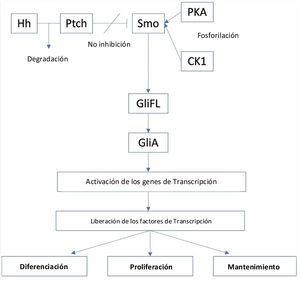
La vía de señalización del Hh se origina a partir de los cilios primarios, y está regulada de forma positiva por la proteína de membrana Smoothened (Smo), un receptor acoplado a la proteína de clase FG (GPCR), y cuya actividad está regulada por la proteína de membrana Patched (PTCH)16. Existen dos tipos de receptores PTCH, PTCH1 y PTCH2. En ausencia de un ligando Hh, PTCH inhibirá la actividad de Smo y conllevará la separación proteolítica del GliFL (del inglés, full-length glioma associated oncogene) a GliR (GLi represor), a través de la fosforilación por la proteína quinasa A (PKA), la glucógeno sintasa cinasa 3 (GSK3) y la caseína quinasa 1 (CK1). Luego, el GliR se unirá a los promotores del gen diana del Hh para evitar la activación de este, desactivando así esta vía de señalización. Por el contrario, en presencia de ligandos Hh, estos se unirán a PTCH y liberarán la inhibición de Smo, iniciando la vía de señalización. Además, Smo luego será fosforilado por PKA y CK1. Posteriormente, la señal puede viajar a través del complejo de proteína citoplasmática compuesto por Kif7, SUFU y GliFL hasta el extremo de los cilios primarios. A continuación, se formará el activador Gli (GliA) y este activará los genes de transcripción. Esto da como resultado la liberación de factores de transcripción, como son los factores oncogénicos asociados al glioma ([Gli] - Gli1, Gli2 y Gli3) que actúan como el efector final de la vía y que resultará en la diferenciación, proliferación y el mantenimiento celular (fig. 1)15,17.
Por otro lado, el papel del gen TP53, aunque no forma parte de la vía de señalización de Hh, también puede alterar la vía, ya que su efecto supresor de tumores puede inhibir la transcripción de Gli. Por lo tanto, la activación de la vía de señalización de Hh puede suprimir la actividad del gen TP5318.
El papel de la vía de señalización de Hh en el carcinoma de células basalesLa activación aberrante de la vía del Hh a través de la mutación en PTCH1, como sucede con la pérdida de función del gen, dejará sin inhibición a Smo, seguido de la posterior liberación de Gli1 y formación de oncogenes precursores de CBC. Las mutaciones de PTCH son un factor de riesgo conocido en los CBC recurrentes que se presentan en la enfermedad autosómica dominante del síndrome del carcinoma basocelular nevoide (BCNS)/síndrome de Gorlin. Además, los factores como la radiación UVB también pueden inducir la mutación en PTCH, especialmente en pieles con fototipo I y II. En estudios posteriores se demostró la presencia de mutaciones en PTCH en el 90% de los casos de los CBC esporádicos. Así mismo, se encontraron mutaciones en el locus 9q22.3 de PTCH1 (Gen ID: 5727) y en el locus 1p34.1 de PTCH2 (Gen ID: 8643), lo que lo convierte en una diana excelente para el desarrollo de terapias dirigidas en el tratamiento del CBC17. Otras mutaciones en la vía, como ocurren en el gen Smo, están presentes hasta en una quinta parte de todos los casos de CBC15,17. Con menor frecuencia, las mutaciones en Smo o TP53 también pueden conducir al desarrollo de un CBC, ya que las mutaciones en estos genes también pueden inducir potencialmente la reactivación de la vía de señalización de Hh2,18.
Inhibidores de la vía HhLos inhibidores de la vía de Hh (IVH) son una clase de fármacos biológicos indicados para el tratamiento del CBCla/CBCm no operable, CBC que con frecuencia recidiva tras el tratamiento quirúrgico o que no son tributarios del tratamiento con radioterapia. Además, los IVH también se pueden utilizar para tratar BCNS. Hasta la fecha dos IVH han sido aprobados para su uso en EE.UU. y Europa, el vismodegib y el sonidegib. De estos dos medicamentos, el vismodegib es el agente más utilizado y su uso ya ha sido aprobado en más de 60 países de todo el mundo8,14.
VismodegibEl vismodegib es un IVH de primera clase que se administra por vía oral a una dosis de 150mg/día. Este actúa como un sustituto de PTCH que se une e inhibe a Smo, evitando así una proliferación y diferenciación celular descontroladas6. El vismodegib se puede administrar en monoterapia o en combinación con otros tratamientos, tanto quirúrgicos como no quirúrgicos11. La idea es que el fármaco actúe como un tratamiento neoadyuvante, y que sea capaz de transformar los casos de CBC previamente inoperables en operables. Sin embargo, esto solo puede ser factible si los pacientes reciben el tratamiento por un periodo prolongado, de por lo menos 3 meses, requiriéndose para esto una buena adherencia de los pacientes, hecho que puede ser difícil en algunos casos, sobre todo debido a los efectos adversos (EA)3. Actualmente no existe una pauta de duración exacta en el tratamiento con el vismodegib. Los pacientes generalmente toman vismodegib hasta que se observe una mejoría notable o hasta que presenten EA que justifiquen la interrupción del tratamiento14.
El vismodegib tiene una elevada tasa de capacidad de concentración dependiente de la unión a las proteínas plasmáticas (>99%), así mismo, tendrán una vida media de entre 4 y 12 días y una distribución de volumen/Vd (la cantidad de volumen del fármaco distribuido necesario para lograr la misma concentración plasmática) de alrededor de 27l19. Esto nos sugiere que el vismodegib se concentrará principalmente en el plasma y tendrá una mínima penetración tisular9.
Los EA del fármaco, aunque en su mayoría son leves, son una de las razones clave que reducen la adherencia al tratamiento20. Algunos de los EA notables son los espasmos musculares (64%), la alopecia (62%), la disgeusia (54%), la pérdida de peso (33%), la astenia (28%), la disminución del apetito (25%), la ageusia/hipogeusia (22%), la diarrea (17%), la fatiga (16%) y las náuseas (16%)6. Así mismo, se ha observado una alteración renal de grado leve/moderada; sin embargo, se necesitan más estudios para confirmar este hallazgo21. El vismodegib también mostró efectos teratogénicos y, por lo tanto, el embarazo está contraindicado durante el tratamiento, así como en los 2 años posteriores a la última dosis. Igualmente, se recomienda a los pacientes de sexo masculino que utilicen métodos anticonceptivos fiables si están tomando vismodegib11,20,21. Por otro lado, se ha informado una posible hepatotoxicidad asociada al tramiento11.
La alopecia es uno de los EA más comunes en el tratamiento con el vismodegib, ya que la inhibición de la vía de señalización del Hh también puede afectar la formación del folículo piloso. Afortunadamente, este EA es reversible y los pacientes presentan una mejoría después de 6 a 12 meses de haber interrumpido el tratamiento11. En un caso presentado por Villani et al., el uso de minoxidil tópico ayudó a reducir la pérdida difusa del cabello22. La disgeusia o la pérdida de las papilas gustativas también se atribuye al uso de vismodegib, ya que la vía de señalización del Hh afecta a la formación y al mantenimiento de las papilas gustativas; este hecho puede conllevar la subsiguiente pérdida de apetito, pérdida de peso y, en última instancia, la depresión11. De manera curiosa, una revisión realizada recientemente informó que la incidencia de los EA en aquellos pacientes que han realizado el tratamiento por más de 12 meses será significativamente menor en comparación con la incidencia de los EA presentados en los primeros 12 meses de tratamiento21.
En cuanto a las interacciones medicamentosas, en el resumen de la UE acerca de las características del producto, se indica que la concentración del vismodegib disminuye cuando se administra junto con inductores de CYP como son la carbamazepina, la rifampicina y la fenitoína21. Tampoco se recomienda tomar vismodegib junto con medicamentos que alteren el metabolismo hepático11.
La información acerca del desarrollo de resistencia al vismodegib aún es escasa, ya que al respecto solo existen pocos casos publicados. Rudin et al. informaron el caso de un paciente varón de 26 años, con el diagnóstico de meduloblastoma, quien presentó inicialmente una regresión tumoral. Sin embargo, tras 3 meses de tratamiento se observó una pérdida de eficacia24. En este caso se ha planteado que la resistencia podría deberse a mutaciones localizadas en Smo, desarrolladas durante el tratamiento. En otro estudio, se encontró que una mutación heterocigótica con cambio de sentido localizada en la posición 1497 de Smo provocó el cambio de ácido aspártico (Asp) por histidina (His) en el codón 473 (D473H). Las mutaciones en Smo que son las responsables de una menor eficacia en la capacidad de unión del vismodegib a Smo, también se mencionaron en un estudio publicado por Djikgraaf et al. En este caso los autores encontraron 21 mutaciones localizadas en la región de Smo, en particular en Smo-E518A, localización donde se observó el mayor pico de actividad25.
En el año 2009, von Hoff et al. publicaron por primera vez el ensayo clínico de fase 1 de vismodegib, en el cual se presentaron las tres dosis de 150mg, de 270mg y de 540mg al dia11,24. Posteriormente, en el año 2011, Loruso et al. publicaron un estudio de seguimiento en el que se concluyó que la dosis óptima del vismodegib era de 150mg una vez al día, ya que una dosis más alta no aumentaba la concentración plasmática27. La aprobación del uso de vismodegib por parte de la UE y EE.UU. se basó en dos ensayos clínicos importantes, ERIVANCE y STEVIE4,11,21.
ERIVANCE fue un ensayo clínico de fase 2, multicéntrico e internacional, de un brazo, con dos cohortes, y con revisión central. Se incluyeron 104 pacientes (33 de los pacientes con CBCm y 71 con CBCla) en quienes se pautó vismodegib 150mg oral una vez al día. Inicialmente, la ORR fue del 30% y del 43%, respectivamente. Sin embargo, tras un periodo de seguimiento de 30 meses, se observó un incremento de la ORR al 60% en el CBCla y al 48,5% en el CBCm con una mediana de duración del tratamiento de 26,2 meses en el CBCm y de 14,8 meses en el CBCla6. El estudio concluyó que una mayor duración del tratamiento se correspondía con un aumento en la ORR general8. Los tiempos de supervivencia libre de enfermedad fueron de 12,9 meses y de 9,3 meses, respectivamente6. La última actualización del estudio se publicó en el año 2017, con un periodo de seguimiento de 39 meses en total y con una ORR general del 60,3% en el CBCla y del 48,5% en el CBCm8. En total fallecieron 33 pacientes. La causa más frecuente de fallecimiento fueron tanto la progresión de la enfermedad como los EA8. La supervivencia libre de progresión promedio o la cantidad de tiempo durante y después del tratamiento en el que los pacientes no experimentaron una progresión de la enfermedad fue de 12,9 meses para el CBCla y de 9,3 meses en el CBCm. El promedio de la duración de la respuesta en el CBCla fue de aproximadamente 26,2 meses en el CBCla y de 14,8 meses en el CBCm11.
STEVIE fue el otro estudio realizado. Se trata de un estudio abierto no aleatorizado (no comparativo) de un solo brazo, con dos cohortes. Este es hasta la fecha el estudio de vismodegib que incluyó el mayor número de participantes. En este se incluyó durante 86 meses un total de 1215 pacientes, de los cuales 1119 tenían un CBCla (208 pacientes con BCNS) y 96 pacientes tenían un CBCm. El análisis preliminar encontró que la ORR del CBCla fue del 68,5% y la del CBCm fue del 36,9%. De manera similar, en un ensayo clínico de fase 2, se observó una ORR del 38% en el CBCm2,14. La supervivencia libre de progresión fue de 23,2 meses en el CBCla y de 13,1 meses en el CBCm. Además, la duración de la respuesta fue de 23,0 meses en el CBCla y de 13,9 meses en el CBCm11.
En una revisión realizada por Brancaccio et al. se llevó a cabo un análisis acerca de la eficacia del vismodegib en el tratamiento del CBCla tras un periodo de seguimiento de 21 meses. En este estudio se encontró que el porcentaje medio de la ORR fue del 47,6%, donde un 25,4% mostró una tasa de respuesta parcial, mientras que un 22,2% logró una respuesta completa. Además, el 34,9% de los pacientes se encontraban en condición estable tras recibir el tratamiento con vismodegib y el 12,7% experimentó una progresión de la enfermedad19. Un estudio realizado por Chang et al. encontró resultados similares en la ORR, con 46,4% en el CBCla y 30,8% en el CBC28. Sin embargo, la supervivencia libre de progresión y la duración de la respuesta no se pudieron evaluar debido a que el periodo de seguimiento fue limitado11.
Recientemente, un estudio sugirió que GAS-1, uno de los 40 genes de la vía de señalización de Hh, fue el que presentó la disminución más llamativa en su expresión tras haber recibido el vismodegib. Por lo tanto, la cuantificación de GAS-1 se ha convertido en un indicador potencial de la respuesta al tratamiento. Sin embargo, dado que este estudio se realizó con un tamaño muestral relativamente pequeño (22 pacientes), más estudios al respecto serán necesarios25.
El último estudio acerca de vismodegib se publicó en el año 2021 en la forma del estudio VISMONEO. En este ensayo abierto de fase 2, se analizó la eficacia y la seguridad del vismodegib como tratamiento neoadyuvante en el CBCla. El vismodegib se administró por vía oral a una dosis de 150mg durante 4 a 10 meses tanto en el CBC operable como en el no operable. Se incluyeron un total de 55 pacientes con una mediana de edad de 73 años. La tasa de respuesta global según los criterios RECIST fue del 71% (IC 95%). También se observó que el vismodegib será responsable de una regresión tumoral en el CBCla, especialmente importante en aquellas localizaciones de mayor relevancia funcional26.
SonidegibTras el éxito inicial de vismodegib, se desarrolló otro IVH oral con características similares. El sonidegib tiene un mecanismo de acción similar al del vismodegib27. Este fármaco fue aprobado por la FDA y por la EMA en el año 201519,28. El sonidegib actúa uniéndose a la proteína Smo, suprimiendo así las proteínas Gli y de esta forma evita la posterior proliferación y el crecimiento tumoral28.
Hasta la fecha, los datos comparativos entre el vismodegib y el sonidegib aún no están disponibles9. Por otro lado, los estudios realizados previamente en ambos medicamentos utilizaron métodos diferentes para determinar la ORR. El estudio ERIVANCE del vismodegib utilizó los criterios RECIST, mientras que en el estudio del sonidegib se utilizaron los criterios mRECIST9,19. El sonidegib posee una farmacocinética diferente a la del vismodegib. La primera diferencia es la dependencia de la concentración. Si bien tanto el vismodegib como el sonidegib tienen una alta capacidad de unión (>99%) a las proteínas plasmáticas alfa-1-cicloproteínas ácidas (AAG) y a la albúmina sérica humana (ASH), la capacidad de unión del sonidegib no dependerá de la concentración, mientras que en el caso del vismodegib esta capacidad de unión será dependiente de la concentración9,19. Además, el VD del sonidegib será significativamente más alto (9170l) en comparación con el del vismodegib (27l). Esto puede explicar por qué la concentración del sonidegib en la piel es 6 veces mayor que en la del plasma, y por qué la vida media del sonidegib es de 28 días en comparación con los 4 días del vismodegib9,19. Estas diferencias justificarían además una posible discrepancia en cuanto a la eficacia de ambos fármacos.
En cuanto a las interacciones medicamentosas, se recomienda no coadministrar sonidegib con inhibidores de CYP3A4, ya que el sonidegib es un sustrato de CYP3A4. Por el contrario, también se deben evitar los inductores de CYP3A4 o, alternativamente, se puede aumentar la dosis del sonidegib a 400-800mg19. En un estudio en fase 1 también se observó que la absorción del sonidegib se reduce cuando se administra junto con 40mg de esomeprazol19. El fármaco se metabolizará en el hígado vía la oxidación e hidrólisis de amidas, procesos en los que la enzima CYP tiene un papel27.
Los datos acerca de la resistencia al sonidegib son aún muy limitados. Un ensayo abierto sobre su uso en el CBCla demostró que los pacientes que habían desarrollado una resistencia al vismodegib y que posteriormente recibieron sonidegib desarrollaron también una resistencia al sonidegib. Cinco de los 9 pacientes estudiados tenían mutaciones en Smo. Las mutaciones eran diferentes entre los pacientes; estas se localizaron en Q477, D473 (2 pacientes), S533 y W535. El resultado de presentar estas mutaciones fue la incapacidad del sonidegib para unirse a Smo. Sin embargo, se debe de tener en cuenta que se trataba de un pequeño tamaño muestral, con una mediana de la duración del tratamiento corta (5 semanas). La interrupción prematura del tratamiento se debió principalmente a los EA del medicamento29.
Uno de los principales ensayos clínicos responsable de la aprobación del sonidegib fue el ensayo BOLT. Este fue un ensayo multicéntrico de fase 1, bajo revisión centralizada, aleatorizado y doble ciego, realizado en el año 2014. Durante este estudio, se encontró que la dosis máxima tolerable del fármaco era de 800mg o 2×500mg al día. En el estudio también se determinó que 200mg era la dosis óptima teniendo en cuenta la biodisponibilidad, la eficacia y los EA28. En un estudio a largo plazo de 42 meses, se encontró una eficacia similar al vismodegib con una ORR del 56,1% y del 46,1% en pacientes con CBCla que recibieron una dosis de 200mg y de 800mg, respectivamente28. Sin embargo, en el CBCm se observó que la dosis de 800mg producía una ORR más elevada (17,4%) en comparación con la dosis de 200mg (7,7%). Además, en el estudio LDE225, un estudio de fase 2 aleatorizado, multicéntrico doble ciego, se observó que 200mg de sonidegib presentaba una mejor ORR del 43% en el CBCla en comparación con el 38% obtenido en aquellos pacientes que habían recibido 800mg de sonidegib. Por otro lado, la dosis de 800mg fue superior en el CBCm con una ORR del 17%, en comparación con un 15% utilizando una dosis de 200mg19. Además, este estudio también determinó el uso potencial de la dosis de 800mg de sonidegib por vía oral en el tratamiento del BCNS. En un pequeño estudio de 13 pacientes con BCNS, 8 de los pacientes experimentaron una respuesta completa. El sonidegib tópico con una concentración del 0,75% también se investigó como una posibilidad para el tratamiento del BCNS, y 3 de los 13 pacientes experimentaron una respuesta completa. Se necesitan más ensayos, pero los resultados iniciales mostraron que el sonidegib podría ser un tratamiento prometedor en el BCNS19,27,28.
En una revisión de Brancaccio et al. se objetivó que la ORR del sonidegib, en un estudio basado en los criterios RECIST, tras un periodo de 18 meses de tratamiento del CBCla, fue del 60,6%. El 21,2% de los pacientes lograron una respuesta completa y el 39,4% logró una respuesta parcial. El 30,3% de los pacientes se mantuvieron con enfermedad estable, mientras que el 1,5% de los pacientes experimentaron una progresión de la enfermedad19.
Al igual que con el vismodegib, el cumplimiento del tratamiento por parte del paciente es un factor importante que puede afectar a la eficacia. El cumplimiento en aquellos pacientes con una dosis más baja fue significativamente mayor, con casi un 30% de diferencia en comparación con aquellos pacientes que recibieron una dosis más alta. El cumplimiento promedio fue de 8,9 meses en aquellos que recibieron la dosis de 200mg de sonidegib y de 6,5 meses en los que recibieron la dosis de 800mg6. Además, la dosis más baja se relacionó con un menor grado de EA, objetivándose EA similares a los observados con el vismodegib. El espasmo muscular fue el EA más frecuente (67%) en pacientes que recibieron una dosis de 800mg de sonidegib, mientras que la incidencia fue menor (49%) en los pacientes tratados con 200mg de sonidegib. La alopecia y la disgeusia son el segundo y tercer EA más frecuentes (43% y 38%), pero la tasa sigue siendo inferior en comparación con el vismodegib (62% y 54%). Curiosamente, no se encontró ageusia/hipogeusia en pacientes con 200mg de sonidegib, mientras que casi una quinta parte de los pacientes con 150mg de vismodegib las experimentaban6,27. Además, un pequeño número de pacientes que recibieron 200mg de sonidegib presentaron EA más graves, como hipertensión (3%), aumento de la CK (3-4%) y aumento de la lipasa (5%)28. Por último, el uso del sonidegib está contraindicado en las pacientes embarazadas, ya que este está clasificado como un fármaco de clase D. Este, además de ser teratogénico, podría causar la muerte fetal27. Antes de pautar la medicación se necesitará realizar una evaluación completa, incluyendo un hemograma y la función renal, y también será necesario instruir y educar adecuadamente a los pacientes. Si los EA persisten, el tratamiento debe suspenderse.
El estudio más reciente acerca de sus EA es algo limitado; este fue realizado por Villani et al. y publicado en el año 2021. El objetivo de este estudio, en el que se incluyó un único centro, fue el de evaluar si la reducción de la dosis del sonidegib disminuiría los EA. Nueve pacientes recibieron un tratamiento diario con 200mg de sonidegib entre las 12 y 24 semanas, seguido de un ajuste de dosis, pautándose una dosis cada 2 días durante las siguientes 8 a 16 semanas. Se observó que los pacientes presentaron EA de menor intensidad, por lo que se logró aumentar la tolerabilidad a tratamientos más prolongados. Este hecho remarca la necesidad de realizar más estudios que puedan confirmar esta observación30.
Rol de los inhibidores de la vía Hh en el tratamiento del carcinoma de células basalesEn todo el mundo existen diversas guías clínicas que han aprobado el uso de los IVH en el tratamiento del CBC. Esto incluye la guía del National Comprehensive Cancer Network (NCCN), la de la Academia Americana de Dermatología (AAD) y la de Asociación Europea de Dermatología Oncológica (EADO).
Este tratamiento aún se encontraba en fase de investigación cuando la guía de la NCCN fue publicada en el año 2016. Por lo tanto, el uso de una terapia sistémica, como son los IVH, en el tratamiento del CBC metastásico aún estaba en estudio. Actualmente, se está elaborando la guía de revisión del 20217. En el año 2017, la guía de la AAD ya recomendaba un enfoque multidisciplinario en el tratamiento del CBC metastásico. Se debe considerar el uso de los IVH en los casos en que la radioterapia esté contraindicada, y si existe persistencia tumoral tras la cirugía y/o la radioterapia, así como si estamos frente a lesiones inoperables31. Al igual que las dos guías anteriores, la guía de la EADO también ha recomendado el uso de IVH en el tratamiento de los CBC «de difícil tratamiento», como es el caso de los CBCla, del CBCm y del síndrome de Gorlin32.
Rol de los inhibidores de la vía Hh como tratamiento neoadyuvante en el carcinoma de células basalesA pesar de que inicialmente se aprobó como tratamiento de primera línea en el CBCla no operable y en el CBCm, existen algunos estudios acerca de la posibilidad de su uso como tratamiento neoadyuvante para poder reducir de esta forma las cirugías muy extensas y así también incrementar el éxito del tratamiento quirúrgico. Los pacientes serán tratados con IVH hasta que no se observe un estancamiento de la respuesta y luego se someterán a las cirugías. Como quedó demostrado con los estudios realizados por Ching et al. y Wong et al., este método puede presentar tanto una respuesta completa como parcial. En el primer estudio, se encontró que el uso del vismodegib como terapia neoadyuvante podría evitar la resección ósea en el 50% de los sujetos, y en el segundo estudio, realizado en pacientes con CBC ocular y periorbitario, se logró una respuesta completa en el 67% y en un paciente, de manera notable, se pudo rescatar la órbita37,38. La guía de la EADO también recomienda su uso como terapia neoadyuvante para así tratar el CBCla. No obstante, todavía no hay datos aleatorios disponibles que puedan comprobar su eficacia. Sin embargo, un estudio inicial, realizado en 15 pacientes, demostró un resultado satisfactorio, donde solo un paciente presentó una recidiva a los 22 meses postoperatorios tras haber recibido vismodegib durante 3-6 meses32.
ConclusiónLos IVH, vismodegib y sonidegib, son tratamientos novedosos indicados en el CBCla inoperable y en el CBCm, siendo además un tratamiento prometedor para el BCNS. De forma general, ambos fármacos producen una muy buena respuesta y se pueden usar tanto en monoterapia como en combinación con otras terapias o como terapia neoadyuvante en el CBC. Los EA de los IVH, aunque son leves, son frecuentes y pueden influir en la adherencia de los pacientes al tratamiento. Se necesitarán nuevos estudios que determinen si existen diferencias en cuanto a la eficacia entre ambos tratamientos, y en los que se incluyan criterios de evaluación similares.
Conflicto de interesesLos autores no declararon ningún conflicto de intereses.
- Home
- All contents
- Publish your article
- About the journal
- Metrics