La incidencia de las infecciones de transmisión sexual (ITS) está aumentando en nuestro medio. Las ITS supurativas son uno de los motivos de consulta más frecuente en las consultas especializadas. La causa de las ITS supurativas es múltiple y su tratamiento empírico cambia con el aumento de las resistencias antimicrobianas. Los dermatólogos estamos formados y preparados para atender estas enfermedades, pero su manejo correcto requiere un conocimiento actual de las guías nacionales e internacionales.
Este documento actualiza, revisa y resume las principales recomendaciones de expertos sobre el manejo y tratamiento de estas ITS.
The incidence of sexually transmitted infections (STIs) is increasing in Spain. Suppurative STIs are one of the most frequent reasons for consultation in specialized centers. The reason for suppurative STIs is multiple and their empirical treatment varies with the currently growing problem of antimicrobial resistance. Dermatologists are trained and prepared to treat these diseases, but their correct management requires active knowledge of national and international guidelines.
The present document updates, reviews and summarizes the main expert recommendations on the management and treatment of these STIs.
La uretritis es el síndrome genitourinario más frecuente en los varones sexualmente activos menores de 50 años1. Los síntomas más frecuentes son: secreción uretral mucoide, mucopurulenta o purulenta (60-90%), disuria (50-80%), aumento de la frecuencia urinaria (6%) o prurito (5%); aunque puede ser asintomática2.
CervicitisLa cervicitis es resultado de la inflamación del cérvix y los síntomas más frecuentes son: secreción endocervical purulenta o mucopurulenta visible en el canal endocervical o en muestra de hisopo endocervical. Algunas mujeres pueden referir flujo vaginal anormal, hemorragia vaginal intermenstrual (p. ej., poscoital), dolor abdominal suprapúbico o dispareunia; aunque suele ser asintomática3.
Proctitis, proctocolitis y enteritisLas infecciones de transmisión sexual (ITS) que afectan al ano, recto, colon e intestino delgado consisten en procesos inflamatorios agudos o subagudos provocados por microorganismos que se pueden transmitir mediante diversas prácticas sexuales como el sexo anal receptivo, el uso de juguetes sexuales contaminados, el fisting o el sexo oroanal. La incidencia de estas infecciones está en aumento, siendo mayoritario su diagnóstico en hombres que tienen sexo con otros hombres (HSH), con mayor prevalencia en personas que viven con VIH (PVVIH)4–6.
En la proctitis existe inflamación del recto y se acompaña de tenesmo rectal, dolor anorrectal o suprapúbico, secreción anal mucosa o purulenta, sangrado rectal, sensación de evacuación incompleta o estreñimiento. También puede asociar fiebre y/o malestar general, úlceras o vesículas, edema y eritema de la mucosa rectal; aunque un elevado porcentaje de proctitis son asintomáticas.
En la proctocolitis la inflamación se extiende más allá del recto, y en la enteritis afecta al colon y/o al intestino delgado. En la proctocolitis puede aparecer clínica de proctitis, dolor cólico abdominal (especialmente hipogástrico), diarrea (con frecuencia con sangre) y síntomas generales (fiebre, escalofríos, mialgias, vómitos). La persona con enteritis puede manifestar náuseas y vómitos, diarrea, dolor abdominal cólico, distensión abdominal o fiebre, pero sin síntomas de proctitis o proctocolitis5.
CausasEtiología de las uretritisLa uretritis puede ser de causa multifactorial (tabla 1)7–12, pero en la mayoría de los casos se adquiere sexualmente. Cuando se adquiere sexualmente, la uretritis se describe como uretritis gonocócica (UG) si se detecta Neisseria gonorrhoeae (NG), o uretritis no gonocócica (UNG) cuando no se detecta. La etiología varía según la prevalencia local de los agentes infecciosos. NG puede representar del 10 al 20% de los casos de uretritis, Chlamydia trachomatis (CT) del 15 al 40% de los casos de UNG y Mycoplasma genitalium (MG) del 15 al 25% de UNG13.
Etiología de la uretritis7–12
| Causas no infecciosas | Adquiridas sexualmente | |||
|---|---|---|---|---|
| Químicos e irritantes (espermicidas, productos de baño, lubricantes, aceite árbol del té)Iatrogénica (cateterismo, instrumentalización)Cuerpos extrañosNeoplasia endouretralDermatitis de contacto | Uretritis gonocócicaNeisseriagonorrhoeae(10-20% U) | UNG frecuenteChlamydia trachomatis(15-40% UNG)Mycoplasma genitalium(15-25% UNG) | UNGUNG menos frecuenteHaemophilus spp.(12% UNG en HSH)Ureaplasma urealyticum(3-11% UNG)Trichomonas vaginalis(2-10% UNG en HSM)Adenovirus(2-4% UNG)Virus herpes simple 1/2(2-3% UNG) | UNG muy poco frecuenteN. meningitidis,Candida spp,Gardnerella vaginalis,Treponema pallidumEnterobacterias |
HSH: hombre que tiene sexo con hombres; HSM: hombre que tiene sexo con mujeres; U: uretritis; UNG: uretritis no gonocócica.
Ureaplasma urealyticum se asocia de manera inconsistente con la UNG y probablemente no sea causa a menos que esté presente con una alta carga bacteriana. En Europa occidental, la Trichomonas vaginalis (TV) como causa de uretritis masculina es poco común. Los adenovirus pueden representar del 2 al 4% y el virus del herpes simple (VHS) es una causa poco común de UNG, aunque pueden causar uretritis en ausencia de la úlcera genital típica. Neisseira meningitidis, Haemophilus spp., Candida spp. y otros han sido reportados en una pequeña proporción de UNG.
Es importante apuntar que se pueden identificar infecciones polimicrobianas hasta en un 20% de los hombres y que en un 20 al 30% de las uretritis no se detectan patógenos conocidos13.
Etiología de las cervicitisCT o NG son la etiología más común de cervicitis13, aunque TV, MG y VHS (principalmente VHS-2, aunque cada vez más frecuente VHS-1) también se han relacionados14–17. Sin embargo, en muchos casos de cervicitis, no se aísla ningún microorganismo, especialmente entre mujeres con un riesgo relativamente bajo de contraer ITS (p. ej., mujeres mayores de 30 años). Datos limitados indican que la vaginosis bacteriana y las duchas vaginales frecuentes pueden causar cervicitis18. Los datos disponibles no indican una asociación entre la colonización por estreptococos del grupo B y la cervicitis, al igual que no existe evidencia específica de un papel para Ureaplasma parvum o Ureaplasma urealyticum en la cervicitis19.
Etiología de las proctitis, proctocolitis y enteritisLa proctitis puede ser multifactorial, pero en la mayoría de los casos se adquiere sexualmente120. Los principales agentes etiológicos de las proctitis transmitidas sexualmente son NG y CT. La infección rectal por únicamente MG es más rara y produce menos síntomas que NG o CT21,22. En el 30-40% de los casos no se identifica ningún microorganismo y en el 10% de los casos está implicado más de un microorganismo20.
En el diagnóstico diferencial de las proctitis hay que tener en cuenta las causas no infecciosas como: radiación médica, enfermedad inflamatoria intestinal, efecto adverso de medicaciones o productos tópicos. Algunos traumatismos se pueden dar en el contexto sexual (prácticas de fisting, enemas, juguetes sexuales, inserción de drogas) y/o en usuarios de chemsex (sustancias como metanfetaminas, mefedrona o gammahidroxibutirato-gammabutirolactona)23,24. En cambio, las proctocolitis y las enteritis no siempre se adquieren por vía sexual. En la tabla 2 se puede ver la principal etiología de estas entidades adquiridas sexualmente.
Etiología de las proctitis, las proctocolitis y las enteritis adquiridas sexualmente47,70
| Proctitis | Proctocolitis | Enteritis |
|---|---|---|
| Neisseria gonorrhoeae (NG)Chlamydia trachomatis (CT), serovares D-K (CT-D-K)Chlamydia trachomatis, causante de linfogranuloma venéreo (LGV), serovares L1-L3 (CT-LGV-L1-L3)Treponema pallidum (TP)Virus herpes simple (VHS)Mycoplasma genitalium (MG)aCitomegalovirus (CMV)a,cMpox | Shigella spp.Campylobacter spp.Salmonella spp.Escherichia coli productora de toxina Shiga (ECTS)CT-LGV-L1-L3Clostridioides difficilebCryptosporidium spp.Espiroquetosis intestinal humana (EIH)dEntamoeba histolyticaCMVa,c | Shigella spp.Campylobacter spp.Salmonella spp.Giardia lamblia spp.Crytosporidium spp.a,cIsospora bellia,cMicrosporidium spp.a,cStrongyloides stercoralisbEntamoeba histolyticaMycobacterium avium-intracellularea,cCMVa,c |
Podemos separar el abordaje de los casos en varias partes: identificación de la causa, tratamiento de la causa, seguimiento y test de cura.
Identificación de la causaPara identificar la causa es necesario realizar: una historia clínica, una exploración física y algunas pruebas complementarias.
Historia clínicaSe recomienda determinar la etiología específica con el fin de prevenir complicaciones, reinfecciones y transmisiones, ya que un diagnóstico específico podría mejorar el cumplimiento del tratamiento, la realización de intervenciones de reducción del riesgo y un adecuado estudio de contactos25.
En la historia clínica debemos preguntar sobre: antecedentes de ITS previas, tiempo desde el inicio de los síntomas, conducta sexual, último contacto sexual, número de parejas en el último mes, 3 y 6 meses; uso de preservativo durante las relaciones sexuales (vaginales, anales u orales); uso de sustancias, tóxicos o juguetes en el contexto sexual; viajes del paciente y profesión (p. ej., manipuladores de alimentos o trabajadores sexuales)26,27 y toma de fármacos anteriores para estos síntomas (Nivel de evidencia 4, Grado de recomendación C).
Exploración físicaEn el examen físico de las uretritis debemos considerar: el color, la cantidad y la consistencia del exudado. También deberemos comprobar si existen signos de meatitis, balanopostitis, epidídimo-orquitis o adenopatías inguinales. Según el tipo de actividad sexual, deberemos examinar la mucosa anorrectal, la cavidad oral y nos aseguraremos si hay otros síntomas sistémicos como la presencia de conjuntivitis o artritis reactiva. La presencia de meatitis asociada a conjuntivitis podría llevarnos a orientar a una causa viral28.
Ante la sospecha de proctitis/proctocolitis se aconseja la palpación abdominal para la búsqueda de signos de peritonitis, inspección de la región perianal y una anoscopia/proctoscopia convencional (si fuera posible).
La tabla 3 resume el diagnóstico diferencial de las uretritis y la tabla 4 el diagnóstico diferencial de las proctitis, proctocolitis y enteritis.
Diagnóstico diferencial de la uretritis gonocócica y no gonocócica13
| Uretritis gonocócica | Uretritis no gonocócica | |
|---|---|---|
| Secreción | Profusa, purulenta, amarillenta | Escasa, mucoide, mucopurulenta |
| Disuria | Intensa sensación de quemazón | Sensación de ardor en la uretra al orinar |
| Periodo de incubación | 3-7 días | 2-3 semanas |
| Síntomas | Suelen estar presentes | Pueden estar ausentes |
Diagnóstico diferencial de las proctitis, proctocolitis y enteritis
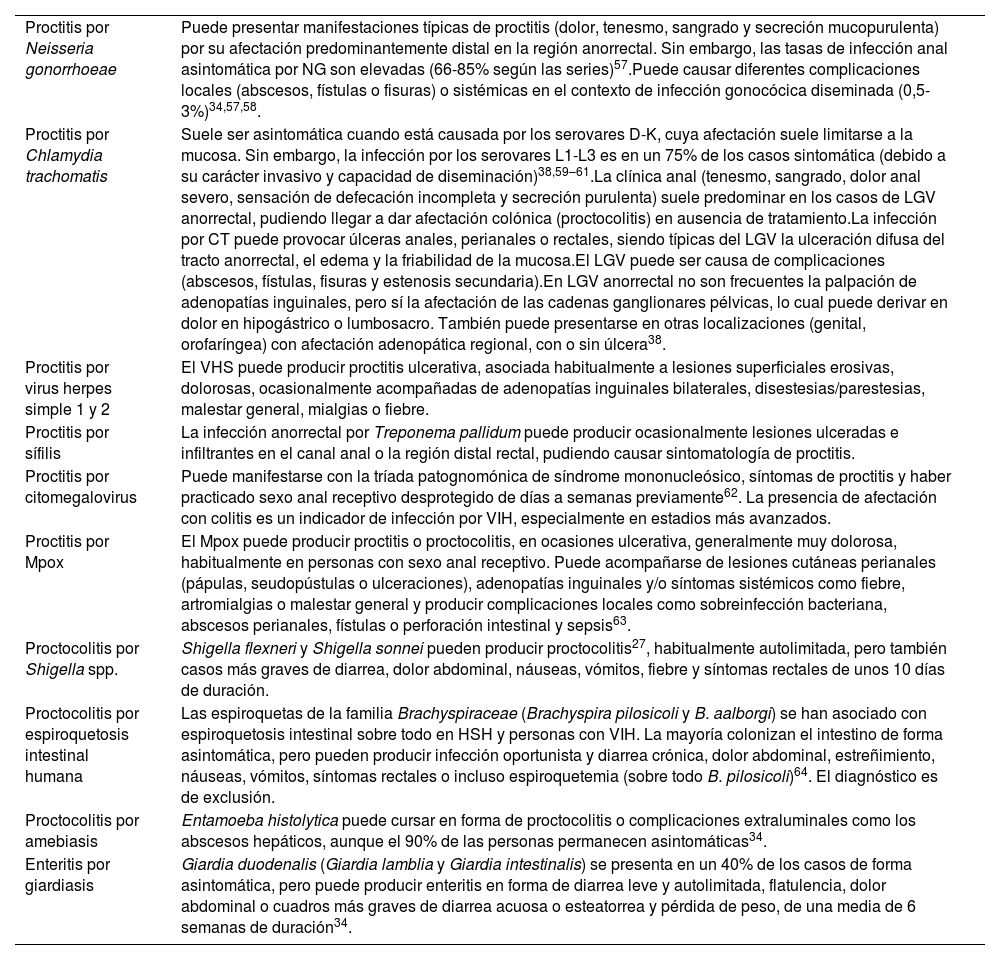
| Proctitis por Neisseria gonorrhoeae | Puede presentar manifestaciones típicas de proctitis (dolor, tenesmo, sangrado y secreción mucopurulenta) por su afectación predominantemente distal en la región anorrectal. Sin embargo, las tasas de infección anal asintomática por NG son elevadas (66-85% según las series)57.Puede causar diferentes complicaciones locales (abscesos, fístulas o fisuras) o sistémicas en el contexto de infección gonocócica diseminada (0,5-3%)34,57,58. |
| Proctitis por Chlamydia trachomatis | Suele ser asintomática cuando está causada por los serovares D-K, cuya afectación suele limitarse a la mucosa. Sin embargo, la infección por los serovares L1-L3 es en un 75% de los casos sintomática (debido a su carácter invasivo y capacidad de diseminación)38,59–61.La clínica anal (tenesmo, sangrado, dolor anal severo, sensación de defecación incompleta y secreción purulenta) suele predominar en los casos de LGV anorrectal, pudiendo llegar a dar afectación colónica (proctocolitis) en ausencia de tratamiento.La infección por CT puede provocar úlceras anales, perianales o rectales, siendo típicas del LGV la ulceración difusa del tracto anorrectal, el edema y la friabilidad de la mucosa.El LGV puede ser causa de complicaciones (abscesos, fístulas, fisuras y estenosis secundaria).En LGV anorrectal no son frecuentes la palpación de adenopatías inguinales, pero sí la afectación de las cadenas ganglionares pélvicas, lo cual puede derivar en dolor en hipogástrico o lumbosacro. También puede presentarse en otras localizaciones (genital, orofaríngea) con afectación adenopática regional, con o sin úlcera38. |
| Proctitis por virus herpes simple 1 y 2 | El VHS puede producir proctitis ulcerativa, asociada habitualmente a lesiones superficiales erosivas, dolorosas, ocasionalmente acompañadas de adenopatías inguinales bilaterales, disestesias/parestesias, malestar general, mialgias o fiebre. |
| Proctitis por sífilis | La infección anorrectal por Treponema pallidum puede producir ocasionalmente lesiones ulceradas e infiltrantes en el canal anal o la región distal rectal, pudiendo causar sintomatología de proctitis. |
| Proctitis por citomegalovirus | Puede manifestarse con la tríada patognomónica de síndrome mononucleósico, síntomas de proctitis y haber practicado sexo anal receptivo desprotegido de días a semanas previamente62. La presencia de afectación con colitis es un indicador de infección por VIH, especialmente en estadios más avanzados. |
| Proctitis por Mpox | El Mpox puede producir proctitis o proctocolitis, en ocasiones ulcerativa, generalmente muy dolorosa, habitualmente en personas con sexo anal receptivo. Puede acompañarse de lesiones cutáneas perianales (pápulas, seudopústulas o ulceraciones), adenopatías inguinales y/o síntomas sistémicos como fiebre, artromialgias o malestar general y producir complicaciones locales como sobreinfección bacteriana, abscesos perianales, fístulas o perforación intestinal y sepsis63. |
| Proctocolitis por Shigella spp. | Shigella flexneri y Shigella sonnei pueden producir proctocolitis27, habitualmente autolimitada, pero también casos más graves de diarrea, dolor abdominal, náuseas, vómitos, fiebre y síntomas rectales de unos 10 días de duración. |
| Proctocolitis por espiroquetosis intestinal humana | Las espiroquetas de la familia Brachyspiraceae (Brachyspira pilosicoli y B. aalborgi) se han asociado con espiroquetosis intestinal sobre todo en HSH y personas con VIH. La mayoría colonizan el intestino de forma asintomática, pero pueden producir infección oportunista y diarrea crónica, dolor abdominal, estreñimiento, náuseas, vómitos, síntomas rectales o incluso espiroquetemia (sobre todo B. pilosicoli)64. El diagnóstico es de exclusión. |
| Proctocolitis por amebiasis | Entamoeba histolytica puede cursar en forma de proctocolitis o complicaciones extraluminales como los abscesos hepáticos, aunque el 90% de las personas permanecen asintomáticas34. |
| Enteritis por giardiasis | Giardia duodenalis (Giardia lamblia y Giardia intestinalis) se presenta en un 40% de los casos de forma asintomática, pero puede producir enteritis en forma de diarrea leve y autolimitada, flatulencia, dolor abdominal o cuadros más graves de diarrea acuosa o esteatorrea y pérdida de peso, de una media de 6 semanas de duración34. |
CT: Chlamydia trachomatis; HSH: hombres que tienen sexo con hombres; LGV: linfogranuloma venéreo; VHS: virus herpes simple; VIH: virus de la inmunodeficiencia humana.
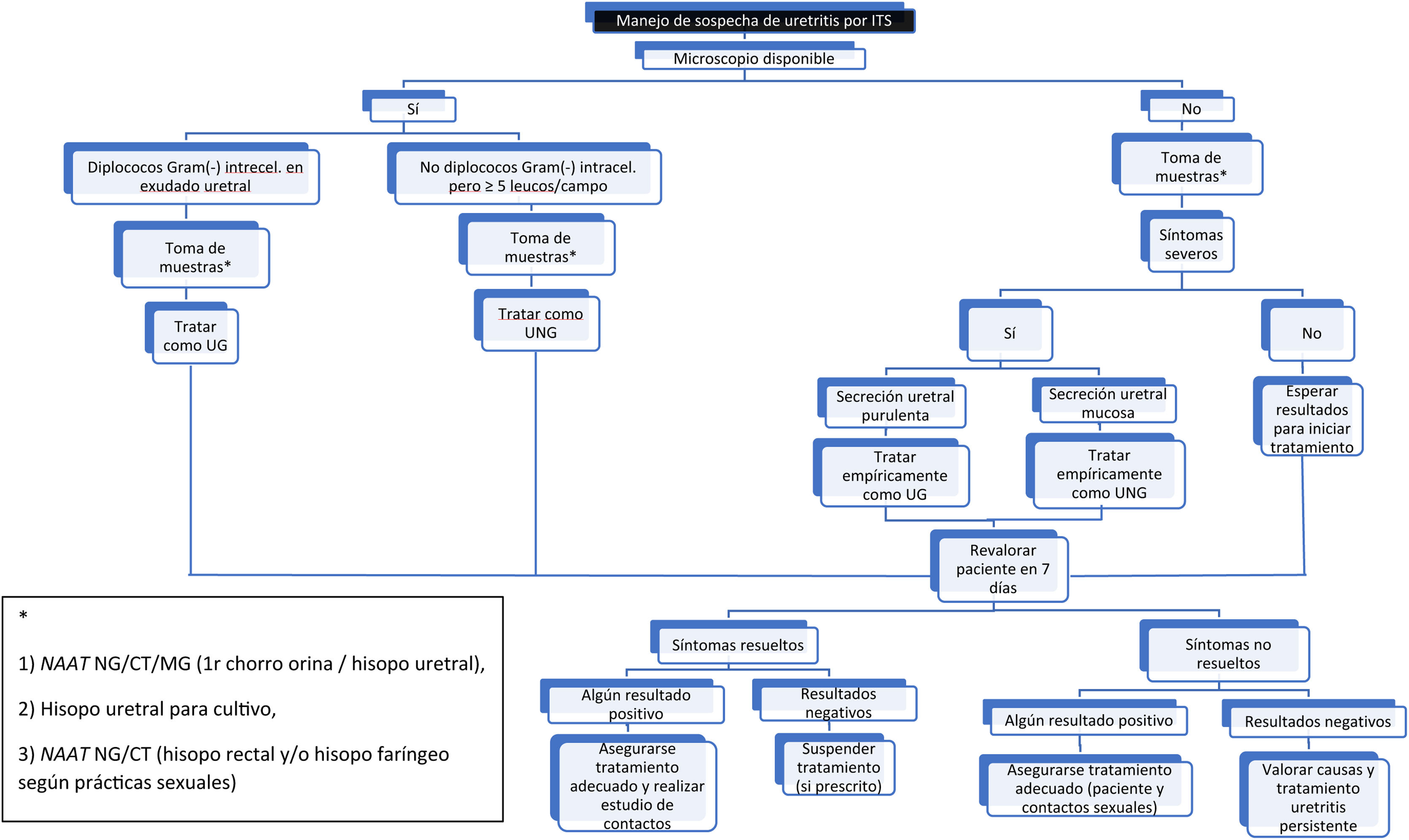
En pacientes sintomáticos y en aquellos con secreción visible, los expertos recomiendan confirmar la uretritis en el consultorio como orientación para el tratamiento inmediato, sin esperar los resultados de laboratorio (fig. 1) (Nivel de evidencia 2a, Grado de recomendación C). Se considera uretritis si la muestra uretral, teñida con azul de metileno o Gram, contiene al menos 5 leucocitos polimorfonucleares por campo microscópico de gran aumento2,13. Sin embargo, este estudio no suele estar disponible en la mayoría de los centros, no se recomienda para descartar uretritis asintomática (estudio de contactos o screening), puede generar diferencias inter/intra-observador y su sensibilidad depende de cómo se obtiene la muestra.
¿Qué pruebas debemos realizar?
- 1.
Prueba de amplificación de ácidos nucleicos (Nucleic Acid Amplification Test [NAAT]) para detectar NG y CT en el primer chorro de orina o en la muestra uretral (Nivel de evidencia 1b, Grado de recomendación A)29. Ambas muestras tienen la misma sensibilidad si se toman correctamente. Además, se recomienda encarecidamente la prueba de MG, preferiblemente con la detección de resistencia a los macrólidos.
- •
El primer chorro de orina no debe contener más de 10ml, ya que un mayor volumen disminuirá la sensibilidad y el tiempo posterior a la micción debe ser de al menos 2h.
- •
Si por el contrario, se realiza toma de muestra uretral deberemos2: retraer el prepucio, limpiar el meato con suero fisiológico e introducir suavemente el dispositivo en la uretra para tomar la muestra. Si hay secreción uretral, se puede recoger una muestra, sin colocar el dispositivo dentro del meato (Nivel de evidencia 4, Grado de recomendación C).
- 2.
Otra muestra uretral o del exudado para cultivo bacteriológico, y así poder realizar antibiograma si fuera necesario. Esta muestra puede ser obtenida de forma autónoma por el paciente (Nivel de evidencia 4, Grado de recomendación C)30.
- 3.
Además, se aconseja NAAT para detectar NG y CT en cualquier sitio potencialmente expuesto según el tipo de actividad sexual (hisopo rectal y/o faríngeo). Con las instrucciones adecuadas, la autotoma por parte del paciente del hisopo rectal y/o faríngeo para la detección de NG y CT, ha demostrado ser una opción válida y aceptable (Nivel de evidencia 2a, Grado de recomendación B)31,32.
¿Qué test no debemos realizar?
No se recomienda testar ni tratar de rutina hombres asintomáticos o sintomáticos para M. hominis, U. urealyticum y U. parvum2. La colonización asintomática de estas bacterias es común y la mayoría de las personas no desarrollan ninguna enfermedad. Aunque U. urealyticum se ha asociado con uretritis en varones, la mayoría de varones infectados/colonizados no desarrollan enfermedad. Por lo que primero deberemos excluir otras causas (NG, CT, MG y TV en hombres que tienen sexo con mujeres) antes de testar U. urealyticum en hombres sintomáticos. Por último, se aconseja tratar sólo a varones con alta carga bacteriana (>1.000 copias/ml de U. urealyticum en primer chorro de orina)2.
En pacientes con síntomas de cervicitis¿Qué pruebas debemos realizar?
Debido a que la cervicitis puede ser un signo de infección del tracto genital superior (p. ej., endometritis), se debe evaluar a las mujeres para detectar signos de enfermedad inflamatoria pélvica y analizar CT y NG con NAAT en muestras vaginales, cervicales u orina13 (Nivel de evidencia 2a, Grado de recomendación B). La toma vaginal puede realizarla el médico o bien por autotoma. Las mujeres con cervicitis también deben ser evaluadas para vaginosis bacteriana y tricomoniasis. Debido a que la sensibilidad de la microscopía para detectar T. vaginalis es relativamente baja (aproximadamente el 50%), las mujeres sintomáticas con cervicitis y microscopía negativa para tricomonas deben someterse a otras pruebas (principalmente NAAT). También se debe considerar testar MG mediante NAAT. Aunque la infección por VHS se ha asociado con cervicitis, solamente se deberá testar si la paciente presenta clínica compatible con herpes genital.
Además, es importante que las pacientes se hagan pruebas para detectar CT y NG en cualquier sitio potencialmente expuesto, según el tipo de actividad sexual (hisopo rectal y/o faríngeo) (Nivel de evidencia 2b, Grado de recomendación B).
¿Qué test no debemos realizar?
No se recomiendan las pruebas para U. parvum, U. urealyticum, Mycoplasma hominis o cultivo genital para estreptococos del grupo B.
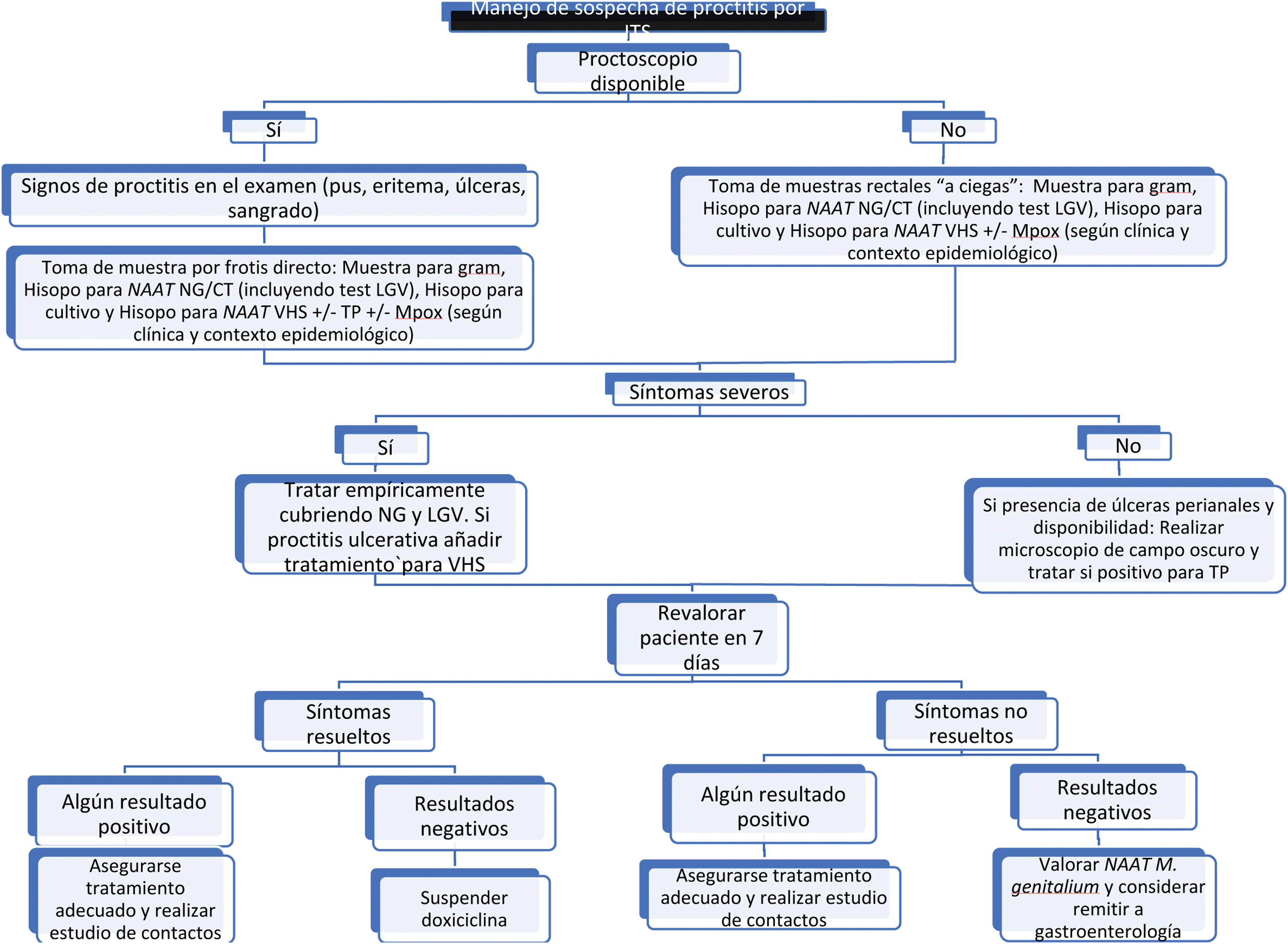
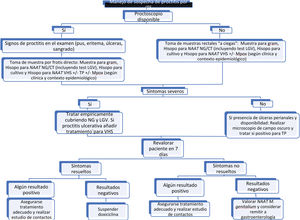
En pacientes con síntomas de proctitisDeben tomarse muestras para obtener confirmación microbiológica del diagnóstico de sospecha (mediante la introducción de hisopo a través del canal anal o mediante visualización por anoscopia/proctoscopia) (fig. 2):
- 1.
Tinción de Gram de secreción rectal (si disponible).
- 2.
Cultivo de secreción rectal para poder realizar antibiograma si fuera necesario (Nivel de evidencia 3a, Grado de recomendación C)33,34.
- 3.
NAAT de secreción rectal para la detección de NG y CT (tanto serovares D-K como L1-L3). (Nivel de evidencia 2a, Grado de recomendación B)35. Es la prueba de elección, pero se puede ampliar el estudio a otros gérmenes como T. pallidum (TP)36, VHS37 y/o Mpox, en caso de sospecha clínica. Toda prueba NAAT rectal positiva para CT debería tipificarse para descartar linfogranuloma venéreo (LGV) (Nivel de evidencia 2a, Grado de recomendación B)38. De inicio, la NAAT específica para MG no está recomendada, pero si es positiva y está disponible, se aconseja realizar un test de resistencia a macrólidos (Nivel de evidencia 3b, Grado de recomendación C)39.
- 4.
Si existen lesiones ulceradas en recto o perianales, puede tomarse una muestra de exudado para microscopía de campo oscuro y detección de TP y/o VHS por NAAT.
- 5.
En el caso concreto de sospecha de infección por citomegalovirus (CMV) pueden ser útiles: serología IgM/IgG de CMV, la NAAT e inmunohistoquímica de biopsias40.
La autotoma de hisopo rectal para realizar NAAT dual para CT y NG en pacientes asintomáticos con riesgo elevado (p. ej., población en que tome profilaxis pre-exposición [PrEP], PVVIH con parejas múltiples, HSH con práctica de sexo anal receptivo no protegido en los últimos 6 meses) es una opción válida (Nivel de evidencia 2a, Grado de recomendación B)41.
En pacientes con síntomas de proctocolitis o enteritisEn pacientes con síntomas de proctocolitis o enteritis, especialmente si presentan diarrea de más de 7 días y fiebre, se recomienda valorar: coprocultivo, NAAT en heces para bacterias y parásitos, rectosigmoidoscopia o endoscopia digestiva alta y baja, entre otras pruebas complementarias, según clínica y disponibilidad.
La proctitis por CT-LGV puede simular clínicamente e incluso histopatológicamente otros cuadros de proctocolitis; por tanto, se debe tener en cuenta en HSH con sospecha de enfermedad inflamatoria intestinal crónica (Nivel de evidencia 4, Grado de recomendación C)42.
TratamientoTratamiento empírico de las uretritisComo tratamiento empírico si identificamos diplococos intracelulares en el microscopio, o el paciente tiene secreción uretral purulenta, después de la recolección de muestras para su análisis, se orienta el caso como uretritis gonocócicas y se recomienda tratamiento43. Todos los expertos y las guías terapéuticas actuales coinciden en que la ceftriaxona debe ser el tratamiento de primera línea, sin embargo, no coinciden con la dosis recomendada. Las guías de la CDC (US Department of Health and Human Services/Centers for Disease Control and Prevention)44 aconsejan 500mg/IM/dosis única (excepto si peso ≥150kg donde estaría indicada 1g/IM/dosis única), mientras que las guías BASHH (British Association of Sexual Health and HIV Clinical Effectiveness Group)45 recomiendan 1g/IM/dosis única y las guías de la International Union Against Sexually Transmitted Infection (IUSTI)43 recomiendan 1gr IM dosis única asociado a azitromicina 2g/VO/dosis única.
Según las guías británicas, la dosis de ceftriaxona se ha aumentado de 500mg a 1g porque se han identificado cepas resistentes a ceftriaxona en todo el mundo (la mayoría vinculadas a la región de Asia y Pacífico), aunque una dosis de 500mg de ceftriaxona sería adecuada para tratar la mayoría de las cepas gonocócicas en Europa45.
De igual forma, las guías británicas45 ya no recomiendan la terapia dual con azitromicina 1g. La evidencia que sugiere una sinergia entre las cefalosporinas y la azitromicina in vitro no es concluyente. La prevalencia de la resistencia a la azitromicina ha aumentado y aunque algunas cepas resistentes a la ceftriaxona son sensibles a la azitromicina, una dosis de 1g de azitromicina puede ser insuficiente para eliminar la infección y una dosis de 2g de azitromicina aumenta la incidencia de efectos secundarios gastrointestinales45.
Además, la coinfección con CT es común en pacientes jóvenes heterosexuales (menores de 30 años) y HSH con UG. En estos casos, las guías de la IUSTI43 aconsejan añadir doxiciclina 100mg/VO/2 veces al día/durante 7 días al tratamiento con ceftriaxona IM, si no se ha prescrito el tratamiento dual con azitromicina, para una posible coinfección por clamidia hasta que se haya excluido. Por el contrario, las guías CDC44 aconsejan añadir la doxiciclina en todos los casos, hasta que se excluya la infección por CT.
En resumen, ante un posible caso de uretritis gonocócica se aconseja tratamiento empírico con:
- •
Ceftriaxona 500mg/1g/IM/dosis única (Nivel de evidencia 1b, Grado de recomendación A) + Doxiciclina 100mg/VO/2 veces al día/durante 7 días (Nivel de evidencia 2b, Grado de recomendación C).
En pacientes con síntomas de uretritis, pero en los casos en los que no se detecten en el estudio microscópico del exudado diplococos gram-negativos, o bien que presenten exudado mucoso, el caso se deberá orientar como uretritis no gonocócica hasta que tengamos los resultados de las muestras2,46. En hombres con síntomas leves y uretritis no comprobada microscópicamente, no se recomienda iniciar el tratamiento hasta tener el resultado de las muestras que suelen tardar 3-7 días, y que deberán guiar el tratamiento antimicrobiano.
Los pacientes con síntomas graves deben recibir tratamiento después de la recolección de muestras para su análisis y sin esperar los resultados de las pruebas microbiológicas. El tratamiento empírico recomendado en estos casos es:
- •
Doxiciclina 100mg/VO/2 veces al día/durante 7 días (Nivel de evidencia 1b, Grado de recomendación A).
La azitromicina 1g no debe usarse de forma rutinaria debido al riesgo de inducir resistencia a los macrólidos en MG13,46.
Tratamiento empírico de las cervicitisEl tratamiento empírico de la cervicitis debe incluir antibióticos que cubran CT:
- •
Doxiciclina 100mg/VO/2 veces al día/durante 7 días (Nivel de evidencia 1b, Grado de recomendación A).
Se asociará tratamiento que cubra NG en mujeres con mayor riesgo (p. ej., edad <25 años y nueva pareja sexual, una pareja sexual con parejas sexuales simultáneas, que tenga una ITS o riesgo de gonorrea; o si vive en una comunidad donde la prevalencia de la gonorrea sea alta)13. La tricomoniasis y la vaginosis bacteriana (VB) deben tratarse solamente si se detectan.
Para las mujeres con bajo riesgo de ITS, es posible aplazar el tratamiento hasta que se disponga de los resultados de las pruebas diagnósticas.
Tratamiento empírico de las proctitisEn caso de sospecha de proctitis aguda con clínica se debe comenzar tratamiento empírico sin esperar a los resultados de las pruebas (Nivel de evidencia 2a, Grado de recomendación B)34:
- •
Ceftriaxona 500mg /1g IM dosis única + doxiciclina 100mg/VO/2 veces al día/durante 7 días (alargar hasta 21 días en caso de LGV) (Nivel de evidencia 3a, Grado de recomendación B)34,47.
- •
En caso de proctitis ulcerativa dolorosa sugestiva de herpes simple, especialmente en HSH y en PVVIH, añadir tratamiento para herpes simple (Nivel de evidencia 4, Grado de recomendación C).
Inicialmente son necesarias medidas de soporte, de rehidratación y no se suele requerir tratamiento antibiótico empírico (Nivel de evidencia 1b, Grado de recomendación B)47. Se podría considerar tratamiento empírico teniendo en cuenta la epidemiología local si asocia sintomatología grave, sepsis o necesidad de ingreso hospitalario (por deshidratación severa, vómitos incoercibles, diarrea severa, insuficiencia renal aguda o comorbilidades).
Tratamiento guiado por resultadosUna vez se tengan los resultados microbiológicos se debe adecuar el tratamiento oportuno. La tabla 5 resume el tratamiento específico en cada caso y esta información se amplía en el Anexo 1 del material Suplementario. El tratamiento de los casos especiales (PVVIH, embarazadas o alérgicos) se expone en el Anexo 2 del material Suplementario.
Tratamiento específico de los casos
| Infección por N. gonorrhoeae | Régimen recomendado para infecciones ano-genitales y faríngeas no complicadas en adultos:Ceftriaxona 500mg/1g/IM/dosis única (Nivel de evidencia 1b, Grado de recomendación A) cuando no se conoce la susceptibilidad a los antimicrobianos44 (decidir la dosis según datos microbiológicos locales y posibilidad para realizar TOC).Si se conoce la susceptibilidad puede guiarse por el antibiograma. |
| Infección por C. trachomatis serovar D-K | Régimen recomendado en adolescentes y adultos54:Doxiciclina 100mg/VO/2 veces al día/durante 7 días (Nivel de evidencia 1b, Grado de recomendación A). |
| Infección por C. trachomatis serovares L1-L3 | Régimen recomendado en adolescentes y adultos38:Doxiciclina 100mg/VO/2 veces al día/durante 21 días (Nivel de evidencia 1b, Grado de recomendación A). |
| Infección por M. genitalium | Regímenes recomendados52,53:- Si es sensible a los macrólidos: Doxiciclina 100mg/VO/2 veces al día/durante 7 días* seguido de pauta extendida de azitromicina (1g/VO el primer día y 500mg/VO/durante 3 días adicionales —2,5g en total—) (Nivel de evidencia 1c, Grado de recomendación A).- Si es resistente a los macrólidos: Doxiciclina 100mg/VO/2 veces al día/durante 7 días* seguido moxifloxacino/400mg/VO/una vez al día/durante 7 días (Nivel de evidencia 1c, Grado de recomendación A). |
| Infección por T. vaginalis | Régimen recomendado56:Metronidazol 500mg/VO/2 veces al día/durante 7 días (Nivel de evidencia 1a, Grado de recomendación A). |
| Vaginosis bacteriana | Regímenes recomendados56:Metronidazol 500mg/VO/2 veces al día/durante 5 a 7 días, ometronidazol gel intravaginal (0,75%)/una vez al día/durante 5 días oclindamicina crema intravaginal (2%)/una vez al día/durante 7 días (Nivel de evidencia 1b, Grado de recomendación A). |
| Sífilis precoz | Régimen recomendado66:Penicilina G benzatina 2.4MUI/IM/dosis única (Nivel de evidencia 1b, Grado de recomendación B). |
| Infección por VHS 1 y 2 | En primoinfección67:- Aciclovir 200mg/VO/5 veces al día o- Aciclovir 400mg/VO/3 veces al día/durante 7-10 días o- Famciclovir 250mg/VO/3 veces al día/durante 7-10 días o- Valaciclovir 0,5-1g/VO/2 veces al día/durante 7-10 díasEn recurrencias67:- Aciclovir 200mg/VO/5 veces al día o- Aciclovir 400mg/VO/3 veces al día/durante 3-5 días o- Valaciclovir 500 mg/VO/2 veces al día/durante 3-5 días o- Famciclovir 125mg/VO/2 veces al día/durante 3-5 días(Nivel de evidencia 1b, Grado de recomendación A). |
| Infección por CMV | La mayoría de los casos se resuelven espontáneamente y no precisan tratamiento antivírico.Solo cuando presenta colitis en paciente inmunosuprimido (por ejemplo, persona con VIH [PVVIH] con CD4<200 células/ml) requiere tratamiento con68,69:- Ganciclovir 5mg/kg/IV/2 veces al día/durante 3-6 semanas hasta que se resuelvan los síntomas. Después se debería continuar con profilaxis secundaria (durante 3 meses más y con CD4>100 células/ml y carga viral de VIH indetectable en [PVVIH]) con valganciclovir 900mg(VO/una vez al día o ganciclovir 5mg/kg/IV/una vez al día/5 días a la semana)- En caso de tolerancia por VO, es preferible cambiar o comenzar el tratamiento ya con valganciclovir 900mg/VO/2 veces al día (con la misma duración que ganciclovir y posterior profilaxis secundaria)(Nivel de evidencia 1b, Grado de recomendación A). |
| Infección por Mpox | Se recomienda tratamiento sintomático analgésico y antiinflamatorio. Valorar el uso de corticoides VO en pauta corta en caso de proctitis muy inflamatoria y baja sospecha de otro patógeno (Nivel de evidencia 5, Grado de Recomendación D). |
| Infección por Shigella spp. | Régimen recomendado70: Azitromicina 1g/VO/una vez al día/durante 3 días o ciprofloxacino 500mg/VO/2 veces al día/durante 3 días (Nivel de evidencia 2a, Grado de Recomendación D). |
| Infección por Campylobacter spp. | Régimen recomendado70: Azitromicina 500mg/VO/una vez al día/durante 3 días o azitromicina 1g/VO/DU (Nivel de evidencia 2a, Grado de Recomendación B). |
| Infección por Salmonella spp. | Régimen recomendado70: Azitromicina 1g/VO/DU o ciprofloxacino 500mg/VO o 200mg/IV/2 veces al día/durante 3-7 días u ofloxacino 200mg/VO o IV/2 veces al día/durante 3-7 días (evitar administrar quinolonas de manera empírica sin tener antibiograma) (Nivel de evidencia 1b, Grado de Recomendación A). |
| Espiroquetosis intestinal humana | Régimen recomendado en personas sintomáticas64,71:Metronidazol 500mg/VO/2 veces al día o metronidazol 250mg/VO/3 veces al día/durante 14 días (Nivel de evidencia 4, Grado de Recomendación D). |
| Infección por E. histolytica spp. | Régimen recomendado34,47:Tinidazol 2g/VO/una vez al día/durante 3 días o metronidazol 750mg/3 veces al día/durante 5-10 días, seguido de paromomicina 500mg (o 25-35mg/kg/día en 3 dosis)/VO/3 veces al día/durante 7 días (Nivel de evidencia 1b, Grado de recomendación C). |
| Infección por Giardia lamblia spp. | El tratamiento acorta la duración de los síntomas y disminuye su gravedad.Régimen recomendado47:Tinidazol 2g/VO en dosis única o metronidazol 2g/una vez al día/durante 3 días o metronidazol 500mg/2 veces al día/durante 5-7 días (Nivel de evidencia 1b, Grado de recomendación A). |
DU: dosis única; IM: vía intramuscular; IV: vía intravenos; VO: vía oral.
Siempre deberemos explicar las causas de la infección y las posibles consecuencias a corto y largo plazo, los efectos secundarios del tratamiento y la importancia que la(s) pareja(s) sexual(es) sea(n) evaluada(s) y tratada(s) y del seguimiento34,46.
Para minimizar la transmisión y las reinfecciones, se debe indicar a los pacientes abstinencia sexual, incluido el sexo oral, hasta que ellos y sus pareja/s hayan sido tratados (es decir, hasta 7 días después del tratamiento si dosis única o hasta completar un régimen terapéutico y que los síntomas se hayan resuelto)44.
Deberemos aconsejar realizar un cribado otras ITS (VIH, sífilis, otras según historia sexual), recomendar vacunación (si no inmunidad previa)47 frente a hepatitis A y B, VPH y Mpox; y ofrecer consejo para iniciar PrEP (según la historia sexual)48 (Nivel de evidencia 4, Grado de recomendación D).
Por último, son de declaración obligatoria las infecciones por: Campylobacter spp., CT D-K, CT LGV-L1-3, Escherichia coli productora de toxina Shiga, Giardia lamblia spp., Mpox, NG, Salmonella spp., Shigella spp. y TP49.
Estudio de contactosTodas las parejas sexuales de riesgo deben ser valoradas y se les debe ofrecer tratamiento epidemiológico, manteniendo la confidencialidad del paciente50.
El tiempo considerado para valorar las parejas sexuales a estudiar es arbitrario (ver tiempos aconsejados en el manuscrito «Recomendaciones de expertos de la AEDV sobre los aspectos legales en el manejo de las infecciones de transmisión sexual»)51.
SeguimientoEl seguimiento de los pacientes se recomienda para confirmar:
- •
El cumplimiento de la terapia
- •
La resolución de síntomas y signos
- •
Excluir la reinfección y
- •
Garantizar la notificación a la/s pareja/s
En el caso de shigelosis en personas manipuladoras de alimentos o personal sanitario pueden existir regulaciones sobre cuándo debería ser la reincorporación laboral tras la desaparición de los síntomas34.
El Anexo 3 del material Suplementario expone el manejo de los pacientes con síntomas de uretritis o cervicitis persistente.
Test de cura (test of cure [TOC])Infección Gonocócica43,44A todos los pacientes diagnosticados con gonorrea se les debería recomendar que regresen para TOC, especialmente si:
- 1.
Síntomas o signos persistentes
- 2.
Infección faríngea,
- 3.
Tratados con cualquer otro tratamiento que no sea de primera línea, o
- 4.
Se adquirió la infección en la región de Asia y el Pacífico
Si síntomas persistentes se aconseja realizar cultivo 3-7 días postratamiento. Para el resto de casos repetir la muestra para NAAT 2 semanas postratamiento. Si la NAAT es positiva, se debe hacer un esfuerzo para realizar un cultivo de confirmación antes de repetir el tratamiento. Todos los cultivos positivos para la prueba de curación deben someterse a pruebas de susceptibilidad a los antimicrobianos.
Uretritis/cervicitis/proctitis no-gonocócicaM. genitalium32,52: Se debe considerar una TOC en todos los pacientes debido a la alta prevalencia de resistencia y especialmente si:
- 1.
Uretritis persistente, o
- 2.
Cervicitis, o
- 3.
EPI, o
- 4.
Régimen que incluya azitromicina en ausencia de test de resistencia a macrólidos
Las muestras de TOC deben recolectarse 4-5 semanas (y no antes de 3 semanas para evitar resultados falsos negativos) después del inicio del tratamiento para garantizar la curación microbiológica y ayudar a identificar la resistencia emergente.
C. trachomatis53–55: No se recomienda realizar una TOC de rutina en pacientes tratados con los regímenes recomendados de primera línea, pero debe realizarse si:
- 1.
Embarazo
- 2.
Infecciones complicadas
- 3.
Síntomas persisten
- 4.
Se han utilizado regímenes de segunda o tercera línea
- 5.
En caso de incumplimiento terapéutico, o
- 6.
Detección de CT rectal pero no se ha sometido a prueba de LGV
El TOC debe posponerse durante al menos 3 semanas después de finalizar la terapia porque la NAAT puede detectar ADN residual no viable de clamidia durante 3 a 5 semanas después del tratamiento.
T. vaginalis y vaginosis bacteriana56: El TOC solo se recomienda en mujeres con síntomas persistentes o embaradas, 4-5 semanas postratamiento.
AdendaPara realizar este artículo se han usado los niveles de evidencia de la Oxford Centre for Evidence-Based Medicine (CEBM)72–74. El Anexo 4 del material Suplementario expone cómo se clasifican estos niveles de evidencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Referencia no citada65.