Diversos estudios sugieren que los pacientes con psoriasis tienen un mayor riesgo de aparición de neoplasias, especialmente cutáneas, lo que podría estar asociado al uso de terapias para tratar la enfermedad. Además, la evidencia disponible sobre la seguridad de algunos tratamientos en este contexto y el manejo de estos pacientes es escasa. Así, las guías de práctica clínica con recomendaciones para el manejo de la psoriasis en el paciente oncológico son ambiguas. En el presente trabajo se recogen recomendaciones para el manejo y el uso de las terapias disponibles para estos pacientes. Estas recomendaciones han sido consensuadas por 45 dermatólogos del Grupo de Psoriasis de la Academia Española de Dermatología y Venereología utilizando el método Delphi, y tienen por objetivo ayudar a los especialistas en la toma de decisiones en la práctica clínica.
Several studies suggest that patients with psoriasis have a higher incidence of neoplasms, especially of the skin, which could be associated with the use of therapies to treat psoriasis. Furthermore, the evidence available on the safety profile of some treatments in this context, and the management of these patients is scarce, which is why clinical practice guidelines with recommendations on the management of psoriasis in cancer patients are ambiguous. This study provides recommendations on the management and use of the therapies currently available for these patients. They are the result of a Delphi consensus reached by 45 dermatologists of the Spanish Academy of Dermatology and Venereology Psoriasis Working Group, whose goal is to help specialists in the field in their decision-making processes.
La psoriasis es una enfermedad inflamatoria cutánea crónica que en su forma moderada-grave tiene una reconocida afectación sistémica1. Puede asociarse con diversas comorbilidades como artritis psoriásica, enfermedades cardiometabólicas, hígado graso y enfermedad inflamatoria intestinal2,3. Numerosos estudios indican que los pacientes con psoriasis tienen mayor riesgo de desarrollar cáncer, especialmente cutáneo, pudiendo estar relacionado con la naturaleza inflamatoria de la enfermedad y con factores ambientales (tabaquismo, consumo de alcohol, exposición a radiación ultravioleta [UV]) prevalentes en estos pacientes4.
Actualmente existen distintas terapias para el tratamiento de la psoriasis, cuya selección depende de factores como la gravedad de la enfermedad o la presencia de comorbilidades5. El uso de terapias basadas en luz UV y determinados fármacos inmunosupresores se ha relacionado con un mayor riesgo de desarrollar cáncer, aunque los datos son contradictorios6. Algunos trabajos sugieren que la fototerapia y las terapias sistémicas aumentan el riesgo de cáncer cutáneo7,8. El tratamiento con terapias biológicas también genera incertidumbre, ya que teóricamente podrían tener efectos en las vías innata y adaptativa de los mecanismos de inmunovigilancia del cáncer9–11. Los estudios publicados, aunque escasos en número y con bajo nivel de evidencia, muestran que no existe un incremento estadísticamente significativo en el riesgo de padecer cáncer en los pacientes tratados con terapias biológicas12–14.
Con todo, la evidencia disponible para orientar a los dermatólogos en el manejo de la psoriasis en el paciente oncológico es escasa y la mayoría de las guías de práctica clínica incluyen recomendaciones generales o ambiguas para el manejo de estos pacientes15–21.
Para el presente estudio, el Grupo de Psoriasis (GPs) de la Academia Española de Dermatología y Venereología (AEDV) consensuó, mediante el método Delphi, una serie de recomendaciones relacionadas con el abordaje terapéutico y asistencial del paciente oncológico con psoriasis.
MétodosSe realizó una consulta Delphi de dos rondas dirigida a un panel de expertos del GPs con una experiencia mínima de 2 años en el manejo de la psoriasis y cáncer. El diseño del cuestionario para la primera ronda se basó en una revisión de la literatura y el asesoramiento de un comité científico constituido por 8 dermatólogos (LP, JN, AL-F, LS, BP, CG, PC, JMC) e incluía 91 afirmaciones. El grado de acuerdo se evaluó mediante una escala Likert de 7 puntos (1=«en total desacuerdo»; 4=«ni acuerdo ni desacuerdo»; y 7=«totalmente de acuerdo»). Se alcanzó un consenso cuando al menos el 66% de los panelistas estuvieron de acuerdo (6-7 puntos) o en desacuerdo (1-2 puntos) con la afirmación propuesta. Las afirmaciones que no alcanzaron consenso en la primera ronda fueron replanteadas en una segunda.
Los panelistas evaluaron mediante una escala de 0 a 10 (siendo 0=«completamente inadecuado»; 5=«ni adecuado ni inadecuado»; y 10=«totalmente adecuado») la adecuación de distintos tratamientos para pacientes con psoriasis y cáncer cutáneo no melanoma y neoplasias hematológicas y no hematológicas activas y no activas. También se evaluó de la misma forma el uso concomitante de inhibidores del checkpoint y tratamientos para la psoriasis en el contexto de pacientes oncológicos con psoriasis y posibles efectos adversos relacionados con la estimulación del sistema inmunitario, como desarrollo de colitis, hepatitis, endocrinopatías y nefritis o enfermedad renal.
ResultadosUn total de 151 miembros del GPs fueron invitados a participar en la consulta. En la primera ronda participaron 45 panelistas (tasa de respuesta: 29,8%), provenientes de 13 comunidades autónomas, y en segunda ronda 36 (tasa de respuesta respecto a la primera ronda: 80,0%). Las características sociodemográficas y profesionales de los panelistas se detallan en la tabla 1.
Variables sociodemográficas y profesionales de los participantes
| Variable | Participantes (n=45) |
|---|---|
| Edad (años): mediana (RI) | 51,0 (45,0-58,0) |
| Sexo (hombre): n (%) | 24 (53,3) |
| Experiencia previa (años): mediana (RI) | 20,0 (15,0-29,0) |
| Nivel asistencial: n (%) | |
| Segundo nivel (centros de especialidades y hospitales de área) | 10 (22,2) |
| Tercer nivel (hospitales de referencia) | 35 (77,8) |
| Pacientes visitados/mes: mediana (RI) | 80,0 (55,0-100,0) |
RI: rango intercuartílico.
De las 91 afirmaciones planteadas, 69 alcanzaron consenso (tablas 2-4).
Consenso sobre el cribado y detección precoz del cáncer en pacientes oncológicos con psoriasis
| Ítem | % | ||
|---|---|---|---|
| Se recomienda aconsejar al paciente con psoriasis seguir las campañas generales de detección precoz de cáncer según edad y sexo (p. ej., detección de cáncer de mama y cáncer de colon) | 91,1a | ||
| Cribado y detección precoz del cáncer en el paciente con psoriasis | Cáncer cutáneo, no melanoma | Melanoma | Otras neoplasias sólidas y hematológicas |
| Se recomienda realizar un cribado activo en pacientes con psoriasis para la detección de… | 77,8a | 68,9a | 45,9 |
Celdas en gris: consenso alcanzado.
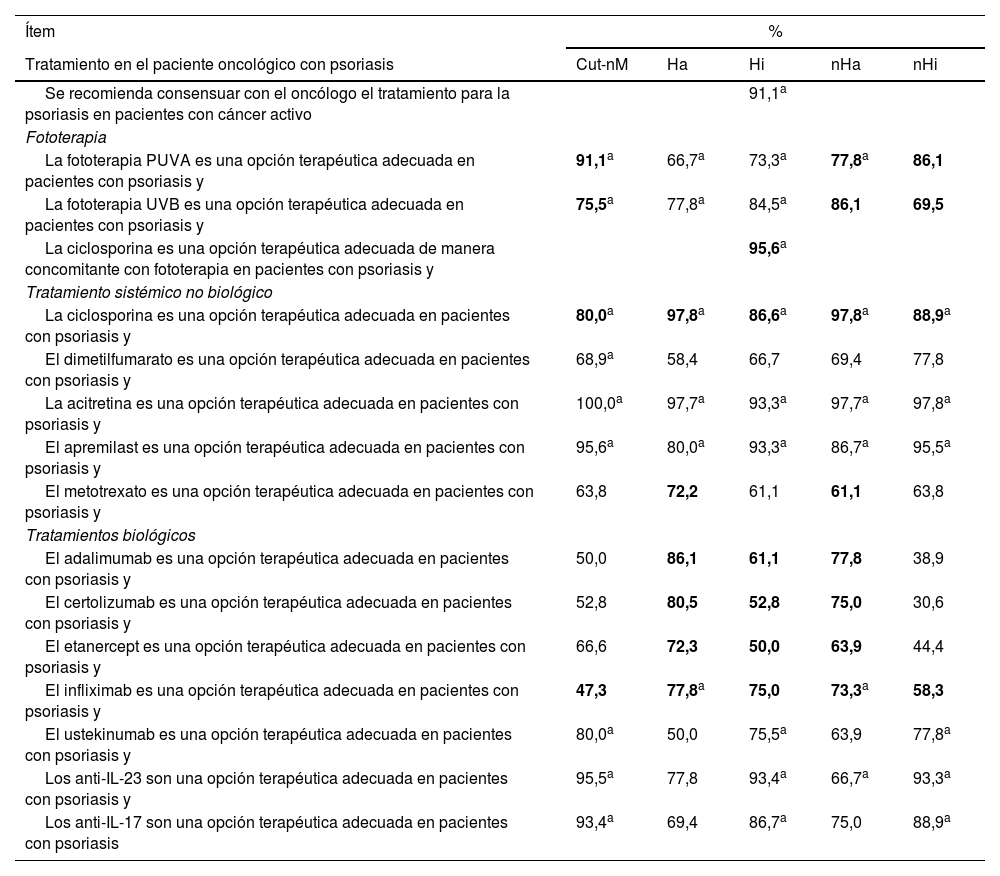
Consenso sobre el uso de distintos tratamientos en pacientes oncológicos con psoriasis
| Ítem | % | ||||
|---|---|---|---|---|---|
| Tratamiento en el paciente oncológico con psoriasis | Cut-nM | Ha | Hi | nHa | nHi |
| Se recomienda consensuar con el oncólogo el tratamiento para la psoriasis en pacientes con cáncer activo | 91,1a | ||||
| Fototerapia | |||||
| La fototerapia PUVA es una opción terapéutica adecuada en pacientes con psoriasis y | 91,1a | 66,7a | 73,3a | 77,8a | 86,1 |
| La fototerapia UVB es una opción terapéutica adecuada en pacientes con psoriasis y | 75,5a | 77,8a | 84,5a | 86,1 | 69,5 |
| La ciclosporina es una opción terapéutica adecuada de manera concomitante con fototerapia en pacientes con psoriasis y | 95,6a | ||||
| Tratamiento sistémico no biológico | |||||
| La ciclosporina es una opción terapéutica adecuada en pacientes con psoriasis y | 80,0a | 97,8a | 86,6a | 97,8a | 88,9a |
| El dimetilfumarato es una opción terapéutica adecuada en pacientes con psoriasis y | 68,9a | 58,4 | 66,7 | 69,4 | 77,8 |
| La acitretina es una opción terapéutica adecuada en pacientes con psoriasis y | 100,0a | 97,7a | 93,3a | 97,7a | 97,8a |
| El apremilast es una opción terapéutica adecuada en pacientes con psoriasis y | 95,6a | 80,0a | 93,3a | 86,7a | 95,5a |
| El metotrexato es una opción terapéutica adecuada en pacientes con psoriasis y | 63,8 | 72,2 | 61,1 | 61,1 | 63,8 |
| Tratamientos biológicos | |||||
| El adalimumab es una opción terapéutica adecuada en pacientes con psoriasis y | 50,0 | 86,1 | 61,1 | 77,8 | 38,9 |
| El certolizumab es una opción terapéutica adecuada en pacientes con psoriasis y | 52,8 | 80,5 | 52,8 | 75,0 | 30,6 |
| El etanercept es una opción terapéutica adecuada en pacientes con psoriasis y | 66,6 | 72,3 | 50,0 | 63,9 | 44,4 |
| El infliximab es una opción terapéutica adecuada en pacientes con psoriasis y | 47,3 | 77,8a | 75,0 | 73,3a | 58,3 |
| El ustekinumab es una opción terapéutica adecuada en pacientes con psoriasis y | 80,0a | 50,0 | 75,5a | 63,9 | 77,8a |
| Los anti-IL-23 son una opción terapéutica adecuada en pacientes con psoriasis y | 95,5a | 77,8 | 93,4a | 66,7a | 93,3a |
| Los anti-IL-17 son una opción terapéutica adecuada en pacientes con psoriasis | 93,4a | 69,4 | 86,7a | 75,0 | 88,9a |
Cut-nM: cáncer cutáneo no melanoma; Ha: neoplasia hematológica activa; Hi: neoplasia hematológica no activa; nHa: neoplasia no hematológica activa (incluyendo melanoma); nHi: neoplasia no hematológica no activa (incluyendo melanoma). Celdas en gris: consenso alcanzado. Valores en negrita: consenso en contra.
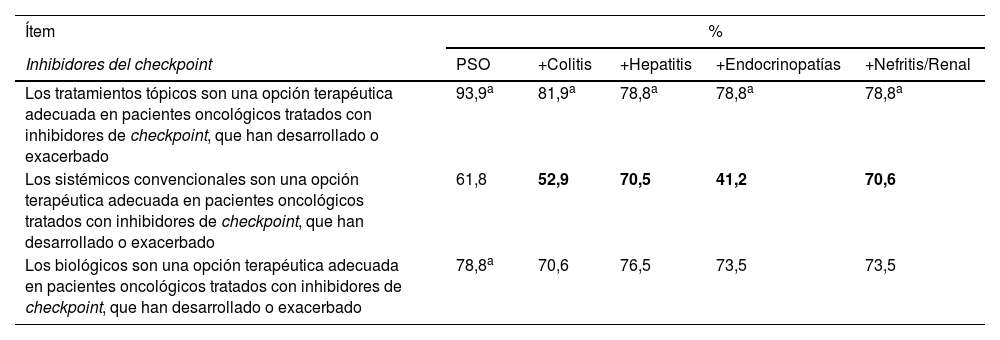
Consenso sobre el uso de inhibidores del checkpoint en pacientes oncológicos con psoriasis y posibles efectos adversos relacionados con la inmunoestimulación
| Ítem | % | ||||
|---|---|---|---|---|---|
| Inhibidores del checkpoint | PSO | +Colitis | +Hepatitis | +Endocrinopatías | +Nefritis/Renal |
| Los tratamientos tópicos son una opción terapéutica adecuada en pacientes oncológicos tratados con inhibidores de checkpoint, que han desarrollado o exacerbado | 93,9a | 81,9a | 78,8a | 78,8a | 78,8a |
| Los sistémicos convencionales son una opción terapéutica adecuada en pacientes oncológicos tratados con inhibidores de checkpoint, que han desarrollado o exacerbado | 61,8 | 52,9 | 70,5 | 41,2 | 70,6 |
| Los biológicos son una opción terapéutica adecuada en pacientes oncológicos tratados con inhibidores de checkpoint, que han desarrollado o exacerbado | 78,8a | 70,6 | 76,5 | 73,5 | 73,5 |
PSO: psoriasis. Celdas en gris: consenso alcanzado. Valores en negro: porcentaje a favor. Valores en negrita: porcentaje en contra.
Recomendación 1. Se recomienda aconsejar al paciente con psoriasis que participe en las campañas generales de detección precoz de cáncer según edad y sexo
En la discusión se citaron las guías de la Academia Americana de Dermatología (AAD-NPF) y la Asociación Británica de Dermatólogos (BAD), que recomiendan reforzar y mejorar la educación del paciente sobre la enfermedad y las comorbilidades asociadas16,22. Además, estudios recientes sugieren que los pacientes con psoriasis presentan un mayor riesgo de desarrollar determinados tipos de neoplasias, como el cáncer cutáneo no melanoma o linfomas23–25.
Recomendación 2. Se recomienda realizar un cribado activo en pacientes con psoriasis para la detección de cáncer cutáneo no melanoma y melanoma
La discusión se basó en la guía AAD-NPF, que recomienda un enfoque proactivo por parte del dermatólogo para la detección de cáncer en los pacientes con psoriasis, evaluando activamente la piel en busca de lesiones cancerosas o precancerosas22.
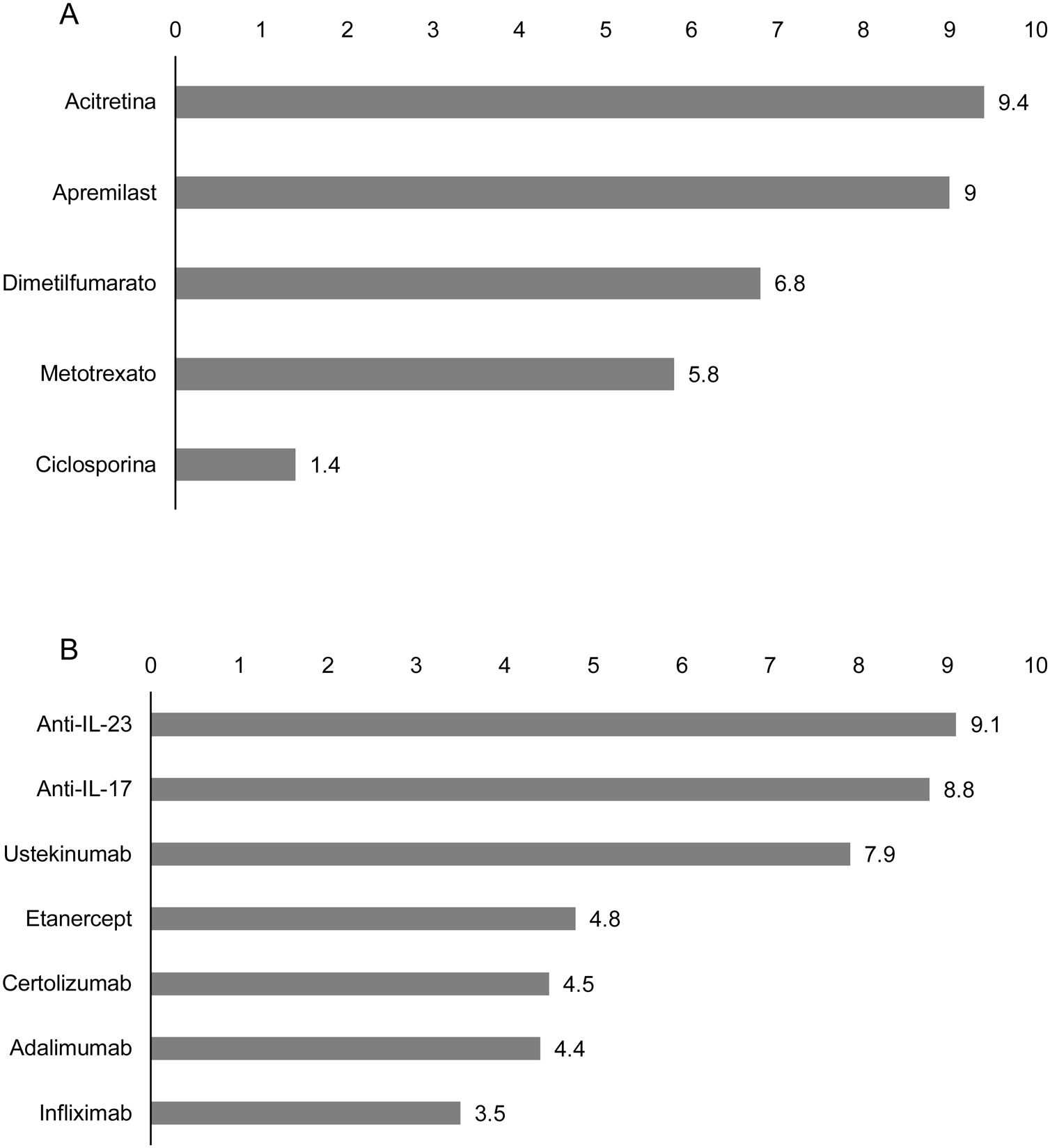
Tratamiento en el paciente oncológico con psoriasisAdecuación de los tratamientos sistémicos en el paciente oncológico con psoriasisLos panelistas calificaron la adecuación de los tratamientos en función de su eficacia y seguridad y consideraron que, en general, la acitretina y el apremilast serían los tratamientos sistémicos no biológicos más adecuados para el tratamiento de la psoriasis en pacientes oncológicos (fig. 1A). Entre las terapias biológicas disponibles, los anti-IL-23 y anti-IL-17 se consideran las opciones terapéuticas más adecuadas (fig. 1B).
Recomendación 3. Se recomienda consensuar con el oncólogo el tratamiento para la psoriasis en pacientes con cáncer activo
La votación se basó en las guías EuroGuiDerm, BAD, BETA-PSO, la francesa (Groupe de Recherche sur le Psoriasis de la Société Française de Dermatologie) y la española del GPs, que recomiendan discutir/consensuar los tratamientos con el oncólogo/hematólogo para cada caso individual15–17,26,27.
Recomendación 4. Tanto la fotoquimioterapia con psoraleno y UVA (PUVA) como la fototerapia con UVB son opciones terapéuticas adecuadas para pacientes con psoriasis y neoplasias en general (activas y no activas), pero se consideran inadecuadas para pacientes con antecedentes de o predisposición al cáncer cutáneo (melanoma y no melanoma)
Los datos disponibles en la literatura sobre el uso de la fototerapia y su relación con el cáncer de piel son contradictorios. Mientras que algunos estudios observacionales han mostrado un aumento del riesgo de desarrollar carcinoma de células escamosas tras el tratamiento con PUVA, otros no han mostrado un aumento significativo en el riesgo de desarrollar cáncer28. En este contexto, las guías EuroGuiDerm y francesa consideran adecuada la fototerapia, en especial el uso de UVB de banda estrecha, en pacientes con psoriasis y cáncer no cutáneo reciente; no así en pacientes con cáncer cutáneo reciente o un elevado riesgo de padecerlo15,27.
Recomendación 5. La ciclosporina es una opción inadecuada para los pacientes oncológicos con psoriasis, tanto en monoterapia como combinada con fototerapia
Para esta recomendación se tuvo en cuenta que el uso de ciclosporina se ha asociado con la aparición de diversos tipos de cáncer en el contexto del trasplante de órganos; sin embargo, esta asociación no es tan clara en pacientes con psoriasis7,29,30. Algunas guías como la EuroGuiDerm, BETA-PSO y la francesa desaconsejan el uso de ciclosporina en pacientes con psoriasis e historia previa de cáncer15,26,27, especialmente en los casos de carcinoma de células escamosas agresivos o invasivos26. Además, diversos estudios y revisiones sistemáticas31,32, así como el propio resumen de características del producto33, desaconsejan el empleo concomitante de ciclosporina y fototerapia (PUVA o UVB) en pacientes con psoriasis debido al riesgo potencial de desarrollar cáncer de piel.
Recomendación 6. El dimetilfumarato es una opción terapéutica adecuada en pacientes con psoriasis y cáncer cutáneo no melanoma, neoplasias no hematológicas (activas e inactivas) y hematológicas no activas
La información sobre el uso de dimetilfumarato en pacientes oncológicos con psoriasis es escasa. Estudios recientes de vida real muestran que el dimetilfumarato es una opción eficaz y segura para el tratamiento de la psoriasis en pacientes con comorbilidades, incluyendo historia de cáncer, y no se ha relacionado con la aparición de neoplasias o recidiva34–36. Asimismo, existe evidencia de que el dimetilfumarato inhibe el crecimiento de células transformadas/no-transformadas, así como la angiogénesis, tanto in vivo como in vitro37, lo que podría tener un efecto antipsoriásico y antitumoral37,38. En las neoplasias hematológicas activas se considera que la posible linfopenia crea un riesgo innecesario.
Recomendación 7. La acitretina y el apremilast son opciones terapéuticas adecuadas para los pacientes oncológicos con psoriasis
La discusión se basó en las guías EuroGuiDerm y BETA-PSO, que proponen apremilast como una opción terapéutica válida en pacientes con psoriasis y antecedentes de cáncer, aunque se recomienda su uso con precaución al no disponer de suficientes datos de seguridad a largo plazo15,26. En este sentido, un estudio reciente sobre una serie de casos y una revisión de la literatura sugieren que apremilast es una opción eficaz y segura para estos pacientes, aunque se requerirían más estudios que confirmen estos resultados39.
Por otra parte, los datos sobre el uso de acitretina son escasos, aunque según las guías EuroGuiDerm y del GPs, y una revisión narrativa sobre los pacientes con psoriasis y su riesgo de desarrollar cáncer, esta opción terapéutica parece no modificar el riesgo de cáncer incidente o de su recidiva en pacientes con psoriasis15,20,40.
Recomendación 8. El metotrexato es una opción inadecuada para los pacientes con neoplasias hematológicas activas
La recomendación se basa en el consenso obtenido, para el que se tuvo en cuenta el posible efecto citopénico del metotrexato, que puede ser contraproducente en estos pacientes; no hubo consenso en cuanto a otras neoplasias. A pesar del uso extendido del metotrexato en práctica clínica, no existe consenso sobre su empleo en pacientes con enfermedades inmunomediadas y neoplasias concomitantes. Así, las guías EuroGuiDerm y del GPs exponen que el metotrexato podría ser empleado como tratamiento sistémico en pacientes con psoriasis e historia previa de cáncer en caso de una respuesta inadecuada o contraindicación en el uso de un tratamiento tópico, fototerapia UVB o acitretina15,18. De manera similar, la guía BETA-PSO incluye el uso de metotrexato en pacientes con psoriasis y cáncer sólido, hematológico y cáncer de piel melanoma y no melanoma. Sin embargo, subraya la importancia de evitar su uso en los casos de carcinoma de células escamosas agresivos o invasivos26. Además, un ensayo clínico aleatorizado, llevado a cabo en adultos con enfermedad cardiovascular, diabetes o síndrome metabólico, encontró una relación entre el uso de dosis bajas de metotrexato y un aumento en el riesgo de cáncer de piel41. Un reciente estudio caso-control en la población danesa ha identificado una asociación entre el diagnóstico de cáncer cutáneo (melanoma y no melanoma) y el tratamiento con metotrexato (dosis acumulada ≥2,5g), de forma dosis-dependiente, aunque en pacientes con psoriasis la asociación sólo continuaba siendo significativa (odds ratio=1,43) para carcinoma basocelular8. Aunque los panelistas no dispusieron de esta evidencia para la discusión, probablemente el metotrexato debiera evitarse en pacientes con riesgo de cáncer cutáneo.
Recomendación 9. Infliximab se considera una opción terapéutica inadecuada en pacientes con psoriasis y neoplasias hematológicas (activas o inactivas) y no hematológicas activas
Recomendación 10. Adalimumab y certolizumab se consideran opciones terapéuticas inadecuadas en pacientes con psoriasis y neoplasias activas, tanto hematológicas como no hematológicas
Recomendación 11. Etanercept es una opción terapéutica adecuada para pacientes con psoriasis y cáncer cutáneo no melanoma, pero inadecuada para pacientes con neoplasias hematológicas activas
La incidencia de cáncer, especialmente de piel, asociado con el uso de terapias anti-TNF (adalimumab, certolizumab, etanercept, infliximab) se ha estudiado fundamentalmente en pacientes con artritis reumatoide y enfermedad de Crohn4. No obstante, el uso de esta terapia en pacientes con psoriasis no se ha asociado con el riesgo de aparición de tumores sólidos ni con su recidiva, como se refleja en las guías de práctica clínica de psoriasis15,26,42, reumatológicas y gastroenterológicas43–46. En general, estas guías recomiendan discutir para cada caso el uso de la terapia anti-TNF con el oncólogo, con otros especialistas y con el propio paciente. En la discusión de los consensos y las consiguientes recomendaciones se han tenido en cuenta el posible riesgo aumentado de infecciones y la evidencia anecdótica de desarrollo o progresión de neoplasias hematológicas (especialmente linfoproliferativas) en pacientes tratados con anti-TNF, así como el diferente mecanismo de acción de etanercept.
Recomendación 12. Ustekinumab es una opción terapéutica adecuada en pacientes con psoriasis y cáncer cutáneo no melanoma y neoplasias no activas, tanto hematológicas como no hematológicas
Recomendación 13. Los tratamientos anti-IL-23 y anti-IL-17 son una opción terapéutica adecuada en pacientes oncológicos con psoriasis
El uso tanto de ustekinumab como de los tratamientos anti-IL-23 y anti-IL-17 no se ha relacionado con un mayor riesgo de cáncer4. Así, las guías EuroGuiDerm y BETA-PSO proponen el uso de ustekinumab en pacientes con psoriasis e historia previa de cáncer15,26 y sugieren que los anti-IL-23 y anti-IL-17 se pueden usar en estos pacientes, aunque con cautela, dada la falta de experiencia y datos de seguridad a largo plazo15,26. La falta de consenso en el caso de ustekinumab por lo que se refiere a las neoplasias hematológicas y no hematológicas activas se justificó por la posible inhibición del efecto protector de la respuesta antitumoral Th1 (mediada por IL-12)47. En todos los casos, se recomienda discutir cada caso particular con el oncólogo/hematólogo responsable.
En la tabla 5 se incluye un resumen de las recomendaciones para cada uno de los fármacos y los tipos de neoplasias.
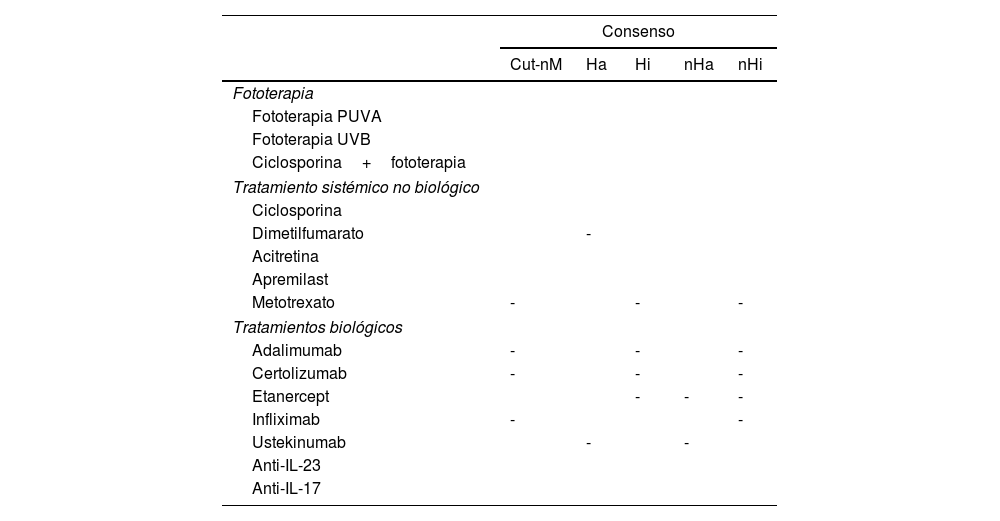
Resumen gráfico del consenso sobre el uso de distintos tratamientos en pacientes oncológicos con psoriasis
| Consenso | |||||
|---|---|---|---|---|---|
| Cut-nM | Ha | Hi | nHa | nHi | |
| Fototerapia | |||||
| Fototerapia PUVA | |||||
| Fototerapia UVB | |||||
| Ciclosporina+fototerapia | |||||
| Tratamiento sistémico no biológico | |||||
| Ciclosporina | |||||
| Dimetilfumarato | - | ||||
| Acitretina | |||||
| Apremilast | |||||
| Metotrexato | - | - | - | ||
| Tratamientos biológicos | |||||
| Adalimumab | - | - | - | ||
| Certolizumab | - | - | - | ||
| Etanercept | - | - | - | ||
| Infliximab | - | - | |||
| Ustekinumab | - | - | |||
| Anti-IL-23 | |||||
| Anti-IL-17 | |||||
Cut-nM: cáncer cutáneo no melanoma; Ha: neoplasia hematológica activa; Hi: neoplasia hematológica no activa; nHa: neoplasia no hematológica activa; nHi: neoplasia no hematológica no activa. Celda verde: consenso a favor (adecuado); Celda roja: consenso en contra (no adecuado); -: sin consenso.
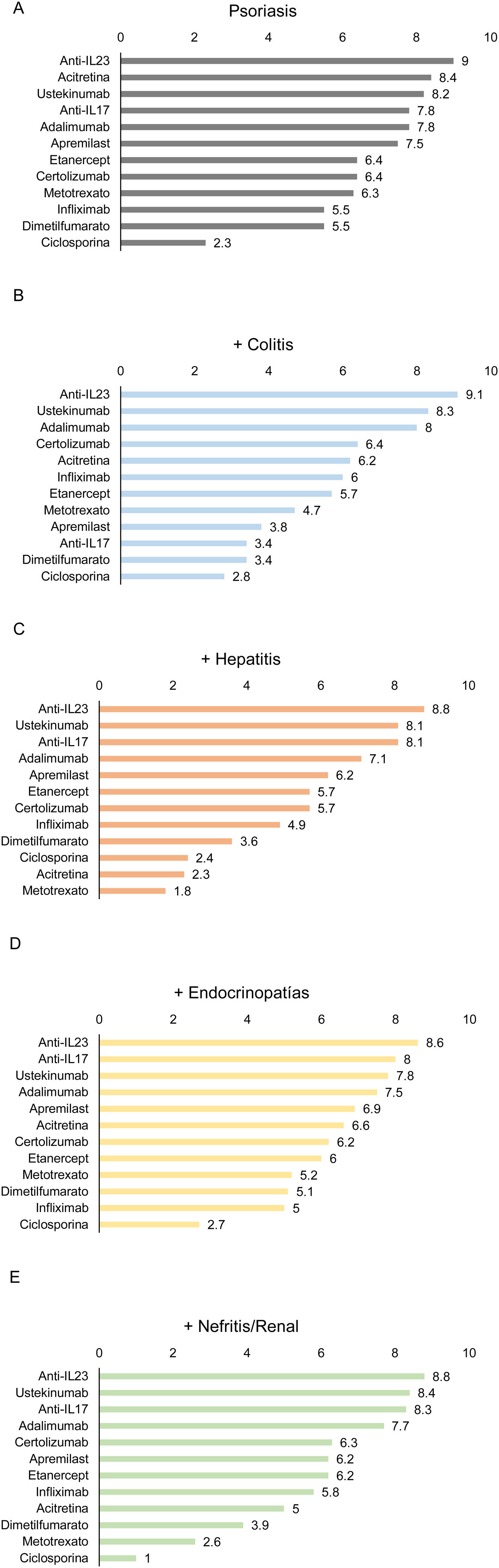
En general, los panelistas consideraron que los agentes biológicos anti-IL-23 son el tratamiento más adecuado para los pacientes con psoriasis y con otras patologías inmunomediadas asociadas al uso de inhibidores de checkpoint (fig. 2), seguido de ustekinumab y anti-IL-17, excepto, para estos últimos, en pacientes con psoriasis y colitis (fig. 2B). Según los panelistas, la ciclosporina es el tratamiento menos adecuado para la mayoría de estos pacientes (fig. 2).
Adecuación de los diferentes tratamientos en pacientes oncológicos tratados con inhibidores del checkpoint y que presenten psoriasis como única manifestación de efecto adverso mediado inmunológicamente (A) o asociada a colitis (B), hepatitis (C), endocrinopatía (D) o nefritis/afectación renal (E). Los números indican la puntuación promedio otorgada por los panelistas.
Recomendación 13. Los tratamientos tópicos son una opción terapéutica adecuada en pacientes oncológicos tratados con inhibidores de checkpoint en quienes se han desarrollado o exacerbado otras patologías como la colitis, hepatitis, endocrinopatías y nefritis o enfermedad renal
Recomendación 14. Los tratamientos sistémicos biológicos son una opción terapéutica adecuada en pacientes oncológicos tratados con inhibidores de checkpoint en quienes se han desarrollado o exacerbado otras patologías como la colitis, hepatitis, endocrinopatías y nefritis o enfermedad renal
Recomendación 15. Los tratamientos sistémicos convencionales son una opción terapéutica inadecuada en pacientes oncológicos tratados con inhibidores de checkpoint en quienes se han desarrollado o exacerbado hepatitis y nefritis o enfermedad renal
Para estas recomendaciones se tuvo en cuenta que el uso de inhibidores de checkpoint en pacientes oncológicos está asociado con la aparición de distintos efectos adversos cutáneos inmunomediados, tales como la psoriasis48,49. Según un estudio reciente sobre informes de reacciones adversas a distintos inhibidores del checkpoint obtenidos de la base de datos EudraVigilance de la Agencia Europea de Medicamentos, la aparición de psoriasis en estos pacientes se trata con tratamientos tópicos, sistémicos no biológicos o biológicos en función de la gravedad49. En este sentido, una revisión sistemática de estudios observacionales ha mostrado que el tratamiento tópico con corticoesteroides es el más común, seguido del uso de acitretina, esteroides sistémicos, fototerapia, metotrexato y agentes biológicos50. En cuanto al uso de las nuevas terapias, distintas publicaciones han mostrado que los inhibidores de IL-1751 e IL-2352,53 suponen una opción terapéutica eficaz y segura para el tratamiento de la psoriasis relacionada con la activación inmune.
DiscusiónPara el manejo de la psoriasis en pacientes oncológicos, los panelistas recomiendan consensuar con el oncólogo el tratamiento para la psoriasis. Además, mostraron su acuerdo en que la fototerapia con UVA y UVB es adecuada para la psoriasis en pacientes con neoplasias hematológicas y no hematológicas, activas o inactivas, pero no en pacientes con cáncer cutáneo (melanoma o no melanoma) o predisposición al mismo. Entre los tratamientos sistémicos, la acitretina, el apremilast y los anti-IL-23 y anti-IL-17 se consideran opciones terapéuticas adecuadas para todos los perfiles de pacientes, al contrario que la ciclosporina, considerada inadecuada para cualquier tipo de cáncer activo o inactivo. En cuanto al resto de las terapias, se consideraron adecuadas o inadecuadas en función del tipo de neoplasia, teniendo en cuenta tanto el posible efecto sobre la progresión o inmunovigilancia tumoral como el riesgo de complicaciones infecciosas o efectos adversos que puedan complicar el manejo de estos pacientes.
En una guía elaborada recientemente por un panel multidisciplinar de expertos54 se recomienda valorar el pronóstico del cáncer antes de iniciar el tratamiento sistémico para la psoriasis. Así, para pacientes con un tumor sólido previo y buen pronóstico, el tratamiento sería similar al de un paciente no oncológico. En casos de mal pronóstico, se debería buscar el equilibrio entre los beneficios del tratamiento para la psoriasis y los posibles riesgos derivados54. Por otra parte, en general, se recomiendan los tratamientos tópicos y los biológicos, en especial los anti-IL-23 y anti-IL-17 y el ustekinumab, para el tratamiento de la psoriasis que aparece o empeora como un efecto adverso inmunomediado de los inhibidores de checkpoint.
El presente estudio presenta algunas limitaciones inherentes a la metodología empleada, donde el consenso se sustenta principalmente en la experiencia de los participantes. Además, la aplicación de estas recomendaciones debe contextualizarse en cada caso concreto, y dentro del sistema sanitario español. No obstante, cabe reseñar que el consenso ha sido alcanzado entre un número considerable de especialistas de ámbito hospitalario, con experiencia en el manejo de estos pacientes y con representación de casi todas las comunidades autónomas.
En conclusión, el consenso alcanzado y las recomendaciones propuestas sobre el manejo y tratamiento de la psoriasis en pacientes oncológicos pueden ayudar en la toma de decisiones en la práctica clínica habitual.
FinanciaciónEl proyecto ha sido financiado con una beca no restringida de Almirall. Ningún miembro de la compañía ha participado en el desarrollo del proyecto, la discusión o la redacción del contenido.
Conflicto de interesesL. Puig ha percibido honorarios como consultor o conferenciante, y ha participado en ensayos clínicos patrocinados por AbbVie, Almirall, Amgen, Biogen, Boehringer Ingelheim, Bristol Myers Squibb, Dice, J&J Innovative Medicine, Leo-Pharma, Lilly, Novartis, Pfizer, Sandoz, Sanofi y UCB. P. de la Cueva ha actuado como consultor y/o ponente y/o investigador para J&J Innovative Medicine, AbbVie, MSD, Pfizer, Novartis, Lilly, Almirall, UCB, Biogen, Celgene, Amgen, Sandoz, Boehringer Ingelheim, Sanofi y Leo-Pharma. A. López-Ferrer ha participado como consultora y/o ponente y/o investigadora para AbbVie, Almirall, Amgen, Boehringer Ingelheim, Bristol Myers Squibb, J&J Innovative Medicine, Leo-Pharma, Lilly, Novartis y UCB. B. Pérez Suárez ha percibido honorarios como consultora o conferenciante y ha participado en ensayos clínicos patrocinados por AbbVie, Almirall, Amgen, Boehringer Ingelheim, Bristol Myers Squibb, J&J Innovative Medicine, Leo-Pharma, Lilly, Novartis y UCB. C. Galache ha percibido honorarios como conferenciante de Amgen, Celgene, Novartis y Sanofi. J. Notario ha percibido honorarios como consultor y/o ponente y/o investigador para AbbVie, Almirall, Amgen, Boehringer Ingelheim, Bristol Myers Squibb, J&J Innovative Medicine, Leo-Pharma, Lilly, Novartis, Pfizer, Sanofi y UCB. JM. Carrascosa ha participado como consultor y/o ponente y/o investigador para AbbVie, Almirall, Amgen, Boehringer Ingelheim, Bristol Myers Squibb, J&J Innovative Medicine, Leo-Pharma, Lilly, Novartis y UCB.
Los autores quieren agradecer a los miembros del Grupo de Psoriasis sus contribuciones al documento y a Outcomes’10 por el apoyo y coordinación metodológica del proyecto. Los miembros del Grupo de Psoriasis que participaron como panelistas se detallan a continuación: M. Teresa Abalde, Mariano Ara, Susana Armesto, Ofelia Baniandrés, Rubén del Río, Noemí Eiris, José Manuel Fernández, Marta Ferran, Rosa Fornons, Manuel Galán, Marta García, M. Carmen García, Francisco Javier Garcia-Latasa, Daniel Godoy, Pedro Herranz, Celia Horcajadas, Mercedes Hospital, Marc Julià, M. del Mar Llamas, Jose Luis López, Francisco Javier Mataix, Almudena Mateu, Héctor Muñoz, Amparo Pérez, Gerard Pitarch, Josep A. Pujol, Conrad Pujol, Leandra Reguero, Miquel Ribera, Raquel Rivera, Lourdes Rodríguez, José Carlos Ruiz, Diana Patricia Ruiz, Ricardo Ruiz, José Luis Sánchez, Sergio Santos, Jorge Santos-Juanes, Caridad Soria, Rosa Taberner y Juan Ignacio Yanguas.