Los inhibidores de los puntos de control inmunológicos anti-PD1 y anti-PDL1 constituyen una nueva arma terapéutica eficaz en el tratamiento del cáncer. Sin embargo, inherentes a su mecanismo de acción antitumoral, estos fármacos producen efectos adversos inmunorrelacionados que afectan frecuentemente a la piel y que pueden motivar su retirada. La toxicidad dermatológica por anti-PD1 y anti-PDL1 se puede manifestar de forma muy variada, entre la que se incluye la psoriasis1. La patogenia de la psoriasis inducida por anti-PD1 y anti-PDL1 parece atribuirse a una sobreactivación de los linfocitos Th1, Th17 y Th22 secundaria a la inactivación de la vía inmunomoduladora PD12.
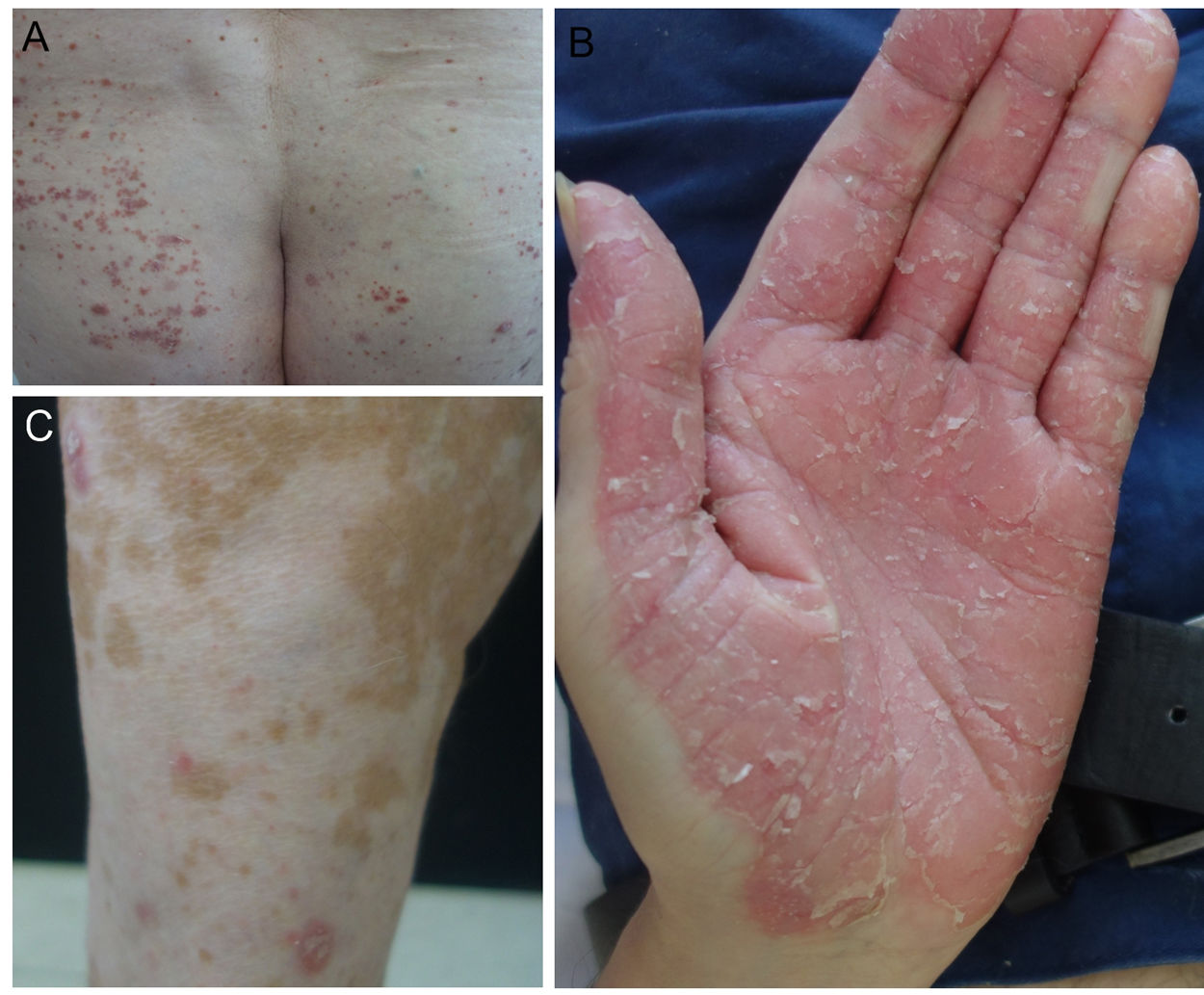
En nuestro centro hemos evaluado tres pacientes que desarrollaron una psoriasis como consecuencia del tratamiento con anti-PD1 y anti-PDL1 para un carcinoma vesical, un carcinoma de laringe y un melanoma metastásico (fig. 1). Junto a esto, realizamos una búsqueda bibliográfica en la literatura de los casos publicados hasta la fecha de psoriasis por anti-PD1 y anti-PDL1 y recogimos de ellos las siguientes variables: edad, sexo, tipo de neoplasia, tipo de anti-PD1/PDL1 y pauta de dosificación empleada, tiempo hasta la aparición de lesiones, historia personal de psoriasis, tratamiento realizado, interrupción del tratamiento con anti-PD1/PDL1 y respuesta del tumor a la inmunoterapia. Finalmente, proponemos un algoritmo para el tratamiento de la psoriasis inducida por anti-PD1 y anti-PDL1.
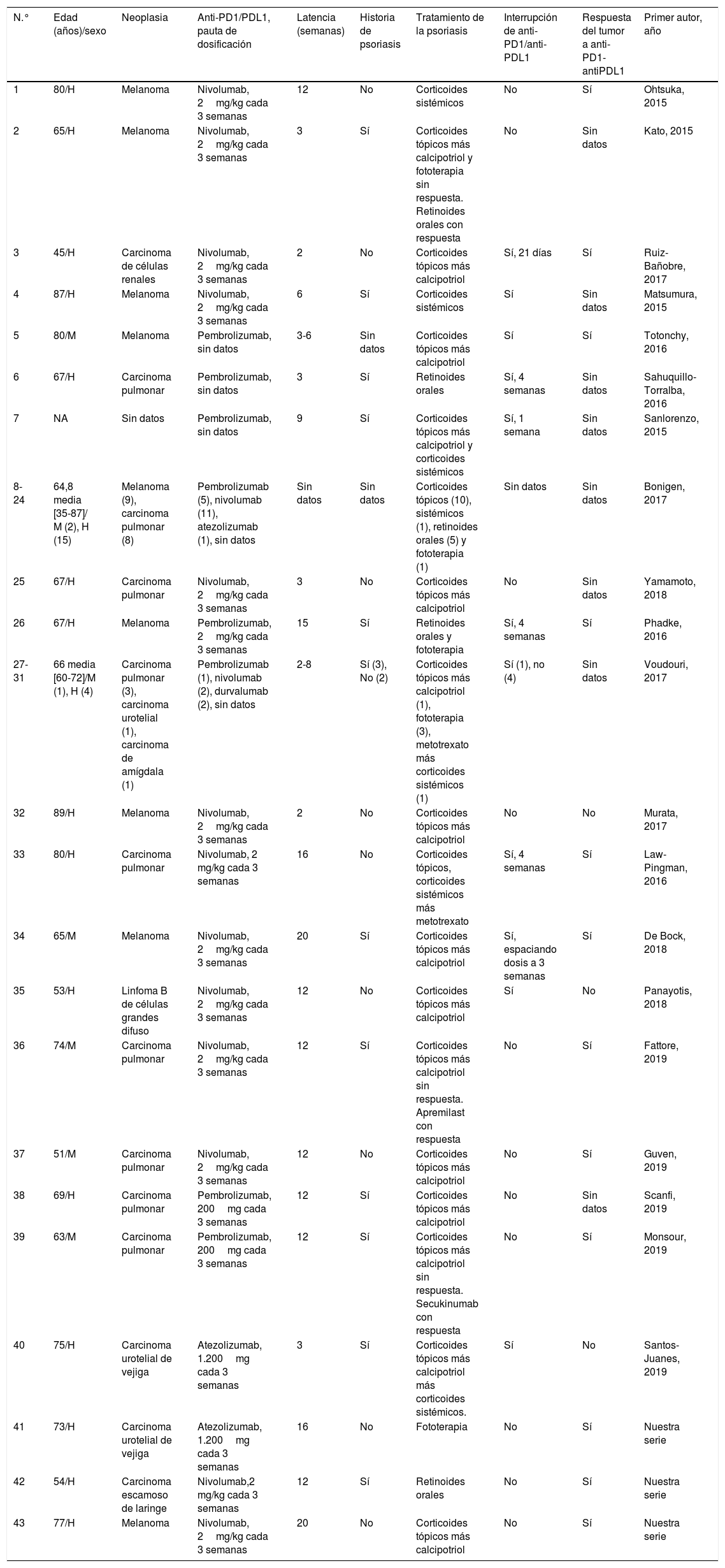
Sumando nuestros pacientes a los publicados en la literatura, existen 43 casos de psoriasis inducida o exacerbada por anti-PD1 (26 por nivolumab y 12 por pembrolizumab) y anti-PDL1 (3 por atezolizumab y 2 por durvalumab) (tabla 1)3-7. La edad media fue de 65,7años (35-87), con un predominio de sexo masculino (34/43; 79%). Los tipos de neoplasia más frecuentes fueron el melanoma y el cáncer de pulmón (entre ambos, 18/43; 41,9%), seguidos de carcinoma urotelial de vejiga (3/43; 7%), carcinoma de células renales, linfomaB de células grandes difuso, carcinoma de amígdala y carcinoma escamoso de laringe (cada uno 1/43; 2,3%). La media de tiempo desde la introducción de la inmunoterapia hasta la aparición de las lesiones de psoriasis fue de 9,6semanas. Aunque en muchos de los casos publicados no queda recogido, 11 de los 43 negaban antecedentes personales de psoriasis (25,6%) y 14 de los 43 presentaron una exacerbación de su psoriasis previa con los anti-PD1/anti-PDL1 (32,6%). En cerca de la mitad de los pacientes la psoriasis se controló únicamente con tratamiento tópico (20/43; 46,5%). Las terapias sistémicas más empleadas fueron los retinoides orales (9/43; 20,9%), la fototerapia y los corticoides sistémicos (5/43; 11,6%, en ambos casos). Dos casos recibieron metotrexato (2/43; 4,7%) y, además, dos casos aislados recibieron apremilast y secukinumab. En 15 pacientes no fue necesario retirar la inmunoterapia por su psoriasis (34,9%), mientras que en 6 se suspendió temporalmente (14%) y en 5 de forma definitiva (11,6%).
Pacientes con psoriasis inducida o exacerbada por anti-PD1/anti-PDL1 publicados en la literatura como casos o series de casos y sus principales características
| N.° | Edad (años)/sexo | Neoplasia | Anti-PD1/PDL1, pauta de dosificación | Latencia (semanas) | Historia de psoriasis | Tratamiento de la psoriasis | Interrupción de anti-PD1/anti-PDL1 | Respuesta del tumor a anti-PD1-antiPDL1 | Primer autor, año |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 80/H | Melanoma | Nivolumab, 2mg/kg cada 3 semanas | 12 | No | Corticoides sistémicos | No | Sí | Ohtsuka, 2015 |
| 2 | 65/H | Melanoma | Nivolumab, 2mg/kg cada 3 semanas | 3 | Sí | Corticoides tópicos más calcipotriol y fototerapia sin respuesta. Retinoides orales con respuesta | No | Sin datos | Kato, 2015 |
| 3 | 45/H | Carcinoma de células renales | Nivolumab, 2mg/kg cada 3 semanas | 2 | No | Corticoides tópicos más calcipotriol | Sí, 21 días | Sí | Ruiz-Bañobre, 2017 |
| 4 | 87/H | Melanoma | Nivolumab, 2mg/kg cada 3 semanas | 6 | Sí | Corticoides sistémicos | Sí | Sin datos | Matsumura, 2015 |
| 5 | 80/M | Melanoma | Pembrolizumab, sin datos | 3-6 | Sin datos | Corticoides tópicos más calcipotriol | Sí | Sí | Totonchy, 2016 |
| 6 | 67/H | Carcinoma pulmonar | Pembrolizumab, sin datos | 3 | Sí | Retinoides orales | Sí, 4 semanas | Sin datos | Sahuquillo-Torralba, 2016 |
| 7 | NA | Sin datos | Pembrolizumab, sin datos | 9 | Sí | Corticoides tópicos más calcipotriol y corticoides sistémicos | Sí, 1 semana | Sin datos | Sanlorenzo, 2015 |
| 8-24 | 64,8 media [35-87]/ M (2), H (15) | Melanoma (9), carcinoma pulmonar (8) | Pembrolizumab (5), nivolumab (11), atezolizumab (1), sin datos | Sin datos | Sin datos | Corticoides tópicos (10), sistémicos (1), retinoides orales (5) y fototerapia (1) | Sin datos | Sin datos | Bonigen, 2017 |
| 25 | 67/H | Carcinoma pulmonar | Nivolumab, 2mg/kg cada 3 semanas | 3 | No | Corticoides tópicos más calcipotriol | No | Sin datos | Yamamoto, 2018 |
| 26 | 67/H | Melanoma | Pembrolizumab, 2mg/kg cada 3 semanas | 15 | Sí | Retinoides orales y fototerapia | Sí, 4 semanas | Sí | Phadke, 2016 |
| 27-31 | 66 media [60-72]/M (1), H (4) | Carcinoma pulmonar (3), carcinoma urotelial (1), carcinoma de amígdala (1) | Pembrolizumab (1), nivolumab (2), durvalumab (2), sin datos | 2-8 | Sí (3), No (2) | Corticoides tópicos más calcipotriol (1), fototerapia (3), metotrexato más corticoides sistémicos (1) | Sí (1), no (4) | Sin datos | Voudouri, 2017 |
| 32 | 89/H | Melanoma | Nivolumab, 2mg/kg cada 3 semanas | 2 | No | Corticoides tópicos más calcipotriol | No | No | Murata, 2017 |
| 33 | 80/H | Carcinoma pulmonar | Nivolumab, 2 mg/kg cada 3 semanas | 16 | No | Corticoides tópicos, corticoides sistémicos más metotrexato | Sí, 4 semanas | Sí | Law-Pingman, 2016 |
| 34 | 65/M | Melanoma | Nivolumab, 2mg/kg cada 3 semanas | 20 | Sí | Corticoides tópicos más calcipotriol | Sí, espaciando dosis a 3 semanas | Sí | De Bock, 2018 |
| 35 | 53/H | Linfoma B de células grandes difuso | Nivolumab, 2mg/kg cada 3 semanas | 12 | No | Corticoides tópicos más calcipotriol | Sí | No | Panayotis, 2018 |
| 36 | 74/M | Carcinoma pulmonar | Nivolumab, 2mg/kg cada 3 semanas | 12 | Sí | Corticoides tópicos más calcipotriol sin respuesta. Apremilast con respuesta | No | Sí | Fattore, 2019 |
| 37 | 51/M | Carcinoma pulmonar | Nivolumab, 2mg/kg cada 3 semanas | 12 | No | Corticoides tópicos más calcipotriol | No | Sí | Guven, 2019 |
| 38 | 69/H | Carcinoma pulmonar | Pembrolizumab, 200mg cada 3 semanas | 12 | Sí | Corticoides tópicos más calcipotriol | No | Sin datos | Scanfi, 2019 |
| 39 | 63/M | Carcinoma pulmonar | Pembrolizumab, 200mg cada 3 semanas | 12 | Sí | Corticoides tópicos más calcipotriol sin respuesta. Secukinumab con respuesta | No | Sí | Monsour, 2019 |
| 40 | 75/H | Carcinoma urotelial de vejiga | Atezolizumab, 1.200mg cada 3 semanas | 3 | Sí | Corticoides tópicos más calcipotriol más corticoides sistémicos. | Sí | No | Santos-Juanes, 2019 |
| 41 | 73/H | Carcinoma urotelial de vejiga | Atezolizumab, 1.200mg cada 3 semanas | 16 | No | Fototerapia | No | Sí | Nuestra serie |
| 42 | 54/H | Carcinoma escamoso de laringe | Nivolumab,2 mg/kg cada 3 semanas | 12 | Sí | Retinoides orales | No | Sí | Nuestra serie |
| 43 | 77/H | Melanoma | Nivolumab, 2mg/kg cada 3 semanas | 20 | No | Corticoides tópicos más calcipotriol | No | Sí | Nuestra serie |
H: hombre; M: mujer.
La respuesta de la neoplasia a los anti-PD1 y anti-PDL1 en estos pacientes está poco descrita. Los datos disponibles hablan de una buena respuesta en 12 pacientes y una ausencia de respuesta en 3. Sin embargo, no parece existir un paralelismo entre la respuesta antitumoral y la gravedad de la psoriasis, como ocurre en el vitíligo asociado al tratamiento con nivolumab en el tratamiento del melanoma8.
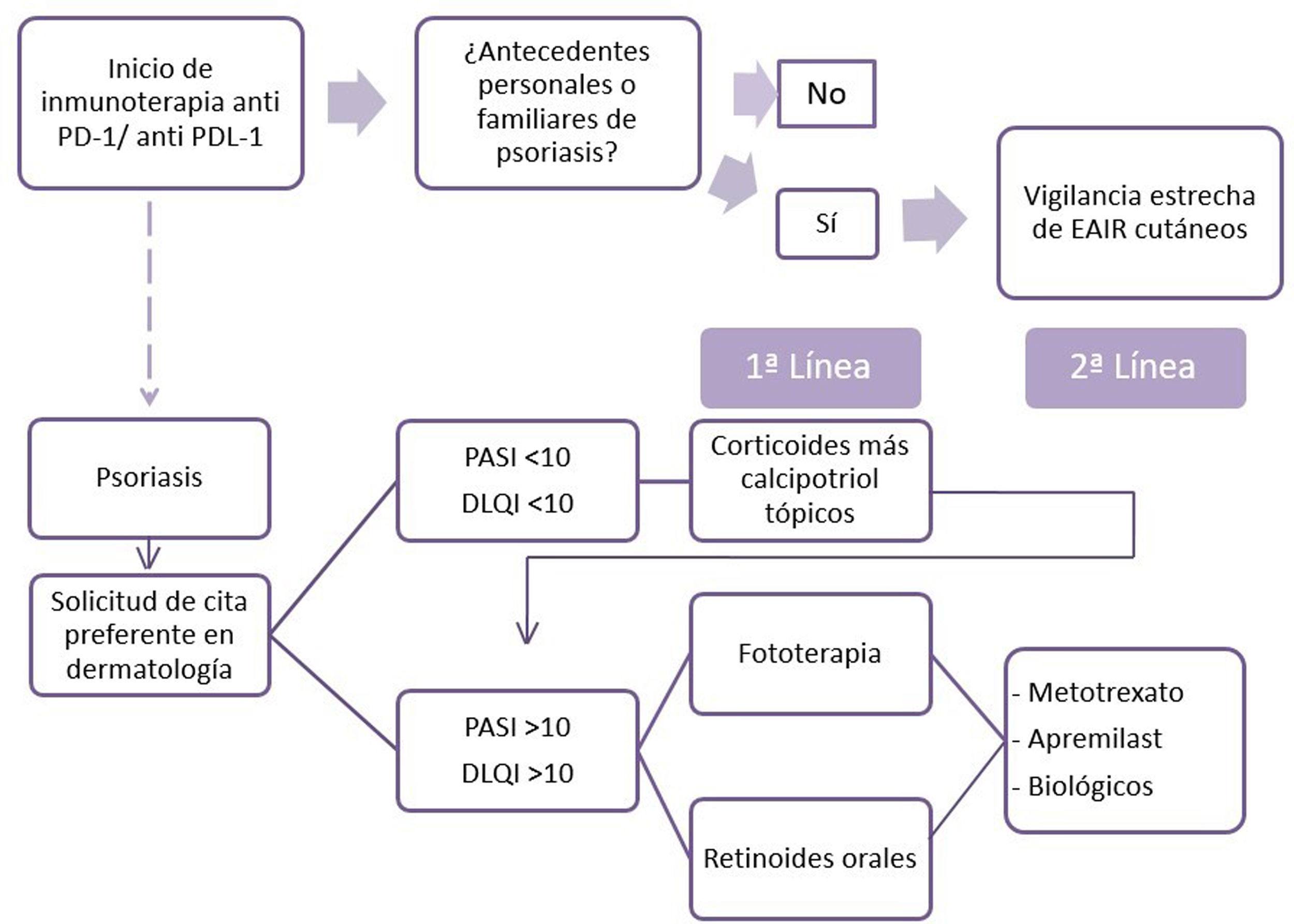
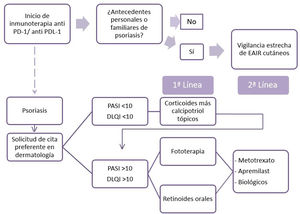
Para el tratamiento de la psoriasis inducida por fármacos, en general, se recomienda un reconocimiento precoz del agente causal y su retirada, si es posible, así como la modalidad terapéutica estándar para la psoriasis de acuerdo con las guías9. Por otro lado, en la psoriasis, cuando hay una neoplasia subyacente, se recomienda evitar el uso de ciclosporina. Hay controversia en cuanto a la seguridad de los anti-TNF y metotrexato, y faltan datos sobre el apremilast y el resto de biológicos10. Con estos datos, proponemos un algoritmo para el tratamiento de los pacientes con psoriasis por anti-PD1 y anti-PDL1 (fig. 2). El primer punto reside en la necesidad de recoger los antecedentes personales y familiares de psoriasis del paciente por parte del oncólogo. Una vez aparezca la psoriasis, es recomendable la evaluación rápida por dermatología. El tratamiento considerado tendrá en cuenta la extensión (PASI) y la repercusión en la calidad de vida (cuestionario DLQI) de su psoriasis. Así, recomendamos pautar tratamiento tópico en psoriasis leve y priorizar la fototerapia y los retinoides orales cuando se requieran terapias sistémicas, por la ausencia de efecto inmunosupresor de los mismos, por la posible influencia negativa en la evolución de la enfermedad neoplásica. En caso de una ausencia de respuesta o de contraindicación, se pueden proponer apremilast, metotrexato o tratamientos biológicos, previo consenso con oncología.
Los dermatólogos debemos aprender a reconocer y tratar los efectos adversos cutáneos inmunorrelacionados por anti-PD1 y PDL1, entre los que se encuentra la psoriasis. Dada su frecuencia, resaltamos la necesidad de realizar un seguimiento dermatológico periódico de estos pacientes. Resulta asimismo imprescindible la colaboración con oncología para acelerar el proceso diagnóstico y ofrecer al paciente la mejor opción terapéutica que lo mantenga sin lesiones, pero sin intervenir negativamente en la enfermedad neoplásica.