Los nevos de localizaciones especiales («nevi of special sites» [NOSS]) son lesiones melanocíticas benignas que se presentan en ubicaciones particulares. Aunque las características histológicas de los NOSS ya han sido descritas, sus especificaciones inmuno-fenotípicas no han sido del todo definidas.
ObjetivosDescribir las características clínico-patológicas de una serie de casos de NOSS y determinar su perfil inmunohistoquímico.
Materiales y métodosSe evaluaron 35 NOSS, utilizando técnicas de tinción con inmunoperoxidasa como marcador melanocítico (S100, Melan-A y HMB45) y de proliferación (Ki-67).
ResultadosTodos los casos de NOSS mostraron cambios arquitectónicos alarmantes (proliferación melanocítica lentiginosa llamativa, irregularidades, conglomerado y cohesión de los nidos) y atipia citológica (melanocitos grandes con núcleos vesiculares, citoplasma claro y presencia de pigmento melánico fino), características que podrían llevar al diagnóstico equivocado de nevo atípico o, incluso, de melanoma. Todos los casos de NOSS mostraron una expresión difusa de las proteínas S100 y Melan-A. El Ki-67 de los melanocitos névicos fue extremadamente bajo. La expresión de la proteína HMB45 se limitó a los melanocitos junturales y a los dérmicos superficiales.
ConclusionesLos NOSS pueden presentar características histológicas que simulan nevos atípicos o melanomas, por lo que es importante tomar en cuenta esto para evitar errores diagnósticos. La expresión de la proteína HMB45 en los NOSS indica que sus melanocitos tienen un fenotipo activado. La disminución de la expresión de la proteína HMB45 en los NOSS, siguiendo un gradiente descendiente desde la zona de la unión hacia la zona dérmica más profunda indica una maduración inmunohistoquímica.
Nevi of special sites (NOSS) are benign melanocytic lesions that occur at particular sites. Although the histological features of NOSS have been described, their immunophenotypic features have not been fully characterized.
AimsTo present the clinicopathological characteristics of a case series of NOSS and to characterize their immunohistochemical profile.
Materials and methodsThirty-five NOSS were assessed using immunoperoxidase staining techniques for the melanocytic (S100, Melan-A, and HMB45) and proliferation (Ki-67) markers
ResultsAll of the cases of NOSS showed concerning architectural changes (prominent lentiginous melanocytic proliferation, irregularities, crowdedness, and dyhesiveness of the nests), and cytological atypia (large nevomelanocytes with vesicular nuclei, clear cytoplasm, and dusty melanin pigment) that can lead to a misdiagnosis of atypical nevi or even melanomas. All of the cases of NOSS showed diffuse expression of S100 and Melan-A proteins. Ki-67 labeling index of the nevomelanocytes was extremely low. HMB45 protein expression was limited to the junctional and superficial dermal nevomelanocytes.
ConclusionsNOSS can show histological features that can easily mimic atypical nevi or melanomas and this diagnostic consideration should be kept in mind to avoid their misdiagnosis. The expression of HMB45 protein in NOSS indicates that their nevomelanocytic cells have an activated phenotype. The decreased HMB45 protein expression following a gradient from junctional to deeper dermal localization in NOSS is indicative of their immunohistochemical maturation.
Los nevos de localizaciones especiales (NOSS), conocidos también como nevos con atipia relacionada con su localización, son lesiones melanocíticas que se presentan en sitios corporales particulares, como la línea mamaria embrionaria (axila, mama, ingle, ombligo y perineo), el área genital, acral y sitios de flexión, así como en la cabeza y en la región cervical. Estas lesiones melanocíticas no tienen un mayor riesgo de desarrollar melanomas. Además, poseen un comportamiento biológico benigno y su extirpación quirúrgica completa es, casi siempre, curativa. Hasta este momento, el conocimiento del comportamiento biológico de los NOSS es aún rudimentario y, por lo tanto, algunos pacientes con este padecimiento tendrán que estar bajo vigilancia incluso tras haberles realizado una extirpación quirúrgica completa1–5.
Los NOSS se caracterizan por presentar algunas particularidades histológicas (cambios arquitectónicos y citológicos) preocupantes y, a veces, es difícil diferenciarlos de otras neoplasias melanocíticas como son los melanomas, los nevos atípicos, nevos melanocíticos con características histológicas congénitas, nevos de Spitz y nevos melanocíticos traumatizados4. Entre los cambios arquitectónicos alarmantes de los NOSS se incluyen la proliferación lentiginosa melanocítica juntural (especialmente la observada en los nevos del cuero cabelludo y de la oreja), agrandamiento, conglomerado y cohesión de los nidos de la unión, así como la formación de puentes o elongación de las crestas interpapilares (se ha visto principalmente en los nevos genitales y acrales)4,6. Dentro de las características citológicas atípicas, están la presencia de melanocitos de gran tamaño con núcleos vesiculares de mayor dimensión, nucléolos pequeños y citoplasma pálido o con granos de pigmento de melanina. Entre otras especificaciones histológicas que son alarmantes, se pueden añadir la extensión pagetoide de bajo grado y la respuesta estromal del huésped en forma de un infiltrado de células inflamatorias dérmicas, melanófagos y fibroplasia. El NOSS puede estar conformado únicamente por un componente de la unión o tener un componente dérmico y otro de la unión1–5. Las características histológicas más importantes que ayudan a diferenciar el NOSS de los melanomas son que la lesión esté bien circunscripta, la simetría, la maduración, la ausencia de una extensión pagetoide intraepidérmica de alto grado y la ausencia tanto de atipia citológica, como de necrosis o de mitosis en grado significativo. En el NOSS, las mutaciones de varios genes, incluidos el BRAF (nevos genitales y conjuntivales)7,8, el GNAQ, el NRAS (nevos conjuntivales) y el c-KIT (nevos conjuntivales y acrales) parecen estar relacionadas.
Hasta la actualidad, el conocimiento acerca del NOSS es limitado. Se han realizado escasos estudios1–5 acerca de las características clínicas y morfológicas de estas lesiones. Este estudio presenta una serie de casos de este padecimiento y realiza una descripción más detallada de su perfil clínico-patológico e inmunohistoquímico.
Materiales y métodosEn total, 35 casos de NOSS (11 nevos acrales, 11 localizados en las zonas de flexura, ocho de cabeza y cuello, tres genitales y dos conjuntivales) fueron identificados a partir de los registros del autor. La información obtenida fue analizada y presentada de tal forma que la identidad de los pacientes fue anonimizada. El estudio no incluyó ninguna interacción o intervención con humanos y tampoco se tuvo acceso a la información personal que permitiera la identificación de los pacientes. Por lo tanto, no resultó necesario que el estudio fuera evaluado por el comité de ética institucional. En todos los casos, las laminillas originales teñidas con hematoxilina y eosina y la inmunohistoquímica fueron revisadas. Se utilizó un panel que integraba tinciones inmunohistoquímicas (los anticuerpos primarios incluían S100: clon 4C4.9; Melan-A: clon: A103; HMB45: anticuerpos monoclonales del clon HMB45) y marcadores de proliferación (Ki-67: anticuerpo policlonal del clon 30-9). Además, se usaron controles positivos (melanoma) y negativos (tejido mamario). El número de células positivas con el HMB45 (marcador de activación de los melanocitos), Ki-67 (marcador de proliferación), Melan-A y S100 (tinción citoplásmica) se evaluó en 100 células de cuatro campos a mayor aumento y se registró como el porcentaje de células positivas siguiendo lo realizado por otros grupos9. Los datos se analizaron utilizando el IBM SPSS 22 (IBM-SPSS Inc., Chicago, IL, EE.UU.). Se realizó la prueba de Mann-Whitney para comparar el porcentaje de células positivas (proteínas S100, Melan-A y HMB45). Todos los resultados se expresaron como media ± error estándar de la media. Los valores de p menores de 0,05 se consideraron como estadísticamente significativos.
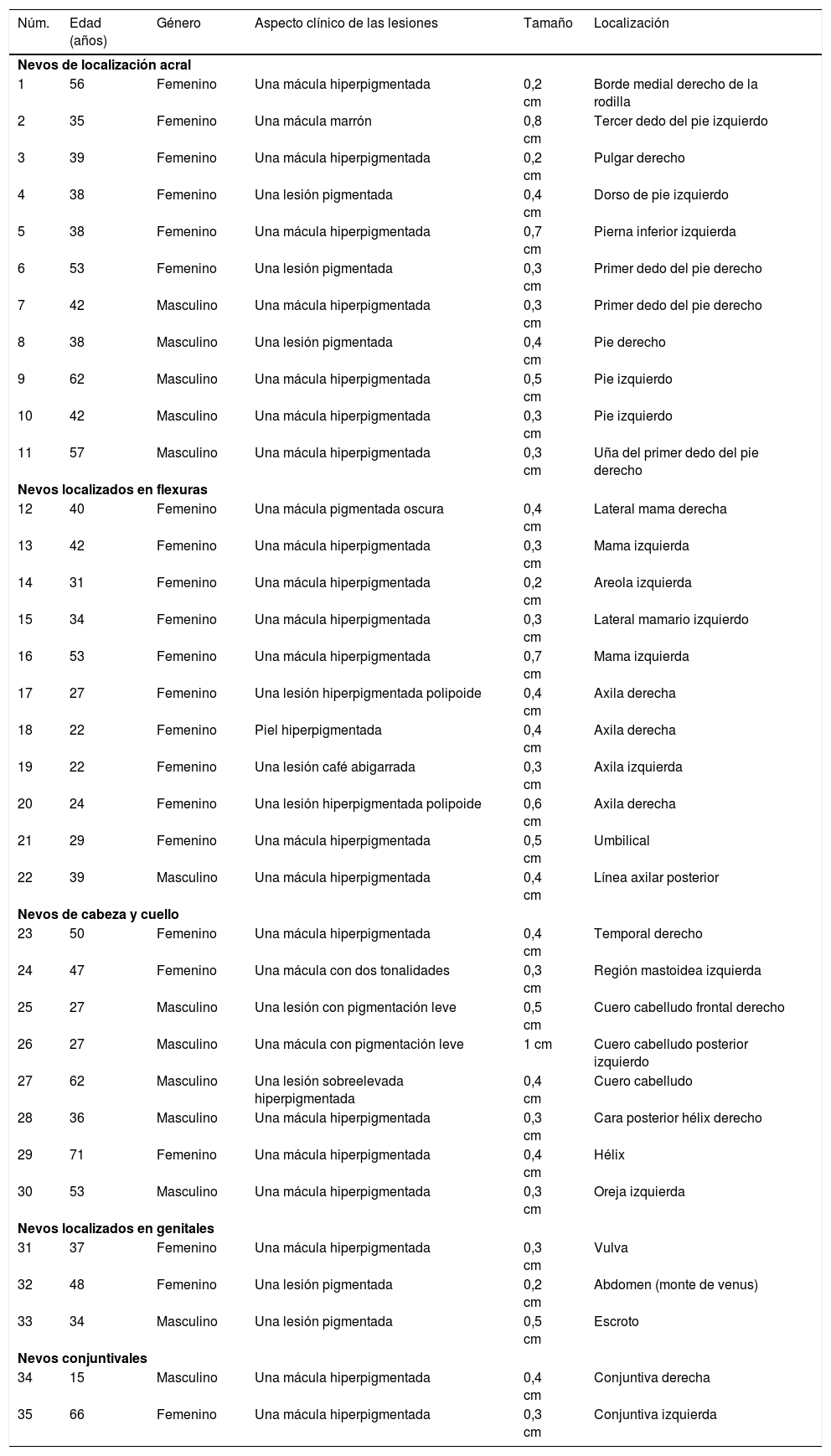
ResultadosLas edades de los pacientes oscilaron entre los 15 y los 71 años. La edad media de las personas con NOSS fue de 39,7 ± 2,1. Los pacientes con estas lesiones localizadas en la cabeza y en el cuello tenían edades relativamente más avanzadas. Los NOSS ubicados en las zonas de flexuras se presentaron con mayor frecuencia en personas de sexo femenino, mientras que los localizados en la cabeza y en el cuello fueron más comunes en los pacientes de sexo masculino. La mayoría de los NOSS aparecieron como lesiones pigmentadas, de pequeño tamaño (0,5 ± 0,03 cm) y con un aspecto clínico que simulaba a los nevos atípicos. En las tablas 1 y 2 se muestra un resumen de estos hallazgos.
Características clínicas de los nevos con atipia relacionada con su localización
| Núm. | Edad (años) | Género | Aspecto clínico de las lesiones | Tamaño | Localización |
|---|---|---|---|---|---|
| Nevos de localización acral | |||||
| 1 | 56 | Femenino | Una mácula hiperpigmentada | 0,2 cm | Borde medial derecho de la rodilla |
| 2 | 35 | Femenino | Una mácula marrón | 0,8 cm | Tercer dedo del pie izquierdo |
| 3 | 39 | Femenino | Una mácula hiperpigmentada | 0,2 cm | Pulgar derecho |
| 4 | 38 | Femenino | Una lesión pigmentada | 0,4 cm | Dorso de pie izquierdo |
| 5 | 38 | Femenino | Una mácula hiperpigmentada | 0,7 cm | Pierna inferior izquierda |
| 6 | 53 | Femenino | Una lesión pigmentada | 0,3 cm | Primer dedo del pie derecho |
| 7 | 42 | Masculino | Una mácula hiperpigmentada | 0,3 cm | Primer dedo del pie derecho |
| 8 | 38 | Masculino | Una lesión pigmentada | 0,4 cm | Pie derecho |
| 9 | 62 | Masculino | Una mácula hiperpigmentada | 0,5 cm | Pie izquierdo |
| 10 | 42 | Masculino | Una mácula hiperpigmentada | 0,3 cm | Pie izquierdo |
| 11 | 57 | Masculino | Una mácula hiperpigmentada | 0,3 cm | Uña del primer dedo del pie derecho |
| Nevos localizados en flexuras | |||||
| 12 | 40 | Femenino | Una mácula pigmentada oscura | 0,4 cm | Lateral mama derecha |
| 13 | 42 | Femenino | Una mácula hiperpigmentada | 0,3 cm | Mama izquierda |
| 14 | 31 | Femenino | Una mácula hiperpigmentada | 0,2 cm | Areola izquierda |
| 15 | 34 | Femenino | Una mácula hiperpigmentada | 0,3 cm | Lateral mamario izquierdo |
| 16 | 53 | Femenino | Una mácula hiperpigmentada | 0,7 cm | Mama izquierda |
| 17 | 27 | Femenino | Una lesión hiperpigmentada polipoide | 0,4 cm | Axila derecha |
| 18 | 22 | Femenino | Piel hiperpigmentada | 0,4 cm | Axila derecha |
| 19 | 22 | Femenino | Una lesión café abigarrada | 0,3 cm | Axila izquierda |
| 20 | 24 | Femenino | Una lesión hiperpigmentada polipoide | 0,6 cm | Axila derecha |
| 21 | 29 | Femenino | Una mácula hiperpigmentada | 0,5 cm | Umbilical |
| 22 | 39 | Masculino | Una mácula hiperpigmentada | 0,4 cm | Línea axilar posterior |
| Nevos de cabeza y cuello | |||||
| 23 | 50 | Femenino | Una mácula hiperpigmentada | 0,4 cm | Temporal derecho |
| 24 | 47 | Femenino | Una mácula con dos tonalidades | 0,3 cm | Región mastoidea izquierda |
| 25 | 27 | Masculino | Una lesión con pigmentación leve | 0,5 cm | Cuero cabelludo frontal derecho |
| 26 | 27 | Masculino | Una mácula con pigmentación leve | 1 cm | Cuero cabelludo posterior izquierdo |
| 27 | 62 | Masculino | Una lesión sobreelevada hiperpigmentada | 0,4 cm | Cuero cabelludo |
| 28 | 36 | Masculino | Una mácula hiperpigmentada | 0,3 cm | Cara posterior hélix derecho |
| 29 | 71 | Femenino | Una mácula hiperpigmentada | 0,4 cm | Hélix |
| 30 | 53 | Masculino | Una mácula hiperpigmentada | 0,3 cm | Oreja izquierda |
| Nevos localizados en genitales | |||||
| 31 | 37 | Femenino | Una mácula hiperpigmentada | 0,3 cm | Vulva |
| 32 | 48 | Femenino | Una lesión pigmentada | 0,2 cm | Abdomen (monte de venus) |
| 33 | 34 | Masculino | Una lesión pigmentada | 0,5 cm | Escroto |
| Nevos conjuntivales | |||||
| 34 | 15 | Masculino | Una mácula hiperpigmentada | 0,4 cm | Conjuntiva derecha |
| 35 | 66 | Femenino | Una mácula hiperpigmentada | 0,3 cm | Conjuntiva izquierda |
Características inmunohistoquímicas de los nevos con atipia relacionada con la localización
| Localizaciones del NOSS | Edad(años) | Tamaño(cm) | Expresión de la proteína HMB45 (porcentaje de células positivas) | Expresión de proteína S100(porcentaje de células positivas) | Expresión de la proteína Melan-A(porcentaje de células positivas) | Expresión del índice Ki-67 |
|---|---|---|---|---|---|---|
| NOSS de todas las localizaciones | 39,7±2,1 | 0,5±0,03 | 39,6±4,5 | 94,5±0,3 | 91,1±0,3 | 1,1±0,1 |
| Nevos de cabeza y cuello | 46,6±5,6 | 0,4±0,08 | 30,0±10,0 | 96,5±0,5 | 93,3±1,0 | 1,3±0,3 |
| Nevos acrales | 44,3±2,9 | 0,4±0,06 | 50,5±6,1 | 98±0,4 | 93,1±0,7 | 1,0±0,4 |
| Nevos de Flexuras | 34,6±2,5 | 0,3±0,03 | 37,5±8,6 | 96,2±0,6 | 93,8±0,7 | 1,2±0,2 |
| Nevos en genitales | 35,5±1,5 | 0,3±0,0 | 40,0±10,0 | 98,5±0,5 | 94,5±0,5 | 1,5±0,5 |
| Nevos conjunctivales | 40,5±25,5 | 0,4±0,1 | 20,0±10,0 | 97,5±0,5 | 96±1,0 | 0,5±0,5 |
NOSS: nevos de localizaciones especiales.
En todos los casos revisados se observaron características histológicas alarmantes, como un patrón lentiginoso juntural melanocítico prominente y la presencia de melanocitos névicos ocasionales, de aspecto benigno, ubicados en las zonas medias de la epidermis (acrales y sitios de flexura), un aumento del tamaño, un conglomerado o la cohesión de nidos de melanocitos en la dermis y en la zona de la unión, con una llamativa variabilidad de su tamaño, forma y alineación (NOSS de todas las localizaciones). Los melanocitos névicos presentaban una atipia citológica leve (aumento de tamaño del núcleo, núcleos vesiculares, nucléolos pequeños, citoplasma claro y presencia de un pigmento melánico fino). Dentro de la dermis, se observó una respuesta del huésped en forma de fibroplasia, la presencia de melanófagos y un infiltrado linfocítico leve (nevos genitales y acrales). Los casos más representativos se muestran en las figuras 1-3.
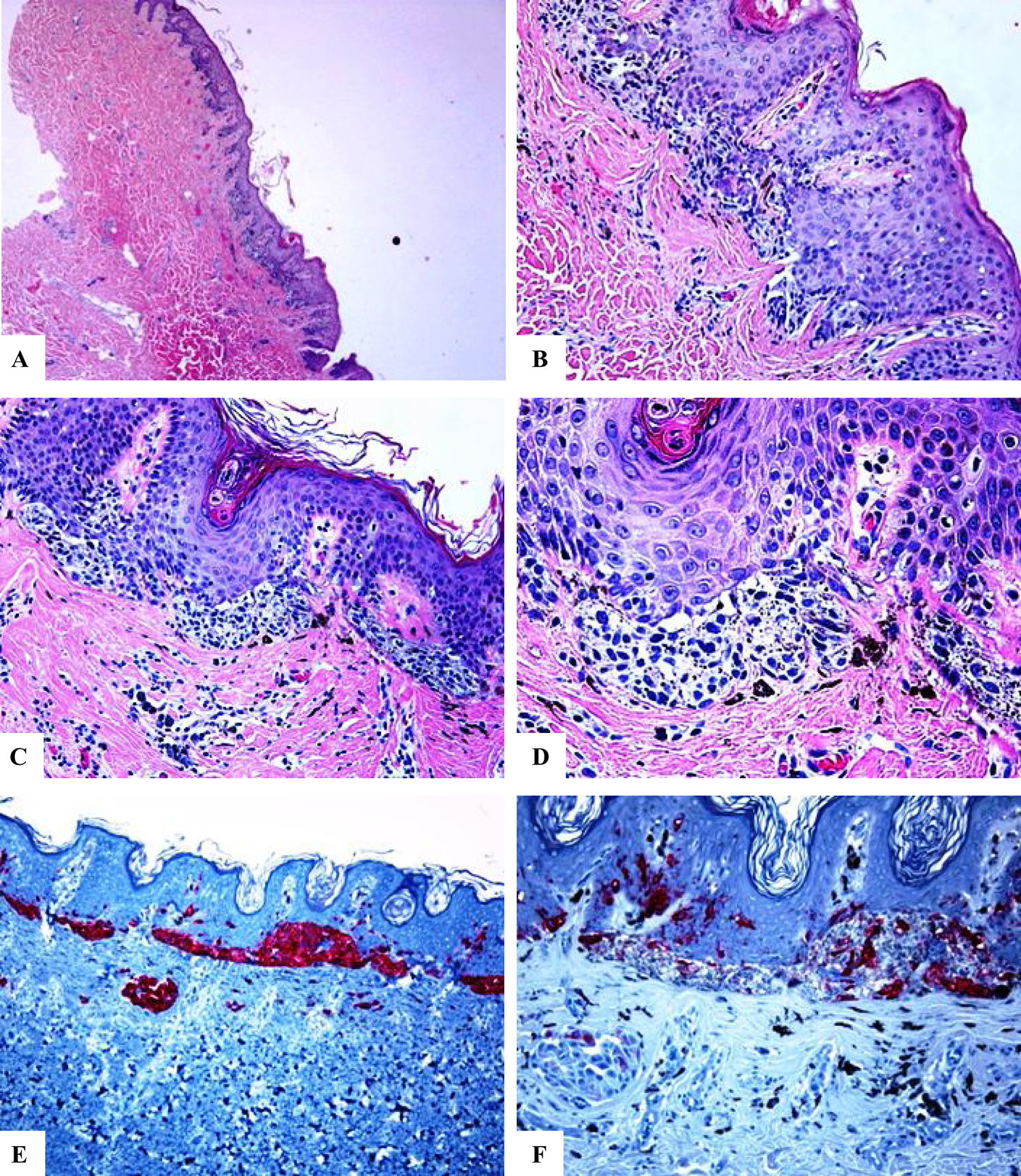
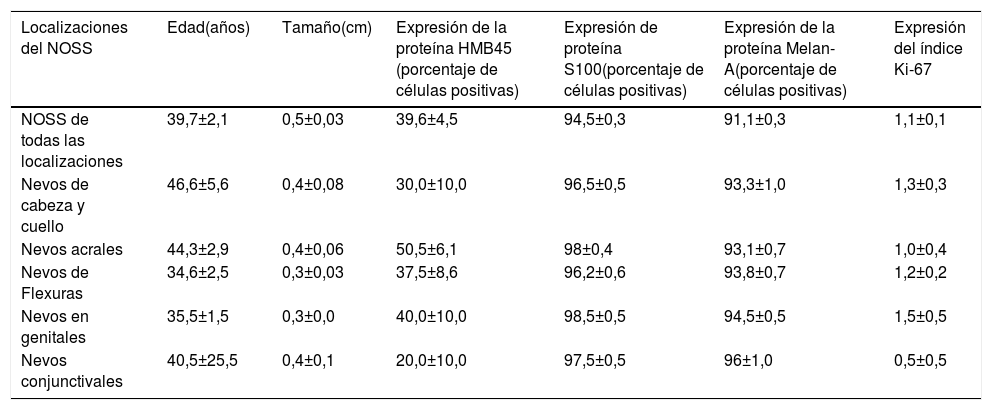
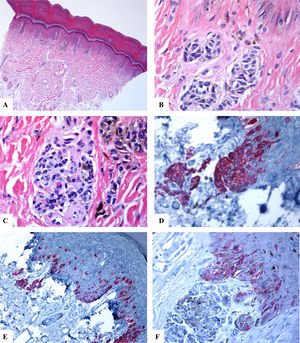
Características inmunohistoquímicas de un nevo melanocítico del área umbilical y con una atipia relacionada con su localización. A-D) Biopsia por afeitado de la piel umbilical que muestra un nevo melanocítico compuesto pequeño, simétrico y bien circunscrito. El crecimiento en el área de la unión revela un patrón lentiginoso y de nidos confluentes horizontalmente. En el interior de la dermis, se observan nidos melanocíticos en maduración, acompañados de fibroplasia y de algunos melanófagos. E) Tinción con melan-A intensa y difusa tanto de los melanocitos névicos localizados en la unión como de los localizados a nivel dérmico. F) Tinción parcheada de HMB45 de los melanocitos lentiginosos y de los nidos localizados a lo largo de la unión dermoepidérmica. En los nidos dérmicos se observan células raras positivas a HMB45. El HMB45 también tiñe para melanocitos solitarios ocasionales de la epidermis Aumento original: A) 20x; B) x200; C) x200; D) x 400; E) x100 y F) 200.
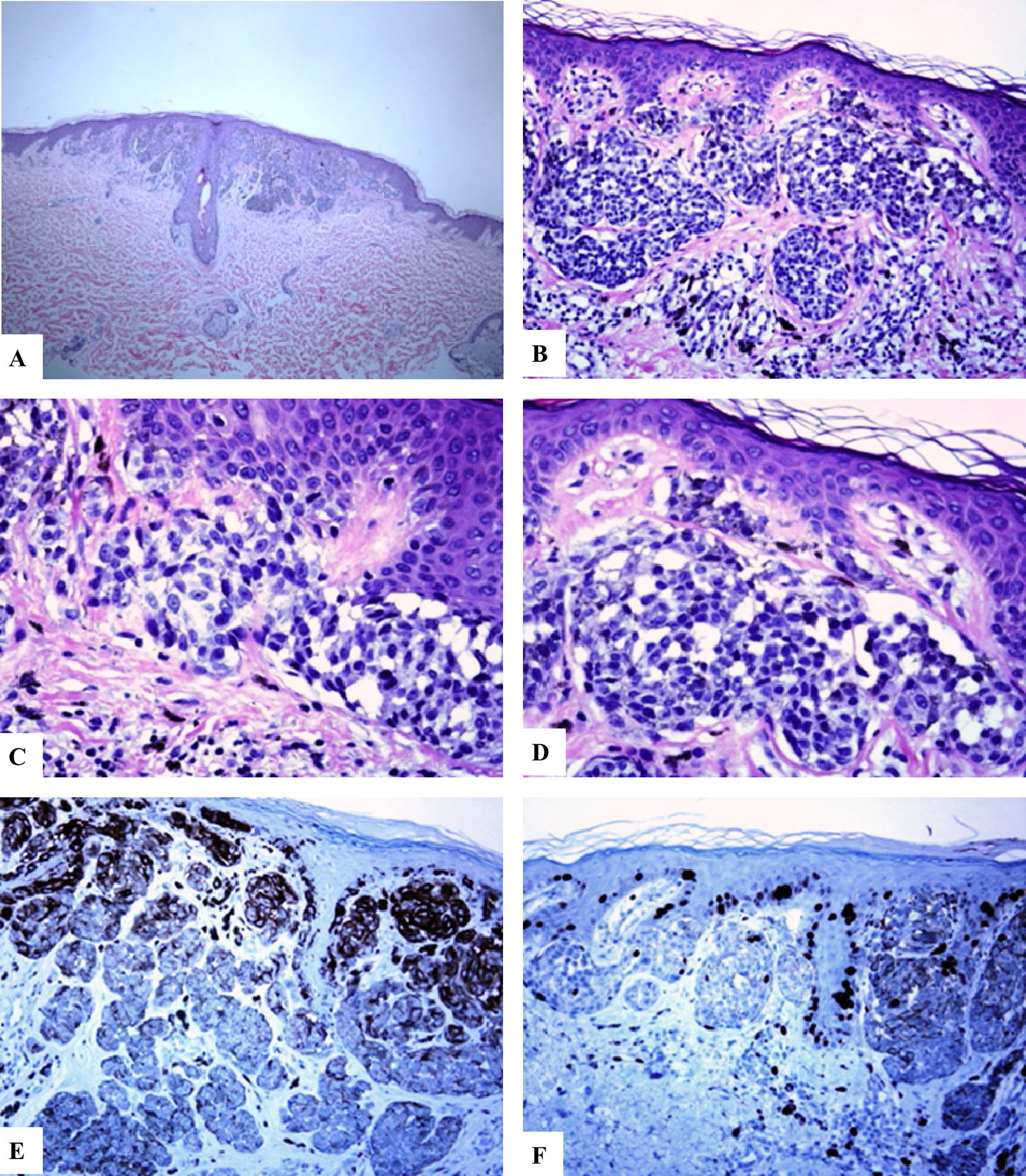
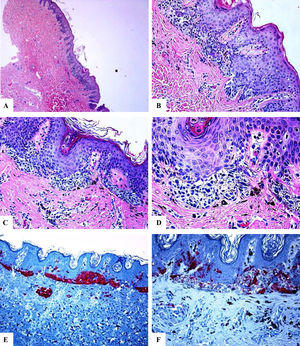
Características inmunohistoquímicas del nevo melanocítico de la línea axilar posterior con atipia relacionada con su localización. A-D) Se observa un nevo melanocítico simétrico compuesto que presenta un patrón predominantemente de nidos y algunos melanocitos névicos solitarios ubicados en la unión dermoepidérmica. Hay nidos de melanocitos que confluyen horizontalmente a nivel de la unión y que maduran siguiendo un gradiente decreciente en la profundidad de la dermis. Los melanocitos son cohesivos, están aumentados en tamaño y tienen un citoplasma claro con presencia de pigmento melánico fino. E) Se observa una reactividad difusa del HMB45 de los melanocitos de la unión, así como en los nidos de la dermis superficial. F) Se observa un Ki-67 positivo tanto de los queratinocitos de la unión como en los melanocitos. Aumento original: A) 20x; B) x100; C) x200; D) x 200; E) x200 y F) 200.
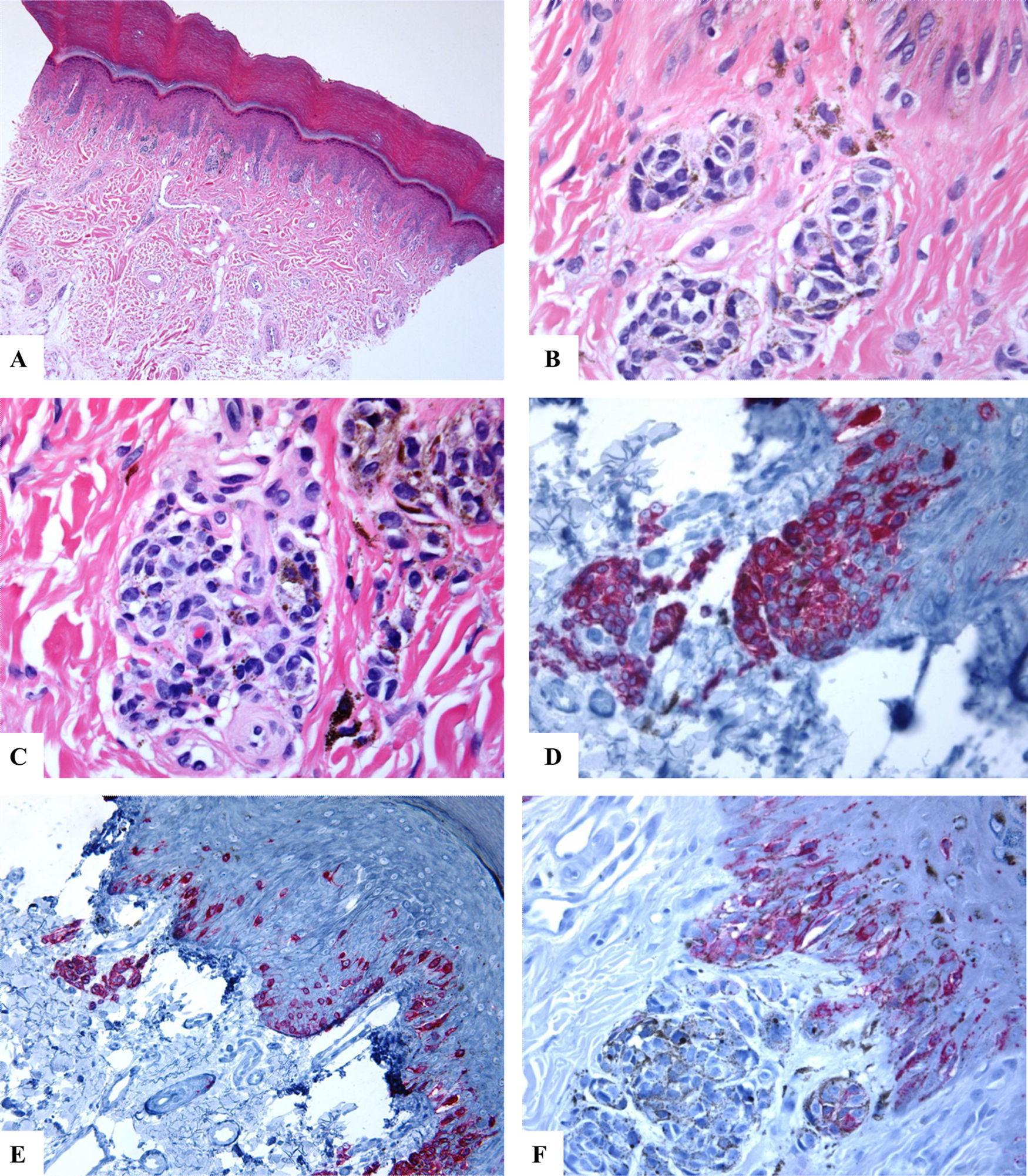
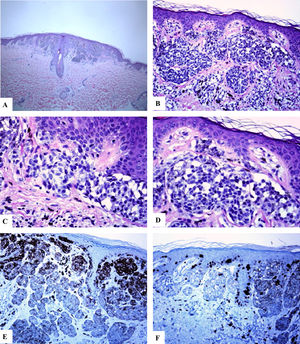
Características inmunohistoquímicas del nevo melanocítico acral del primer dedo del pie derecho (MANIAC). A-C) Las secciones muestran piel acral con un pequeño nevo melanocítico compuesto simétrico y bien delimitado. No hay confluencia de los nidos. Los melanocitos carecen de atipia citológica significativa. Dentro de la dermis hay fibroplasia y escasos melanófagos. D-E) El Melan-A tiñe para los melanocitos de la unión y dérmicos. Se observa un patrón lentiginoso con la extensión pagetoide ascendente de algunos melanocitos (sin atipia citológica) dispuestos como unidades solitarias en la capa espinosa (MANIAC). F) Se observa una tinción parcheada de HMB45 en los melanocitos con patrón lentiginoso a lo largo de la unión dermoepidérmica. El HMB45 también tiñe ocasionalmente melanocitos solitarios localizados en las zonas basales de la epidermis. Casi todos los melanocitos dérmicos carecen de expresión de la proteína HMB45, es decir, se observa una maduración inmunohistoquímica.Aumento original: A) 20x; B) x200; C) x200; D) x 400; E) x200 y F) 400.
En todos los casos revisados, hubo una expresión intensa y difusa de las proteínas S100 y Melan-A en toda la lesión (el porcentaje de células positivas varió entre el 91% y el 95%. La proteína HMB45 se expresó intensamente en el componente de la unión (melanocitos lentiginosos y nidos). Dentro de la dermis, la expresión de la proteína HMB45 seguía una gradiente que iba disminuyendo desde la zona de la unión hacia el área dérmica más profunda, con melanocitos névicos positivos ocasionales en la porción dérmica media y con una pérdida casi completa de la positividad en las porciones dérmicas profundas de los nevos. Esto indica una maduración inmunohistoquímica (característica que habla en favor de la benignidad) de estas lesiones. El valor medio del porcentaje de células positivas para HMB45 fue de 39,6 ± 4,5. Los valores de la expresión de la proteína HMB45 fueron elevados en los nevos acrales y en los de cabeza y cuello. Los valores medios del porcentaje de células positivas para S100 o Melan-A fueron significativamente mayores en comparación con los de la proteína HMB45 (prueba U de Mann-Whitney, p < 0,0001). No hubo una correlación entre los valores de expresión de la proteína HMB45 y las características clínicas de las lesiones (edad y sexo del paciente, o sitio y tamaño de las lesiones). El índice del Ki-67 fue extremadamente bajo en los NOSS (el Ki-67 medio fue de 1,1 ± 0,1, una particularidad que hablaba en favor de la benignidad). Un resumen de estos hallazgos se muestra en la tabla 2 y en las figuras 1-3.
DiscusiónLos NOSS presentan características histológicas sospechosas, por lo que son un desafío diagnóstico para los patólogos en la práctica clínica. Aunque estas especificaciones ya se habían descrito previamente1–5, el perfil inmunofenotípico del NOSS no ha sido completamente caracterizado. Este estudio demuestra diversas observaciones: i) todos los casos de NOSS mostraron algunas características histológicas alarmantes y, por lo tanto, pueden ser fácilmente confundidos con nevos atípicos o incluso con melanomas, ii) todos los casos de NOSS mostraron una expresión intensa de la proteína HMB45 en el componente lentiginoso y en los nidos, y iii) todos los casos de NOSS mostraron una maduración inmunohistoquímica.
Todos los casos de NOSS mostraron algunas características histológicas preocupantesLas características histológicas del NOSS en esta serie coinciden con las de estudios previos1–5. A pesar de presentar cambios morfológicos alarmantes, se observaron especificidades histológicas que hablaban a favor de la benignidad, donde se incluyen la simetría, las lesiones bien circunscriptas, el predominio de nidos sobre el componente lentiginoso, la maduración dérmica y la ausencia de una importante extensión ascendente de los melanocitos o de una actividad mitótica que fuese significativa4,6. En el NOSS, los posibles mecanismos patogénicos que subyacen al desarrollo de las características histológicas alarmantes (nidos grandes, conglomerados, cohesión y la extensión pagetoide intraepidérmica de bajo grado) incluyen los efectos hormonales latentes específicos para cada localización10 (NOSS de la línea mamaria embrionaria o en áreas genitales), traumatismos repetitivos relacionados con el sitio (NOSS de las regiones acrales y de cabeza y cuello), irradiación ultravioleta (UV) relacionada con la localización (NOSS de cabeza y cuello)11, alteración de las interacciones melanocíticas-queratinocíticas10 y algunos cambios mutacionales.
El patrón de nidos cohesivos en el NOSS se puede deber a una regulación negativa o a la pérdida de moléculas de adhesión celular. Los hallazgos histológicos alarmantes observados en el NOSS de cabeza y cuello son el resultado de los efectos de la irradiación UV. En apoyo a esta teoría, la irradiación UV inducirá cambios morfológicos que recordarán al melanoma al acentuar la actividad proliferativa y metabólica de los melanocitos névicos11.
La extensión pagetoide de bajo grado (en nevos acrales y genitales) representa «un mecanismo pasivo pasajero a través de la vía de maduración de los queratinocitos»12,13 o refleja una alteración de la interacción entre melanocitos-queratinocitos10. Los melanocitos localizados en la capa espinosa (melanocitosis pagetoide) pueden ser más evidentes en algunos nevos acrales, también conocidos como nevos melanocíticos acrales con ascenso de células intraepiteliales (MANIAC). Estos nevus se diferencian de los melanomas acrales gracias a varios hallazgos, incluido el hecho de que estos melanocitos con extensión pagetoide carecen de atipia citológica y no se extienden más allá del centro de la lesión. Los MANIAC generalmente son lesiones simétricas, están bien circunscriptas y maduran según descienden en la profundidad por la dermis14,15.
Todos los casos de NOSS mostraron una expresión intensa de la proteína HMB45 a nivel del componente lentiginoso y de los nidosEn el presente estudio, se evidenció una fuerte expresión de la proteína HMB45 en el componente de la unión del NOSS, lo que indica que estos nevos tienen focalmente un fenotipo activado con formación de melanosomas. Los mecanismos subyacentes a este incluyen la liberación de factores de crecimiento melanocíticos16. Este documento también reveló una disminución gradual en la expresión de la proteína HMB45, la cual seguía un gradiente que iba desde la zona de la unión hacia el área más profunda dérmica en el NOSS, es decir, presentando una maduración inmunohistoquímica. La reactividad del HMB-45 puede constatar la presencia o ausencia de la «maduración inmunohistoquímica» de una lesión melanocítica determinada. Los melanocitos de tipo A activados (células epitelioides) de la unión o superficiales expresan HMB45, mientras que los melanocitos de tipo C localizados profundamente (células fusiformes) no expresan este anticuerpo17–19. Según la opinión del autor, un Ki-67 extremadamente bajo, junto con una maduración inmunohistoquímica, son características importantes que favorecen la benignidad de una lesión melanocítica determinada (localizada en los sitios especiales) con características histológicas alarmantes. El patrón decreciente del HMB45 en las zonas profundas, así como la ausencia del Ki-67 en el NOSS, se había descrito en estudios previos, donde se señalaban como clave diagnóstica entre nevo y melanoma20–23.
En conclusión, el diagnóstico de NOSS se debe de tener en cuenta ante cualquier proliferación melanocítica que ocurra en una zona específica (como cabeza y el cuello, línea mamaria embrionaria, en genitales, perineo, conjuntiva y zonas acrales). La expresión de la proteína HMB45 en el NOSS indica que las células melanocíticas névicas tendrán un fenotipo activado. La expresión de la proteína HMB45, siguiendo un gradiente decreciente desde la zona de la unión hacia la parte más profunda dérmica del NOSS es una característica que evidenciará una maduración inmunohistoquímica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.