MPOX es una enfermedad zoonótica emergente que se ha propagado rápidamente por todo el mundo y que ha sido declarada por la OMS como una emergencia de salud pública de interés internacional. Esta es una revisión no sistemática de los aspectos clínicos, epidemiológicos, diagnósticos y terapéuticos más relevantes para el dermatólogo. En el brote actual, la transmisión durante las relaciones sexuales es la principal forma de contagio como resultado del contacto físico cercano. Si bien los casos iniciales se informaron en hombres que tienen sexo con hombres, cualquier persona en contacto cercano con personas o fómites infectados está en riesgo. El pródromo clásico puede ser subclínico y la erupción puede ser sutil. Las complicaciones son frecuentes, pero el requerimiento de hospitalización es infrecuente. El diagnóstico definitivo se realiza mediante PCR de las lesiones mucocutáneas. Actualmente no existen tratamientos específicos, y el tratamiento sintomático es el pilar terapéutico.
Mpox is an emerging zoonotic disease that has spread rapidly around the world. It has been declared a public health emergency of international concern by the World Health Organization. This review is an update for dermatologists on the epidemiology, clinical presentation, diagnosis, and treatment of Mpox. The primary mode of transmission in the current outbreak is close physical contact during sexual activity. Although most of the initial cases were reported in men who have sex with men, anyone who has close contact with an infected person or contaminated fomites is at risk. Classic prodromal features of Mpox include subclinical manifestations and a mild rash. Complications are common but rarely require hospitalization. Polymerase chain reaction analysis of mucocutaneous lesions is the test of choice for a definitive diagnosis. In the absence of specific treatments, management focuses on symptomatic relief.
La MPOX está causada por un ortopoxvirus1 que pertenece al mismo género que el virus Variola (agente causante de la viruela) y el virus Vaccinia (el virus utilizado en la vacuna contra la viruela)2. Tras la erradicación de la viruela, la MPOX se ha convertido en el ortopoxvirus más significativo y patógeno de los humanos.
Historia y epidemiologíaLa MPOX se aisló por primera vez en Dinamarca en una colonia de monos Cynomolgus enviados desde un laboratorio de Singapur y utilizados para la investigación del virus de la poliomielitis1. En 1970 se identificó por primera vez como una causa de enfermedad en humanos en la República Democrática del Congo (RDC) durante una intensa vigilancia en esa área para garantizar la erradicación de la viruela3. Estos estudios revelaron que la vacuna contra la viruela brindaba una protección del 85% contra la MPOX4.
Desde entonces se han observado casos de MPOX en África central y occidental, donde es endémica. Se han identificado y secuenciado dos clados: el de la Cuenca del Congo (clado1) y el de África Occidental (clado2), y muchas cepas de MPOX5,6.
El aumento de casos de MPOX en África desde 2016 ha sido particularmente significativo en RDC, Nigeria, República Centroafricana, Liberia y Sierra Leona7. El mayor brote anterior de MPOX en humanos fuera de la RDC se produjo en Nigeria en 2017-20186.
Los primeros casos de MPOX en humanos fuera de África fueron 47 casos, confirmados o probables, entre mayo y junio de 2003 en varios estados de Estados Unidos8. La mayoría de casos fueron por transmisión zoonótica, por contacto con perros de las praderas infectados. No se documentó transmisión de persona a persona y se consideró probable la infección por contacto indirecto9.
En febrero de 2022, Bunge et al.10 publicaron una revisión sistemática sobre la epidemiología cambiante de la MPOX en humanos que ilustra dramáticamente el aumento progresivo del número de casos11-13.
El 7 de mayo de este mismo año se confirmó un caso de MPOX en Inglaterra en un ciudadano del Reino Unido que había viajado desde Nigeria14. El brote se expandió rápidamente. En los días siguientes, varios países de la Unión Europea informaron casos no vinculados a países endémicos15.
El 23 de julio, la OMS declaró este brote de MPOX una emergencia de salud pública de interés internacional16.
Vía de transmisión y contagioComo enfermedad zoonótica, la MPOX se adquiere a través del contacto con un animal infectado (fluidos corporales, mordeduras o ingesta de carne de animales silvestres)17. El reservorio se desconoce, pero es probable que sean roedores18. Las partículas virales pueden penetrar a través de la piel lesionada, las vías respiratorias y las superficies mucosas (p.ej., boca, nariz, vagina, ano, conjuntiva)19,20. En África, se han encontrado pruebas de infección por MPOX en muchos tipos de animales (ardillas, ratas, lirones africanos y monos), que, como los humanos, son huéspedes incidentales.
La transmisión de persona a persona del virus de la MPOX puede ocurrir de varias maneras19,20:
- •
Contacto directo: a través del contacto con heridas, costras o fluidos corporales infecciosos, facilitado por microabrasiones en las mucosas.
- •
Contacto indirecto a través de fómites.
- •
Secreciones respiratorias: a través de microgotas, en contexto de contacto estrecho prolongado.
- •
Transmisión vertical: el virus puede cruzar la barrera placentaria, dando lugar a MPOX congénita.
Según la vía de entrada, las infecciones causadas por ortopoxvirus se pueden clasificar como sistémicas o localizadas20-22. La enfermedad generalizada tras una infección por vía respiratoria generalmente se manifiesta como una erupción difusa, expresión de la viremia y extensión a órganos internos del virus. Por el contrario, tras la inoculación subcutánea puede aparecer un exantema localizado en el sitio de entrada del virus, con afectación del sistema linfático regional y seguido o no de unas pocas lesiones diseminadas.
Hasta el brote de 2022, la transmisión fuera del ambiente familiar y la propagación sostenida de persona a persona habían sido excepcionales. En cambio, en el brote iniciado en 2022 la vía de transmisión sospechada fue el contacto sexual en el 95% de los pacientes23. El 23-26% de los pacientes tenía una pareja sexual habitual con MPOX23-25, mientras que el 1-3% tuvo un contacto doméstico con MPOX24,26 y solamente el 1% tuvo un contacto profesional (sanitario)24. En la mayoría de los casos fue difícil realizar un estudio de contactos completo o detectar la persona que les transmitió la infección.
Se ha detectado ADN de MPOX en muestras de saliva, recto, nasofaringe, semen, orina y heces, revelando un potencial papel importante de los fluidos corporales en la transmisión27.
Un estudio evaluó la carga viral en diferentes localizaciones, siendo mayor en los frotis de lesión cutánea que en los faríngeos26, lo que sugiere que el contacto directo es la ruta de transmisión dominante en este brote, siendo la transmisión respiratoria menos relevante. Se han descrito escasos pacientes con posible infección asintomática28. De hecho, no ha podido confirmarse si estaban completamente asintomáticos o bien se trataba de pacientes paucisintomáticos.
Se considera que una persona es infecciosa desde el inicio de la clínica hasta que todas las lesiones se han reepitelizado. Todo el proceso puede durar de 2 a 4semanas o más. Se ha demostrado positividad persistente (>3semanas) mediante PCR en sangre y tracto respiratorio superior29, pero no está claro el significado en cuanto a infectividad de estos hallazgos, y basándonos en la detección de virus competentes para la replicación de algunos estudios30-31, este tiempo podría reducirse.
Manifestaciones clínicasForma endérmicaPoblación afectadaHistóricamente, las personas más afectadas han sido los niños. Además, a medida que se describieron más pacientes con MPOX en la RDC en la década de 1980, se observó que los pacientes vacunados frente a la viruela presentaban una erupción cutánea más leve, linfadenopatías menos evidentes y sin fallecimientos asociados32,33.
ClínicaEl tiempo de incubación, que oscila entre 5 y 13días (rango 4-21días)9, podría ser más corto en personas con antecedentes de exposición invasiva (mordeduras o arañazos de animales) respecto a aquellas con contacto no invasivo (táctil)9.
La MPOX ha causado tradicionalmente una enfermedad sistémica, que puede dividirse en dos fases: período de invasión y erupción cutánea34.
Período de invasión. En áreas endémicas, con una vía de transmisión predominantemente respiratoria, dura de 0 a 5días. Los síntomas sistémicos son comunes y pueden ocurrir antes de que aparezca la erupción (etapa prodrómica) o poco después (etapa clínica temprana)6,17,18,20:
- •
Fiebre (88%).
- •
Cefalea intensa (79%).
- •
Linfadenopatía (69%):
- ∘
Inguinal y cervical.
- ∘
Rasgo distintivo en comparación con otras enfermedades (varicela, sarampión, viruela).
- •
Mialgias (63%).
- •
Odinofagia (58%).
- •
Astenia intensa.
Erupción cutánea. Por lo general, comienza dentro de 1-3 días después de la fiebre35. En áreas endémicas la erupción tiende a afectar:
- •
Cara (96%).
- •
Piernas (91%).
- •
Tronco (80%).
- •
Brazos (79%).
- •
Palmas (69%).
- •
Genitales (68%).
- •
Plantas (64%).
El número de lesiones varía de unas pocas a miles32, aunque el recuento medio de lesiones en el momento de presentación del paciente se estimó en 3706.
Secuelas, gravedad y letalidadA nivel analítico, se pueden observar múltiples hallazgos inespecíficos, que incluyen: aminotransferasas anormales, leucocitosis, trombocitopenia e hipoalbuminemia33.
Los casos graves de MPOX son más comunes entre los niños y están relacionados con:
- •
El grado de exposición al virus.
- •
El estado de salud del paciente.
- •
Las complicaciones.
- •
El acceso a una atención sanitaria de calidad.
No disponemos de muchos datos sobre la gravedad de la enfermedad en pacientes inmunocomprometidos. En brotes previos se ha documentado un mayor riesgo de enfermedad grave, con más lesiones y más larga en pacientes con infección por VIH avanzada33.
Las complicaciones más frecuentes son el dolor, la ulceración y la sobreinfección bacteriana. Además, se ha descrito afectación de distintos órganos (meningoencefalitis, miocarditis, bronconeumonía, fallo renal…). La afectación neurológica y la sepsis por sobreinfección bacteriana son las complicaciones con mayor letalidad asociada19. De forma similar a la viruela, las secuelas más comunes de la MPOX son las cicatrices cutáneas.
Históricamente, la tasa de letalidad en África ha sido del 1-10% (según el clado), aunque más recientemente esta cifra ha disminuido (3-6%)19.
Características clínicas durante el brote de 2022Desde el comienzo del brote de 2022 se han publicado varias series de pacientes23-26,36,37. Los datos de todos los trabajos son muy similares y coinciden en rasgos que lo diferencian de los brotes anteriores. Se ha calculado que el período medio de incubación de 6-9días (rango 4-10)24,26,38,39.
Población afectadaEl brote actual afecta predominantemente a hombres, con una mediana de edad de 38años, que se definen como hombres que tienen sexo con hombres (HSH). Sin embargo, hay que tener en cuenta que el modo de transmisión comunitaria de la infección puede cambiar. El porcentaje de pacientes con coinfección por VIH es muy alto (generalmente bien controlados), y entre los que son VIH negativos, el porcentaje de pacientes que toman profilaxis preexposición (PrEP) también es alto23-26,36,37.
Un alto porcentaje de pacientes presenta factores de riesgo para infecciones de trasmisión sexual (ITS), y en los pacientes en los que se realizó cribado de ITS, más de la mitad fueron positivos para alguna ITS24,25.
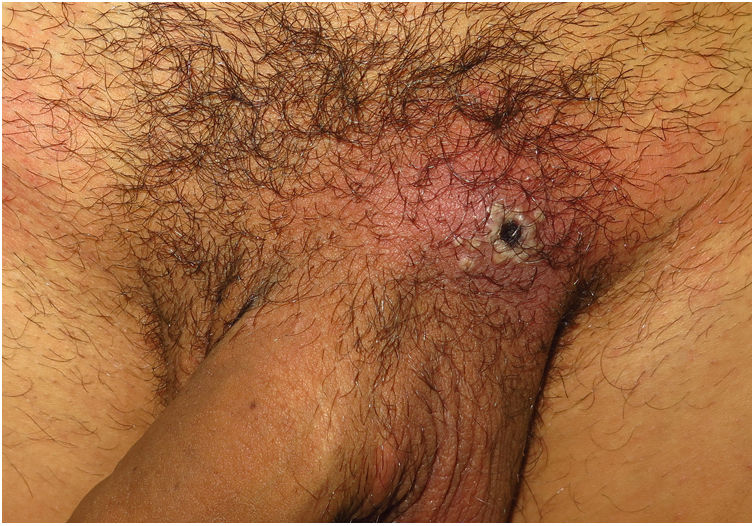
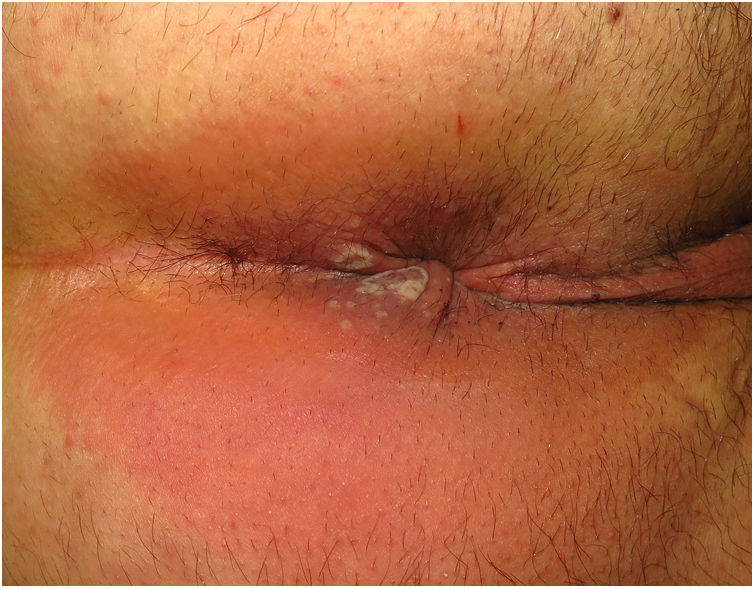
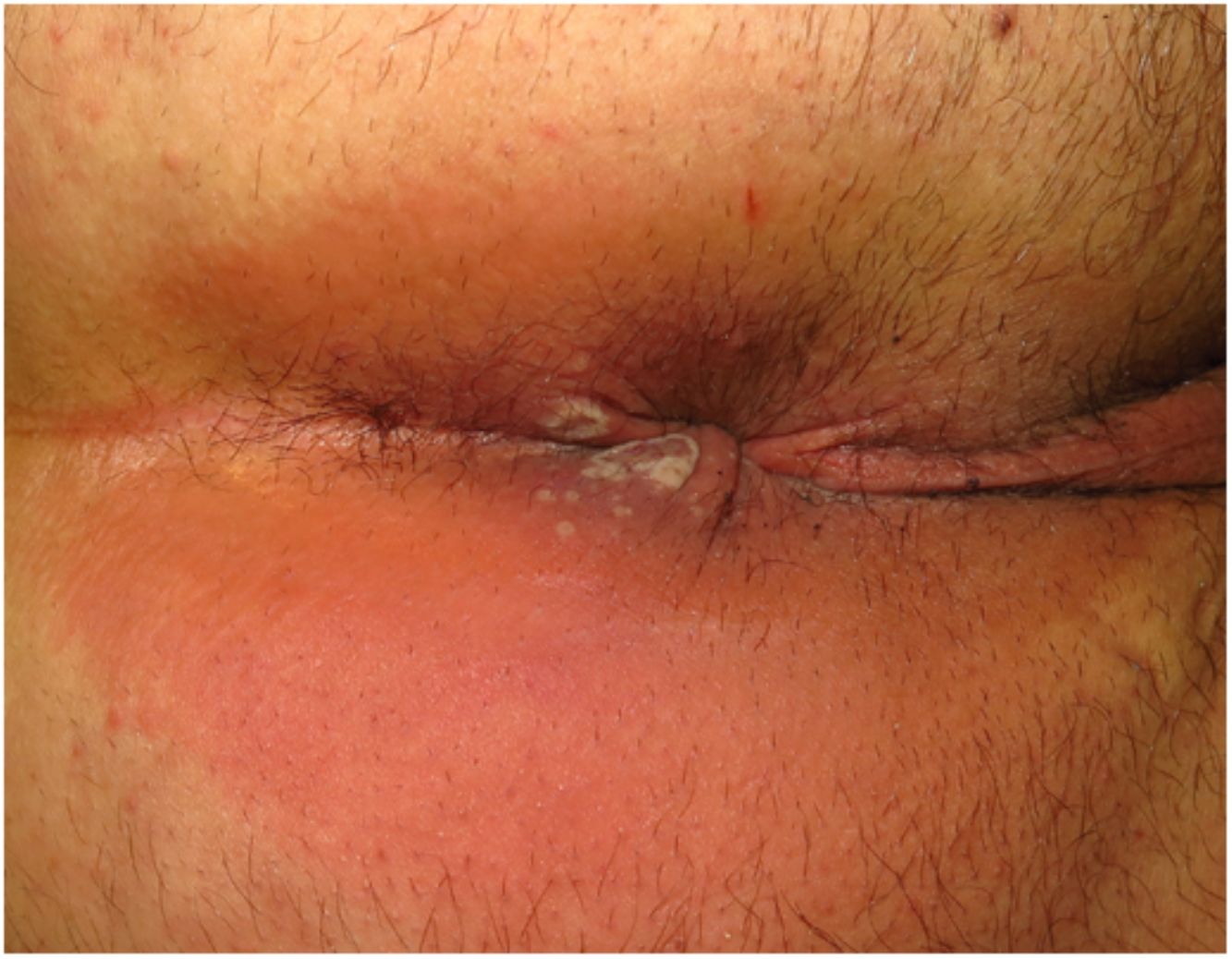
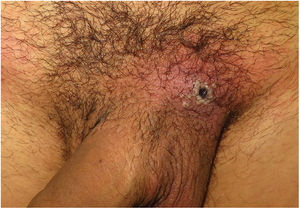
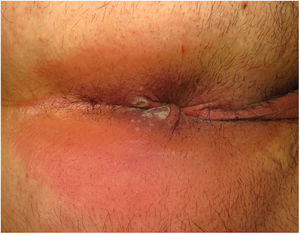
ClínicaLas lesiones primarias en las zonas de inoculación son habitualmente pseudopústulas (pápulas sólidas que simulan pústulas en las que es imposible raspar el techo y obtener pus) similares a otros poxvirus (Orf o molluscum) (fig. 1)24. Descripciones histológicas confirman estos hallazgos40. La mayoría de los pacientes presentan las lesiones de inoculación en genitales, zona perianal (fig. 2) o facial, con variabilidad en el número24 (tabla 1). Estas lesiones suelen estar bien circunscritas, suelen ser profundas, a menudo desarrollan umbilicación, se describen como dolorosas y tardan semanas en curarse por completo. En algunos casos tienen tendencia a coalescer o a necrosarse, por lo que pueden evolucionar a lesiones ulceradas. Suelen ir acompañadas de linfadenopatía regional y edema circundante, que en algunos casos puede ser muy intenso.
Resumen de las características más importantes de las series de casos publicadas en el brote de 2022
| Estudio | N Engl J Med.Thornhill et al.23 | BMJ.Patel et al.25 | Lancet.Tarín-Vicente et al.26 | Br J Dermatol.Català et al.24 | Clin Microbiol Infect.Mailhe et al.37 |
|---|---|---|---|---|---|
| n | 528 | 197 | 181 | 185 | 264 |
| Género | Masculino >99%Trans <1% | Masculino 100%Femenino 0% | Masculino 97%Femenino 3% | Masculino 100%Femenino 0% | Masculino 99%Femenino 1%Trans 1% |
| Edad media (años) | 38 | 38 | 37 | 38,7 | 35 |
| Orientación sexual | HSH o 99%BisexHTX 1% | HSH o>99%Bisex | HSH o 92%BisexHTX 8% | HSH o 99%BisexHTX 1% | HSH 95% |
| HIV | 41%CV <50 cop/ml 95%Tratamiento TAR 96% | 35,9%CV <50 cop/ml 78,6%Tratamiento TAR 91,4% | 40%CD4 >500 cells/μl 89%Tratamiento TAR 99% | 42%CV <50 cop/ml 92% | 29% |
| Si HIV(−)Usuario PrEP | 57% | − | − | 77% | 71% |
| Historia de vacunación frente a la viruela | 9% | − | 18% | 11% | 12% |
| Lesiones cutáneas, n | <5 39%5-10 25%11-20 21%> 20 11% | 1 11,2%2-10 51,8%11-50 18,3%51-100 0%≥ 100 4,1% | 1-2 12%3-20 80%> 20 8% | 1 11%2-25 82%26-100 6%> 100 1% | Media 5[rango 3-10] |
| Manifestaciones extracutáneas | |||||
| Linfadenopatía | 56% | 57,9% (mayoritariamente inguinal o cervical) | 85% (mayoritariamente inguinal o cervical) | 56% | 69% |
| Fiebre | 62% | 61,9% | 72% | 54% | 68% |
| Astenia | 41% | 23,4% | 81% | 44% | - |
| Mialgia | 31% | 31,5% | 44% | - | |
| Cefalea | 27% | 24,8% | 53% | 32% | 35% |
| Odinofagia | 21% | 16,8% | 36% | 18% | 20% |
Entre otras formas de presentación, destacan las pseudopústulas periorales, lesiones en la lengua —que suelen ser pápulas blancas con una depresión central— o lesiones ulceradas de la mucosa oral o de los labios. También se han observado lesiones primarias solitarias en los dedos formando un panadizo24.
Tras esta primera fase puede aparecer una erupción secundaria con lesiones que evolucionan de mácula a vesícula, pústula y costra (no necesariamente de forma simultánea). Estas otras lesiones se describen como pruriginosas y tardan días en resolverse. Se localizan en la cara, el cuero cabelludo, los brazos, las piernas, las palmas, las plantas y el tronco. Aunque las manifestaciones extracutáneas son muy frecuentes24-26,36,37 y generalmente aparecen junto con los síntomas cutáneos, solamente el 36% de los pacientes presentan pródromos previos a la aparición de las lesiones cutáneas24. Entre el 6 y el 13,7% de los pacientes presentan una erupción morbiliforme maculopapular24,25 que puede deberse a un fenómeno inmunológico análogo al de otras infecciones virales (p.ej., EBV, CMV, COVID), aunque, según el contexto, deben descartarse otras posibilidades, como una toxicodermia o una sífilis secundaria.
Complicaciones mucocutáneas, gravedad y letalidadPara la mayoría de las personas la MPOX es una enfermedad leve que se autolimita entre 1 y 4semanas. Sin embargo, algunos pacientes pueden desarrollar complicaciones o enfermedades graves.
Proctitis. El 14-36% de los pacientes presentan dolor anorrectal, tenesmo, estreñimiento, secreción purulenta o sangrado23-26,36,37, asociado o no a lesiones visibles en la zona perianal. Suelen tener antecedentes de sexo anal-receptivo y presentan con mayor frecuencia pródromos sistémicos26. No se recomienda realizar proctoscopia, dado el intenso dolor asociado. Si se sospecha perforación rectal (dolor intenso o signos de sepsis) es preferible realizar una resonancia magnética25. Siempre debemos realizar el diagnóstico diferencial con otras causas de proctitis.
Faringoamigdalitis ulcerosa. Del 10 al 21% de los pacientes presentan odinofagia y disfagia22-26,36,37. Se asocia a placas ulcerativas en las amígdalas palatinas o la faringe poco específicas y generalmente a adenopatías cervicales dolorosas. En pacientes en áreas con altas tasas de transmisión o con factores de riesgo epidemiológico y prueba rápida de StrepA negativa debe descartarse esta posibilidad26.
Edema genital. La presencia de lesiones en el pene, especialmente en el glande, el prepucio y el meato urinario, puede asociarse a edema en glande y prepucio que puede resultar en parafimosis (8-16% de los casos informados)22-26,36,37. Puede requerir evaluación urológica.
Sobreinfección bacteriana grave. El edema progresivo, el dolor y el empeoramiento de las lesiones ulceradas pueden indicar una infección bacteriana secundaria que puede requerir ingreso y tratamiento intravenoso25. En el brote de 2022 se ha descrito esta complicación en el 3-4% de los casos22-26,36,37. Se recomienda tomar una muestra para cultivo y antibiograma, ya que se han detectado casos de bacterias multirresistentes25.
Compromiso ocular. Se han descrito casos41 de afectación ocular en forma de conjuntivitis, blefaritis, presencia de pápulas en párpados, úlceras corneales, edema de párpado y/o celulitis periorbitaria. En concreto, la afectación corneal puede comprometer la visión y requiere una respuesta rápida para la que es imprescindible un manejo multidisciplinar con oftalmología.
Durante el brote de 2022 se han informado de pocas hospitalizaciones (1-13% de casos informados). La necesidad de tratamiento intravenoso para un mayor control del dolor ha sido el motivo de la mayoría de estos ingresos. Otros motivos fueron el manejo de complicaciones (infecciones secundarias, edema peneano, disfagia, encefalitis, afección ocular, miocarditis) o realizar un correcto aislamiento del paciente22-26,36,37. La mortalidad en los países occidentales ha sido muy baja respecto a los brotes africanos, siendo <0,1% de los casos reporados42.
Al igual que en el brote de 2003 en Estados Unidos33, la vacunación previa contra la viruela no se ha asociado con la gravedad de los síntomas22-26. Tampoco se ha observado una diferencia en cuanto a gravedad entre los pacientes con o sin infección por VIH. Es importante destacar que la mayoría de los pacientes con coinfección por VIH descritos en este brote estaban recibiendo una terapia antirretroviral eficaz y son una población bien controlada, a diferencia de otros casos publicados en pacientes con VIH en estadio avanzado33,43.
DiagnósticoEl diagnóstico de MPOX tiene en cuenta hallazgos epidemiológicos, clínicos y de laboratorio. El European Centre for Disease Prevention and Control (ECDC) ha propuesto las definiciones de caso que se describen en la tabla 244.
Criterios de caso sospechoso, probable y confirmado según los criterios de la ECDC40
| Caso sospechoso |
| a) Una persona que es contactoa de un caso probable o confirmado de MPOX en los 21 días anteriores al inicio de signos o síntomas, y que presenta cualquiera de los siguientes: inicio agudo de fiebre (>38,5°C), cefalea, mialgia, dolor de espalda o asteniaOb) Una persona que presenta desde el 1 de enero de 2022 una erupción cutánea aguda inexplicable, lesiones en las mucosas o linfadenopatía/s. La erupción cutánea puede incluir lesiones únicas o múltiples en la región anogenital o en cualquier otra parte del cuerpo. Las lesiones de la mucosa pueden incluir lesiones orales únicas o múltiples conjuntivales, uretrales, peneanas, vaginales o anorrectales. Las lesiones anorrectales también pueden manifestarse como proctitis, dolor y/o sangradoY se han descartado otras causas: varicela zoster, herpes zoster, sarampión, herpes simple, infecciones bacterianas de la piel, infección gonocócica diseminada, sífilis primaria o secundaria, chancroide, linfogranuloma venéreo, granuloma inguinal, molusco contagioso, reacción alérgica y cualquier otra causa común localmente relevante de erupción papular o vesicular |
| Caso probable |
| Una persona que presenta una erupción cutánea aguda inexplicable, lesiones en las mucosas o linfadenopatía/s. La erupción cutánea puede incluir lesiones únicas o múltiples en la región anogenital o en otra parte del cuerpo. Las lesiones de la mucosa pueden incluir una o múltiples lesiones orales, conjuntivales, uretrales, peneanas, vaginales o anorrectales. Las lesiones anorrectales también pueden manifestarse como proctitis, dolor y/o sangrado.YUno o más de los siguientes:1. Tiene un nexo epidemiológicoa con un caso probable o confirmado de MPOX en los 21 días antes del inicio de los síntomas2. Se identifica como gay, bisexual u otro hombre que tiene sexo con hombres3. Ha tenido parejas sexuales múltiples y/o ocasionales en los 21 días anteriores al inicio de los síntomas4. Tiene niveles detectables de anticuerpos IgM contra el ortopoxvirus (OPXV)b (durante el período de 4 a 56 días después del inicio de la erupción); o un aumento de cuatro veces en el título de anticuerpos IgG basado en las muestras agudas (hasta el día 5-7) y convalecientes (día 21 en adelante); en ausencia de una vacunación frente a la viruela reciente u otra exposición conocida a OPXV5. Tiene un resultado positivo en la prueba de infección por ortopoxvirus (p. ej., PCR específica para OPXV sin PCR o secuenciación específica para MPOX)c |
| Caso confirmado |
| Una persona con una infección de MPOX confirmada por laboratorio mediante la detección de secuencias únicas de ADN viral por reacción en cadena de la polimerasa en tiempo real (PCR)c y/o secuenciación |
La persona ha estado expuesta a un caso probable o confirmado de MPOX. Un contacto se define como una persona que ha estado expuesta a una persona infectada durante el período de infección (desde el inicio de la clínica hasta la reepiteliación de todas las lesiones) y que ha tenido una o más de las siguientes exposiciones con un caso probable o confirmado de MPOX: a)contacto directo piel con piel o piel con mucosa (tocar, abrazos, besos, contacto íntimo o sexual); b)contacto con materiales contaminados tales como ropa o ropa de cama, incluido el material que se haya desprendido de la ropa; c)exposición respiratoria cara a cara prolongada y próxima; d)exposición respiratoria (es decir, posible inhalación de material (p.ej., costras) de una persona infectada; e)también aplica a los trabajadores de la salud potencialmente expuestos en ausencia del uso adecuado del equipo de protección personal adecuado (EPI).
La serología se puede utilizar para la clasificación retrospectiva de un caso probable en circunstancias específicas (p.ej., imposibilidad de realizar PCR de muestras de lesiones cutáneas o en el contexto de una investigación). La prueba diagnóstica primaria para el diagnóstico de la MPOX es la PCR del material de la lesión cutánea u otra muestra, como una muestra oral o hisopado nasofaríngeo, según corresponda. La serología no debe utilizarse como prueba diagnóstica de primera línea.
Dentro del diagnóstico diferencial se deben considerar: varicela, infección por herpes zóster, sarampión, zika, dengue, chikingunya, herpes simple, impétigo, MARSA, gonorrea diseminada o localizada, sífilis primaria o secundaria, chancroide, linfogranuloma venéreo, molusco contagioso.
Los pacientes que cumplan los criterios de caso sospechoso o probable deben someterse a una prueba de PCR específica para el virus de la MPOX o para ortopoxvirus, que luego se confirma mediante secuenciación. Si es negativa, estos pacientes deben ser excluidos.
La secuenciación de los genomas recogidos en España indica que pertenecen al clado de África occidental y son casi idénticos a otros genomas subidos desde otros países europeos45.
Aislamiento, cuarentena y estudio de contactosLos pacientes sometidos a PCR diagnóstica deben permanecer aislados hasta su resultado. El aislamiento de contacto y respiratorio debe mantenerse durante todo el período infeccioso. Aunque el aislamiento respiratorio se realiza de forma empírica, algunos autores26 han especulado que el grado de viremia seguido de la inoculación del virus es de bajo grado o nulo, lo que resultaría en una replicación mínima en el tracto respiratorio y poca o ninguna transmisión a través de las gotas respiratorias.
La MPOX es una enfermedad de declaración obligatoria. Realizar un estudio de contactos, aunque incompleto, puede contribuir a reducir la transmisión46. La cuarentena de contactos asintomáticos tras la exposición a un caso de MPOX debe valorarse individualmente.
La información sobre la transmisión del brote MPOX2022 está evolucionando rápidamente. Se desconoce si el ADN viral detectado en muestras de personas asintomáticas es competente para la replicación. Sin embargo, un trabajo israelí47 destacó la fuerte correlación de los valores del ciclo de cuantificación (Cq) de MPOX con la infectividad del virus y definieron un umbral (Cq?≥?35; ADN viral ?≤?4.300?copias/ml) que predecía especímenes poco infecciosos o no infecciosos.
TratamientoHoy en día no existen tratamientos específicos aprobados por la FDA ni la EMA para los pacientes con MPOX. El tratamiento sintomático es, por tanto, el pilar de la terapia15:
- •
Antitérmicos.
- •
Medicamentos antiinflamatorios no esteroideos (AINE).
- •
Corticoides tópicos o sistémicos en casos de inflamación importante.
- •
Analgésicos para atenuar el dolor.
- •
Un microambiente limpio y húmedo cubriendo las úlceras infecciosas puede mitigar el potencial de transmisión y promover la reepitelización del exantema.
- •
Las infecciones bacterianas secundarias deben ser tratadas con los antibióticos apropiados.
Se pueden prescribir medicamentos antivirales aprobados para la viruela a las personas con MPOX:
- •
Tecovirimat es el único fármaco antiviral con indicación para el tratamiento de infecciones por ortopoxvirus, incluido MPOX, autorizado por la EMA.
- •
Brincidofovir no está autorizado en la Unión Europea pero ha sido autorizado por la FDA para el tratamiento de MPOX.
- •
El cidofovir es activo in vitro para la viruela, pero la nefrotoxicidad asociada a su uso sistémico lo hace inadecuado como tratamiento de primera elección. Sin embargo, su uso tópico off-label sí parece tener efecto, reduciendo el tiempo de resolución de las lesiones y mejorando su resultado cosmético48.
Se deben considerar los riesgos y los beneficios de iniciar un tratamiento específico y seguir las guías locales49.
VacunasLa vacunación contra la viruela puede conferir protección cruzada contra la MPOX, que se ha estimado de hasta el 85%4. Este efecto protector disminuye con el tiempo (>20años), aunque parece que podría producirse una protección de por vida contra la enfermedad grave gracias a las célulasB yT de memoria50.
La vacunación temprana, dentro de los cuatro días posteriores a la exposición a un caso de MPOX, con la vacuna contra la viruela (uso off-label) puede prevenir la enfermedad o reducir su gravedad50.
Se autorizó el uso de una vacuna no replicante de tercera generación (Imvanex™-Vaccinia Ankara modificada) contra la viruela, y se ha recomendado a las personas en riesgo51,52:
- •
Personas con prácticas sexuales de alto riesgo, principalmente pero no exclusivamente HSH en PrEP o con infección por VIH, o bien:
- •
Personas con riesgo laboral, como personal sanitario en consultas especializadas en ITS/VIH y personal de laboratorio que manipule muestras potencialmente contaminadas con MPOX o personal que se encargue de la limpieza de las superficies en consultas específicas.
Las vacunas contra la viruela de generaciones anteriores (Dryvax™ y ACAM2000™) ya no están autorizadas en la Unión Europea por sus efectos secundarios.
El régimen estándar implica una inyección subcutánea de 0,5ml (dos dosis con 28días de diferencia). En el contexto de escasez de vacunas y demanda mundial, la EMA aprobó el 19 de agosto de 2022 un régimen intradérmico alternativo de 0,1ml (dos dosis con 28días de diferencia)53.
ConclusionesLa MPOX es una enfermedad zoonótica emergente que se ha propagado rápidamente por todo el mundo. Existe la preocupación de que la propagación continua favorecerá nuevas zonas endémicas.
Durante el brote de 2022, el contacto sexual es la principal vía de transmisión. Si bien los casos iniciales se han informado principalmente en HSH, cualquier persona en contacto con personas, animales infectados o fómites contaminados tiene riesgo de desarrollar la enfermedad en los siguientes 21días.
Los pródromos sistémicos pueden ser subclínicos y la erupción puede aparecer inicialmente en las regiones genital o anal y puede ser sutil. Las pseudopústulas típicas y la linfadenopatía son características útiles para distinguirlas de otras enfermedades.
Las complicaciones locales son frecuentes, aunque en la mayoría de los casos no revisten gravedad.
El diagnóstico definitivo de la MPOX requiere la detección de ADN del virus de una muestra lesional mediante PCR. La coinfección de ITS con la MPOX es posible y frecuente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.