Las micosis superficiales son algunas de las enfermedades más comunes en todo el mundo, siendo los agentes causales más frecuentes las levaduras de los géneros Malassezia y Candida, comensales habituales de la piel que pueden actuar como patógenos oportunistas. El objetivo de este trabajo es investigar si los glicosaminoglicanos (GAG) de las células epiteliales son utilizados por estos microrganismos como receptores de adhesión a las mismas.
Materiales y métodosSe utilizaron cultivos de queratinocitos y fibroblastos dérmicos. La participación de los GAG en la adhesión de Candida albicans (C. albicans) y Malassezia spp. se estudió mediante inhibición específica de la síntesis de estas moléculas empleando rodamina B o genisteína. También se analizó mediante digestión enzimática in situ empleando liasas específicas.
ResultadosEl tratamiento con rodamina B produjo una inhibición parcial de la adherencia de ambas especies fúngicas a queratinocitos, pero no a fibroblastos. La digestión selectiva del heparán sulfato produjo un aumento de la unión de Malassezia a los queratinocitos y de ambas especies a los fibroblastos. La digestión del condroitín sulfato redujo la unión de C. albicans en los queratinocitos, pero favoreció la unión de la forma filamentada de esta levadura en los fibroblastos.
ConclusionesLos GAG de superficie celular de queratinocitos parecen estar implicados en la adherencia de Candida y Malasezzia a la superficie celular. En los fibroblastos, por el contrario, su eliminación favorece la adherencia, sugiriendo la implicación de otro tipo de receptores.
Superficial mycoses are some of the most common diseases worldwide. The usual culprits — yeasts belonging to the genera Malassezia and Candida — are commensal species in the skin that can cause opportunistic infections. We aimed to determine whether these yeasts use glycosaminoglycans (GAGs) as adhesion receptors to mediate binding to epithelial cells.
Material and methodsIn keratinocyte and dermal fibroblast cultures, we used rhodamine B and genistein to inhibit GAG synthesis to study the role these molecules play in the adhesion of Candida albicans (C. albicans) and Malassezia species to cells. We also analyzed GAG involvement by means of enzyme digestion, using specific lyases.
ResultsRhodamine B partially inhibited the adhesion of both fungi to keratinocytes but not to fibroblasts. Selective digestion of heparan sulfate enhanced the binding of Malassezia species to keratinocytes and of both fungi to fibroblasts. Chondroitin sulfate digestion decreased C. albicans adhesion to keratinocytes, but increased the adhesion of the filamentous forms of this species to fibroblasts.
ConclusionsCell surface GAGs appear to play a role in the adhesion of C albicans and Malasezzia species to keratinocytes. In contrast, their adhesion to fibroblasts appears to be enhanced by GAG inhibition, suggesting that some other type of receptor is the mediator.
La piel está colonizada por diversos microorganismos, principalmente bacterias y en menor proporción hongos, virus y parásitos1. Numerosos estudios se han centrado en la importancia de las bacterias y en su papel tanto manteniendo la homeostasis cutánea como en el desarrollo de algún tipo de infección cutánea. Sin embargo, poco se sabe acerca del micobioma, es decir, de la población fúngica que habita en ella. Al igual que las bacterias, muchos hongos pueden desarrollar su potencial patógeno si proliferan en exceso o cuando el sistema inmunitario del hospedador se encuentra alterado. Las micosis superficiales se sitúan entre las enfermedades más prevalentes en la población mundial y los hongos oportunistas más frecuentes en este tipo de infecciones son las levaduras del género Malassezia y Candida, seguido de otros hongos como los dermatofitos2-4.
Dentro de la comunidad fúngica que reside en la piel de un adulto, los miembros más abundantes pertenecen al género Malassezia, un grupo de levaduras que utilizan los lípidos como única fuente de carbono pero que son incapaces de sintetizarlos, por lo que colonizan principalmente las zonas sebáceas de la piel2,5. Constituyen más del 90% de los hongos comensales presentes en la piel, siendo las especies más frecuentes Malassezia globosa, Malassezia restricta y Malassezia sympodialis. Aparte de su naturaleza comensal, pueden aparecer asociadas a trastornos comunes de la piel, como pitiriasis versicolor o dermatitis seborreica2,5,6.
El género Candida es un grupo heterogéneo de hongos comensales presentes en la piel, las uñas y las mucosas del 70% de los individuos. Sin embargo, en personas inmunocomprometidas, y en unas condiciones propicias para ello, pueden convertirse en patógenos, causando desde infecciones superficiales hasta sistémicas con una alta ratio de mortalidad7-9. Aunque unas 20 especies de Candida son patógenos en el ser humano, la gran mayoría de las candidiasis registradas están causadas por Candida albicans (C. albicans). Una característica de este género es que son polimórficos, pudiendo presentarse en forma de levadura o en forma de hifa o seudohifa10-12.
A través de la piel y las mucosas, el ser humano está continuamente expuesto a una gran variedad de agentes patógenos, pero para que estos sean capaces de colonizar dichas superficies deben primero anclarse a los receptores presentes en el hospedador. Esto es, por tanto, un paso crítico que implica el reconocimiento específico entre las moléculas de la superficie del microorganismo y las moléculas que conforman parte del receptor13. Existen varias moléculas en la superficie de la célula que actúan como mediadores en la unión, incluyendo hidratos de carbono, lípidos, proteínas o proteoglicanos (PG)14,15. Los PG están formados por una molécula proteica central a la que se unen cadenas de polisacáridos llamados glicosaminoglicanos (GAG) en número variable. Estos GAG están formados por un disacárido que se repite en un número variable de veces y, en función de la estructura química que presenten podemos encontrar diferentes especies. Dos de ellos son el heparán sulfato (HS) y el condroitín sulfato (CS), compuestos por la unión de un ácido glucurónico (GlcA) a N-acetilglucosamina en el caso del HS, o N-acetilgalactosamina en el del CS16. Posteriormente, estas cadenas sufren una serie de modificaciones postranscripcionales que las dota de una gran diversidad estructural lo que les hace estar implicadas en numerosas funciones biológicas normales y patológicas16,17. La interacción de los GAG con multitud de ligandos. como citocinas, factores de crecimiento o enzimas, implica que forme parte de procesos como la adherencia y migración celular, regulación de la morfogénesis, inflamación e incluso cáncer o diversos procesos infecciosos18-20. Han sido descritos multitud de casos en los que los GAG facilitan la unión de patógenos a la superficie celular eucariota y, en ciertos casos, también la invasión, internalización y diseminación por el organismo21.
El objetivo de este artículo es investigar el papel de los GAG como receptores en el proceso de adherencia de 2especies de hongos comensales de la piel, C. albicans y Malassezia spp., que en determinadas circunstancias pueden convertirse en patógenos oportunistas. El trabajo pretende identificar si los GAG están implicados en la adherencia de estos microorganismos a los queratinocitos de la epidermis y a fibroblastos de la dermis, así como analizar el papel de las principales especies de GAG presentes en la superficie celular en dichas interacciones. Todo ello ampliaría el conocimiento de las bases moleculares de la adhesión, lo que permitiría plantear nuevas estrategias antiinfecciosas mediante el bloqueo de la adherencia de los patógenos a los tejidos diana, punto clave en el inicio del proceso patogénico. Esto resultaría de gran utilidad ya que la adhesión también es un prerrequisito para que muchos patógenos desplieguen diferentes factores de virulencia sobre las células hospedadoras.
Material y métodosLíneas celulares, cepas fúngicas y condiciones de cultivoLa presente investigación se llevó a cabo de acuerdo con los principios expresados en la Declaración de Helsinki. Los queratinocitos y los fibroblastos fueron obtenidos de biopsias humanas procedentes del banco de tejidos del centro comunitario de sangre y tejidos de Asturias, y se obtuvieron después del consentimiento informado por escrito de conformidad con las leyes españolas sobre donación de órganos y tejidos para investigación. Las células se cultivaron como se indicó previamente22.
Las cepas de C. albicans y Malassezia spp. fueron obtenidas de aislados clínicos cedidos por el Hospital Universitario Central de Asturias. C. albicans fue crecida a temperatura ambiente en medio Sabouraud Difco (BD, MD, EE. UU.) con cloranfenicol a una concentración de 50μg/l. Para obtener C. albicans filamentada se utilizó medio conteniendo glucosa 0,1%, glicina al 1% y extracto de levadura al 0,1% a pH 7,5, y se incubó a 37°C, y el 5% CO2 durante 48 h. Malassezia spp. se cultivó en medio Sabouraud enriquecido con aceite de oliva y tween 20, ambos al 1%, a 37°C.
Marcaje de fluorescenciaLos hongos incubados durante una noche se lavaron 4 veces con PBS. Posteriormente, los cultivos se resuspendieron en una solución de PBS al 0,1mg/ml de isotiocianato de fluoresceína (FITC, Sigma Aldrich, MO, EE. UU.) a una A600 de 0,5 y se incubaron en oscuridad durante 1h a 37°C. Pasado ese tiempo, los cultivos fueron centrifugados, lavados 4 veces con PBS para eliminar el exceso de FITC y resuspendidos en PBS a una A600 de 0,5.
Ensayos de adherenciaLos ensayos de adherencia de los hongos a monocapas celulares se llevaron a cabo en placas de 24 pocillos crecidas en torno a un 70-90% de confluencia. El medio de cultivo fue eliminado, las células se lavaron 2 veces con PBS y se bloquearon con suero fetal bovino al 10% en medio Dulbecco's Modified Eagle's minimal essential (DMEM) (Gibco, Life Technologies, CA, EE. UU.) durante 2h a 37°C y 5% CO2. Tras este tiempo, los pocillos se lavaron con PBS y se añadió 200μl de la suspensión de hongo marcado, completando hasta un volumen de 500μl con medio DMEM; la mezcla se incubó durante 90 min a 37°C y 5% CO2. Posteriormente, los pocillos se lavaron 2 veces con PBS para eliminar los hongos no unidos. Finalmente, los cultivos se disgregaron utilizando SDS 1% y la fluorescencia de los hongos unidos se determinó en un fluorímetro Perkin Elmer LS55 (MA, EE. UU.), utilizando longitudes de onda de 488nm para la excitación y 560nm para la emisión. Los datos de los diferentes experimentos se normalizaron usando los valores de adhesión obtenidos en ausencia de cualquier tratamiento y se les dio el valor arbitrario de 100%.
Inhibición de la síntesis de GAGLos cultivos celulares en placas de 24 pocillos y crecidos aproximadamente a un 70% de confluencia fueron incubados en DMEM conteniendo rodamina B (Sigma-Aldrich) a 50μg/ml y genisteína (Sigma-Aldrich) a 30μM durante toda la noche a 37°C. Los cultivos se lavaron 2 veces con PBS; se comprobó la integridad celular mediante microscopio óptico y, a continuación, se procedió a realizar los ensayos de adherencia tal y como se describió en el párrafo anterior.
Digestión enzimática de GAG de la superficie celularLa digestión del HS de los cultivos celulares se llevó a cabo incubando en medio DMEM con una mezcla de heparinasa i y iii (Sigma Aldrich) a 500 mU/ml cada una, durante 3h a 37°C y 5% CO2. La digestión del CS se llevó a cabo de modo análogo, pero usando 250 mU/ml de condroitinasa ABC (Sigma Aldrich). Las reacciones se detuvieron mediante 2 lavados con PBS, se comprobó la integridad celular mediante microscopio óptico y, a continuación, se procedió a realizar los ensayos de adherencia tal y como se describió anteriormente.
Análisis estadísticosTodos los experimentos se realizaron al menos 3 veces con al menos 3 réplicas en cada caso. Todos los datos se analizaron mediante el empleo del programa Statistica (Statsoft Inc.; Tulsa, OK, EE. UU.). Los valores medios entre 2muestras se compararon mediante el test U de Mann-Whitney; p<0,05 fue aceptado como significativo.
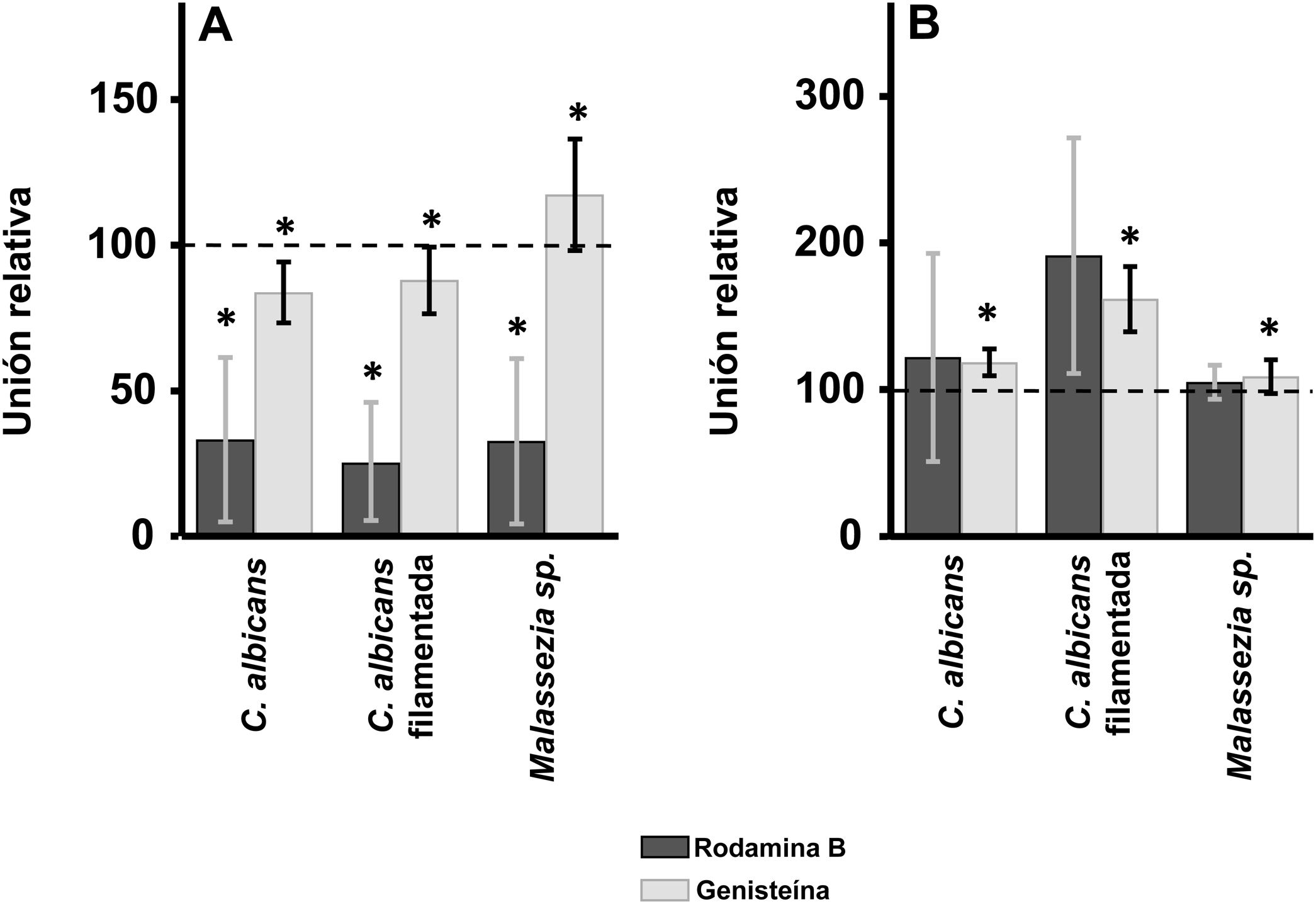
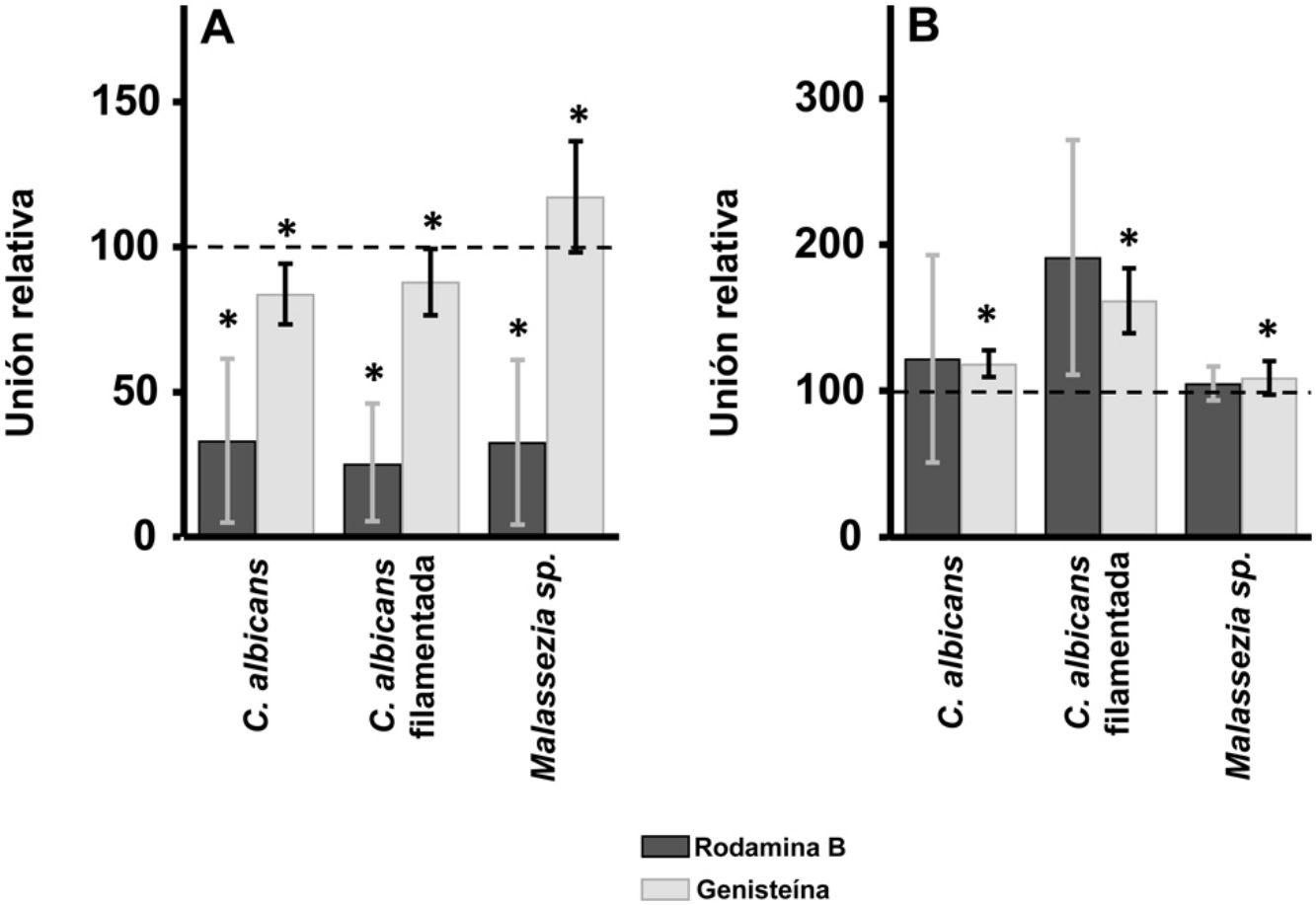
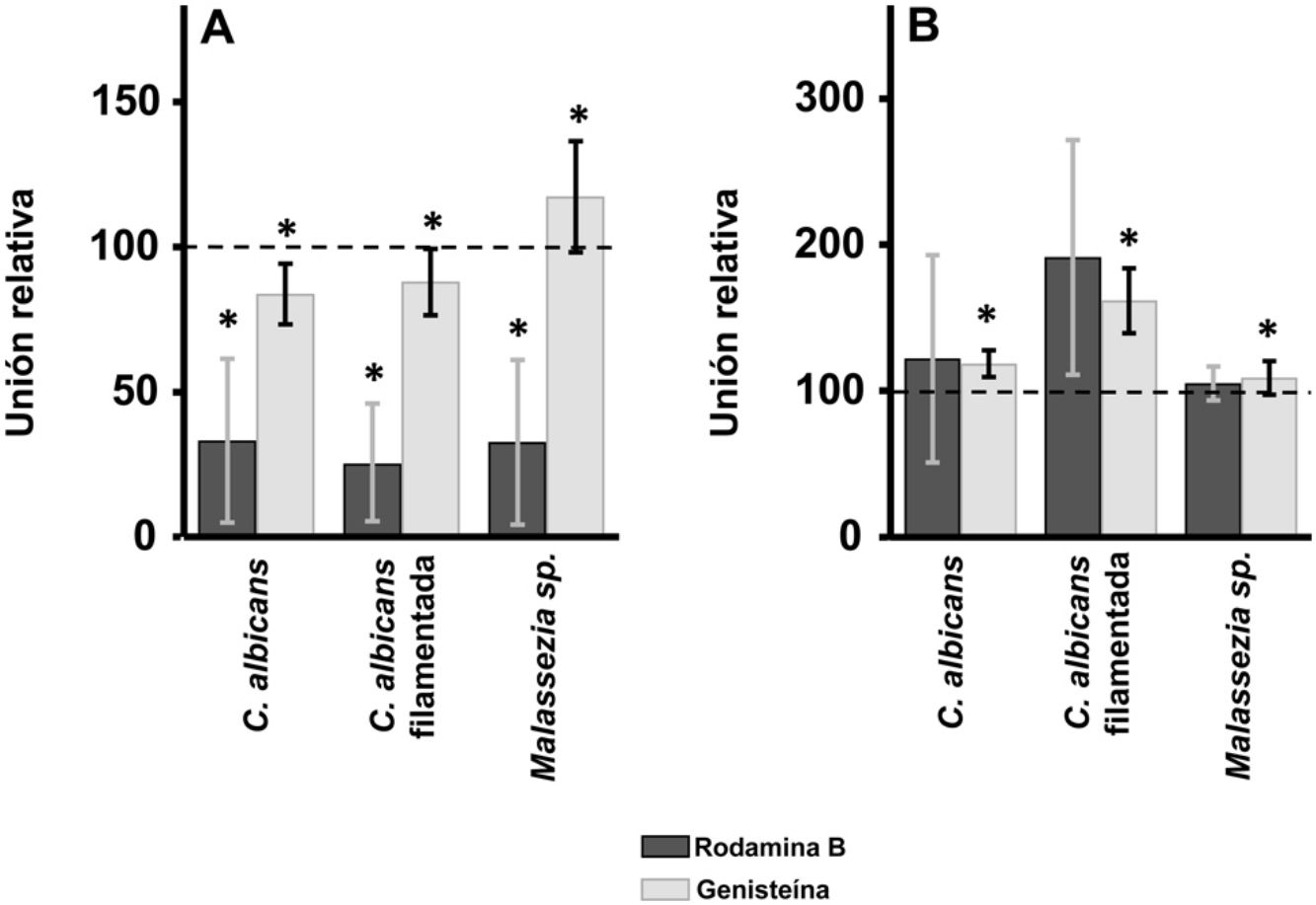
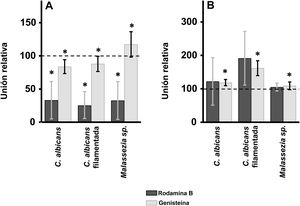
ResultadosEfecto de la inhibición de la biosíntesis de GAG sobre la adherencia de las levaduras a los queratinocitos y fibroblastos de la pielEn los queratinocitos, la adherencia de C. albicans resultó inhibida por el tratamiento de las células tanto con rodamina B como con genisteína, independientemente de la forma celular analizada, levadura o filamentada. Sin embargo, la intensidad del efecto fue dependiente del inhibidor, observándose un efecto intenso con rodamina B, mientras la genisteína solo redujo los valores de adherencia en un 15% de media en ambos casos (fig. 1A). En el caso de Malassezia spp., la rodamina B produjo un efecto similar a los anteriores, pero el tratamiento con genisteína incrementó la adherencia en torno a un 17% respecto al control (fig. 1A).
Efecto de la inhibición de la biosíntesis de GAG sobre la adhesión de levaduras a células de la piel. Efecto del tratamiento con rodamina B (barras oscuras) o genisteína (barras claras) sobre la unión a queratinocitos (A) y fibroblastos (B). Los datos fueron normalizados usando los valores de adhesión de las levaduras a células no tratadas, a las cuales se les dio el valor arbitrario de 100. Las barras representan las desviaciones estándar.
* p<0,05.
Los fibroblastos dérmicos, tratados mediante los mismos tratamientos, ofrecieron resultados radicalmente diferentes. En ningún caso se observó inhibición de la unión, la cual curiosamente se incrementó en todas las formas microbianas analizadas. Además, el incremento observado resultó estadísticamente significativo para la genisteína (fig. 1B).
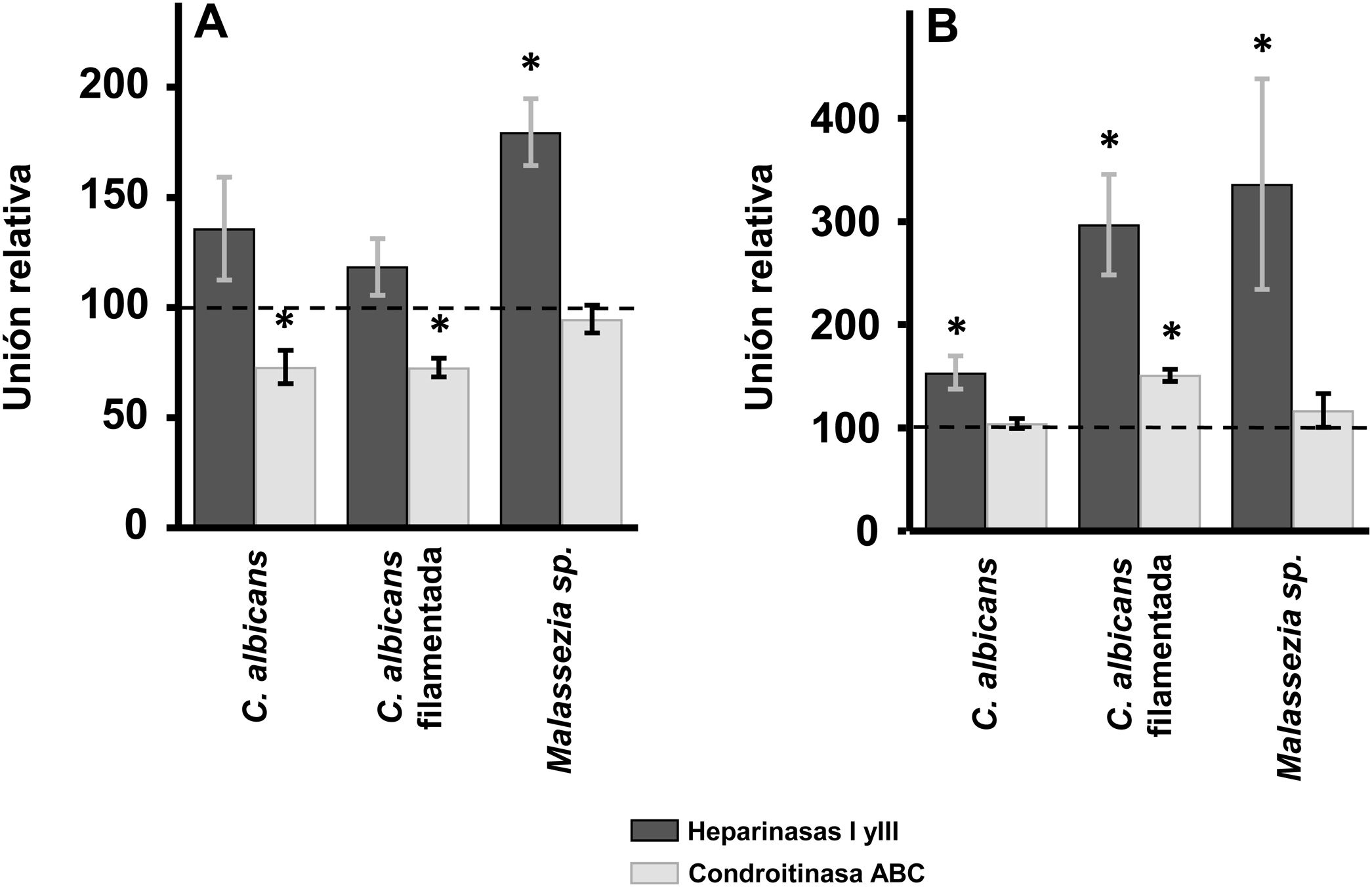
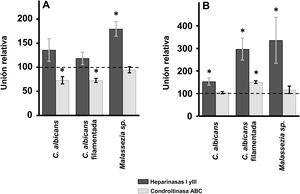
Efecto de la digestión enzimática de GAG sobre la adherencia de las levaduras a los queratinocitos y fibroblastos de la pielEn los queratinocitos de la epidermis, el tratamiento con heparinasas i y iii no produjo diferencias significativas en la adherencia de las levaduras respecto al control, salvo en el caso de Malassezia spp., donde la eliminación del HS de la superficie celular produjo un aumento del 80% de su adherencia (fig. 2A). Sin embargo, la degradación del CS con condroitinasas ABC produjo un efecto contrario: la unión de Malassezia spp. no se vio alterada, pero se pudo determinar la existencia de un descenso significativo en el caso de C. albicans, tanto filamentada como en forma de levadura, reduciéndose en ambos casos un 27% la unión (fig. 2A).
Efecto de la degradación enzimática de GAG celulares sobre la adhesión de las levaduras a células de la piel. Inhibición de la unión de las levaduras a queratinocitos (A) y fibroblastos (B) tras el tratamiento con heparinasas i y iii (barras oscuras) o condroitinasa ABC (barras claras). Los datos fueron normalizados usando los valores de adhesión de las levaduras a células no tratadas, las cuales les dimos el valor arbitrario de 100. Las barras representan las desviaciones estándar.
* p<0,05.
En el caso de los fibroblastos, la digestión del HS de la superficie celular mediante tratamiento con heparinasas i y iii produjo en todos los casos un aumento de la adherencia, siendo más intensa en Malassezia spp. y en la forma filamentada de C. albicans que en la levadura (fig. 2A). Por otro lado, la degradación del CS no produjo alteraciones significativas, excepto en el caso de la forma filamentada de C. albicans, cuya adherencia se incrementó significativamente (fig. 2B).
DiscusiónLos PG y, en concreto, sus cadenas de GAG, están implicados en diferentes procesos infecciosos actuando como receptores de muchos patógenos21. La epidermis es la capa más superficial de la piel, formada principalmente por queratinocitos, y su función principal es actuar de barrera, manteniendo la homeostasis y protegiendo de agresiones externas, incluyendo la colonización e infección por patógenos. Inmediatamente debajo se encuentra la dermis, en la cual se encuentran fibroblastos, menos expuestos a los factores ambientales y a los microorganismos. Dado que la participación de los GAG en la patogénesis microbiana está condicionada por su estructura21, y esta es variable en función del tipo celular y su estado fisiológico17, es interesante determinar la influencia que estas moléculas tienen como receptores en infecciones fúngicas.
Para evaluar la implicación de los GAG en la interacción de C. albicans y Malassezia spp. con queratinocitos de la epidermis y fibroblastos de la dermis se inhibió la síntesis de los GAG con rodamina B y genisteína.
El empleo de estos inhibidores produjo diferentes efectos. En los queratinocitos, la rodamina inhibió notablemente la adherencia, mientras la genisteína solo producía leves inhibiciones sobre las formas celulares de C. albicans, mientras incrementaba la adherencia de Malassezia spp. En los fibroblastos, los tratamientos no resultaron en inhibiciones, sino en incrementos de adherencia, significativos en algunos casos, pero no en otros, aunque probablemente la significación estadística está condicionada por la dispersión de los resultados obtenidos. Por otra parte, las diferencias observadas en función del inhibidor empleado están probablemente relacionadas con el modo de acción de los mismos; la rodamina B inhibe iniciación y elongación de las cadenas de los GAG17,23,24, mientras que la genisteína inhibe la actividad cinasa del receptor del factor crecimiento epidérmico. el cual es necesario para la expresión completa de los genes codificantes de las enzimas implicadas en la producción de GAG25, aunque se ha descrito que la actividad de esta molécula sobre la biosíntesis de los GAG es dependiente de su tipo y localización26,27. En conjunto, estos resultados muestran que los GAG parecen ser utilizados como receptores por las levaduras potencialmente patógenas en los queratinocitos, pero no en los fibroblastos.
La degradación enzimática de los GAG mediante diferentes liasas mostró que, en los queratinocitos, el CS parece ser más relevante para la adhesión de C. albicans y que la eliminación del HS favorece dicha interacción en el caso de Malassezia spp. En los fibroblastos de la dermis no se observó ninguna reducción en los niveles de adherencia. Se observó incluso, un aumento de la misma tras la eliminación del HS de la superficie celular en todos los casos. Tras el tratamiento con condroitinasa ABC, la eliminación del CS favoreció la adhesión de C. albicans filamentada. El aumento de la unión de las levaduras a las células de la piel tras la degradación de los GAG podría favorecer una mayor exposición de otra clase de receptores eucariotas que intervengan en la unión. Por otra parte, el efecto limitado que la degradación de especies de GAG individuales tiene sobre la adherencia fúngica podría ser indicativo de fenómenos cooperativos en los que interviniesen ambas especies de GAG, así como la interacción con otros receptores, tal y como ha sido descrito en otros epitelios21.
En conclusión, los datos aportados por este estudio parecen indicar que los GAG de superficie celular de queratinocitos están implicados en la adherencia de Candida y Malasezzia, probablemente de forma cooperativa. Por el contrario, en fibroblastos estas moléculas no parecen desempeñar el mismo papel y, de hecho, interfieren en la adherencia, sugiriendo que la adherencia implica receptores celulares de otra naturaleza. El empleo de antifúngicos para el tratamiento de este tipo de infecciones conlleva la aparición de resistencias a largo plazo, por lo que son necesarias nuevas alternativas terapéuticas. Estos resultados ofrecen nuevas posibilidades para el desarrollo de diferentes estrategias antiadhesión como pueden ser el bloqueo de la síntesis de las adhesinas o receptores celulares, moléculas competitivas de las adhesinas que mimeticen a los GAG o anticuerpos específicos.
FinanciaciónEl presente trabajo ha sido financiado por el premio 2019 «AEDV investiga», de la Fundación Piel Sana de la Academia Española de Dermatología y Venereología (AEDV).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.