Una de las medidas que puede guiar al dermatólogo y farmacéutico es el número de pacientes necesario a tratar (NNT), es decir, el número de pacientes que deben recibir tratamiento con una terapia específica para lograr o evitar un resultado o evento clínico, en comparación con el número necesario para lograr el mismo resultado con una opción de tratamiento alternativo o placebo1. Este parámetro estadístico es una medida de riesgo absoluto calculada como la inversa de la reducción absoluta de riesgo (RAR) y desarrollada en el contexto de la medicina basada en la evidencia como herramienta útil para la toma de decisiones clínicas. De hecho, el Consolidated Standards of Reporting Trials (CONSORT) recomienda el uso de medidas de efecto tanto relativas como absolutas en los ensayos clínicos aleatorizados (ECA)2. Sin embargo, estas últimas no suelen comunicarse, mientras que las medidas relativas se utilizan ampliamente.
El uso del NNT ha ido aumentando en los últimos años en dermatología, en particular en psoriasis, al utilizarse variables de eficacia muy similares entre los distintos ECA. De hecho, recientemente, el Grupo de Psoriasis de la Academia Española de Dermatología y Venereología ha recomendado que, para la priorización por criterios de eficiencia, se evalúen parámetros como el NNT, siempre tomando como referencia los objetivos de respuesta aceptados del índice de área y gravedad de la psoriasis (PASI) (respuesta PASI 90 o PASI 100)3, en línea con las nuevas recomendaciones de la Comisión Permanente de Farmacia de incluir el NNT y coste por NNT como medida de eficiencia en los Informes de Posicionamiento Terapéutico4.
Por ello, presentamos un ejemplo de cómo el NNT facilita la interpretación de la efectividad de los distintos fármacos biológicos inhibidores de la interleucina 17 (anti-IL-17) y de la IL-23 (anti-IL-23p19). Y de cómo utilizar el coste por NNT, como medida de eficiencia, permitiendo clasificar los distintos tratamientos según su nivel de eficiencia.
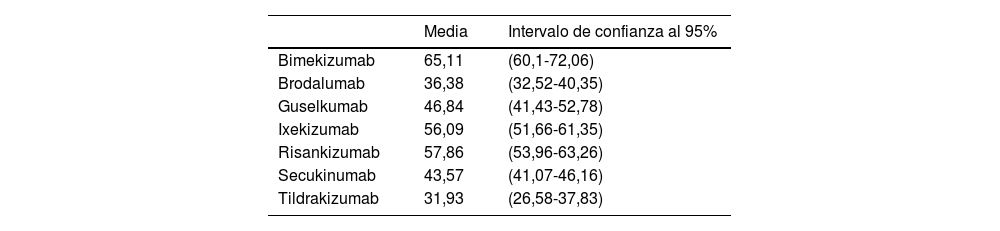
Basándonos en los resultados de eficacia, a largo plazo, que las terapias biológicas anti-IL-17 y anti-IL-23 han obtenido en sus ECA, con características basales de los pacientes comparables y consistentes entre sí y, tomando como medida de eficacia el aclaramiento completo del paciente (PASI 100) a largo plazo (48-52 semanas), se estimó, de forma conservadora, la RAR del fármaco biológico frente a placebo, asumiendo que la eficacia obtenida por placebo a las 16 o 24 semanas se hubiese mantenido a largo plazo (tabla 1).
Reducción absoluta de riesgo (PASI 100) del fármaco biológico versus placebo a las 48-52 semanas si se hubiera mantenido la eficacia obtenida por placebo a las 16-24 semanas en el largo plazo
| Media | Intervalo de confianza al 95% | |
|---|---|---|
| Bimekizumab | 65,11 | (60,1-72,06) |
| Brodalumab | 36,38 | (32,52-40,35) |
| Guselkumab | 46,84 | (41,43-52,78) |
| Ixekizumab | 56,09 | (51,66-61,35) |
| Risankizumab | 57,86 | (53,96-63,26) |
| Secukinumab | 43,57 | (41,07-46,16) |
| Tildrakizumab | 31,93 | (26,58-37,83) |
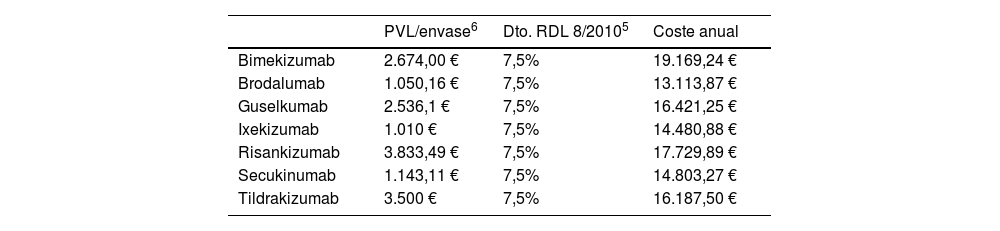
El coste por NNT se obtuvo multiplicando el coste del tratamiento anual medio del primer año y subsiguientes por el NNT. Al tratarse de medicamentos hospitalarios, los costes se calcularon utilizando el precio de venta del laboratorio (PVL) notificado, de cada formulación farmacéutica y el tipo de deducción del Real Decreto Ley (RDL) 8/20105 (tabla 2). Los costes unitarios se obtuvieron de la base de datos Bot Plus 2.0 publicada por el Consejo General de Colegios Oficiales de Farmacéuticos6. Los costes anuales se calcularon considerando dichos costes unitarios y las dosis recomendadas en las fichas técnicas de cada uno de los anti-IL considerados7. Dado que las dosis son superiores en el primer año de administración, se empleó la media del primer año y subsiguientes.
Costes de las alternativas terapéuticas evaluadas
| PVL/envase6 | Dto. RDL 8/20105 | Coste anual | |
|---|---|---|---|
| Bimekizumab | 2.674,00 € | 7,5% | 19.169,24 € |
| Brodalumab | 1.050,16 € | 7,5% | 13.113,87 € |
| Guselkumab | 2.536,1 € | 7,5% | 16.421,25 € |
| Ixekizumab | 1.010 € | 7,5% | 14.480,88 € |
| Risankizumab | 3.833,49 € | 7,5% | 17.729,89 € |
| Secukinumab | 1.143,11 € | 7,5% | 14.803,27 € |
| Tildrakizumab | 3.500 € | 7,5% | 16.187,50 € |
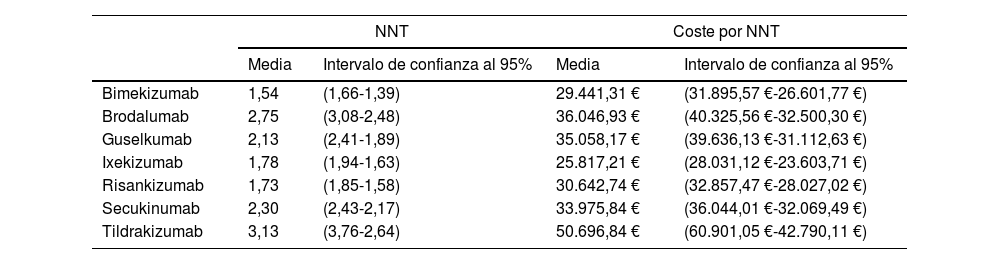
Por tanto, si se aplica el objetivo óptimo (PASI 100) a largo plazo, bimekizumab, risankizumab e ixekizumab obtienen tasas de respuesta superiores a los demás tratamientos con un NNT de 1,54 (1,66; 1,39), 1,73 (1,85; 1,58) y 1,78 (1,91;1,63), respectivamente (tabla 3), siendo las alternativas más eficientes ixekizumab seguido de bimekizumab y risankizumab. No obstante, estos resultados cambian cuando se aplican los PVL financiados confidenciales, siendo bimekizumab el tratamiento más eficiente, seguido de ixekizumab y risankizumab.
NNT y coste (PVL notificado) por NNT del fármaco biológico versus placebo a las 48-52 semanas (PASI 100) si se hubiera mantenido la eficacia obtenida por placebo a las 16-24 semanas en el largo plazo
| NNT | Coste por NNT | |||
|---|---|---|---|---|
| Media | Intervalo de confianza al 95% | Media | Intervalo de confianza al 95% | |
| Bimekizumab | 1,54 | (1,66-1,39) | 29.441,31 € | (31.895,57 €-26.601,77 €) |
| Brodalumab | 2,75 | (3,08-2,48) | 36.046,93 € | (40.325,56 €-32.500,30 €) |
| Guselkumab | 2,13 | (2,41-1,89) | 35.058,17 € | (39.636,13 €-31.112,63 €) |
| Ixekizumab | 1,78 | (1,94-1,63) | 25.817,21 € | (28.031,12 €-23.603,71 €) |
| Risankizumab | 1,73 | (1,85-1,58) | 30.642,74 € | (32.857,47 €-28.027,02 €) |
| Secukinumab | 2,30 | (2,43-2,17) | 33.975,84 € | (36.044,01 €-32.069,49 €) |
| Tildrakizumab | 3,13 | (3,76-2,64) | 50.696,84 € | (60.901,05 €-42.790,11 €) |
Los resultados sugieren que los fármacos anti-IL-17 y anti-IL-23p19, como tratamiento para los pacientes adultos con psoriasis en placas de moderada a grave, con mayor eficacia (bimekizumab, risankizumab e ixekizumab) también pueden presentar un menor NNT y una mayor eficiencia, siendo bimekizumab el tratamiento más eficiente cuando se aplican los PVL financiados. Sin embargo, dada la superposición de los intervalos de confianza entre algunos de los tratamientos, estos resultados serían orientativos y no llegarían a representar diferencias estadísticamente significativas.
Nuestro estudio no está exento de limitaciones. En primer lugar, no existe ningún metaanálisis publicado, a largo plazo, donde se incluyan todos los anti-IL-17 y anti-IL-23p19 autorizados hasta la fecha ni estudios head-to-head entre los distintos tratamientos; no obstante, consideramos que los resultados son robustos dada la homogeneidad, comparabilidad y consistencia de las características basales de los pacientes entre los ECA incluidos. En segundo lugar, no se han utilizado los precios de compra de los hospitales o servicios de salud dado que estos no son públicos.
A modo de conclusión, nos gustaría resaltar cómo estas medidas pueden ayudar a los profesionales sanitarios y pagadores en la elección de los fármacos que deben administrarse tanto a nivel de eficacia como de eficiencia para el Sistema Nacional de Salud.
Conflicto de interesesAlmudena González-Domínguez trabaja en Weber, empresa que ha recibido honorarios para la realización de este estudio. Nuria García-Agua ha recibido honorarios por la realización de proyectos de investigación de: Amgem, Almirall, Archimedes Pharma, Astra-Zeneca, Boeringher Ingelheim, Bristol-Myer Squib, Chiesi, Coloplast, Eisai farmacéutica, Ferrer, Genzyme, Janssen, Lundbeck, Merk Sharp Dohme, Novartis, Pfizer, Rovi, Sanofi-Aventis, Teva pharma, UCB, Zambon. Esteban Daudén realiza o ha realizado las siguientes actividades: miembro de Advisory Board, consultor, recepción de becas, apoyo a la investigación, participación en ensayos clínicos, honorarios por impartir ponencias, con las siguientes compañías farmacéuticas: Abbott/Abbvie, Almirall, Amgen, Biogen, Celgene, Janssen-Cilag, Leo Pharma, Lilly, MSD, Novartis, Pfizer, UCB, Brystol-Myers y Boehringer-Ingelheim. Pere Ventayol ha recibido pagos por asistencia a eventos (cursos, seminarios, workshops) como ponente para Boehringuer, Gilead, Astra Zeneca, Novartis, Janssen, Clovis, Roche, Viiv y BMS.
FinanciaciónEste proyecto fue financiado por UCB Pharma S.A.
Los autores quisieran a gradecer a Carlos Dévora y Yoana Ivanova de Weber por la búsqueda de los ECA.