La vía de señalización de citocinas Janus cinasa/transductor de señal y activador de transcripción (JAK/STAT) es un área de interés emergente en dermatología, con evidencia creciente del papel clave en la patogénesis de las enfermedades inflamatorias cutáneas. Debido a que algunas citocinas proinflamatorias usan la vía JAK/STAT para la transducción de señales se convierte en una diana terapéutica prometedora para el tratamiento de dichas enfermedades al modular de forma selectiva el sistema inmune. El objetivo de esta revisión es conocer la vía de señalización JAK/STAT y su papel en distintas enfermedades dermatológicas inmunomediadas. En esta segunda parte, se revisará la eficacia y seguridad de los inhibidores de JAK –en formulación oral o tópica– para el tratamiento de la psoriasis, la dermatitis atópica y otras dermatosis.
Dermatologists’ interest in the Janus-associated kinase (JAK)/signal transducers and activators of transcription (STAT) pathway has been growing as evidence builds to support its key role in the pathogenesis of inflammatory skin diseases. Because certain proinflammatory cytokines use the JAK/STAT pathway for signal transduction, it has become a promising therapeutic target in diseases where selective modulation of the immune system can be useful. We aim to review current knowledge of the JAK/STAT signaling pathway and its role in immune-mediated skin diseases. In the second part of the review we cover the efficacy and safety of oral and topical JAK inhibitors in the treatment of psoriasis, atopic dermatitis, and other skin diseases.
En la parte 1 de esta revisión se ha descrito de forma detallada la familia de las Janus cinasas (JAK) y la vía de señalización intracelular Janus kinase/signal transducer and activator of transcription (JAK/STAT). Se ha destacado el papel que podrían tener los inhibidores de JAK (JAKi) en el tratamiento de distintas enfermedades inflamatorias dermatológicas, revisando específicamente la evidencia actual disponible en vitíligo y alopecia areata.
En esta parte 2 se realiza una revisión de la patogénesis y el papel de la vía JAK/STAT en psoriasis y dermatitis atópica y también otras dermatosis como la hidrosadenitis, la dermatomiositis o la enfermedad de injerto contra húesped, entre otras.
PsoriasisAunque el eje interleucina-23/interleucina-17 (IL-23/IL-17) se considera actualmente la vía patogénica principal en la psoriasis, en esta enfermedad intervienen numerosas citocinas, algunas de las cuales transmiten su señal tras la unión a los correspondientes receptores a través de la vía JAK/STAT: el interferón gamma (IFN-γ), el interferón alfa (IFN- α), la IL-2, la IL-6, la IL-12, la IL-13, la IL-19, la IL-20, la IL-21, la IL-22 y la IL-23. El factor de necrosis tumoral alfa (TNF-α) y otras citocinas, como la IL-17, la IL-8 o las de la familia IL-1 (IL-1, IL-18, IL-36 e IL-38) no activan directamente la vía JAK/STAT pero su actividad se puede suprimir indirectamente mediante la inhibición de la vía JAK/STAT1–3.
Se ha demostrado una sobrerregulación de la señalización JAK con un incremento en la expresión de STAT1 y STAT3 en las lesiones de psoriasis cuando se comparan con piel sana4–6.
STAT1 es responsable de la transducción de señales del IFN tipo I (α y β) y tipo II (γ) a través de un mecanismo dependiente de JAK1/JAK2, llevando a la producción de múltiples mediadores proinflamatorios y la activación y maduración de las células dendríticas con estimulación de linfocitos Th1 y Th177,8.
A través de la activación de JAK2/TYK2 inducida por IL-23, STAT3 está involucrada en la inducción y diferenciación de las células Th179. Adicionalmente las células Th17 pueden producir IL-22, responsable de hiperplasia epidérmica y producción de péptidos antimicrobianos por los queratinocitos2,10. STAT3 participa también en la proliferación de queratinocitos a través de la activación de JAK1/JAK2 o JAK1/TYK2 inducida por IL-611,12. Además, IL-17 activa de forma indirecta STAT3 a través de la inducción de IL-19 y/o IL-36 por los queratinocitos13.
Tofacitinib oralTofacitinib (Xeljanz®, Pfizer) inhibe primariamente JAK1 y JAK3. Está aprobado por la FDA para el tratamiento de pacientes adultos con artritis psoriásica (PsA) y para el tratamiento de la artritis reumatoide moderada a grave a dosis de 5mg dos veces al día14. Recientemente ha sido aprobada para el tratamiento de la artritis idiopática juvenil poliarticular en niños de 2 años o más15, y también para el tratamiento de la colitis ulcerosa a dosis de 10mg dos veces al día durante 8 semanas y posteriormente 5mg dos veces al día14,16. Tofacitinib ha demostrado eficacia en psoriasis moderada-grave en ensayos en fase II y III.
En 197 pacientes tratados con tofacitinib 2mg, 5mg y 15mg dos veces al día se consiguió a las 12 semanas una respuesta Psoriasis Area and Severity Index 75 (PASI75) del 25%, 41% y 67% respectivamente, en comparación con el 2% del placebo. El 22% de los pacientes que recibieron tofacitinib consiguieron una respuesta PASI90 en la semana 1217.
En un ensayo de fase III que incluyó a 1106 pacientes con psoriasis en placas con PASI de 12 o superior se demostró la no inferioridad de tofacitinib 10mg/12h frente a etanercept 50mg subcutáneo en la semana 12, con una tasa de efectos adversos similar en ambos grupos18.
En dos ensayos de fase III (OPT pivotal 1 –incluyendo 901 pacientes– y OPT pivotal 2 –con 960 pacientes–19), tofacitinib 10mg/12h fue más eficaz que 5mg/12h a partir de la semana 16, con una mayor tasa de respuesta PASI75 entre las semanas 16 a 28. Entre los pacientes que consiguieron PASI75 en la semana 16, el 74,1% del grupo de 5mg/12h y el 79,4% del grupo 10mg/12h mantuvieron la respuesta a las 52 semanas y la mayoría lo seguían haciendo a los 24 meses20. Además, a las 16 semanas de tratamiento ambas dosis produjeron mejoría en la psoriasis ungueal, el prurito (la diferencia se hacía evidente un día después del inicio del tratamiento) y el Dermatology Life Quality Index, con mantenimiento de la mejoría a la semana 5221,22. En otro ensayo en fase III en la semana 16 se consiguió una respuesta American College of Rheumatology 20 (ACR20) en todos los pacientes con PsA tratados con tofacitinib (5mg/12h o 10mg/12h), y una respuesta ACR50 o ACR70 en más de la mitad. Las respuestas se mantuvieron en la semana 5223.
La mayoría de los efectos adversos presentados fueron leves o moderados. En los grupos de tofacitinib doce pacientes tuvieron herpes zóster, aunque el efecto adverso más frecuente fue la nasofaringitis19. Dos pacientes tratados con tofacitinib 10mg cada 12h presentaron infecciones graves (apendicitis, neumonía y pielonefritis) en OPT Pivotal 1, mientras que tres pacientes que recibieron tofacitinib 5mg cada 12h presentaron infecciones graves (neumonía, herpes zóster, erisipela) en OPT Pivotal 2. En ambos estudios describen incremento en las cifras de colesterol, creatina fosfocinasa (CPK) y disminución de la hemoglobina.
Los efectos adversos de tofacitinib son similares con dosis de 5mg y 10mg, siendo los más frecuentes citopenias leves, infecciones del tracto respiratorio superior (IRVA), cefalea, infección del tracto urinario y diarrea17,19,20,24,25. En octubre de 2015, la FDA rechazó la autorización de tofacitinib para el tratamiento de la psoriasis en placas moderada a grave alegando que eran precisos más estudios sobre su seguridad a largo plazo26.
Tofacitinib tópicoTofacitinib tópico podría ser una alternativa terapéutica para psoriasis en placas leve a moderada, con un perfil de seguridad favorable, aunque la mejoría ha sido discreta en los estudios publicados. En un estudio en fase IIa con 71 pacientes se encontraron resultados prometedores con pomada de tofacitinib al 2%/12h. El cambio porcentual respecto al valor inicial en la semana 4 en la puntuación de gravedad de placa objetivo (TPSS) fue estadísticamente significativo con la pomada de tofacitinib en comparación con el vehículo (promedio de mínimos cuadrados -54,4% vs.-41,5%, respectivamente)27. Posteriormente, se llevó a cabo un estudio aleatorizado multicéntrico incluyendo 435 pacientes, en el que tofacitinib en pomada al 1% y al 2% demostraron más eficacia que el vehículo para el tratamiento de la psoriasis en la semana 8 (Physician's Global Assessment-PGA-0/1 en el 18,6% para tofacitinib 2% cada 24h y en el 22,5% para tofacitinib 2% cada 12h), pero no en la semana 12. El 8,1% de los pacientes tuvieron reacciones en el sitio de aplicación, aunque la mayor incidencia fue en el grupo vehículo28.
Ruxolitinib tópicoRuxolitinib, un inhibidor de JAK1/2, se ha estudiado en el tratamiento tópico de la psoriasis. En un ensayo clínico en fase II, 29 pacientes se aleatorizaron a recibir ruxolitinib crema al 0,5% o al 1% una vez al día o al 1,5% dos veces al día 28 días, vehículo o un comparador activo (crema de calcipotrieno 0,005% o betametasona dipropionato 0,05%). El tratamiento con ruxolitinib crema al 1% y 1,5% fue seguro, bien tolerado y efectivo, con reducción en el grosor de las placas, el eritema, la descamación y el área de la lesión en comparación con el vehículo (reducción del 53% en los grupos de tratamiento vs. 32% del vehículo). No se encontraron diferencias significativas en cuanto a eficacia entre ruxolitinib y los comparadores activos29.
Baricitinib oralBaricitinib, un inhibidor de JAK1/2 (Olumiant®, Lilly), está aprobado por la FDA30 y la European Medicines Agency (EMA)31 para el tratamiento de la artritis reumatoide moderada a grave con dosis recomendadas de 4mg al día. Recientemente ha recibido la aprobación para el tratamiento de la dermatitis atópica moderada a grave31.
Se ha estudiado en un ensayo en fase IIb para el tratamiento de la psoriasis en placas moderada a grave en 271 pacientes. La respuesta PASI75 en la semana 12 fue significativamente superior para el grupo tratado con 8mg y de 10mg una vez al día en comparación con placebo (42,9%, 54,1% y 16,1%, respectivamente). Los efectos adversos más frecuentemente observados fueron las infecciones, con una tasa de incidencia del 26,5% en el grupo placebo y del 21,5% para los grupos de baricitinib, siendo la más común la nasofaringitis32.
Abrocitinib oralAbrocitinib (Pfizer) es un inhibidor de JAK1 que se ha evaluado para el tratamiento de la psoriasis moderada a grave en un ensayo en fase II de 12 semanas de duración, asignando 59 pacientes en total a recibir aleatoriamente 200mg/24h, 400mg/24h o 200mg/12h o placebo durante 4 semanas. En la semana 4, la proporción de pacientes que consiguieron una respuesta PASI75 fue de 17% para placebo y 200mg/24h, 50% para 400mg/24h y 60% para 200mg/12h. Se observaron más anormalidades analíticas (neutropenia, trombocitopenia, reticulopenia) en el grupo 200mg/12h, pero sin infecciones graves ni hemorragias asociadas33.
Solcitinib oralSe ha descrito una mejoría de la psoriasis dependiente de la dosis con Solcitinib (GlaxoSmithKline), un inhibidor JAK1 que se ha ensayado en fase II. Se incluyeron 60 pacientes y se observaron respuestas PASI75 del 13% con dosis de 100mg/día, 25% con dosis de 200mg/día, 57% con dosis de 400mg/día y 0% con placebo34.
Itacitinib adipato oralItacitinib adipato (Incyte Corporation), un inhibidor JAK1, demostró mejoría significativa en pacientes con psoriasis moderada a grave en un ensayo en fase II de 12 semanas de duración que incluyó a 50 pacientes. La tasa de respuesta PASI75 al cabo de un mes fue de 0%, 11,1%, 0%, 22,2% y 27,7% en los grupos placebo, itacitinib 100mg/24h, 200mg/24h, 200mg/12h y 600mg/24h, respectivamente. Únicamente se observaron diferencias significativas con placebo en el grupo de itacitinib 600mg al día35.
Pefitinib oralPefitinib (Smyraf®, Astellas Pharma Inc.) es un inhibidor pan-JAK aprobado en Japón para el tratamiento de la artritis reumatoide36 que ha demostrado eficacia en un ensayo de fase II en 124 pacientes con psoriasis en placas moderada a grave. Los pacientes recibieron tratamiento activo (10mg, 25mg, 60mg, 100mg dos veces al día o 50mg una vez al día) o placebo. El promedio de mejoría en PASI y Body Surface Area (BSA) con respecto al valor basal fue significativamente superior en todos los grupos de tratamiento en comparación con el grupo placebo a las 6 semanas, de forma dependiente de la dosis37.
Inhibidores de TYK2Las investigaciones actuales se centran en los inhibidores de TYK2 para el tratamiento de la psoriasis moderada a grave.
La proporción de pacientes que alcanzó PASI75 a las 12 semanas en un ensayo en fase II con 267 pacientes fue significativamente superior con deucravacitinib (un inhibidor de TYK2, Bristol-Myers Squibb) que con placebo (39% a dosis de 3mg/24h, 69% a dosis de 3mg/12h, 67% a dosis de 6mg/12h y 75% a dosis de 12mg/24h, en comparación con 7% en el grupo placebo). La tasa de respuesta PASI90 fue 43% a las 12 semanas, y la tasa de respuesta PASI100 fue del 25%38. Actualmente, hay tres ensayos de fase III en curso con este fármaco (NCT0403643539, NCT0392442740), uno de ellos comparándolo con apremilast (NCT0361175141).
Brepocitinib (Pfizer), un inhibidor potente de TYK2/JAK1, se está evaluando como tratamiento de la psoriasis. En un ensayo en fase I, 30 pacientes con psoriasis en placas moderada a grave recibieron 30mg o 100mg oralmente o placebo una vez al día durante 28 días. La respuesta PGA0/1 se consiguió en el 57,1%, 100% y 0% de los casos respectivamente42. Su aplicación tópica se está testando actualmente en un ensayo en fase IIb en pacientes con psoriasis leve a moderada (NCT03850483)43.
Finalmente, se está investigando otro inhibidor de TYK2 (PF-06826647, Pfizer) para psoriasis moderada a grave en un ensayo en fase II (NCT0389537244).
Dermatitis atópicaLa dermatitis atópica (DA) es una enfermedad inflamatoria cutánea con una respuesta inmune polarizada con predominio Th2 en su fase aguda. La vía JAK/STAT juega un papel esencial en la disregulación de la respuesta inmune en la DA, incluyendo la sobrerregulación de la respuesta Th2, la activación de los eosinófilos, la supresión de las células T reguladoras (Treg) y la maduración de las células B, con diferenciación a células plasmáticas y secreción de inmunoglobulina E (IgE) que se une a los mastocitos cutáneos y causa liberación de histamina. La respuesta Th2 produce asimismo liberación de citocinas proinflamatorias y factores proangiogénicos por las células epidérmicas.
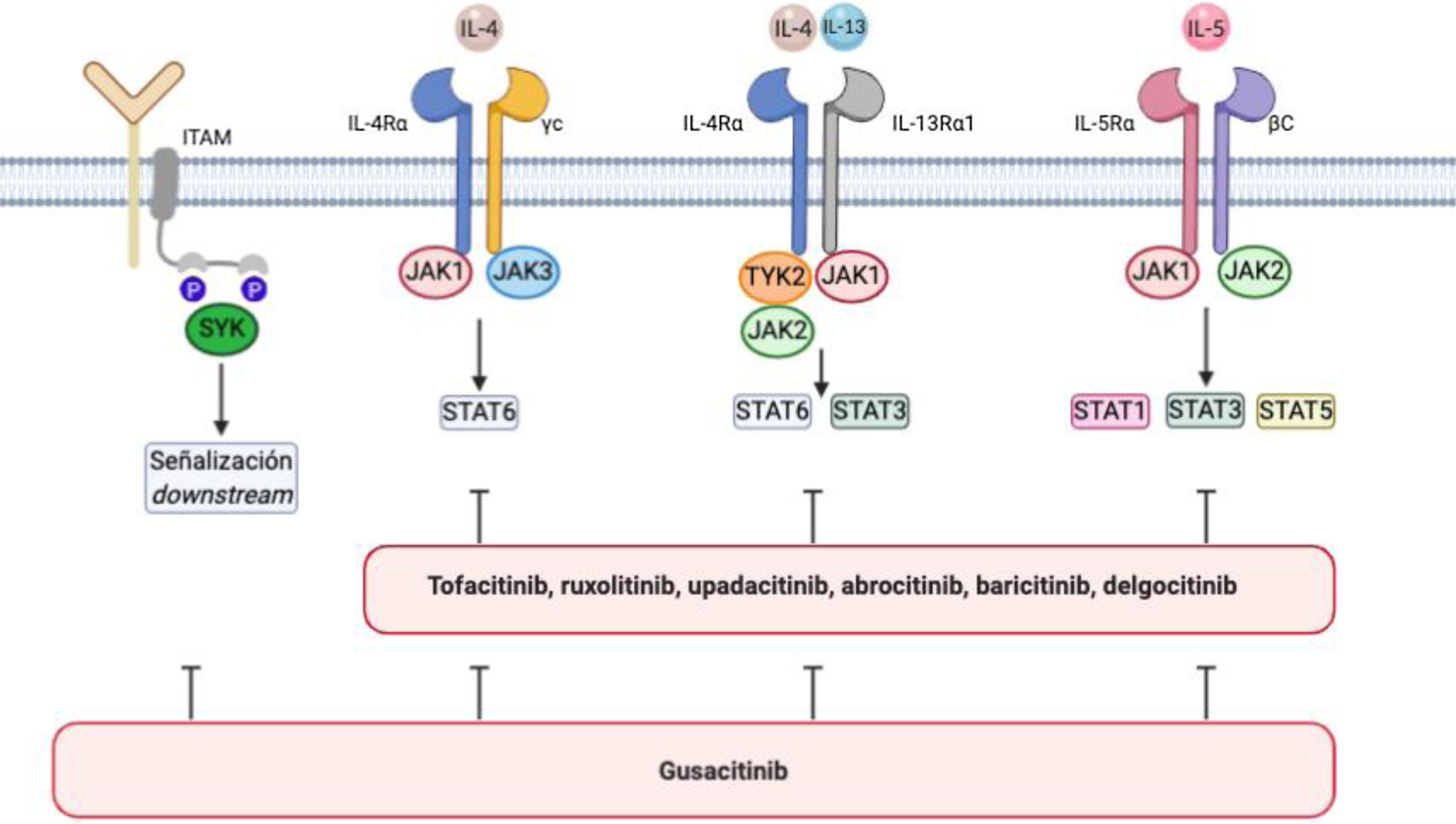
La DA se asocia a un incremento en la señalización a través de JAK1, JAK2, JAK3 y TYK245 (fig. 1). JAK1, JAK3 y STAT6 son componentes de la señalización IL-4 críticos para la diferenciación Th246–48 y la producción de IL-4, IL-5, IL-10, e IL-13. STAT6 regula los genes involucrados en Th2 y diferenciación de células B, el switching de IgG a IgE y la producción de moléculas del complejo mayor de histocompatibilidad de clase II. Diversos polimorfismos de STAT6 se han relacionado con una mayor susceptibilidad a la DA y presencia de niveles elevados de IgE49.
Vía de señalización IL-4/IL-13/JAK/STAT y vía SYK en dermatitis atópica.
Se representan en la imagen los diferentes inhibidores de JAK y los inhibidores duales de JAK/SYK en dermatitis atópica. Las funciones biológicas de IL-4 e IL-13 son mediadas por su unión a las subunidades IL-4Rα e IL-13Rα1 de los correspondientes receptores. La IL-4 se une a un receptor de tipo I que comprende la IL-4Rα y la cadena γ del receptor de citocinas o bien a un receptor tipo II configurado por IL-4Rα e IL-13R α1. Este último es el receptor principal de IL-13.
La IL-5 producida como consecuencia de la polarización Th2 se une a la subunidad IL-5Rα de su receptor, formando un complejo con una subunidad de señalización compartida, la cadena β, e induciendo la fosforilación de JAK1/JAK2 y la activación de STAT1, STAT3, y STAT5.
La SYK se une mediante sus dominios SH2 característicos a motivos de activación de inmunorreceptores basados en tirosina (ITAM) difosforilados, situados en la región citoplasmática de diversos receptores inmunológicos, como por ejemplo los receptores de células T, B, NK o los diversos receptores para la fracción constante de inmunoglobulina (Fc) localizados en neutrófilos, mastocitos, macrófagos, células dendríticas y otras estirpes del sistema inmune. Como resultado de esta interacción se activan otras proteínas que transmiten las señales «aguas abajo».
Dibujo creado con la ayuda de Biorender.com.
La vía IL-4/IL-13/JAK/STAT50 es importante para la integridad de la barrera cutánea. Se ha demostrado que la supresión mediante un JAKi no selectivo de la activación de STAT3 inducida por IL-4/IL-13 mejora la función de barrera, promoviendo la producción de filagrina y loricrina51. Además, IL-4 e IL-13 también intervienen en el prurito mediante sus interacciones con IL-4Rα y JAK1 en las neuronas sensoriales52.
Otros factores, además de la IL-4, son importantes para la diferenciación Th2. La linfopoyetina del estroma tímico (TSLP) promueve la diferenciación Th2, activa las células natural killer (NK) y los basófilos y afecta la maduración de células B. La TSLP se une a un heterodímero compuesto por receptor de TSLP y receptor IL-7 alfa e induce la forforilación de JAK1 y JAK2, llevando a la activación de STAT1, STAT3 y STAT553.
La vía de la tirosina cinasa esplénica (spleen tyrosine kinase, SYK) también está involucrada en la patogénesis de la DA. SYK es una tirosina cinasa citoplasmática involucrada en la señalización de citocinas proinflamatorias y la producción de CCL20, que atrae células Th17 a la piel54,55 (fig. 1). La inhibición de SYK suprime esta activación y determina un efecto antiinflamatorio, que puede ser sinérgico con la inhibición concomitante de JAK; se han visto resultados favorables con algunos inhibidores duales para el tratamiento de la DA.
Tofacitinib oralUn estudio abierto con 6 pacientes tratados con tofacitinib 5mg una o dos veces al día, además de tratamiento tópico, mostró una reducción del Severity Scoring of Atopic Dermatitis (SCORAD) del 36,6% en la semana 8 a 12, y del 12% a la semana 29 sin efectos adversos destacables56.
Tofacitinib tópicoLa aplicación de tofacitinib tópico al 2% (20mg/g) cada 12h en 69 pacientes con DA leve a moderada durante 4 semanas consiguió una reducción del 81,7% en la puntuación Eczema Area and Severity Index (EASI) al cabo de 4 semanas, en comparación con el 29,9% del placebo. También mejoraron desde la primera semana de tratamiento el Investigator Global Assessment (IGA), el BSA y el prurito57.
Baricitinib oralBaricitinib (Olumiant®, Lilly) se ha estudiado en un ensayo de fase II y dos ensayos de fase III para DA moderada a grave.
Se empleó de forma concomitante con triamcinolona 0,1% tópica durante 16 semanas en un ensayo en fase II con 124 pacientes58. Los pacientes tratados con dosis de 2mg y 4mg mejoraron la gravedad de la DA de forma significativa en comparación con placebo, con una mejoría rápida del prurito en la primera semana y Health-related quality of life (HRQoL). En el grupo tratado con baricitinib 4mg consiguieron respuesta EASI-50 a las 16 semanas el 61% de los pacientes, en comparación con 37% en el grupo placebo.
En dos estudios en fase III en adultos (BREEZE-AD1 –con 624 pacientes– y BREEZE-AD2 –con 615 pacientes–) baricitinib mejoró la gravedad de la DA a las 16 semanas y consiguió una rápida reducción del prurito a partir de la primera semama. En BREEZE-AD1 y BREEZE-AD2 consiguieron IGA0/1 en la semana 16 el 4,8% y 4,5% de los pacientes de los grupos placebo, el 11,8% y 8,8% de los grupos tratados con baricitinib 1mg, el 11,4% y 10,6% de los tratados con baricitinib 2mg y el 16,8% y 13,8% de los tratados con baricitinib 4mg, respectivamente59. Los efectos adversos más frecuentes fueron nasofaringitis, cefalea y elevación de CPK, y se está evaluando la seguridad a largo plazo (NCT0333443560).
Recientemente baricitinib ha recibido la aprobación de la EMA para el tratamiento de pacientes con dermatitis atópica moderada a grave en pacientes adultos candidatos a tratamiento sistémico, con una dosis recomendada de 4mg al día31.
Upadacitinib oralUpadacitinib (Rinvoq®, AbbVie) es un inhibidor JAK1 aprobado para el tratamiento de la artritis reumatoide61. En un ensayo clínico de fase IIb se evaluó la eficacia y seguridad en adultos con DA moderada-grave. Se asignaron aleatoriamente 167 pacientes a recibir tres dosis diferentes de upadacitinib (7,5mg, 15mg o 30mg diarios) o placebo. El porcentaje promedio de mejoría del EASI en la semana 16 con respecto al valor basal fue superior al placebo para todas las dosis de upadacitinib (39% para 7,5mg, 62% para 15mg, 74% para 30mg vs. 23% en el grupo placebo). Se observó una respuesta EASI-100 en el 24% de los pacientes tratados con 30mg diarios, mientras que no se observó en ningún paciente tratado con placebo.
Recientemente se han publicado los resultados de dos ensayos en fase III –Measure Up 1 y Measure Up 2– que evalúan la eficacia y seguridad de upadacitinib para el tratamiento de la DA moderada a grave en adultos y adolescentes (NCT0356929362 y NCT0360742263). Entre los pacientes que recibieron upadacitinib 15mg –n=281 (Measure Up 1) y n=276 (Measure Up 2)– consiguieron EASI75 en la semana 16 el 70%/60%, mientras que lo hicieron el 80%/73% de los que recibieron upadacitinib 30mg –n=285 (Measure Up 1) y n=282 (Measure Up 2)– y solo el 16%/13% del grupo placebo –n=281 (Measure Up 1) y n=278 (Measure Up 2)–. Por lo que respecta a IGA 0/1, lo lograron el 48%/39% de los pacientes tratados con upadacitinib 15mg y el 62%/52% de los tratados con upadacitinib 30mg, en comparación con el 8%/5% de los grupos placebo. Se produjo una reducción precoz del prurito para ambas dosis, que se mantuvo a la semana 16. Los efectos adversos observados con mayour frecuencia fueron acné, nasofaringitis, infecciones de vías respiratorias altas y cefalea64,65.
Además se está evaluando la seguridad y farmacocinética de diferentes dosis de upadacitinib en población pediátrica con DA grave (NCT0364660466) y se encuentra en curso un ensayo en fase III que compara upadacitinib con dupilumab en adultos (NCT0373839767).
Abrocitinib oralAbrocitinib podría ser efectivo y bien tolerado en pacientes con DA moderada a grave.
En un estudio de fase IIb controlado con placebo de 12 semanas de duración se trataron 269 adultos con 4 dosis diarias (10, 30, 100, 200mg). Se observó mejoría del EASI significativa con respecto a placebo solo para 100 y 200mg al día (reducción de 59% y 82,6% respectivamente vs. 35,2% del grupo placebo), con reducción del prurito ya en el día 2 del estudio68.
En un ensayo en fase III publicado recientemente se trataron 391 adolescentes y adultos con abrocitinib 200mg o 100mg o placebo 12 semanas. Una mayor proporción de pacientes en los grupos abrocitinib 200mg y 100mg vs. placebo consiguieron IGA0/1 (38,1%, 28,4% y 9,1%, respectivamente), EASI75 (61%, 44,5%, 10,4%, respectivamente) y EASI90 (37,7%, 23,9% y 3,9%, respectivamente). El 65,8% de los pacientes del grupo tratado con 200mg, el 62,7% del grupo tratado con 100mg y el 53,8% del grupo placebo presentaron efectos adversos. Los más frecuentes fueron náuseas en el grupo de 200mg, nasofaringitis en el grupo de 100mg y dermatitis atópica en el grupo placebo. Se observaron efectos adversos graves en los grupos de abrocitinib 200mg, 100mg y placebo en el 1,3%, 3,2% y 1,3% de los pacientes, respectivamente. Se consideraron relacionados con el tratamiento un caso de herpangina y una neumonía en el grupo de abrocitinib 100mg. Dos pacientes en el grupo tratado con abrocitinib 200mg desarrollaron herpes zóster y dos pacientes en el grupo tratado con abrocitinib 100mg desarrollaron eczema herpeticum. Además en el grupo tratado con 200mg se produjo un descenso del número de plaquetas en dos pacientes y trombocitopenia en 5 pacientes69.
Se está estudiando la eficacia y seguridad de abrocitinib en adolescentes a largo plazo (NCT0379667670; NCT0362776771; NCT0342282272). Existen estudios en curso que comparan la eficacia de abrocitinib oral con dupilumab subcutáneo en adultos con DA (NCT0434536773, NCT0372047074).
Gusacitinib oralGusacitinib (Asana BioSciences) es un inhibidor dual de la vía JAK y SYK que se está ensayando por vía oral. En un ensayo en fase Ib con 36 pacientes se consiguió EASI50 y disminución del prurito en casi todos ellos a las 4 semanas de tratamiento con dosis de 20, 40 o 80mg. Se consiguió una respuesta EASI75 en el 63% de los pacientes tratados con 40mg y el 50% de los tratados con 80mg cada 24h, en comparación con 22% del grupo placebo. La mejoría en el EASI se correlacionaba con un descenso en los biomarcadores Th2 y Th22 cutáneos75.
Un ensayo en fase IIb controlado con placebo para evaluar la eficacia y seguridad de ASN002 en DA moderada a grave, incluyendo 220 pacientes, se encuentra pendiente de resultados (NCT0353195776).
Ruxolitinib tópicoEn un estudio en fase IIb77, 307 pacientes con DA de leve a moderada se aleatorizaron a recibir durante 8 semanas ruxolitinib en crema 1,5%/12h, 1,5%/24h, 0,5%/24h o 0,15%/24h, vehículo o crema de acetónido de triamcinolona 0,1% cada 12h durante 4 semanas. Todos los regímenes de ruxolitinib demostraron beneficio terapéutico en la semana 4, pero el que produjo un cambio mayor en el EASI fue el grupo de ruxolitinib 1,5%/12h (71,6% vs. 15,5% del vehículo). Los pacientes tratados con ruxolitinib 1,5%/12h o cada 24h presentaron mayor mejoría en el EASI en comparación con el grupo tratado con triamcinolona 0,1% aunque las diferencias no fueron estadísticamente significativas. Además, ruxolitinib consiguió reducir el prurito de forma rápida y mantenida, fue bien tolerado y no se observaron reacciones relevantes en el sitio de aplicación.
Actualmente un ensayo en fase I está evaluando la seguridad y farmacocinética de ruxolitinib tópico en pacientes pediátricos (NCT0325764478), y otros ensayos en fase III incluyen adolescentes (NCT0374563879, NCT0374565180).
Delgocitinib tópicoDelgocitinib (Corectim®, Japan Tobacco/LEO Pharma), un inhibidor de JAK1, JAK2 y JAK3, se ha desarrollado como tratamiento tópico de la DA81. Los estudios en fase I y II82,83 probaron el concepto de eficacia terapéutica por lo que respecta a la gravedad de la enfermedad y el prurito. Se ha observado mejoría del prurito al cabo de un día del inicio de la aplicación de delgocitinib, probablemente debido a la inhibición de IL-31.
Recientemente se ha publicado un estudio que evalúa la eficacia y seguridad de delgocitinib 0,5% en pomada en 158 pacientes japoneses de 16 años o más con DA moderada a grave. El cambio medio porcentual en la puntuación EASI a las 4 semanas desde el inicio fue de -44,3% en el grupo delgocitinib y 1,7% en el grupo que se aplicó vehículo, y los resultados se mantuvieron a las 24 semanas. Tuvieron lugar efectos adversos, mayoritariamente leves, en el 4,7% de pacientes en el grupo tratado con delgocitinib y en el 1,9% de pacientes en el grupo que se aplicó vehículo. El efecto adverso más común fue nasofaringitis, seguido de erupción variceliforme de Kaposi y acné84.
Delgocitinib tópico al 0,5% (Corectim®) ha sido aprobado en Japón para el tratamiento de la DA85. Hay estudios en marcha evaluando diferentes concentraciones (NCT0372572286) e incluyendo pacientes pediátricos (NCT0382690187).
OtrosExiste un estudio en curso evaluando la eficacia y seguridad de SHR0302, un inhibidor de JAK1 (NCT0416289988), para el tratamiento de pacientes con DA moderada a grave. Otro estudio con brepocitinib tópico para la DA leve a moderada está pendiente de resultados (NCT03903822)89.
Otras aplicaciones en dermatologíaRecientemente los JAKi se han empleado para el tratamiento de otras entidades dermatológicas refractarias al tratamiento en las que la activación de la vía JAK/STAT tiene un papel clave, como se detalla en la tabla 1.
Uso de inhibidores de JAK en otras dermatosis. En la tabla se muestran los estudios realizados o en curso con inhibidores de JAK para el tratamiento de diferentes dermatosis, los principales resultados obtenidos y la seguridad de los mismos. La evidencia disponible con JAKi se basa principalmente en series de casos, aunque hay ensayos clínicos en curso
| Enfermedad | Inhibidor de JAK | Estudios | Resultados | Seguridad |
|---|---|---|---|---|
| Dermatomiositis | Tofacitinib oral | Kurtzman DJB, et al. (2016)90-n=3 (2 con DM clásica, 1 con DM amiopática)-Tofacitinib 5-10mg/12h (1 paciente hidroxicloroquina concomitante) | - Respuesta clínica a las 4 semanas- Periodo medio de tratamiento de 9,6 meses- Mejoría media en CDASI scores de 12 puntos- Mejoría del prurito en todos los pacientes- Mejoría de fuerza y la fatiga en todos los pacientes con DM clásica | No describen efectos adversos |
| Wendel S, et al. (2019)91-n=2- Paciente A: DM clásica con calcificaciones musculares y subcutáneas. Tratado con tofacitinib 5mg/12h+MTX 12,5mg/semana+PDN 5mg/día- Paciente B: DM clásica con calcificaciones y enfermedad pulmonar intersticial. CDASI 25. Tratado con tofacitinib 5mg/12h | - Paciente A: estabilización de las calcificaciones a las 2 semanas. A las 28 semanas calcificaciones estables o en regresión, sin aparición de úlceras acrales- Paciente B: mejoría de síntomas respiratorios, cutáneos y musculoesqueléticos. CDASI de 10 a las 12 semanas. A las 28 semanas CDASI de 3, sin aparición de nuevas calcificaciones y mejoría o estabilización de las previas | - Paciente A: hipercalcemia transitoria y moderada, incremento de peso- Paciente B: incremento de peso | ||
| NCT0300264992- Fase I- n=10- Pacientes con DM refractaria- Tofacitinib 11mg/24h. 12 semanas de tratamiento con periodo de extensión de 4 semanas | No dispone de resultados | No dispone de resultados | ||
| Ruxolitinib oral | Hornung T, et al. (2014)93- n=1- DM clásica, CDASI=30- Ruxolitinib 15mg/12h | - CDASI=0 a los 2 meses -Recuperación de fuerza muscular | No describen efectos adversos | |
| Fetter T, et al. (2020)94- n=1- DM clásica de 6 años de evolución+alopecia areata de 10 años evolución- Ruxolitinib 10mg/12h--> 30mg/24h | - A los 4 meses mejoría de las mialgias, fuerza muscular y lesiones cutáneas de DM. Recrecimiento de pelo y cejas | No describen efectos adversos | ||
| Jalles C, et al. (2020)95- n=1- DM clásica con MDA5+y neumonía intersticial rápidamente progresiva- Ruxolitinib 15mg/12h+corticoides 4mg/24h | - A los 9 meses estabilización clínica sin signos de actividad de la enfermedad a nivel muscular, pulmonar o cutáneo | Desarrolló un carcinoma pulmonar microcítico y se suspendió ruxolitinib | ||
| EICH cutánea | Ruxolitinib oral | Spoerl S, et al. (2014)96- n=4- Pacientes con EICH cutánea refractarios a corticoides y a 2 inmunosupresores previos. Área afecta 50%- Ruxolitinib oral 10mg/12h | - Reducción del área afectada a<25%- Respuesta en 1 semana y una semana y media | No describen efectos adversos |
| Zeiser R, et al. (2015)97-Estudio retrospectivo de 19 centros en Europa y Estados Unidos.- 95 pacientes con EICH refractaria a corticoides (EICH aguda n=54, EICH crónica n=41), todos moderada-grave.- Ruxolitinib 5-10mg/12h | - EICH aguda: la tasa de respuesta global fue de 81,5% (44/54), incluyendo 25 respuestas completas (46,3%). Mediana de tiempo hasta respuesta de 1,5 semanas.- EICH crónica: tasa de respuesta global de 85,4% (35/41), 78% respuesta parcial (32/41) y 7,3% respuesta completa (3/41). Mediana hasta respuesta de 3 semanas.- Los pacientes con afectación cutánea mostraron una respuesta muy satisfactoria. | Citopenias (55,6% en el grupo EICH aguda y 17,1% en EICH crónica)Reactivación CMV (33,3% en EICH aguda y 14,6% en EICH crónica) | ||
| Sarmiento M, et al. (2017)98- n=8- EICH refractaria a corticoides y fotoféresis extracorpórea. 3 pacientes EICH aguda (1 pulmonar, 2 cutáneo, 1 multisistémico), 5 pacientes EICH crónica (3 cutáneo)- Ruxolitinib oral 10-20mg/día | 85% obtuvieron respuesta y el 50% respuesta completa | 2 pacientes precisaron reducción de dosis por neutropenia grado 2 | ||
| Ensayos en curso:- Fase II: NCT03491215NCT02953678NCT03616184- Fase III:NCT02913261NCT03112603 | No dispone de resultados | No dispone de resultados | ||
| Itacitinib oral | Ensayos en cursoFase I: NCT03497273Fase II: NCT03846479Fase III: NCT03584516 | No dispone de resultados | No dispone de resultados | |
| Ruxolitinib tópico | Ensayos en cursoFase II NCT03395340 | No dispone de resultados | No dispone de resultados | |
| Baricitinib oral | Ensayos en cursoFase I/II: NCT02759731 | No dispone de resultados | No dispone de resultados | |
| Hidradenitis supurativa | Tofacitinib oral | Savage KT et al. (2020)99- n=2- Paciente A: HS estadio de Hurley III. Tratado con tofacitinib 5mg/12h+amoxicilina 500mg/12h+ciclosporina 5mg/kg- Paciente B: HS estadio de Hurley III. Tofacitinib 5mg/12h+amoxicilina-clavulánico 3 semanas+azitromicina 1 semana+MMF 1250mg/12h+corticoides tópicos | - Paciente A: a los 4 meses disminución del dolor y del número de lesiones, permitiendo reducción de ciclosporina. A los 11 meses sin dolor y persistencia solo de lesiones inactivas- Paciente B: disminución de hospitalizaciones, mejoría de las úlceras | - Paciente A. sin efectos adversos- Paciente B: herpes zóster a los 3 años del inicio |
| INCB054707 oral (inhibidor JAK1) | Ensayos en cursoFase II:NCT03607487NCT03569371 | No dispone de resultados | No dispone de resultados | |
| Liquen plano | Tofacitinib oral | Yang CC, et al. (2018)100- Liquen plano pilar n=10- Tofacitinib 10-15mg/día durante 2-19 meses.- Tratamiento adyuvante: triamcinolona intralesional (2 pacientes), HCQ (1 paciente), triamcinolona intralesional+HCQ (1 paciente), triamcinolona IL+pomada tacrolimus (1 paciente) | - Respuesta clínica en 8 pacientes (4 en monoterapia y 4 con tratamiento adyuvante)- LPPAI inicial 6,22 y postratamiento 3,08. Reducción en LPPAI entre 30-94%. | 1 paciente incremento de peso (4,5kg a los 12 meses del inicio) |
| Damsky W, et al. (2020)101- n=3 con liquen plano erosivo refractario a tratamientos previos (paciente 1: prednisona, metilprednisolona; paciente 2: metotrexato, micofenolato mofetilo, ciclosporina; paciente 3: prednisona, acitretino).- Tofacitinib 5mg/12h- El paciente 1 recibió tratamiento adyuvante con MTX y PDN 10mg diarios | - Paciente A: Remisión de síntomas y de lesiones. Al suspender tofacitinib y MTX presentó recurrencia, al reintroducir tofacitinib se observó nuevamente mejoría- Paciente B: desaparición del dolor y sangrado. Remisión de las lesiones.- Paciente C: desaparición del dolor. Remisión de las lesiones. | No describen efectos adversos | ||
| Ruxolitinib tópico | Ensayos en cursoFase II NCT03697460 | No dispone de resultados | No dispone de resultados | |
| Lupus eritematoso cutáneo | Ruxolitinib oral | Wenzel J, et al. (2016)102- n=1Paciente con mielofibrosis primaria y perniosis lúpica-Ruxolitinib 20mg/12h | Remisión completa de las lesiones cutáneas a los 4 meses | No describen efectos adversos |
| Baricitinib oral | Wallace DJ, et al. (2018)103- Ensayo fase II, 24 semanas- n=314, randomizados a placebo, baricitinib 2mg/día o baricitinib 4mg/día (1:1:1)- Pacientes con LES. El 84% tenían actividad mucocutánea medida por SLEDAI-2K, aunque con CLASI bajo | No se observó mejoría significativa en las lesiones cutáneas.El CLASI basal era de 4,2 lo que podría ser insuficiente para hallar diferencias entre placebo y grupo de tratamiento. | En el grupo baricitinib 4mg 6% infecciones graves, en el grupo 2mg un 2% y en el grupo placebo 1%.Baricitinib resultó en disminución dosis dependiente de hemoglobina, neutrófilos y triglicéridos, e incremento de plaquetas, CK, colesterol HDL y colesterol total | |
| Tofacitinib oral | Ensayos en cursoFase I: NCT03159936 | No dispone de resultados | No dispone de resultados | |
| Eccema crónico de manos | Delgocitinib tópico | Ensayos en cursoFase II:NCT03683719NCT02664805 | No dispone de resultados | No dispone de resultados |
| Pioderma gangrenoso | Tofacitinib oral | Gregory MH, et al. (2019)104- n=1.- Tofacitinib 10mg/12h oral+infliximab 10mg/kg (cada 4semanas) | A las 3 semanas de añadir tofacitinib la lesión estaba prácticamente curada | No describen efectos adversos |
| Kochar B, et al. (2019)105- n=3. Enfermedad de Crohn y PG refractario- Tratados con tofacitinib 5-10mg/12h para artritis inflamatoria grave | - Paciente A. A las 2 semanas mejoría, a las 12 semanas resolución del PG-Paciente B: PG curó completamente a las 12 semanas- Paciente C: Mejoría de las lesiones al mes pero requirió incremento de dosis a 10mg/12h para la resolución completa | No describen efectos adversos | ||
| Ruxolitinib oral | Nasifoglu S, et al. (2018)106- n=1- Policitemia vera concomitante con JAK2 mutado | Mejoría rápida del PG y a los 4 años desaparición de la lesión | No describen efectos adversos | |
| Sarcoidosis cutánea | Tofacitinib oral | Damsky W, et al. (2019)107- n=3- Tofacitinib 5mg/12h | 2 pacientes presentaron respuesta completa1 paciente perdió el seguimiento después de una mejoría del 96% en CSAMI a los 4 meses | No describen efectos adversos |
| Granuloma anular | Tofacitinib oral | Damsky W, et al. (2019)107- n=1- Tofacitinib 5mg/12h | Respuesta completa | No describen efectos adversos |
Ensayos en curso obtenidos de Clinicaltrials.gov108.
CDASI: Cutaneous Dermatomyositis Disease Area and Severity Index; CK: creatin kinasa; CLASI: Cutaneous Lupus Erythematosus Disease Area and Severity Index; CMV: citomegalovirus; CSAMI: cutaneous sarcoidosis activity and morphology instrument;DM: dermatomiositis; EICH: enfermedad del injerto contra el huésped; HCQ: hidroxicloroquina; HS: hidradenitis supurativa; LES: lupus eritematoso sistémico; LPPAI: Lichen Planopilaris Activity Index; MMF: micofenolato mofetilo; MTX: metotrexato; PDN: prednisona; PG: pioderma gangrenoso; SLEDAI-2K: Systemic Lupus Erythematosus Disease Activity Index-2000.
La disregulación de la vía JAK/STAT podría intervenir en la patogenia de muchas enfermedades dermatológicas, incluyendo el vitíligo, la alopecia areata, la psoriasis y la DA. Los JAKi se podrían usar para tratar simultáneamente diferentes enfermedades inflamatorias cutáneas con similitudes patogenéticas y vías de señalización compartidas, con un perfil de seguridad aceptable.
Por lo que respecta a la psoriasis moderada a grave, tofacitinib se ha evaluado en ensayos en fase I, II y III, que muestran eficacia especialmente a dosis de 10mg/12h, aunque no ha sido aprobado por los comités regulatorios. Datos recientes sugieren que los inhibidores de TYK2 podrían ofrecer resultados prometedores para el tratamiento de la psoriasis. Uno de ellos, deucravacitinib, ha mostrado la máxima eficacia como tratamiento oral para la psoriasis hasta la fecha. Las opciones terapéuticas en DA son actualmente limitadas pero los JAKi orales y tópicos han demostrado resultados esperanzadores, con reducciones en la gravedad de la DA y una rápida y marcada mejoría del prurito y la calidad de vida. Recientemente baricitinib ha sido aprobado para el tratamiento de la dermatitis atópica moderada a grave en adultos.
Los JAKi en un futuro podrían ser una alternativa terapéutica real para algunas enfermedades inflamatorias de la piel. Los inhibidores selectivos tienen un perfil de eficacia/seguridad superior, mientras que los no selectivos se están desarrollando principalmente por vía tópica. La inhibición de múltiples señales, y en especial de la respuesta a interferón, podría determinar una mayor susceptibilidad a infecciones y reactivaciones víricas; aunque por el momento el perfil de eficacia/seguridad parece favorable, son precisos más estudios para evaluar las dosis óptimas para optimizar la eficacia, coste-efectividad y seguridad a largo plazo de esta clase terapéutica en sus posibles indicaciones dermatológicas.
Conflicto de interesesC. Garcia-Melendo declara no tener conflicto de intereses.
X. Cubiró ha recibido honorarios de Novartis, Leo-Pharma y Almirall.
L. Puig ha recibido honorarios y/o ha participado en ensayos clínicos patrocinados por Abbvie, Almirall, Amgen, Baxalta, Biogen, Boehringer Ingelheim, Celgene, Gebro, Janssen, JS BIOCAD, Leo-Pharma, Lilly, Merck-Serono, MSD, Mylan, Novartis, Pfizer, Regeneron, Roche, Sandoz, Samsung-Bioepis, Sanofi, y UCB.