Los medicamentos industriales comercializados para uso tópico oral son muy escasos y con vehículos poco adecuados. En consecuencia, frecuentemente hay que recurrir a preparados magistrales que permitan aplicar principios activos en vehículos diseñados especialmente para su aplicación en la mucosa oral. La formulación magistral también permite incluir varios principios activos en un mismo vehículo y prescribir fármacos actualmente en desabastecimiento, entre otras ventajas. Describimos las principales fórmulas magistrales para el tratamiento de la patología de la mucosa oral más frecuente.
Commercial topical medications for oral conditions are scarce and the vehicles used are not very suitable. Therefore, formulations containing active ingredients in vehicles specially designed for oral application must often be prepared. Drug compounding offers other advantages, including the possibility of combining several active ingredients in a single vehicle and prescribing drugs that are in short supply. In this article, we describe the main pharmaceutical formulations used to treat the most common diseases of the oral mucosa.
La mucosa oral presenta una estructura anatómica y funcional muy diferente a la de la piel. Sus condiciones especiales de permeabilidad, humedad y motilidad dificultan la aplicación de tratamientos tópicos. Se precisan vehículos adecuados para ser aplicados en esta región, y actualmente se dispone de un escaso arsenal comercializado terapéutico específico. En la práctica clínica diaria, en el tratamiento de las lesiones de la mucosa oral hay que recurrir a la formulación magistral en la mayoría de ocasiones.
Vehículos adecuados para la mucosa oralApenas existen medicamentos comercializados para su uso en la mucosa oral, por lo que en ocasiones se utilizan los medicamentos de aplicación cutánea. Cuando se aplica una emulsión a nivel de la mucosa oral, dado que dicha mucosa es hidrófila y posee una continua motilidad, la emulsión desaparece rápidamente y obliga a repetir la aplicación, lo que puede comportar problemas de absorción sistémica de diversos principios activos. Los vehículos muy grasos, por el contrario, resbalan y son difíciles de aplicar en los lugares adecuados1,2.
Los vehículos apropiados para esta zona son:
- •
Excipiente adhesivo oral (EAO). Consiste en un vehículo graso (vaselina) que contiene un alto número de gelificantes hidrófilos (carboximetilcelulosa sódica, gelatina, pectina, etc.) que permiten una fijación del vehículo en la mucosa a la vez que una cesión más lenta de los principios activos a la misma, pero dan una textura granulosa que en ocasiones no es agradable para los pacientes. Su fijación se mantiene unos 30min, aunque el efecto terapéutico puede prolongarse más. Permite tratar lesiones localizadas. Se recomienda secar la mucosa antes de la aplicación y no comer ni beber durante al menos 30min después de la misma.
- •
Gel adhesivo oral. En este caso el vehículo está constituido por polioles (glicerina y sorbitol principalmente) junto con el gelificante. La avidez por la humedad de la mucosa es menor que en el EAO y también su capacidad adhesiva, pero su textura y su sabor son mejores. También permite tratar lesiones localizadas, y está indicado para los pacientes que no toleran la textura del EAO.
- •
Soluciones-suspensiones. Son soluciones acuosas que contienen principios activos en solución o suspensión dependiendo de la solubilidad en medio acuoso de los principios activos que contengan. Permiten tratar lesiones múltiples en la mucosa oral. En algunos casos deben ser soluciones hidroalcohólicas para poder incorporar principios activos, como la nistatina o el clotrimazol, pero deben tener un bajo contenido en etanol para no irritar la mucosa.
- •
Comprimidos bucales. Son comprimidos que tienen un tiempo de disgregación más alto que los convencionales, permitiendo una cesión más lenta de los principios activos.
- •
Caramelos infantiles (lollipops). Constituidos por una base de polietilenglicoles con una buena saborización y con un soporte que permite aplicarlo como un caramelo, están indicados especialmente en la población infantil.
En la tabla 1 se especifican las características de los principales vehículos.
Vehículos para la mucosa oral
| Excipiente adhesivo oral | Gel adhesivo oral | Colutorio, spray bucal | |
|---|---|---|---|
| Componentes | Vaselina +gelificante | Polioles +gelificante | Agua +polioles |
| Ventajas | Mayor permanencia | Mejor sabor y textura (mentolado) | Solubilizar activos |
| Aplicación | Permite focalizar sobre las lesiones por su adhesividad | Permite la aplicación sobre toda la mucosa en general |
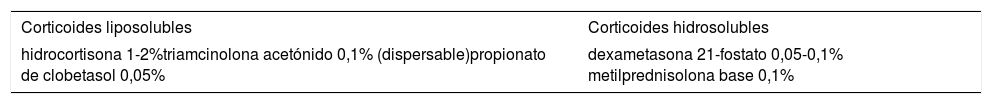
En el liquen plano oral (LPO) precisan tratamiento especialmente la forma erosiva y las formas reticulares/hipertróficas extensas sintomáticas. Los corticoides tópicos son el tratamiento de elección. Principalmente se utiliza el propionato de clobetasol al 0,05%, aunque al 0,025% también ha demostrado ser eficaz3. Incluso no se han encontrado diferencias entre la respuesta al tratamiento con prednisona sistémica frente a propionato de clobetasol tópico en base adhesiva4. El vehículo más adecuado es el EAO, pero si el paciente no tolera su textura también se puede vehiculizar en un gel adhesivo oral. Para las lesiones múltiples se recomiendan enjuagues con una solución donde se incorpore dexametasona. La dexametasona es hidrosoluble, a diferencia de la mayoría de corticoides, que son liposolubles, y por ello es la más adecuada para incorporarla en una solución. El uso de un tratamiento antimicótico concomitante es seguro y eficaz en la profilaxis de la candidiasis mucosa5.
Existen varios estudios que describen la eficacia del acetónido de triamcinolona tópico al 0,1% aplicado de 2 a 4 veces al día6, pero en la experiencia clínica de los autores esta eficacia es mucho menor que la del propionato de clobetasol 0,05% aplicado dos veces al día.
Cuando se aplican los corticoides en solución se debe advertir al paciente que realice enjuagues manteniendo el contenido durante unos minutos y que no ingiera la solución. Se ha descrito que los pacientes prefieren el aerosol a los enjuagues7, pero en la experiencia clínica de los autores los enjuagues son más eficaces, aunque el EAO es el vehículo de elección siempre que sea posible.
En la tabla 2 se describe la solubilidad de los principales corticoides tópicos disponibles para formulación en mucosa oral. Conviene señalar que el acetónido de triamcinolona, aunque no se puede formular en una solución acuosa, sí puede incluirse en una suspensión.
En varios estudios se ha demostrado que el tacrolimus tópico puede ser eficaz y seguro, con una absorción sistémica muy baja y pocos efectos secundarios locales8. Se considera la siguiente alternativa al uso de corticoides tópicos. La mejoría se inicia a las pocas semanas de la aplicación, controla los síntomas, aclara las lesiones y en general es bien tolerado, pero hay que advertir que puede aparecer ardor, especialmente con las primeras aplicaciones. Para algunos autores, el tacrolimus debería ser considerado como la primera línea en el tratamiento del LPO9. En las distintas publicaciones utilizan la pomada o la solución de uso oral comercializadas. La formulación permite utilizar un vehículo adecuado, ya que el uso de la pomada comercializada es desagradable para los pacientes y no permite una buena adhesividad a la mucosa. Consideramos un EAO como el vehículo más apropiado.
Los retinoides, el ácido retinoico al 0,1% y el ácido 13 cis-reticoico al 0,1%, son útiles en las formas queratósicas para restaurar la diferenciación epitelial anómala, aunque pueden producir irritación local10. En nuestra experiencia combinamos el retinoide con el corticoide tópico con una tolerancia buena. No parece haber diferencias de eficacia entre el ácido retinoico y el ácido 13 cis-retinoico. Por otra parte, se ha establecido que los retinoides son eficaces en el tratamiento del LPO en comparación tanto con placebo como con betametasona11,12.
La ciclosporina tópica en forma de solución oleosa o en base adhesiva se prescribe cada vez menos por su elevado coste, su posible absorción sistémica y su posible acción carcinogénica13. La mayoría de los estudios no han demostrado que sea más eficaz que los corticoides tópicos14. En nuestra opinión, en un paciente con LPO recalcitrante a las terapias convencionales es preferible utilizar la rapamicina tópica, a pesar de que solo se ha publicado una serie de 7casos de LPO resistentes a corticoides tratados con este principio activo, donde 4pacientes presentaron remisión completa del brote15. Actualmente, dado que se ha ampliado el uso de la rapamicina tópica en otras patologías como los angiofibromas, ha disminuido su coste y permite su prescripción gracias a la formulación magistral en el excipiente adhesivo oral como vehículo más adecuado.
El aloe vera también se puede incluir en las fórmulas magistrales por su efecto antiinflamatorio con muy buena tolerancia. Aunque se ha sugerido que la aplicación de aloe vera en gel presenta una eficacia significativamente superior al acetónido de triamcinolona al 0,1% en pacientes con LPO16, hacen falta más estudios para corroborarlo17. En nuestra experiencia, el uso de aloe vera consigue respuestas parciales y en raras ocasiones respuestas completas, y se podría considerar como un ahorrador de corticoides. La formulación magistral permite su combinación con otros principios activos.
En un estudio aleatorizado, doble ciego, en el que se comparaba la aplicación de un gel con extracto de manzanilla al 2% con placebo en pacientes con LPO, el uso del gel de manzanilla, tres veces al día, mejoraba los síntomas y las lesiones18. Al extracto de manzanilla se le han atribuido propiedades antiinflamatorias, antiespasmódicas, antibacterianas y antifúngicas. Los ingredientes activos de la manzanilla incluyen las esencias azoleno y camozolena, así como los flavonoides, siendo los responsables de estas propiedades. En nuestra experiencia no lo recomendamos como monoterapia, pero sí como un vehículo para un corticoide tópico o como tratamiento sintomático coadyuvante.
Por las propiedades antiinflamatorias, la tetraciclina se ha probado en el tratamiento del LPO con éxito en algún caso aislado19. Puede ser una alternativa terapéutica cuando los tratamientos clásicos no han sido eficaces.
La terapia fotodinámica se podría considerar una alternativa para el LPO resistente a tratamientos convencionales, aunque faltan aún más estudios bien diseñados para demostrar su eficacia20. Se ha descrito tanto con azul de metileno al 5% como con ácido 5-aminolevulínico del 5 al 20%, ambos formulables21-23. Carecemos de experiencia con esta modalidad terapéutica, pero solamente la formulación magistral permitiría este tratamiento.
Las fórmulas propuestas para el tratamiento del LPO se detallan en la tabla 3.
Formulación magistral en el tratamiento del liquen plano oral
| propionato de clobetasol (0,025- 0,05%)clotrimazol 1%excipiente adhesivo oral c.s.p. 40 g | ácido retinoico 0,1%propionato de clobetasol 0,05%clotrimazol 1%excipiente adhesivo oral 40 g |
| dexametasona 21-fosfato 0,2%solución acuosa c.s.p. 50 ml | tacrolimus 0,1%excipiente adhesivo oral c.s.p. 30 g |
| aloe vera 70%sorbitol 20%gel acuoso c.s.p. 100 ml | propionato de clobetasol 0,05%gel de aloe vera c.s.p. 50 g |
| rapamicina 0,2%excipiente adhesivo oral c.s.p. 30 g | extracto de manzanilla 2%gel fluido c.s.p. 250 ml |
| propionato de clobetasol 0,05%gel de manzanilla c.s.p. 100 g | extracto de manzanilla 2%aloe vera 50%gel fluido c.s.p. 250 ml |
| ciclosporina 0,025-0,05%excipiente adhesivo oral c.s.p. 50 g | ciclosporina 5-10%solución oleosa c.s.p. 40 ml |
| tetraciclina 2,5%agua-glicerol c.s.p. 100 ml | azul de metileno 2%excipiente adhesivo oral c.s.p.30g(para aplicación en consulta) |
| 5-aminolevulínico 5-20%excipiente adhesivo oral c.s.p. 30 g(para aplicación en consulta u hospitalaria) | |
La lengua geográfica no suele requerir tratamiento, salvo cuando es sintomática. El tratamiento sintomático se basa en la aplicación de corticoides tópicos, asociados o no a lidocaína o sucralfato24. Se ha descrito una experiencia favorable con tacrolimus tópico25. Estas fórmulas se detallan en la tabla 4.
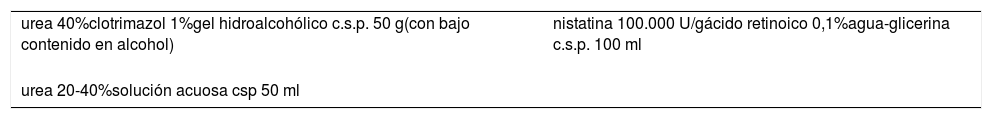
Lengua negra vellosaEl tratamiento de la lengua negra vellosa incluye, en primer lugar, el abandono de fármacos que puedan estar implicados, el aumento de la higiene dental y la discontinuación de hábitos que predispongan a esta patología. Aunque solo hay publicaciones de casos anecdóticos en relación con el tratamiento con retinoides o urea tópicos26, por la experiencia personal recomendamos cepillar la zona afecta con un cepillo impregnado con uno de estos agentes queratolíticos (ácido retinoico al 0,1% o urea al 40%) asociado a un fármaco antifúngico (clotrimazol o nistatina) por la posible implicación de Candida albicans27. Las soluciones con urea a una concentración mayor del 30% tienen poca estabilidad y pueden desprender amoníaco, por lo que es necesario estabilizar la solución con una ligera acidificación; el farmacéutico formulador es conocedor de este problema. Hay que tener en cuenta que si a las soluciones acuosas de urea se quiere añadir un antifúngico, la falta de solubilidad en agua del antifúngico obliga a cambiar el vehículo. Un recurso es formular un gel con un bajo contenido en alcohol (20%), al cual se le puede incorporar el clotrimazol. Para utilizar la nistatina se recomienda una solución glicérica. Estas fórmulas se describen en la tabla 5.
AftosisLa elección del tratamiento en la aftosis tiene como objetivo acelerar la curación y reducir el dolor. Después de valorar la frecuencia de las recidivas y la gravedad instauraremos el tratamiento más adecuado. Tras eliminar los posibles desencadenantes y/o tratar las alteraciones asociadas pautaremos un tratamiento médico.
De primera línea son los corticoides tópicos, que tanto van a acortar la duración de las aftas como a disminuir el dolor. Se selecciona un corticoide u otro y el vehículo correspondiente según la gravedad y la extensión de las lesiones; los más frecuentemente descritos son el acetónido de triamcinolona al 0,1% y, en menor medida, la dexametasona al 0,2%28,29. De nuevo hay que de tener en cuenta la solubilidad de los corticoides antes de elegir un vehículo, tal como se ha señalado anteriormente. En la actualidad la industria farmacéutica comercializa hidrocortisona para uso tópico oral, pero es insuficiente en casos de brotes extensos o graves, y es en estos casos en los que hay que recurrir a la formulación magistral.
Una de las principales ventajas de la formulación magistral es poder incorporar varios principios activos en un solo vehículo. Se pueden añadir al corticoide:
- a)
Tetraciclinas y sus derivados (minociclina, doxiciclina), por su efecto antiinflamatorio y porque suprimen la actividad de la colagenasa contribuyendo a la cicatrización30,31.
- b)
Sucralfato, protector de la mucosa gástrica que forma una película sobre el afta y favorece su cicatrización.
- c)
Difenhidramina, antihistamínico con efecto anestésico cuando se aplica a nivel de la mucosa oral.
- d)
Lidocaína, para disminuir el dolor32.
- e)
Diclofenaco, por su acción antiinflamatoria; se puede formular en un gel de ácido hialurónico (esta asociación es superior a la lidocaína y al ácido hialurónico en monoterapia33).
- f)
Aloe vera, que acorta el tiempo de curación de las aftas y disminuye el dolor en casos anecdóticos34.
- g)
Ácido hialurónico, que actúa como demulcente, protector de la mucosa oral, inmunomodulador y reparador celular. Su aplicación ha demostrado ser segura y eficaz, tanto en la aftosis recidivante, como en la enfermedad de Behçet35.
Las fórmulas propuestas se describen en la tabla 6.
Formulación magistral en el tratamiento de la aftosis
| sucralfato (4-6%)tetraciclina 2%triamcinolona 0,1%excipiente adhesivo oral c.s.p. 40 g | lidocaína base 2%triamcinolona 0,1%excipiente adhesivo oral c.s.p. 50 g |
| tetraciclina 2-2,5%acetónido de triamcinolona 0,1%clorfeniramina 0,2%sucralfato 2%agua-glicerol c.s.p. 100 ml | ácido hialurónico 0,5%aloe vera 20%agua c.s.p. 100 ml |
| ácido hialurónico 1%aloe vera 20%dexametaso21-fosfato 0,05%agua c.s.p. 100 ml | diclofenaco 3%ácido hialurónico 2%gel acuoso c.s.p. 50 g |
| minociclina 1,5%%triamcinolona acetónido 0,1%agua-glicerol c.s.p. 100 ml | dapsona csp 50mg por cápsulan.° de cápsulas=90 |
En cuanto a los tratamientos orales, sobre todo prescritos para evitar recidivas, la colchicina es de primera elección, pero si esta no es eficaz se puede añadir un tratamiento con dapsona36. La formulación permitirá la prescripción de dapsona por no estar comercializada en España, a menos que sea en un medio hospitalario, donde podrá ser dispensada como medicamento extranjero.
Queilitis actínicaCuando en la queilitis actínica las alternativas como la terapia física o cirugía, que presentan mayor eficacia, no sean las modalidades de elección será preciso el medicamento individualizado. Entre los tratamientos tópicos, el 5-fluorouracilo al 5% es el que presenta mayor nivel de evidencia en monoterapia37, pero la terapia fotodinámica asociada de forma secuencial a imiquimod tópico al 5% es el tratamiento más eficaz después del tratamiento con láser y la cirugía38. Actualmente el 5-fluorouracilo al 5% no está comercializado, ni existe un vehículo apropiado para ser aplicado a nivel labial, de modo que la formulación magistral ofrece esta alternativa terapéutica. Como vehículo es preferible el ‘cold cream’, dado que es una emulsión o/w con alto contenido graso. El imiquimod al 5% o el diclofenaco al 3%, pese a que el nivel de evidencia es menor, pueden ser alternativas terapéuticas. En el caso del imiquimod, cuando ha habido un desabastecimiento se ha podido seguir utilizando gracias a la formulación. Los detalles de estas fórmulas se incluyen en la tabla 7.
XerostomíaCon independencia del tratamiento de la enfermedad de base causante de la xerostomía y de la prevención de las complicaciones, la estrategia terapéutica tiene como objetivo aumentar la producción de saliva cuando aún existe función residual de las glándulas salivares. El zumo de limón es un estimulante natural pero produce desmineralización de los dientes. Se puede formular una solución de ácido cítrico al 3,5% pero saturado con fosfato dicálcico para evitar la desmineralización39.
Actualmente existe evidencia de que el uso de pilocarpina es útil en el tratamiento de la hiposalivación teniendo en cuenta sus contraindicaciones y sus efectos secundarios. En un estudio reciente se comparó la pilocarpina oral a dosis de 15mg al día, aplicada en forma de gotas, frente a saliva artificial, tres veces al día, en un grupo de pacientes con síndrome de Sjögren40. El grupo tratado con pilocarpina mostró una mejoría significativa del flujo salivar40.
La formulación de pilocarpina permite su elaboración en dosis inferiores, si es necesario, para evitar efectos secundarios, así como realizar solución para los pacientes con dificultad para la ingestión de cápsulas o comprimidos. Además, es un fármaco con repetidos periodos de desabastecimiento.
Hay pacientes con una capacidad nula o prácticamente nula de producción de saliva que requieren el uso de saliva artificial. Dado que existen múltiples salivas artificiales comercializadas, en pocas ocasiones será necesaria su formulación magistral. A modo de ejemplo, en la tabla 8 se adjuntan posibles fórmulas que, al ser individualizadas para el paciente, se pueden seleccionar los componentes que más se adapten en sus propiedades organolépticas a su gusto.
Formulación magistral en el tratamiento de la xerostomía
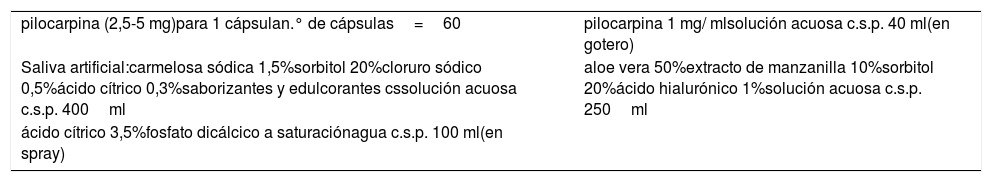
| pilocarpina (2,5-5 mg)para 1 cápsulan.° de cápsulas=60 | pilocarpina 1 mg/ mlsolución acuosa c.s.p. 40 ml(en gotero) |
| Saliva artificial:carmelosa sódica 1,5%sorbitol 20%cloruro sódico 0,5%ácido cítrico 0,3%saborizantes y edulcorantes cssolución acuosa c.s.p. 400ml | aloe vera 50%extracto de manzanilla 10%sorbitol 20%ácido hialurónico 1%solución acuosa c.s.p. 250ml |
| ácido cítrico 3,5%fosfato dicálcico a saturaciónagua c.s.p. 100 ml(en spray) |
Además de las formulaciones de salivas clásicas con gelificantes y sales minerales, el uso de colutorios hidratantes con aloe vera y otros extractos, polioles y ácido hialurónico tiene buena aceptación por los pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.