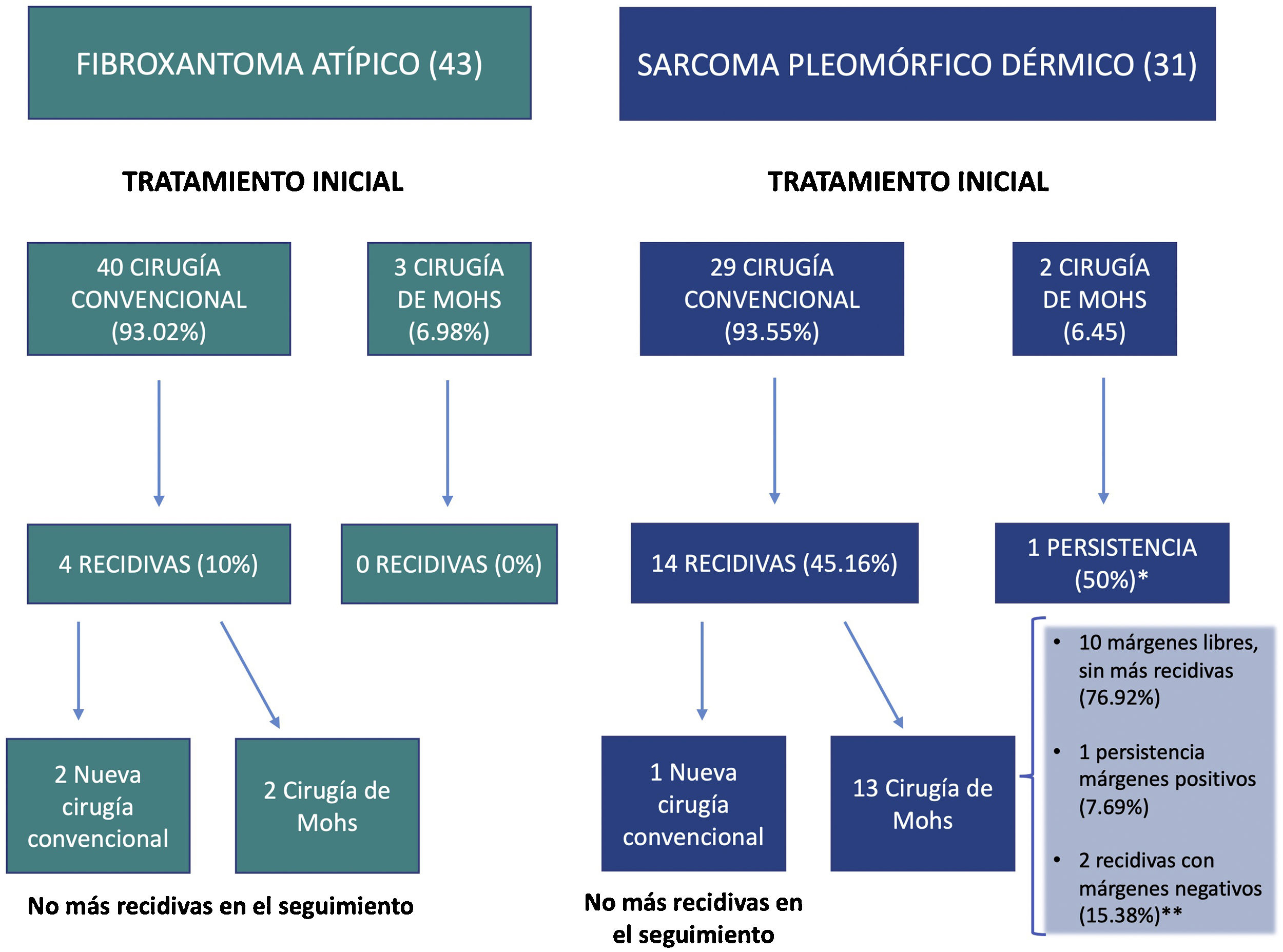
El fibroxantoma atípico (FXA) y el sarcoma pleomórfico dérmico son neoplasias mesenquimales poco frecuentes1–4. Históricamente, la clasificación de estos tumores se ha basado en una terminología cambiante y poco precisa, lo cual ha dificultado su estudio, y hasta recientemente eran escasos los datos disponibles respecto a su potencial de agresividad2,5. En el año 2012 se acuñó el término sarcoma pleomórfico dérmico (SPD) para describir las neoplasias dérmicas sin una clara diferenciación celular y con unas características histológicas superponibles a las del FXA, pero con unas características clínicas y/o histológicas de agresividad1,2,4. La presencia de necrosis, invasión linfovascular o perineural, y/o invasión evidente del tejido celular subcutáneo son los criterios histopatológicos definitorios del SPD1,2,4. Actualmente, el FXA y el SPD tienden a ser considerados parte de un espectro común, con unas características epidemiológicas e histológicas generales superponibles, pero con un comportamiento clínico y un grado de agresividad diferente3,6. En el presente estudio revisamos 43 FXA y 31 SPD diagnosticados y tratados entre los años 2005 y 2020 en el Instituto Valenciano de Oncología y en el Hospital Clínico Universitario de Valencia, con el objetivo de identificar las diferencias en las características clínico-patológicas y el comportamiento de ambos tumores. Las características clínicas e histológicas evaluadas están recogidas en el material suplementario (tablas suplementarias 1-4), así como los análisis estadísticos realizados. En todos los casos se confirmó la ausencia de una línea de diferenciación celular definida, requiriéndose de una ausencia de tinción con S100, desmina, pancitoqueratina (CKAE1-AE3) y CD34. En algunos casos se realizaron, además, tinciones adicionales incluyendo CD10, CD31 y actina de músculo liso (SMA), entre otros. El 94,6% de los casos fueron varones (70), con una mediana de edad de 79,5 años. Un 97,3% de los pacientes presentaron antecedentes de fotoexposición crónica y la localización más frecuente fue el cuero cabelludo (58,1%). El tamaño mediano de las lesiones fue de 15mm de diámetro (rango: 5-60mm). El tiempo de evolución mediano desde la aparición de la lesión hasta el diagnóstico fue de 3 meses (rango 1-48 meses). Respecto a las características clínicas y epidemiológicas generales, no existieron diferencias significativas entre ambos tumores en cuanto a la distribución por sexo, edad, localización del tumor ni por el tiempo de evolución hasta el diagnóstico. El tamaño mediano de los FXA fue de 13,5mm, mientras que el de los SPD fue de 23mm (p<0,001) (tabla 1). No se observaron diferencias significativas entre FXA y SPD respecto al patrón de crecimiento tumoral, el grado de pleomorfismo celular, el tipo celular predominante, el número de mitosis, la ulceración, el grado de inflamación, la localización predominante del componente inflamatorio y el tipo de células inflamatorias predominante. El espesor tumoral mediano de los SPD (7,2mm) fue significativamente superior al de los FXA (4,1mm). Además, hallamos diferencias significativas en la zona de invasión máxima y en la presencia de necrosis, invasión linfovascular, invasión perineural e invasión del tejido celular subcutáneo (tabla 1). En conjunto, 18 casos (24,3%) recidivaron tras el primer tratamiento, de los cuales 4 (22,2%) fueron FXA y 14 (77,8%) SPD. Ocho casos (10,8%) fueron localmente avanzados en algún momento de la evolución, siendo todos ellos SPD (fig. 1). La mediana de seguimiento fue de 16 meses (rango 1-228). Cuatro casos (5,4%) presentaron metástasis (uno ganglionar, 2 pulmonares y uno pulmonar y cerebral) y 3 casos (4,1%) fallecieron a consecuencia de la enfermedad, tratándose en todos los casos de SPD. Por último, se realizó un análisis de supervivencia mediante el estimador de Kaplan-Meier, encontrando diferencias significativas entre ambos tumores: la supervivencia libre de enfermedad a 2 años fue de 88,2% para el FXA, frente a 46,7% para el SPD (hazard ratio 6,1; IC 95% HR: 2,017-18,753; log-rank p<0,001; fig. 2).
Características clinicopatológicas que mostraron diferencias entre fibroxantoma atípico y sarcoma pleomórfico dérmico
| Característica | FXA | SPD |
|---|---|---|
| Tamaño tumoral (mm) | Media 14,5Mediana 13,5 | Media 25,2Mediana 23 |
| Espesor tumoral (mm) | Media 4,04Mediana 4,1 | Media 7,7Mediana 7,2 |
| Zona de invasión máxima | Dermis | Uno dermis17 TCS9 galea aponeurótica3 cartílagoUno músculo |
| Necrosis | Ninguno | 10/31 |
| Invasión vascular | Ninguno | 12/31 |
| Infiltración perineural | Ninguno | 10/31 |
| Infiltración del TCS | Ninguno | 30/31 |
| Recidiva | Ninguna 39Una recidiva 3 Más de una recidiva uno | Ninguna 17Una recidiva 5Más de una recidiva 9 |
| SLE a 2 años | 88,2% | 46,7% |
FXA: fibroxantoma atípico; SLE: supervivencia libre de enfermedad; SPD: sarcoma pleomórfico dérmico; TCS: tejido celular subcutáneo.
Debido a la confusión histórica que ha rodeado la clasificación de estos tumores, el comportamiento y el verdadero potencial de agresividad del FXA y el SPD eran relativamente desconocidos hasta recientemente2–4,7. Hace años, el término de FXA se utilizó para designar tumores cutáneos, incluyendo aquellos con extensión subdérmica, y se describieron varios casos de FXA con afectación metastásica locorregional y sistémica1–3,7. Sin embargo, en revisiones más recientes se ha esclarecido que estos tumores hoy en día serían diagnosticados como SPD, o incluso como tumores mesenquimales con orígenes diferentes al dérmico3. Desde la introducción del término de SPD, la publicación de series bien definidas de FXA y SPD ha permitido caracterizar mejor el comportamiento de estos tumores. Utilizando criterios diagnósticos estrictos, el FXA tiene un comportamiento clínico eminentemente benigno, mientras que el SPD puede presentar una agresividad local en un porcentaje no desdeñable, e incluso metástasis a distancia1–3,5,8,9. Sin embargo, aún no se ha identificado qué factores de riesgo permiten predecir un peor pronóstico, y tampoco existe un consenso amplio respecto al tratamiento y al seguimiento de estos tumores3,7. En el tratamiento del FXA la cirugía de Mohs es superior a la cirugía convencional10, pero aún no hay datos suficientes en SPD (aunque estudios recientes sugieren que la cirugía de Mohs sería más útil)6. En nuestra serie, en concordancia con la literatura disponible, no encontramos diferencias entre las características clínico-patológicas generales de ambos tumores, pero sí para aquellas relacionadas con la agresividad (tamaño tumoral, espesor tumoral, porcentaje de recidivas). Un porcentaje importante de SPD recidivó tras el tratamiento con cirugía convencional (fig. 1), y la supervivencia libre de enfermedad a los 2 años fue significativamente superior para FXA. En conclusión, presentamos una serie amplia y bien caracterizada de FXA y SPD, en la que se evidencian las similitudes clínico-patológicas generales de ambos tumores y su diferente comportamiento y potencial agresivo.


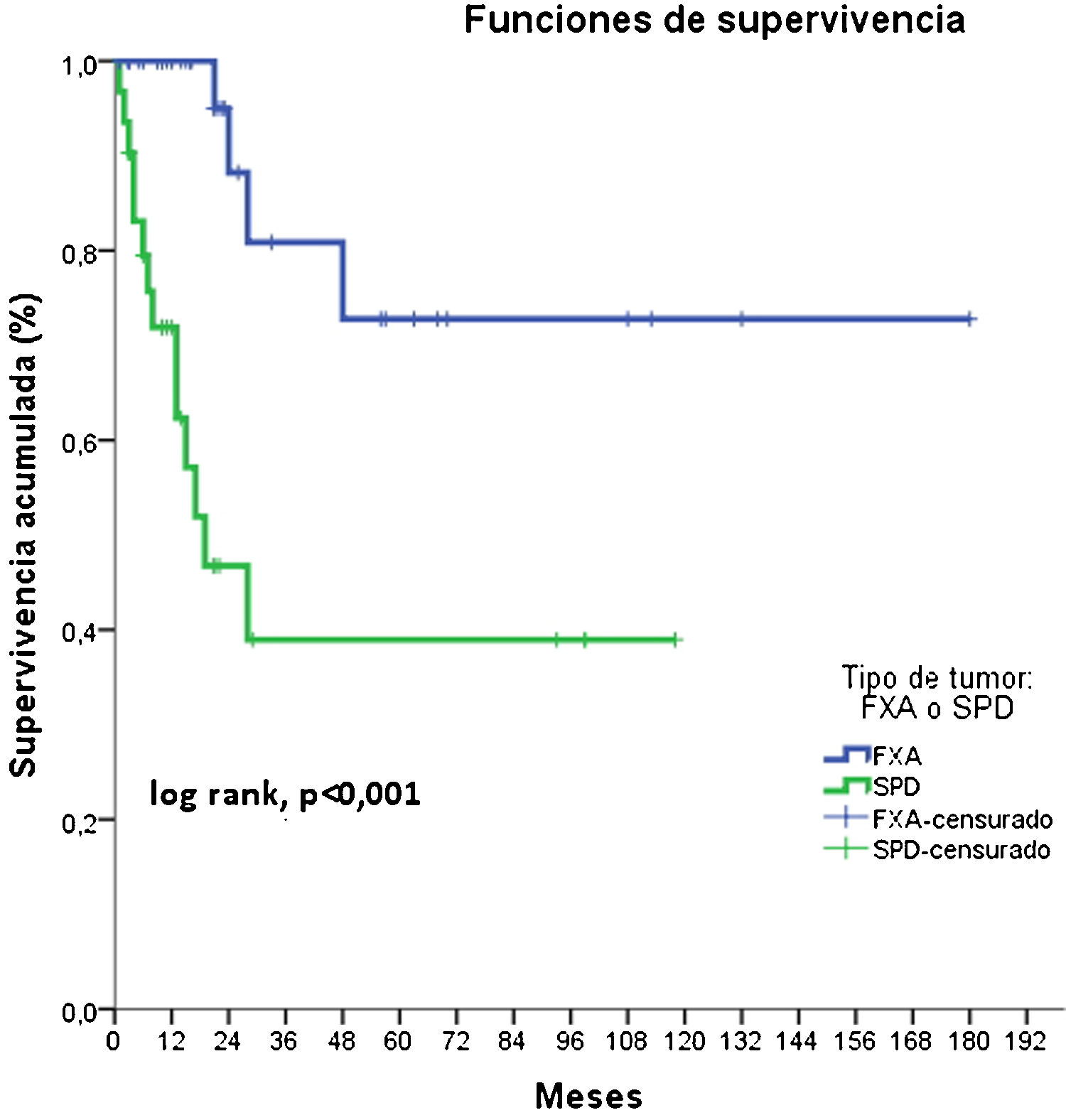
![Supervivencia estimada libre de enfermedad según el tipo de tumor (fibroxantoma atípico [FXA] o sarcoma pleomórfico dérmico [SPD]): la supervivencia libre de enfermedad a 2 años fue del 88,2% para el FXA, frente al 46,7% para el SPD (hazard ratio 6,1; log rank p<0,001). Supervivencia estimada libre de enfermedad según el tipo de tumor (fibroxantoma atípico [FXA] o sarcoma pleomórfico dérmico [SPD]): la supervivencia libre de enfermedad a 2 años fue del 88,2% para el FXA, frente al 46,7% para el SPD (hazard ratio 6,1; log rank p<0,001).](https://static.elsevier.es/multimedia/00017310/0000011300000006/v1_202206190516/S0001731022001636/v1_202206190516/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w9/t1/zx4Q/XH5Tma1a/6fSs=)



