La patología vascular oclusiva es causante de diversas y variadas manifestaciones clínicas, algunas de las cuales son de catastróficas consecuencias para el paciente. Sin embargo, las causas de tal oclusión son muy variadas, extendiéndose desde trombos por acción descontrolada de los mecanismos de coagulación, hasta anomalías de los endotelios de los vasos u oclusión por materiales extrínsecos. En una serie de dos artículos hacemos una revisión de las principales causas de oclusión vascular, resumiendo sus manifestaciones clínicas principales y los hallazgos histopatológicos fundamentales. Esta primera parte corresponde a las oclusiones vasculares que cursan con trombos.
Vascular occlusion has multiple, diverse clinical manifestations, some of which can have grave consequences for patients. The causes of vascular occlusion are also highly variable, ranging from thrombi triggered by the uncontrolled activation of coagulation mechanisms, on the one hand, to endothelial dysfunction or occlusion by material extrinsic to the coagulation system on the other. In a 2-part review, we look at the main causes of vascular occlusion and the key clinical and histopathologic findings. In this first part, we focus on vascular occlusion involving thrombi.
Los vasos sanguíneos pueden ocluirse por muchas causas, tanto intrínsecas como extrínsecas.
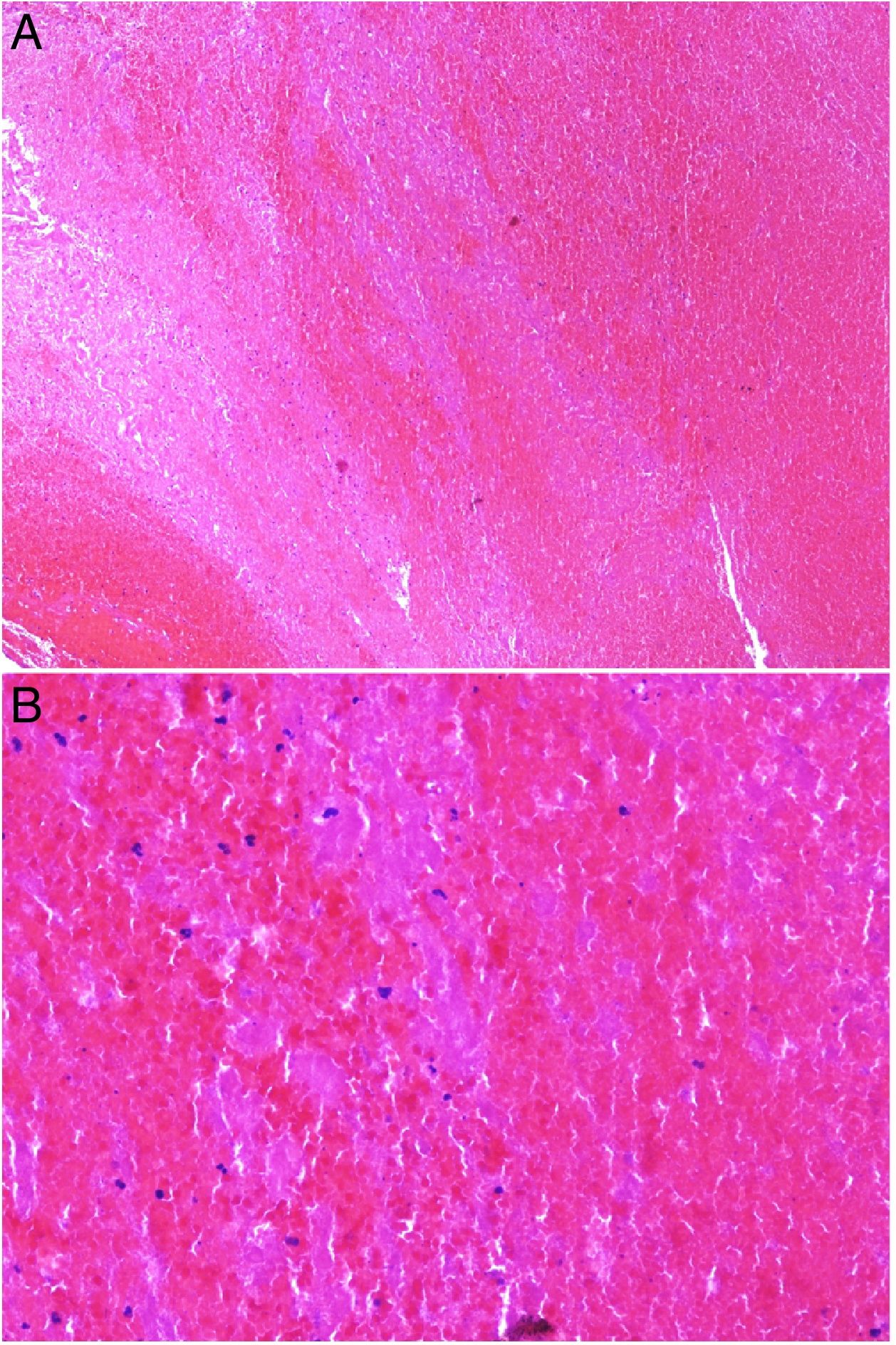
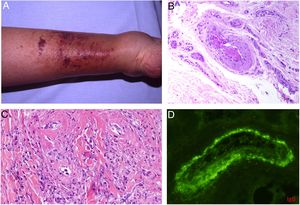
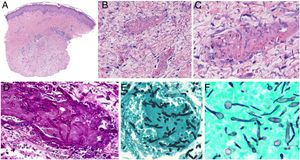
Entre las intrínsecas cabe citar las anomalías de la hemostasis. La coagulación es un proceso natural, fisiológico, que se encarga de ocluir soluciones de continuidad de los vasos sanguíneos, impidiendo que nos desangremos ante cualquier mínimo traumatismo. Lo normal es que el proceso de hemostasis se salde con un pequeño parche coagulado en la pared del vaso, reparando así el defecto. Sin embargo, en ocasiones y por distintos motivos patológicos, los fenómenos de hemostasis son exagerados, pudiendo producirse una agregación de plaquetas, fibrina, células y/o factores de coagulación, que ocluye total o parcialmente la luz del vaso, y a la que llamamos trombo. Los trombos ricos en fibrina y plaquetas tienen una coloración más blanquecina que los que tienen componentes celulares. Sin embargo, los trombos suelen tener estratos alternantes de zonas blanquecinas y zonas más oscuras rojizas (líneas alternantes de Zahn) (fig. 1A y 1B). La presencia de plaquetas en un trombo puede estudiarse mediante inmunohistoquímica con el marcador plaquetario CD61.
Numerosas causas pueden producir la formación anormal de un trombo. Entre ellas, estados de hipercoagulabilidad, defectos del endotelio de los vasos, depósitos de inmunoglobulinas o de complejos antígeno-anticuerpo.
Junto a esto, hemos de recordar que la luz de un vaso puede ocluirse por cuerpos o materiales que no tienen que ver con la coagulación y que pueden ser orgánicos, inorgánicos o incluso seres vivos como parásitos circulando por nuestro torrente sanguíneo.
El presente artículo es la primera de dos partes que muestran una recopilación de las principales causas de oclusión vascular, con un repaso de sus manifestaciones clínicas e histopatológicas.
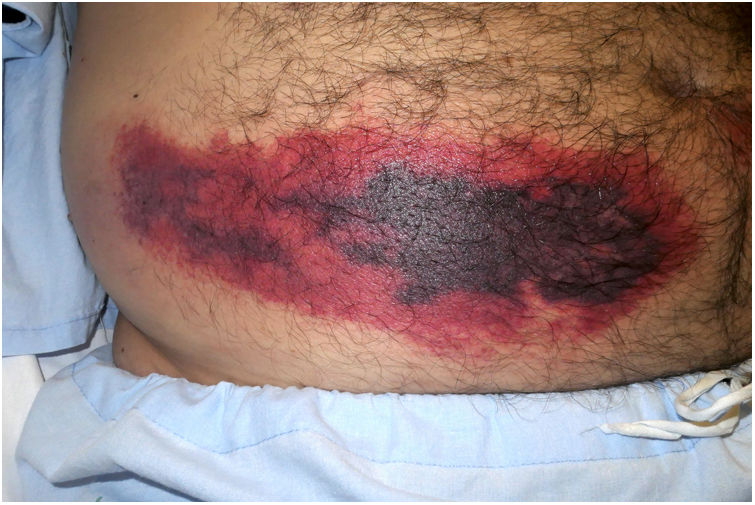
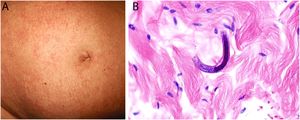
Trombos ricos en plaquetasNecrosis inducida por heparinaDefinición: Se trata de un síndrome poco frecuente, secundario al uso subcutáneo o intravenoso de heparina, especialmente de las formas no fraccionadas. La formación de inmunocomplejos PF4-heparina en el sitio de inyección conduce a la activación plaquetaria y posterior oclusión vascular, con el desarrollo secundario de una trombocitopenia por consumo1.
Clínica: Se manifiesta en forma de púrpura retiforme dolorosa con necrosis central en los sitios de inyección de la heparina (fig. 2), junto con un descenso analítico superior al 50% del número de plaquetas1. El tratamiento pasa por la interrupción de la administración de heparina, y proceder a la anticoagulación terapéutica, estando contraindicados los antagonistas de la vitamina K.
Histopatología: Se observa oclusión no inflamatoria de los vasos sanguíneos, con formación de trombos de fibrina en el interior de arteriolas y vénulas de dermis y tejido celular subcutáneo, junto con hemorragia tisular en grado variable y aparición secundaria de signos de necrosis cutánea isquémica.
Trombocitosis secundaria a trastornos mieloproliferativosDefinición: Presencia en sangre de un número elevado de plaquetas (a menudo disfuncionales), secundaria a trastorno mieloproliferativo, principalmente trombocitemia esencial (TE) y policitemia vera (PV)2,3.
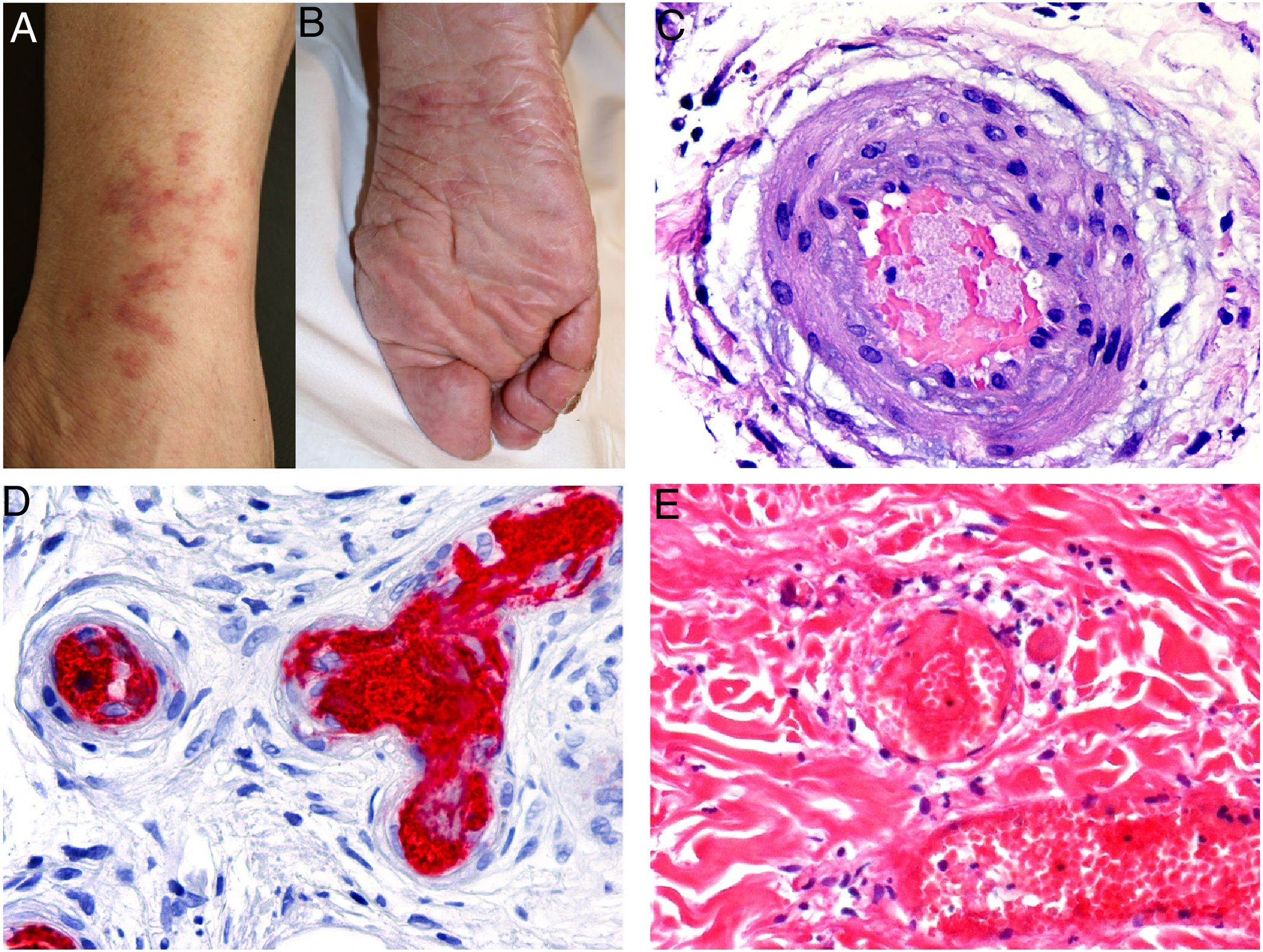
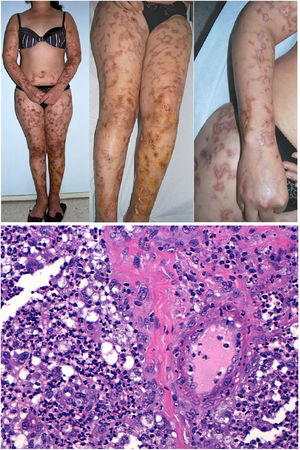
Clínica: Las lesiones pueden ser hemorrágicas (petequias, púrpura, hematomas) u oclusivas (livedo racemosa, livedo reticularis, eritromelalgia, placas eritematosas, fenómeno de Raynaud, ulceración y gangrena). Las manifestaciones cutáneas pueden ser la primera manifestación clínica de TE y de PV (10% de los casos)4 (fig. 3A y 3B).
A y B: Lesiones de tipo livedo reticularis en parte inferior de pierna y planta del pie, como forma de presentación de trombocitemia esencial en una paciente de 77 años, sin antecedentes significativos. En la analítica realizada se observó marcada trombocitosis (919.000/mm3) (cortesía de los Dres. Rosario Haro y Luis Requena; Dermatología, Fundación Jiménez Díaz, Madrid). C: Trombocitosis secundaria a un trastorno mieloproliferativo (trombocitemia esencial). Oclusión de la luz de arteriolas por material finamente granular y hemático (H&E 40x). D: Trombocitosis secundaria a un trastorno mieloproliferativo (trombocitemia esencial). Estudio inmunohistoquímico para plaquetas (CD61), que confirma la oclusión de la luz por trombocitos (40x). E: Hemoglobinuria paroxística nocturna. Se observan dos vasos localizados en dermis con trombos de plaqueta y fibrina con mínimo infiltrado linfocitario perivascular (H&E 400x).
Histopatología: Además de extravasación hemática en los casos con manifestaciones hemorrágicas, la oclusión vascular se manifiesta por la presencia en la luz vascular de abundantes plaquetas, que pueden constituir la mayor parte del material que ocluye la luz5 (fig. 3C y 3D).
Hemoglobinuria paroxística nocturnaDefinición: La hemoglobinuria paroxística nocturna (HPN) es una entidad clonal no maligna, adquirida, ligada al cromosoma X, de las células progenitoras hematopoyéticas, condicionada por la mutación del gen PIG-A (fosfatidil-inositol-glucano A), que induce una sensibilidad inusual de dichas células a la acción lítica del complemento6.
Clínica: Se trata de una enfermedad crónica con crisis hemolíticas que pueden estar desencadenadas por varios factores, tales como una infección común, vacunación, intervención quirúrgica o ciertos antibióticos. Tiene una incidencia de 15,9/106 habitantes, sin diferencias sexuales. Generalmente compromete a adultos jóvenes (alrededor de los 35 años), aunque puede acontecer a cualquier edad. Las manifestaciones clínicas habituales incluyen: palidez, fatiga, disnea de esfuerzo, anemia hemolítica intravascular (hemoglobinuria en un 26% de inicio y en un 62% en algún momento de la enfermedad), trombosis frecuente (30-40%) (en ocasiones en forma de trombosis venosa profunda e inusualmente interesando a venas suprahepáticas [síndrome de Budd-Chiari]), mesentéricas, del sistema nervioso central, pulmonares, cutáneas y ocasionalmente vasos arteriales (15%). Por último, insuficiencia medular de intensidad variable, que puede condicionar en casos severos pancitopenia (32%). La mortalidad está en torno al 24% a los 10 años, mayoritariamente por complicaciones trombóticas (40-60%) y hemorrágicas. Aunque puede haber casos de recuperación espontánea, la media de supervivencia es de 22 años.
Las lesiones cutáneas asociadas a esta enfermedad son raras y generalmente se localizan en regiones acrales: plantas, dedos, punta nasal y pabellones auriculares e incluyen: petequias, ampollas hemorrágicas, úlceras en las piernas, pioderma gangrenoso y púrpura retiforme no inflamatoria que puede progresar a necrosis7–9. La trombosis cutánea asociada a HPN constituye un 0,6% de todos los casos. Se ha descrito que la infección por parvovirus B19 durante las fases de anemia hemolítica puede condicionar el desarrollo de necrosis cutáneas en estos pacientes10.
Histopatología: Los hallazgos histopatológicos que podemos objetivar en las biopsias cutáneas de estos pacientes encajan dentro del espectro de las vasculopatías oclusivas sin vasculitis11. Los trombos intraluminales, cuya etiopatogenia es incierta, y que probablemente estén en relación con el incremento de la agregabilidad plaquetaria, se asocian, dependiendo del compromiso luminal de los vasos dérmicos, a epifenómenos morfológicos que tienen en la necrosis cutánea su mayor exponente lesional (fig. 3E).
Púrpura trombótica trombocitopénica (PTT)/Síndrome hemolítico urémico (SHU)Definición: Ambas entidades son trastornos con una predisposición trombótica. Sin embargo, aunque se consideran relacionadas, el mecanismo trombótico es diferente en cada una.
Clínica: La trombosis en capilares y arteriolas de distintos órganos determina la sintomatología que suele acompañarse de anemia hemolítica y trombocitopenia. En el SHU predomina la afectación renal, mientras que la PTT puede acompañarse de afectación del sistema nervioso central. La afectación cutánea puede ser en forma de petequias.
HistopatologíaTanto en PTT como en SHU se ven trombos intraluminales, y si la oclusión es suficientemente intensa, puede producirse ulceración suprayacente. Sin embargo, el mecanismo trombogénico es distinto en ambas entidades, esto se traduce en diferencias morfológicas sutiles entre ambos procesos.
La PTT es debida a multímeros excesivamente largos de factor de von Willebrand (vWF) en el plasma sin la proteasa adecuada para degradarlos. Esto produce un consumo de plaquetas con trombopenia. Por lo tanto, los microtrombos de los vasos son ricos en plaquetas y pobres en fibrina («blancos»), y la inflamación perivascular es mínima o ausente12.Por el contrario, en el SHU se produce un daño primario al endotelio con trombosis secundaria al mismo. En los vasos afectos se ve desprendimiento focal del endotelio, y los trombos son ricos en fibrina («rojos»), pudiendo acompañarse de infiltrado inflamatorio perivascular12,13.
Trombos debidos a aglutinación por fríoLas crioglobulinas son proteínas que precipitan con bajas temperaturas, volviendo a solubilizarse con el calor. Ello hace que precipiten en las partes acrales del cuerpo. La mayor parte de las crioglobulinas son inmunoglobulinas.
Las crioaglutininas son anticuerpos que desempeñan su función bien (unirse al antígeno) a bajas temperaturas (generalmente inferiores a 37 ̊C). La mayor parte son del tipo IgM. Están implicadas en reconocimiento anómalo de antígenos de hematíes.
CrioglobulinemiaDefinición: La crioglobulinemia (CR) es una rara vasculopatía trombosante y/o vasculítica secundaria a crioglobulinas circulantes, que corresponden a inmunoglobulinas que precipitan con el frío, y cuya causa es esencialmente vírica (virus de la hepatitis C), autoinmunitaria o neoplásica de tipo linfoide B.
Clínica: Se distinguen tres tipos de CR en función de la mono y/o policlonalidad de la inmunoglobulina depositada14.
La CR tipo I es de tipo monoclonal y sus crioglobulinas son cadenas ligeras kappa o lambda, producidas especialmente por linfomas B bien diferenciados o mielomas.
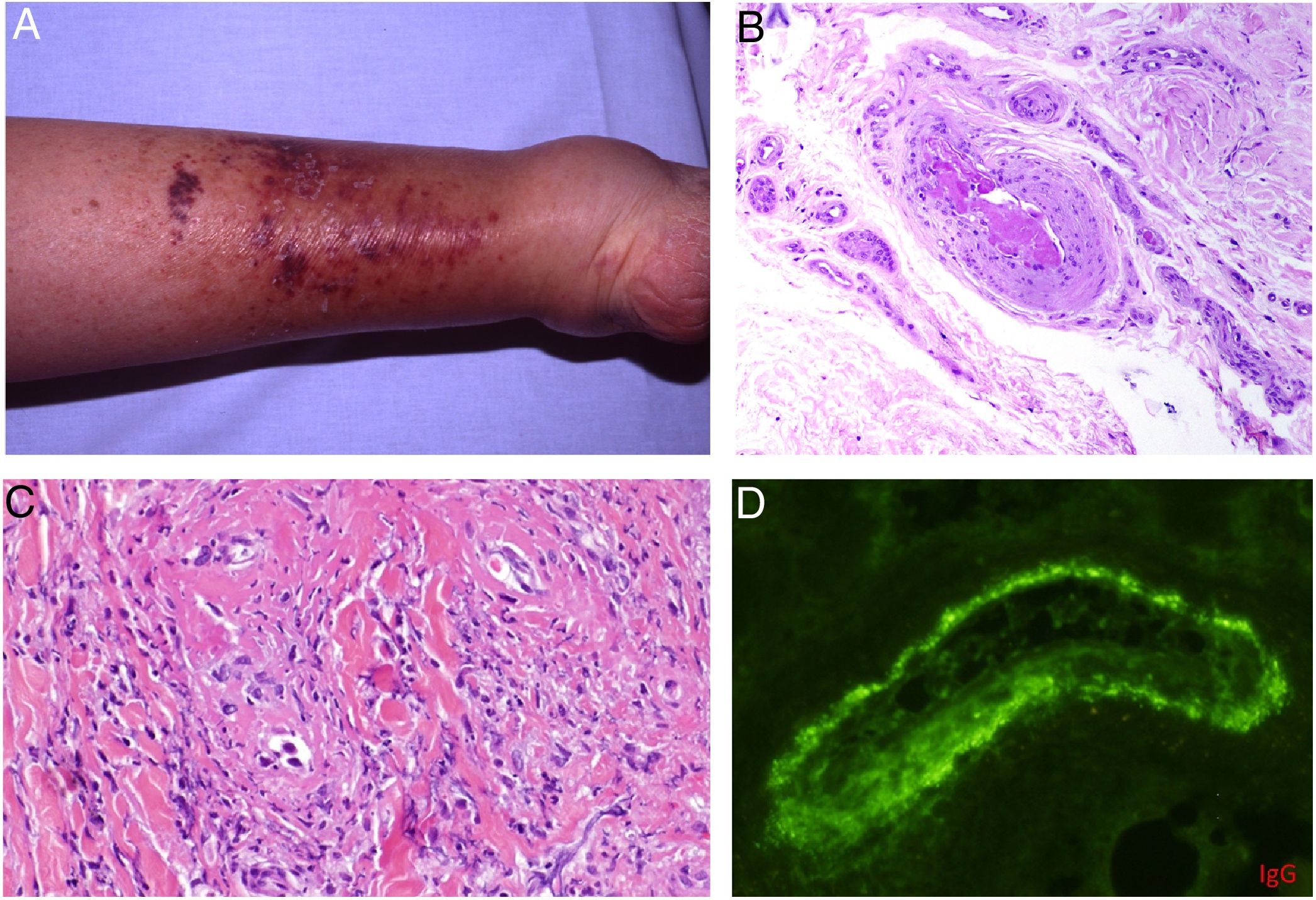
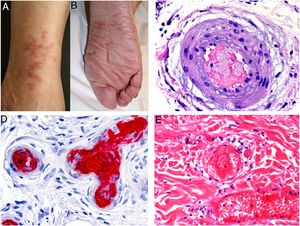
Las CRs tipos II y III, también llamadas CRs mixtas, se deben a autoanticuerpos monoclonales IgM frente a IgG o a anticuerpos policlonales, respectivamente, que forman complejos inmunes circulantes15. Las causas habituales son la hepatitis por virus C, enfermedades autoinmunes y, en ocasiones, neoplasias linfoides también de tipo B16. Sólo un 8% de las CRs producen sintomatología, consistente en púrpura, debilidad muscular y artralgias. También se puede producir afectación renal, que cursa como proteinuria, hematuria y edemas, y neuropatía por afectación de los vasa nervorum. Las lesiones cutáneas surgen especialmente en las extremidades inferiores y consisten en púrpura con tendencia a la ulceración y descoloración de la piel (fig. 4A).
A: Crioglobulinemia. Se observan múltiples pápulas purpúricas en la extremidad inferior, acompañadas de descoloración de la piel por hemorragia. B: Crioglobulinemia tipo I. Presencia de un molde hialino intravascular ocluyendo parcialmente la luz del vaso (H&E 100x). C: Crioglobulinemia mixta. Piel que muestra vasos de la dermis reticular con fenómenos de necrosis fibrinoide, suboclusión vascular, leucocitoclasia y necrosis endotelial (H&E 200x). D: Crioglobulinemia. Se aprecian depósitos de IgG en la pared del vaso inflamado mediante estudio de inmunofluorescencia directa (200x).
Histopatología: Las CRs no tienen hallazgos histopatológicos patognomónicos.
En la CR tipo I se observan vasos con trombos hialinos, como moldes del vaso afecto, en la luz de pequeños vasos de la dermis no asociados a vasculitis (fig. 4B). Estos depósitos se tiñen con técnica de PAS, que marca la porción glucídica de la inmunoglobulina precipitada.
Por el contrario, en las CRs tipos II y III, se aprecia vasculitis necrotizante acompañada de hemorragia, trombosis y ocasional leucocitoclasia (fig. 4C). En el estudio de inmunofluorescencia se pueden observar depósitos de inmunoglobulinas y complemento (fig. 4D).
En el diagnóstico diferencial de la vasculopatía asociada a CR es fundamental la correlación clínico-patológica y la identificación de las crioglobulinas séricas. En la diferenciación de la CR tipo I de otras formas de vasculopatías trombosantes es de utilidad la demostración de la PAS positividad de los depósitos. A diferencia de la vasculitis leucocitoclástica, no se producen agregados vasculares glomeruloides. En el caso de las vasculitis de las CRs mixtas es también muy importante la correlación clínico-patológica para diferenciarlas de las vasculitis asociadas a enfermedades autoinmunitarias no crioglobulinémicas, a agentes infecciosos o a fármacos.
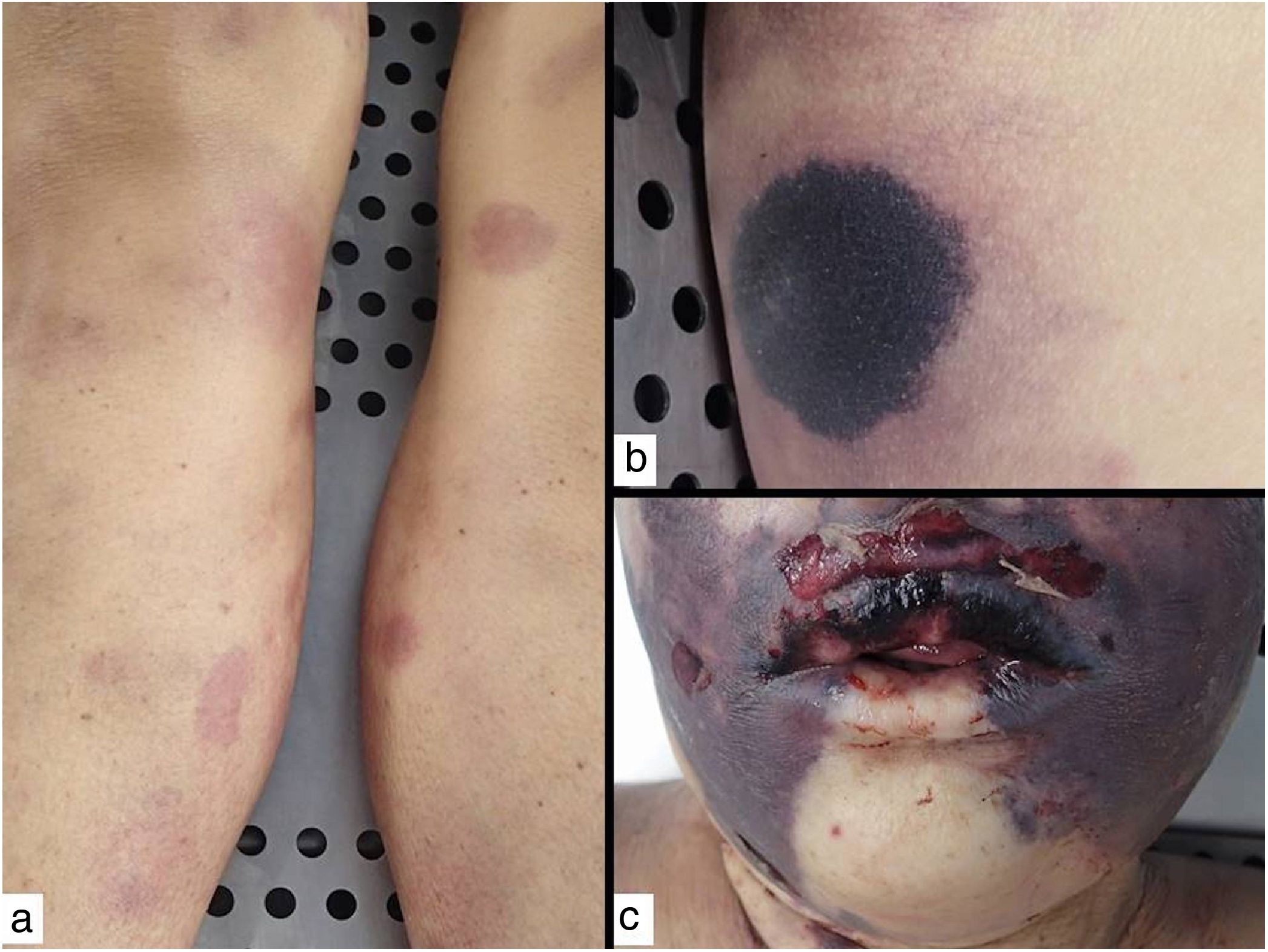
CriofibrinogenemiaDefinición: Enfermedad por precipitación del criofibrinógeno. Este último (a diferencia de la crioglobulina) sólo precipita en plasma y no en suero. Por ello, para su detección, la sangre debe ser extraída en tubos que contenga oxalato, EDTA o citrato, ha de centrifugarse inmediatamente a 37°C y posteriormente refrigerarse a 4°C durante 72 horas. La criofibrinogenemia puede ser primaria o secundaria (a infección, conectivopatías o, sobre todo, a enfermedades hematológicas)17.
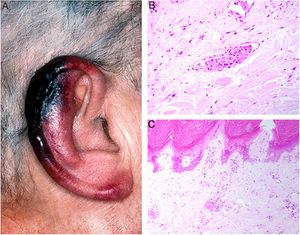
Clínica: Pueden aparecer úlceras, fenómeno de Raynaud y/o lesiones purpúricas retiformes, que pueden acompañarse de sintomatología general, e incluso de fiebre, y que se desencadenan tras la exposición al frío. Afecta preferentemente extremidades inferiores y zonas acras, como las orejas18 (fig. 5A). Además, hay una correlación entre la concentración de criofibrinógeno y la intensidad de las lesiones cutáneas, sobre todo cuando el precipitado es a expensas del fibrinógeno18.
A: Criofibrinogenemia. Lesiones eritemato-purpúricas en pabellón auricular, especialmente en lóbulo y hélix, donde las lesiones son necróticas. B: Enfermedad por crioaglutininas: trombos intraluminales con agregados de hematíes, fibrina y polimorfonucleares neutrófilos (H&E 200x). C: Enfermedad por crioaglutininas: necrosis de la epidermis suprayacente con oclusión luminal de los vasos de la dermis superficial (H&E 100x).
Histopatología: Los hallazgos son superponibles a los de crioglobulinemias, con depósitos intraluminales de material homogéneo, eosinofílico y PAS positivo. Puede acompañarse de necrosis dérmica. Cuando se encuentra vasculitis leucocitoclástica franca, aparte de los hallazgos anteriores, puede indicar la coexistencia con crioglobulinas18. La isquemia que produce puede inducir una angioendoteliomatosis reactiva19.
Enfermedad por crioaglutininasDefinición: enfermedad causada por crioaglutininas que reaccionan con la superficie de los hematíes a baja temperatura. Puede tratarse de formas mono- o policlonales.
Clínica: Dependiendo de la activación mayor o menor del complemento, las manifestaciones pueden ser más acentuadas o menos. Desde anemia hemolítica por hemólisis intravascular (que suele ser un cuadro autolimitado) a signos de isquemia acral (acrocianosis). Hemoglobinuria. Fatiga por la anemia.
Histopatología: Vasos repletos de hematíes, sobre todo en la dermis superficial. Se acompañan de trombos de fibrina y neutrófilos19 (fig. 5B). Si desemboca en isquemia, se acompañará de necrosis en cuña de la dermis/epidermis (fig. 5C). Puede producirse una proliferación vascular reactiva con vasos dilatados y capilares intraluminales. En algunos casos, la proliferación vascular puede adoptar un patrón glomeruloide19.
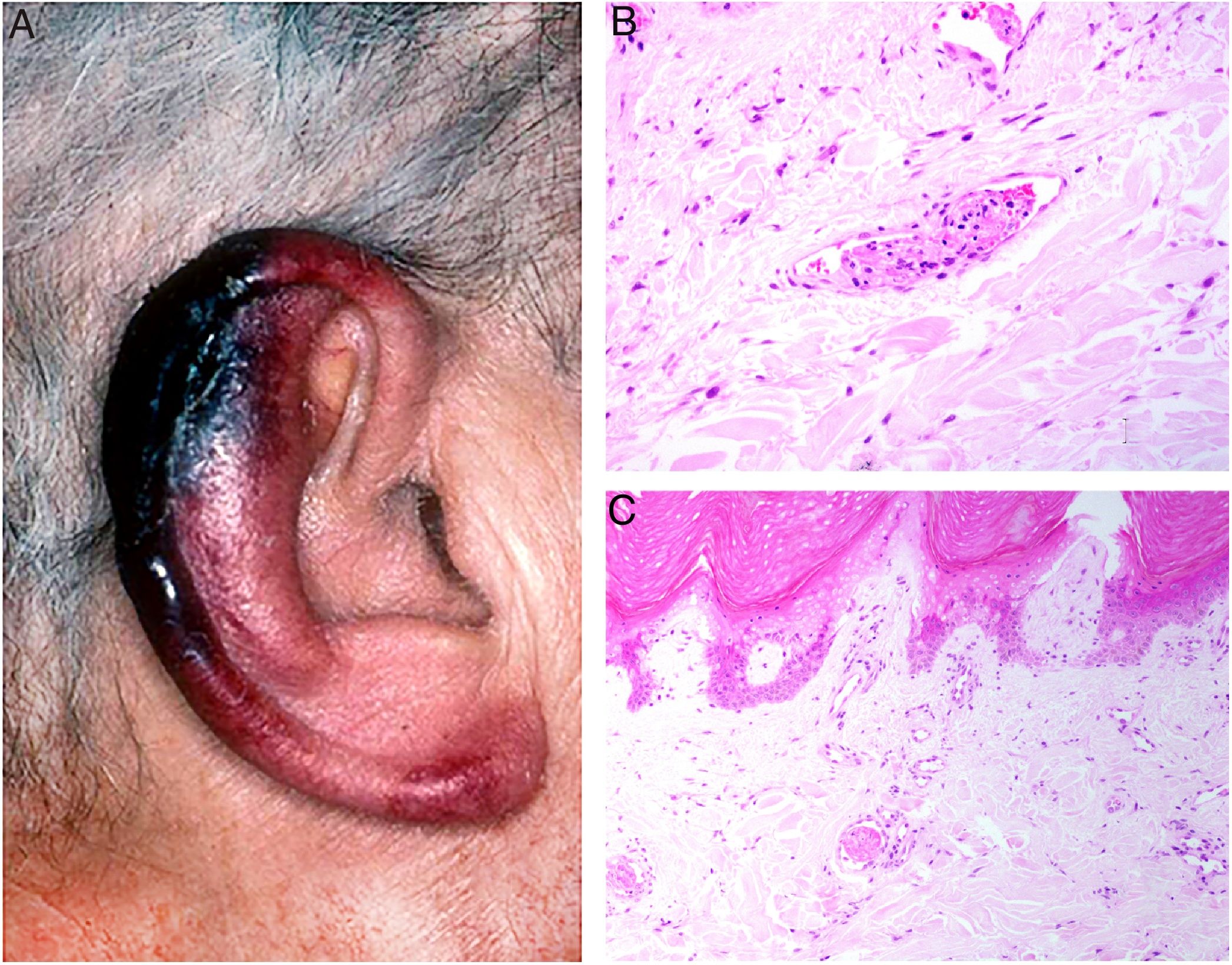
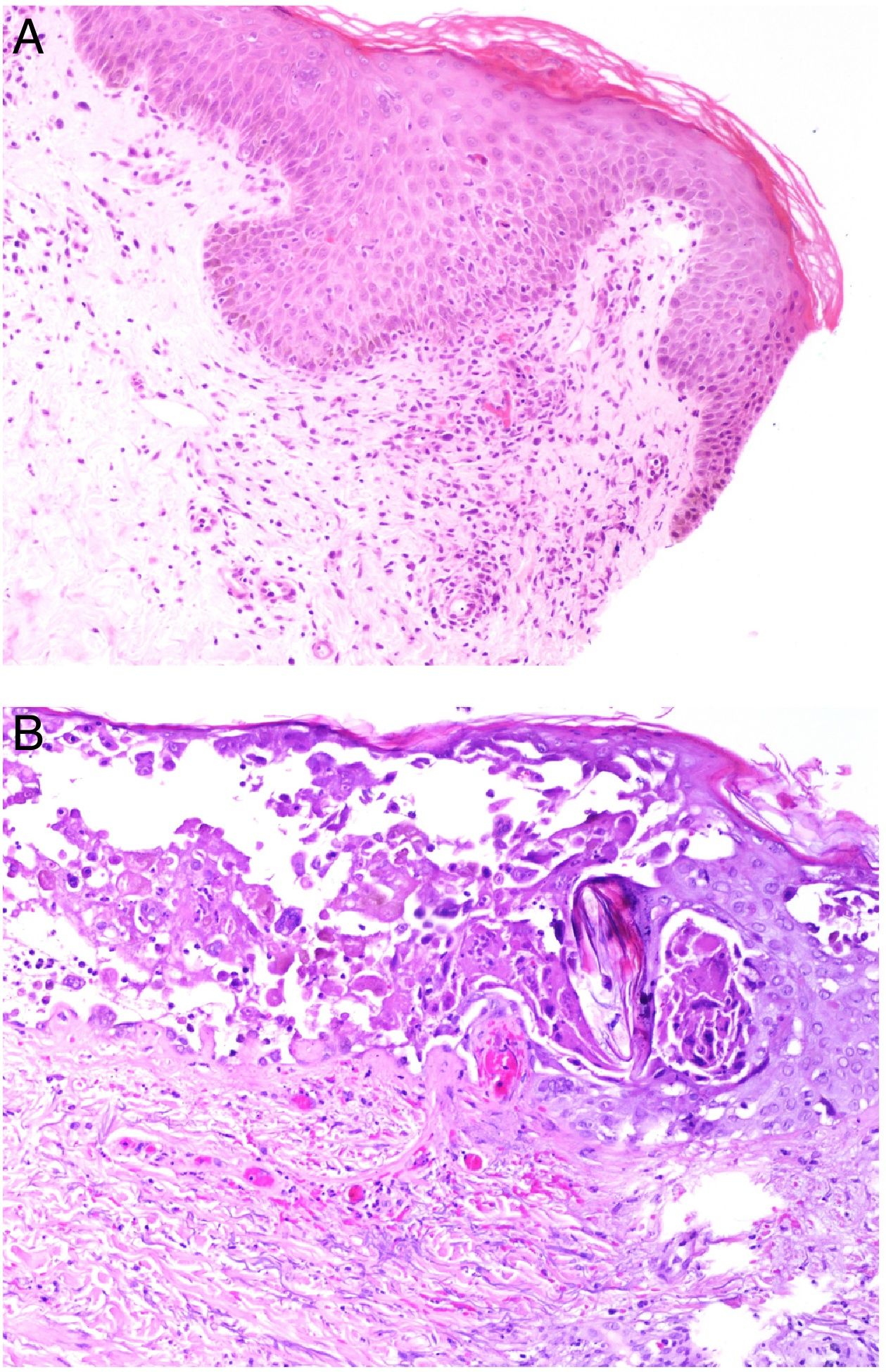
Trombosis de causa infecciosaEctima gangrenosoDefinición: El ectima gangrenoso (EG) es una infección cutánea profunda potencialmente letal, que ocurre con mayor frecuencia como complicación de una bacteriemia por Pseudomonas aeruginosa en individuos inmunocomprometidos, particularmente neutropénicos. Con menos frecuencia puede tener un origen primario cutáneo, acompañado o no, de septicemia secundaria. Las toxinas y enzimas producidos por P. aeruginosa como exotoxina A, elastasa y fosfolipasa C, causan destrucción vascular y cutánea20. Aunque la Pseudomonas aeruginosa es el patógeno más frecuente, se han descrito cuadros clínicamente idénticos causados por otros microorganismos21,22.
Clínica: Característicamente, las lesiones que pueden ser únicas o múltiples, evolucionan rápidamente en un lapso de dos a cinco días. Comienzan en forma de mácula eritematosa que progresa rápidamente a ampolla hemorrágica, que pronto se rompe dando paso a la característica úlcera gangrenosa con centro negruzco indurado y borde eritematoso23. Afecta predominantemente las áreas axilares, anogenitales, tronco o extremidades, y raramente la cara (fig. 6). En casos secundarios a sepsis, las lesiones suelen ser múltiples, y el pronóstico es muy malo. En los casos de infección primaria cutánea, las lesiones suelen ser únicas, de predominio en zonas intertriginosas, y el pronóstico es algo menos adverso. Un diagnóstico precoz y la instauración de un tratamiento antibiótico adecuado son de vital importancia24,25.
Ectima gangrenoso. Autopsia de una paciente severamente neutropénica con sepsis por Pseudomonas aeruginosa y ectima gangrenoso, con lesiones en varias fases de evolución: (a) iniciales en forma de máculas eritematosas en piernas; (b) lesiones más avanzadas negruzcas con borde eritematoso en tronco y (c) necrótico-ampollosas en cara.
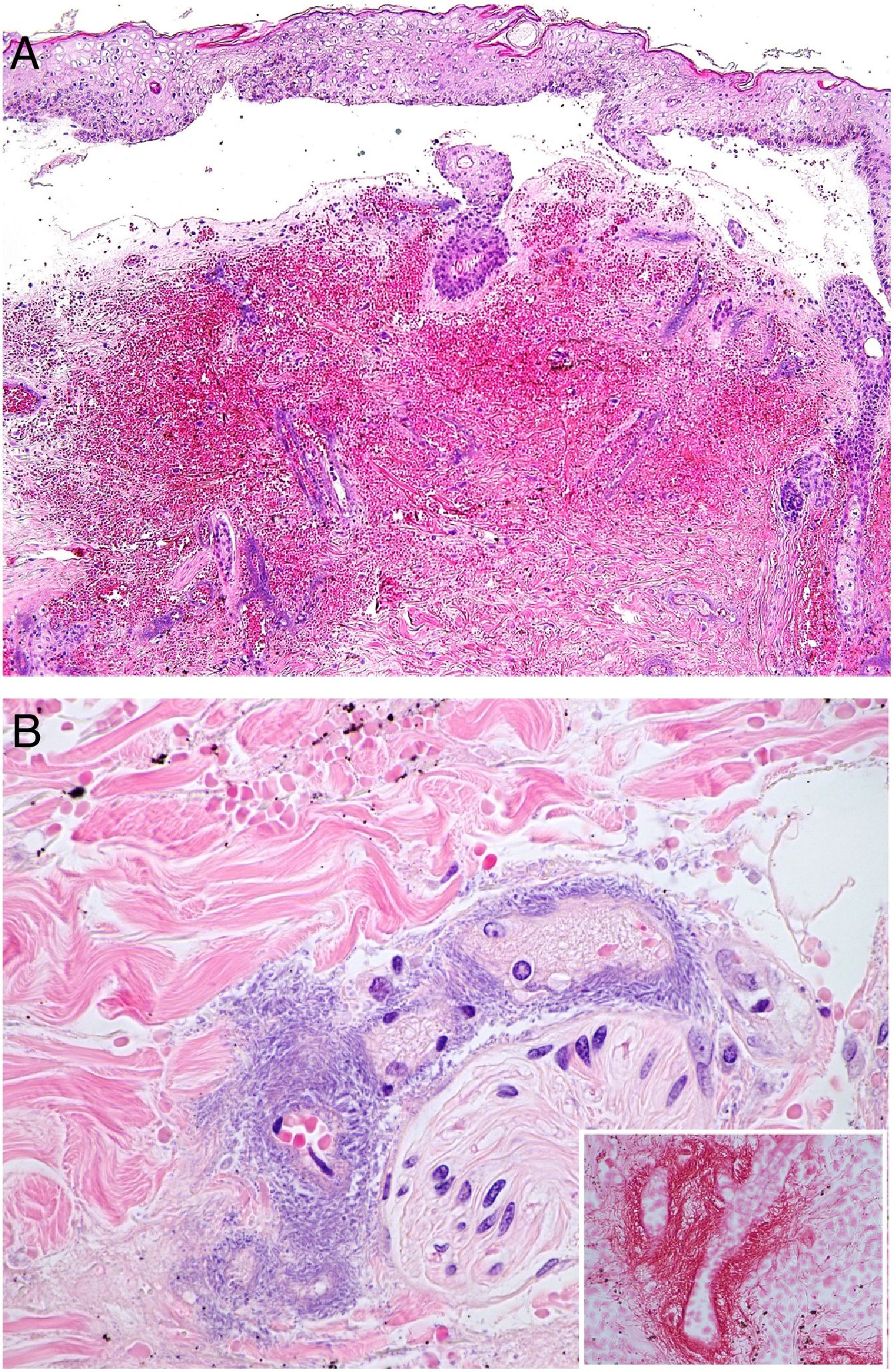
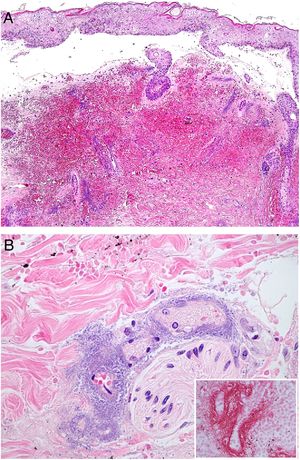
Histopatología: La histopatología puede mostrar una ampolla hemorrágica subepidérmica (fig. 7A) o necrosis epidérmica, con ulceración y base fibrinopurulenta. En dermis e hipodermis se observan cambios hemorrágicos y necrosis, junto a un infiltrado inflamatorio con frecuencia escaso, debido a la neutropenia de muchos de los pacientes26.
A: Ectima gangrenoso. Infarto hemorrágico cutáneo con separación epidérmica, edema subepitelial y marcada extravasación hemática en dermis. Aspecto basófilo de las paredes de los vasos dérmicos. (H&E 10x). B: Ectima gangrenoso. Paredes vasculares sustituidas por material basófilo de aspecto difuminado, que destruye la pared sin apenas infiltrado inflamatorio. Dicho material está constituido por acúmulos de bacilos Gram negativos (recuadro) correspondientes a Pseudomonas aeruginosa (H&E 40x).
La imagen característica es la infiltración de las paredes vasculares por un material basófilo de aspecto difuminado («hazy»), que corresponde a los acúmulos de bacilos Gram negativos (fig. 7B). Los bacilos afectan característicamente a la adventicia y a la media, pero no a la íntima, y en ocasiones se acompañan de trombosis. Se observan también bacilos dispersos entre el colágeno dérmico o entre los adipocitos de hipodermis24,26.
A pequeño aumento, el aspecto basófilo de los vasos pequeños podría ser confundido con calcio e inducir a un diagnóstico erróneo de calcifilaxis, entidad que puede tener un aspecto clínico similar27.
Micosis cutáneas angioinvasivasDefinición: Los hongos angioinvasivos causan oclusión vascular y trombosis, y a consecuencia de ello, isquemia y/o necrosis, no solo cutánea sino en muchos órganos, especialmente cerebro y pulmones28. Los principales hongos angioinvasivos cutáneos son Aspergillus, Fusarium, Candida y mucorales (Rhizopus, Mucor y Lichtheimia)29.
Afectan a pacientes neutropénicos (neoplasias hematológicas, quimioterapia y trasplante de órganos), pero mientras que las aspergilosis y fusariosis sistémicas aparecen casi exclusivamente en estos pacientes (en los que son las más frecuentes), Candida y mucorales afectan también a pacientes no neutropénicos. Otros factores de riesgo son: recién nacidos de bajo peso (por inmadurez de las barreras epidérmica y de la mucosa intestinal), hospitalización prolongada, catéteres venosos centrales, nutrición parenteral total, antibióticos de amplio espectro, quemaduras, transfusiones e inyecciones de drogas. Los mucorales tienen una particular tendencia a afectar a diabéticos mal controlados (especialmente con cetoacidosis, ya que un pH bajo plasmático reduce la respuesta fagocítica de los neutrófilos).
Clínica:
Aspergillus: Hay afectación cutánea en un 5% de pacientes con aspergilosis sistémica. La angioinvasión produce rápidamente necrosis y hemorragia. Desarrollan lesiones similares al ectima gangrenoso, papulonódulos necróticos y/o nódulos subcutáneos profundos, con o sin escara central. La aspergilosis cutánea primaria es menos frecuente y menos agresiva que las formas sistémicas que producen una alta mortalidad. Se presenta en forma de máculas, pápulas o placas eritemato-violáceas que pueden progresar a vesículas hemorrágicas y úlceras.
Fusarium: Presentan lesiones cutáneas el 75% de pacientes inmunodeprimidos30. Es la causa más frecuente de fungemia con afectación cutánea. Produce lesiones eritemato-violáceas, necróticas, en diana o ampollosas. Existen tres formas bien definidas: 1) nódulos subcutáneos múltiples; 2) lesiones similares a ectima gangrenoso; y 3) máculo-pápulas eritematosas dolorosas con ulceración y/o cicatriz negruzca, localizadas preferentemente en brazos y piernas. Las formas sistémicas cursan con fiebre e infiltrados pulmonares y/o sinusitis. La tasa de mortalidad de las fusariosis con afectación cutánea es del 40%.
Candida: Fiebre, miopatía y afectación variable visceral. Las lesiones cutáneas están presentes en 13-38% de los casos, a modo de pápulas, pústulas o nódulos, inespecíficas, y con frecuencia tienen un halo eritematoso con o sin una zona pálida o vesicular central. Se han descrito foliculitis en drogadictos.
Mucorales: Afectación cutánea en 20-25% de casos. Las formas primarias cutáneas (asociadas a cirugía, quemaduras o traumatismos) son más frecuentes que las secundarias, y se manifiestan como escaras necróticas con induración y eritema. Pueden dar lesiones en diana y/o purpúricas. Las formas secundarias pueden ser máculas eritematosas, nódulos o necrosis similares al ectima gangrenoso. Las formas pulmonares y/o de senos paranasales pueden extenderse a la órbita y al cerebro. La mortalidad es alta (45%) y aún mayor en casos de diseminación sistémica.
Histopatología: Se pueden observar microabscesos dérmicos y/o subcutáneos con presencia variable (dependiendo del estado inmunitario del paciente) de neutrófilos, macrófagos (con o sin células multinucleadas) y necrosis. Se observan los hongos en las paredes y en el interior de los vasos con presencia habitual de trombosis y hemorragia.
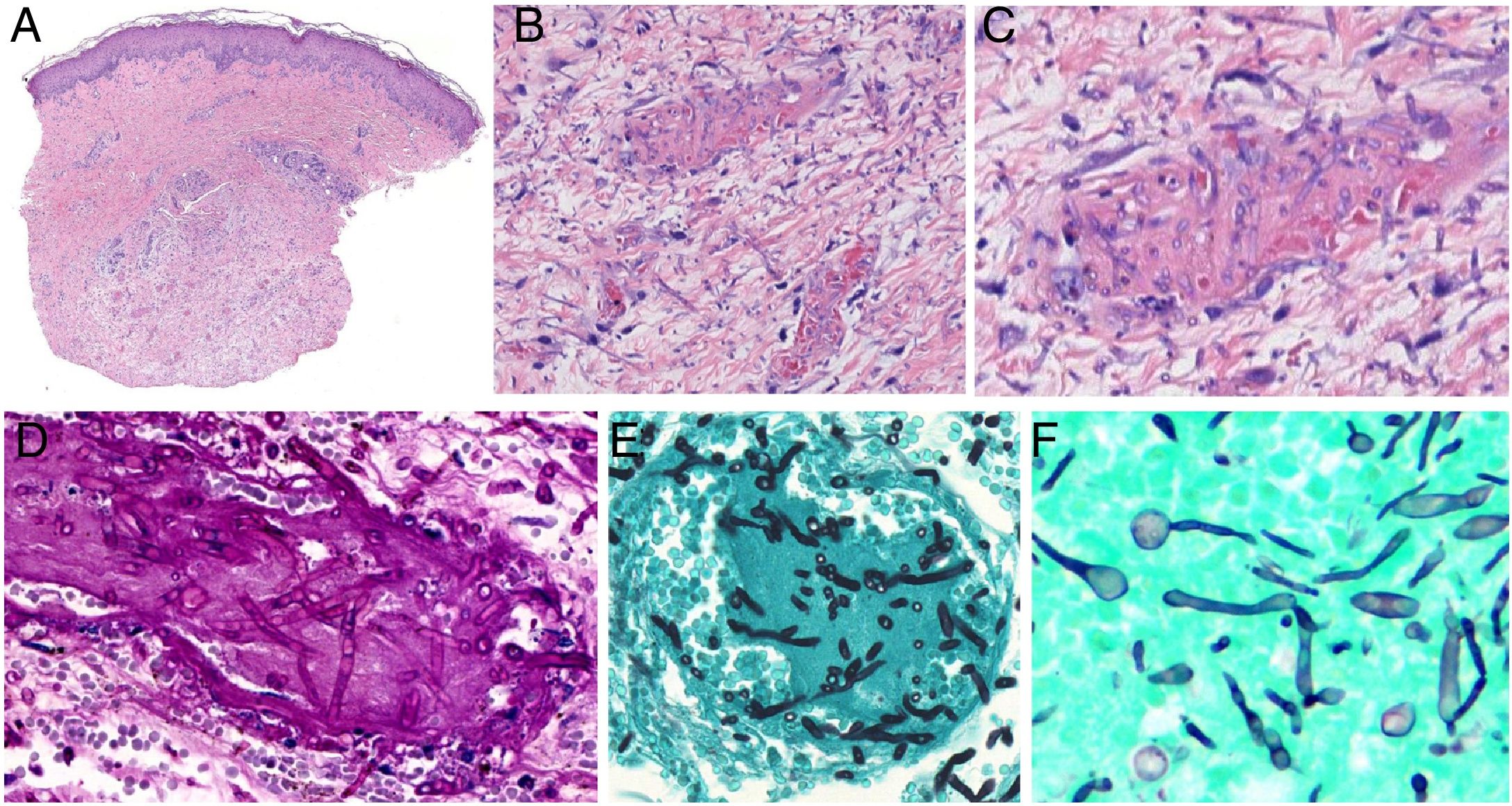
Aspergillus: Hifas de 3 a 6 μm, septadas y ramificadas en ángulo agudo (típicamente de 45°), y habitualmente sin prácticamente respuesta inflamatoria (fig. 8 A-C).
Micosis cutáneas angioinvasivas. A-C: Aspergilosis cutánea angioinvasiva: las hifas ramificadas y septadas ocluyen los vasos dérmicos y atraviesan sus paredes, sin prácticamente componente inflamatorio (A: H&E 20x; B: H&E 200x; C: H&E 400x). D-E: Fusariosis angioinvasiva: las hifas son morfológicamente indistinguibles de las de Aspergillus (D: PAS 400x; E: plata-metenamina 400x). F: Candidiasis invasiva: presencia de levaduras y pseudomicelio (plata-metenamina 600x).
Fusarium: Fusarium es histológicamente indistinguible de Aspergillus, con hifas septadas, no pigmentadas y ramificadas en ángulo agudo (fig. 8 D-E). Sólo pueden distinguirse en las muestras cutáneas mediante hibridación in situ o PCR.
Candida: Se presenta en los tejidos en forma de levaduras (con o sin germinación), pseudomicelio y/o micelio (fig. 8 F). Los cultivos de muestras biópsicas son positivos en la mitad de los casos, al igual que los hemocultivos.
Mucorales: Hifas anchas (de 3-25 μm), no septadas (aunque pueden parecerlo, por lo que se describen como pseudoseptadas). Tiene una pared celular fúngica fina, lo que da lugar a una tinción débil con PAS y tinciones de plata. En esos casos se puede utilizar la fluorescencia con blanco de calcoflúor. Además de angioinvasión, se aprecia con mucha frecuencia invasión perineural.
Estrongilioidiasis diseminadaDefinición: El Strongyloides stercoralis es un nematodo intestinal endémico en países tropicales y subtropicales. La entrada en el ser humano se produce a través de la piel en contacto con la tierra donde residen las larvas filariformes. Estas viajan hasta los pulmones, para posteriormente situarse en el intestino delgado31.
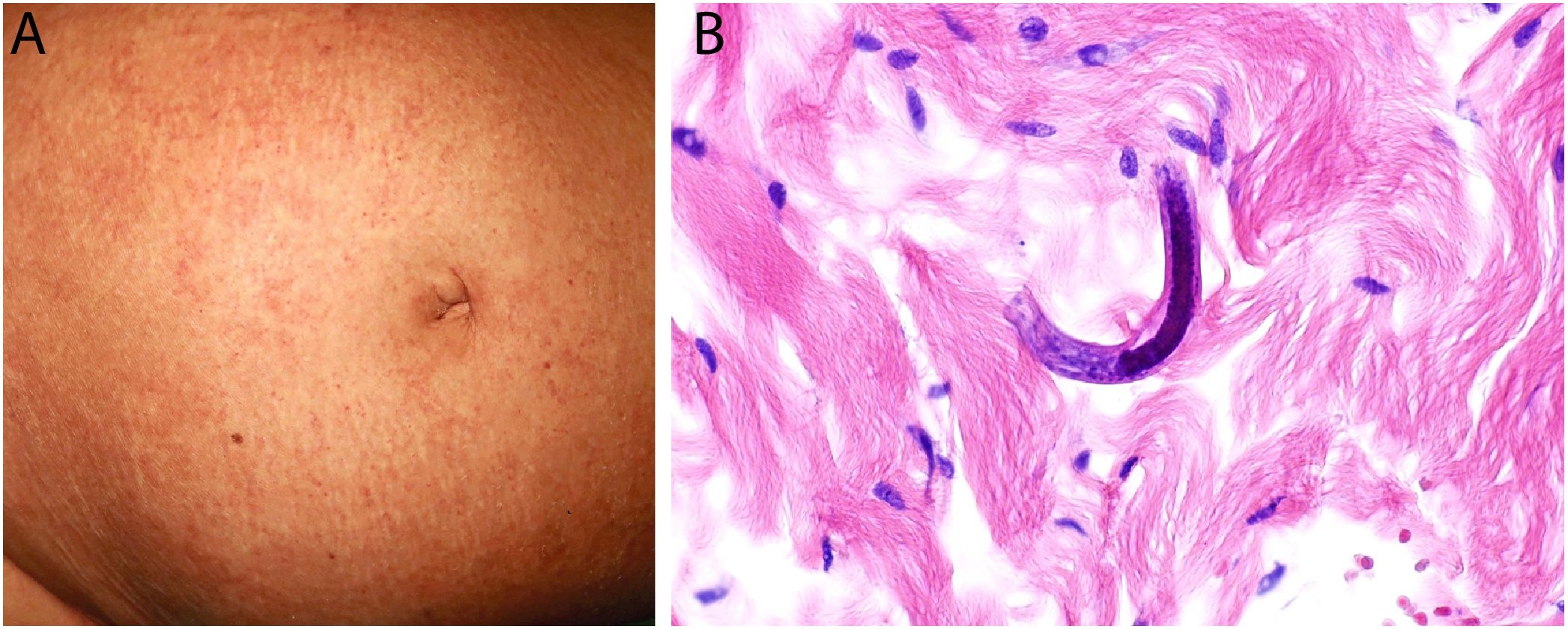
Clínica: El huésped suele manifestar síntomas leves e inespecíficos, como molestias gastrointestinales y eosinofilia. En la piel, la manifestación más frecuente es la larva currens, visible por tractos urticariales serpiginosos de progresión rápida. En casos de inmunosupresión, se puede producir una estrongiloidiasis diseminada, cuya mortalidad es alta. En la piel, esta se manifiesta con una púrpura diseminada, pero característicamente situada alrededor del ombligo (fig. 9A) y en la parte proximal de las extremidades inferiores31,32. Es frecuente que sea digitiforme33.
Histopatología: La biopsia muestra un infiltrado inflamatorio perivascular con algunos eosinófilos. En el caso de que no se vean larvas, conviene hacer muchos cortes para confirmar su ausencia. Cuando se ven, miden entre 9 y 15 μm de diámetro y suelen estar situadas en el colágeno de la dermis, aunque en ocasiones pueden verse dentro de los vasos sanguíneos32,34 (fig. 9B).
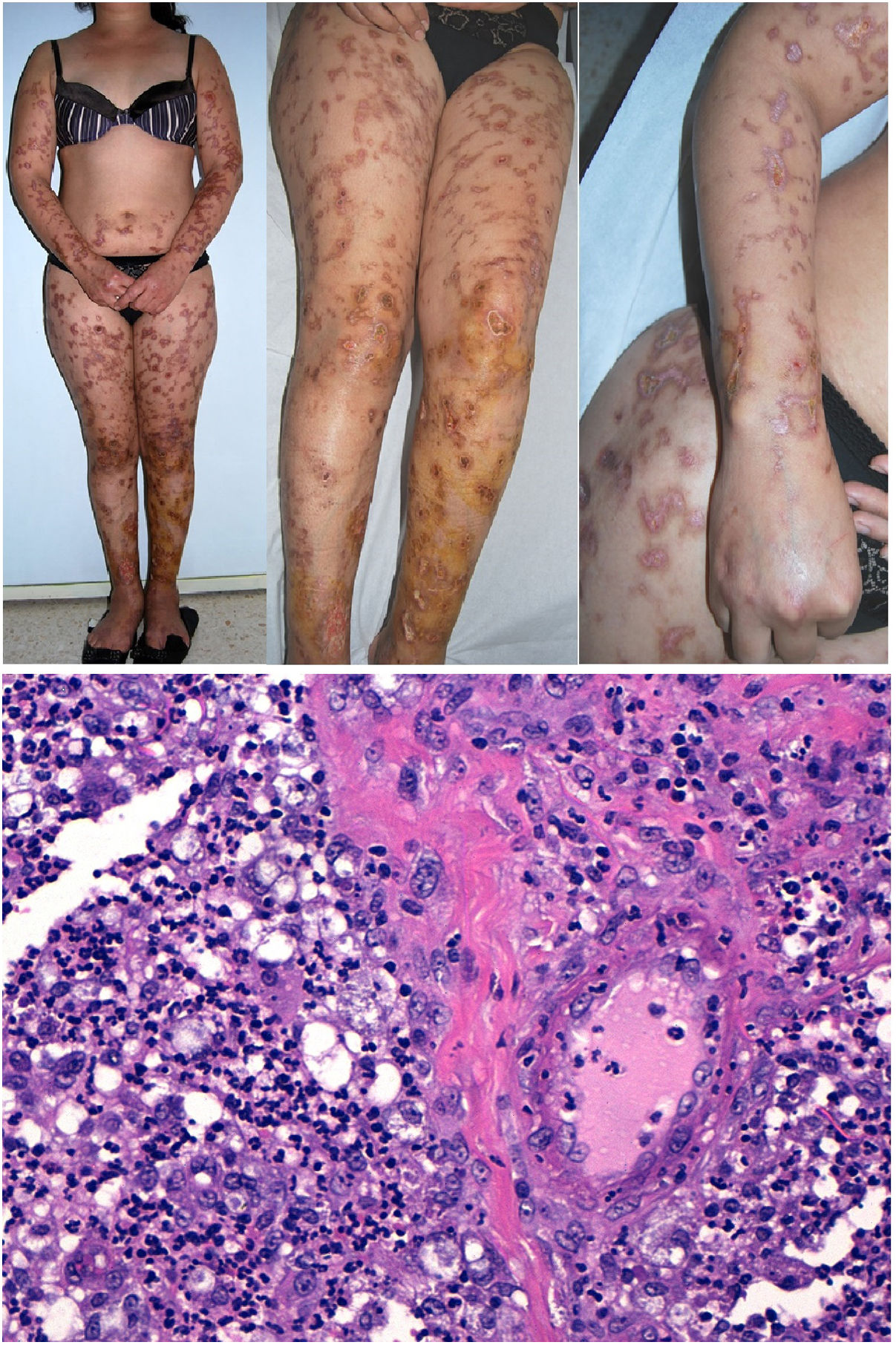
Fenómeno de LucioDefinición: Es una leprorreacción tipo II (algunos la consideran tipo III)35, que se desarrolla en el espectro de la lepra lepromatosa, especialmente la lepra lepromatosa difusa (lepra de Lucio o lepra bonita). Consiste en una vasculitis necrotizante de vasos finos y medianos de la dermis reticular superficial y profunda en pacientes con lepra lepromatosa difusa36. Se considera una enfermedad mediada por complejos inmunes que se producen al liberarse y exponerse gran cantidad de proteínas antigénicas micobacterianas a los anticuerpos circulantes. Recientemente, se ha aislado en estos pacientes un nuevo bacilo, Mycobacterium lepromatosis, por lo que se considera el responsable de este fenómeno37.
Clínica: Ocurre casi exclusivamente en individuos de México o Costa Rica, aunque se ha descrito de forma esporádica en diferentes partes del mundo en pacientes con lepra lepromatosa difusa, no nodular, inadecuadamente tratada o no tratada, sobre la que aparecen úlceras hemorrágicas múltiples cutáneas en miembros y tórax38. Las lesiones isquémicas cutáneas comienzan como máculas que rápidamente evolucionan a úlceras con formas irregulares, lineales o de contorno serpiginoso, de bordes bien definidos, que finalmente dejan cicatrices atróficas residuales pigmentadas (fig. 10 arriba), por lo que también se ha denominado «lepra manchada»39. A diferencia del eritema nodoso leproso, las lesiones del fenómeno de Lucio no responden a talidomida38.
Arriba: Imágenes clínicas panorámicas y detalles de una forma clásica de fenómeno de Lucio evolucionado a cicatrices pigmentadas. Úlceras irregulares, lineales o serpiginosas, de bordes bien definidos, así como las cicatrices atróficas residuales pigmentadas (cortesía del Dr. Andrés Sánz). Abajo: imagen microscópica del fenómeno de Lucio. A la derecha se identifica un vaso de mediano tamaño con necrosis fibrinoide y abundantes polimorfonucleares neutrófilos en la pared. A la izquierda se reconocen células espumosas cargadas de micobacterias (células de Virchow) e infiltrado neutrofílico dérmico (H&E 200x).
Histopatología: Característicamente se observa una infiltración lepromatosa, difusa cutánea, por abundantes macrófagos espumosos repletos de bacilos Mycobacterium lepromatosis (células de Virchow), que ocupan la dermis, tejido celular subcutáneo y nervios pequeños36. Se acompaña de una vasculitis necrotizante extensa de vasos capilares y arterias de mediano tamaño en la dermis y tejido celular subcutáneo (fig. 10 abajo), algunas con trombos intravasculares y bacilos40. El término fenómeno de Lucio debería ser usado cuando se cumplen los tres criterios clínicos-patológicos: ulceración cutánea, trombosis y vasculitis e invasión de los vasos por micobacterias lepromatosas.
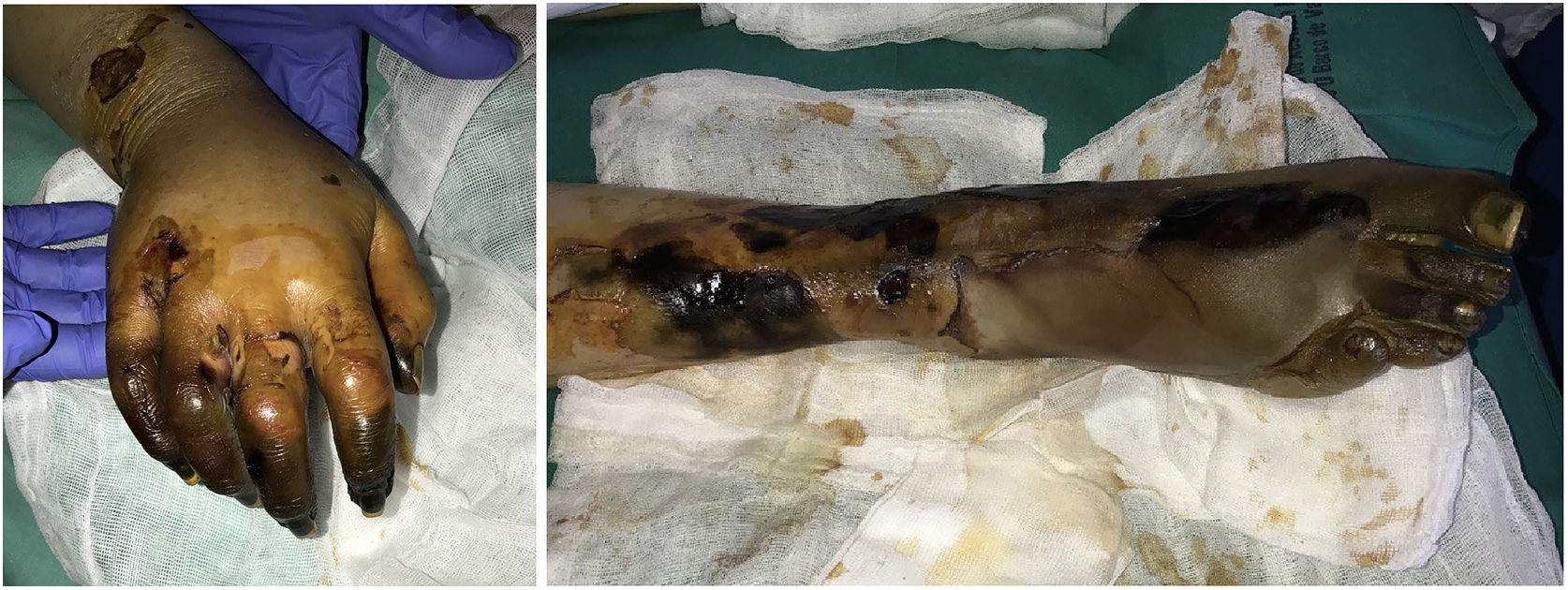
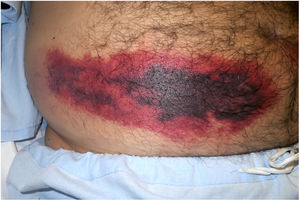
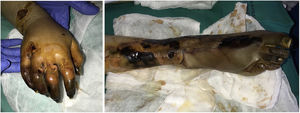
Púrpura fulminansDefinición: Se trata de un síndrome rápidamente progresivo que cursa con trombosis intravascular, hemorragia e infartos cutáneos múltiples41. El cuadro puede evolucionar a coagulación intravascular diseminada (CID) y muerte. Se debe a un defecto de la proteína C, que es un regulador importante de la cascada de coagulación42. Una proteína C defectuosa, induce un estado protrombótico. Tal defecto puede ser hereditario (tal y como sucede en la púrpura fulminans neonatal) o adquirido (fundamentalmente secundario a infecciones por Neisseria meningitidis, estreptococos y Staphylococcus aureus meticilina-resistente, pero también idiopático). Aunque el cuadro se ve sobre todo en niños, puede presentarse en adultos43.
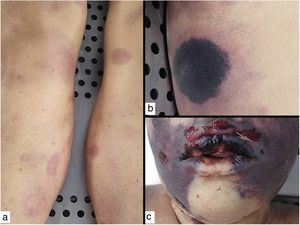
Clínica: Las cuatro manifestaciones clínicas fundamentales comunes a todas las formas de púrpura fulminans son las lesiones purpúricas cutáneas, la fiebre, la hipotensión y, dejado a su libre evolución, la CID. El cuadro se establece de forma rápida y progresa de modo fulminante. Puede comenzar con eritema o petequias que evolucionan a equimosis o placas induradas dolorosas de bordes irregulares (fig. 11). Se pueden también formar vesículas, ampollas, áreas necróticas y, si el paciente sobrevive, cicatrices. La trombosis diseminada se acompaña de hipoperfusión drástica de muchos territorios aparte de la piel, como las extremidades, las zonas acras, los pulmones, el corazón y los riñones.
Histopatología: Se observan trombos en los vasos sanguíneos pequeños, sobre todo en la unión dermo-epidérmica. Los trombos son mixtos, con fibrina, plaquetas y leucocitos44. Los endotelios pueden aparecer hinchados. El infiltrado inflamatorio perivascular acompañante suele ser leve, con evidencia de algunos neutrófilos en la púrpura fulminans aguda infecciosa, pero ausentes en las formas idiopáticas o neonatales45. El cuadro se acompaña de extravasación hemática más o menos pronunciada que suele evolucionar a edema dérmico, y en última instancia, a necrosis dermoepidérmica con o sin formación concomitante de ampollas.
Trombopatías de origen víricoDefinición: Se trata de trombopatías causadas directa o indirectamente por virus. Pueden deberse a una inoculación directa de los mismos en la piel (como sucede con el orf), a una diseminación cutánea desde otras localizaciones (como en el herpes zóster), a su diseminación generalizada a través del endotelio vascular (como en el exantema morbiliforme del sarampión), o (frecuentemente) pueden ser secundarias a la reacción inmune al virus46.
Clínica: Es muy variada según el virus.
El virus varicela zóster es un herpesvirus alfa humano que produce varicela en su infección primaria y herpes zóster cuando se reactiva. Puede producir una vasculopatía sistémica que afecta principalmente a arterias de pequeño tamaño y puede producir tanto ictus como infartos en otros territorios, e incluso aortitis granulomatosa47.
El sarampión está causado por un virus de la familia Paramyxoviridae y cursa con un exantema característico.
El dengue está producido por un virus de la familia Flaviviridae, que es trasmitido por mosquitos del género Aedes, principalmente el Aedes aegypti. Entre la mitad y el 82% de los pacientes presentan a nivel cutáneo un exantema morbiliforme, que se describe como «islotes blancos en un mar rojo» y que pueden acompañarse de manifestaciones hemorrágicas, como petequias, epistaxis y sangrado gingival. Los pacientes presentan además fiebre, dolor (característicamente muy intenso a nivel retro-orbital), malestar gastrointestinal y también frecuentes adenopatías palpables e incluso hepatoesplenomegalia.
Zika: Virus también transmitido por mosquitos, que cursa con fiebre, artritis, conjuntivitis y fatiga. La lesión cutánea habitual es un exantema máculo-papuloso pruriginoso, simétrico, generalizado, y que afecta cara, cuello, tronco y región palmo plantar, pudiendo ser más acentuado en zonas proximales de los miembros48. Más raramente puede ser morbiliforme. Su cronología es muy característica, puesto que en el 90% de los casos aparece 24-48 horas después del resto de síntomas sistémicos.
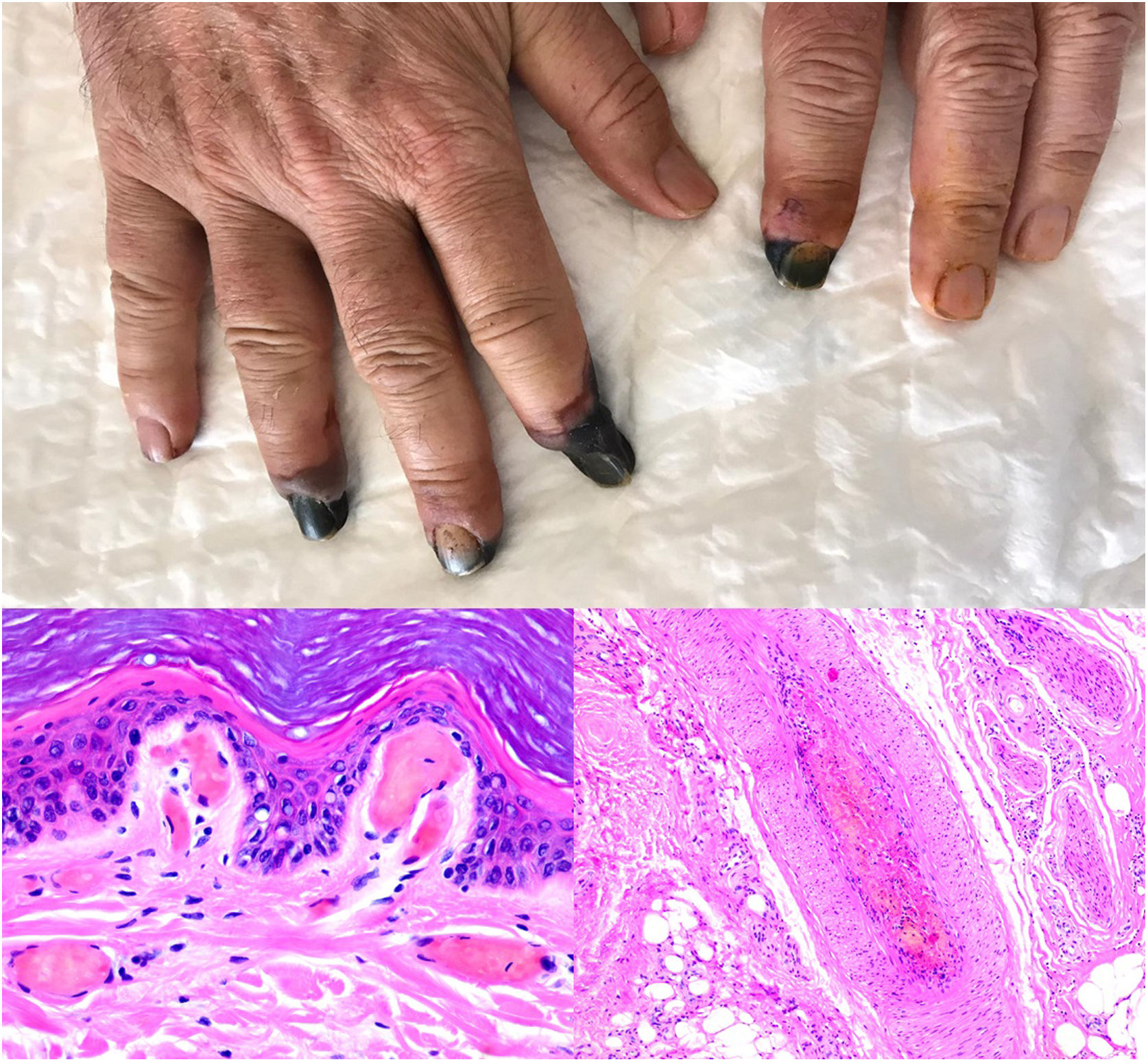
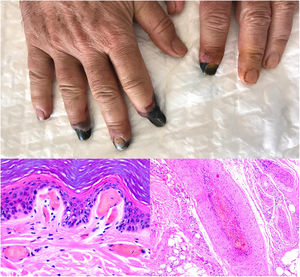
SARS-CoV-2: Coronavirus de gran actualidad, causante de la COVID-19 y capaz de producir lesiones de patogenia trombótica. Se han publicado trombos cutáneos en dos escenarios clínicos diferentes: las lesiones pernióticas acrales (fig. 13, clínica) y, las lesiones necróticas/livedoides.
Trombopatía por COVID-19. Clínicamente se observa afilamiento distal de varias falanges, con tonalidad negruzca. Proximalmente a estas áreas de isquemia, mácula parduzca de aspecto retiforme residual. Histopatológica derecha: detalle de trombosis en vaso arterial. Histopatológica izquierda: trombos hialinos dentro de los vasos dilatados en dermis papilar.
Sarampión: A nivel epidérmico suele observarse paraqueratosis (con especial tropismo por afectar la zona del acrosiringio), espongiosis, un grado variable de degeneración vacuolar y queratinocitos apoptóticos (fig. 12A). En dermis hay un infiltrado linfocítico predominantemente perivascular. Los trombos de fibrina y la leucocitoclasia se ven en aproximadamente un tercio de los casos, siendo más frecuente la presencia de extravasación hemática, identificada hasta en dos terceras partes de los casos49. Un dato histopatológico relativamente característico es la presencia de células gigantes sincitiales, que pueden encontrarse en la epidermis, en los folículos pilosos o en la dermis. Existe un anticuerpo monoclonal frente a la nucleoproteína MeV del virus49.
A: Sarampión. Se observa ligera paraqueratosis focal y exocitosis linfocitaria ligera, así como algunos queratinocitos apoptóticos. En la capa basal, se observan epiteliotropismo a expensas de polimorfonucleares y, en dermis papilar subyacente infiltrado inflamatorio mixto y vasos con trombos, así como extravasación de algunos hematíes (H&E 100x). B: Varicela. Vesícula intraepidérmica en la que se observan células acantolíticas, células con marginación de la cromatina, células multinucleadas y, en la dermis subyacente, capilares dilatados con trombos de fibrina y extravasación hemática (H&E 100x).
Varicela-zóster: A nivel cutáneo hay algunos casos descritos con vasculitis leucocitoclásica franca50, aunque es más frecuente encontrar trombos de fibrina en vasos de dermis superficial, a veces rodeados de un infiltrado inflamatorio linfocítico y que suelen localizarse bajo la vesícula intradérmica, en la que se suelen encontrar, además, los cambios citopáticos característicos de esta entidad51 (fig. 12B). Tanto el herpes simple como el herpes zóster pueden detectarse mediante inmunohistoquímica52.
Dengue: Hallazgos relativamente inespecíficos con edema, infiltrados perivasculares mixtos y daño endotelial, junto con extravasación hemática y, más raramente, trombosis53,54.
Zika: Podemos encontrar un espectro de hallazgos que van desde un infiltrado linfocítico perivascular inespecífico, a espongiosis, exocitosis, queratinocitos apoptóticos, ligero edema y extravasación hemática, e incluso, en las lesiones psoriasiformes postzika, una hiperplasia psoriasiforme regular con infiltrado liquenoide y perivascular48. A pesar de que no se remarque la trombosis entre sus características histopatológicas, al igual que otros virus de la familia de los Flavivirus (dengue, Zika, West Nile, fiebre amarilla, encefalitis japonesa), puede segregar una glicoproteína denominada proteína no estructural 1 (NS1), capaz de unirse a las células endoteliales y de alterar su permeabilidad a nivel cutáneo, pulmonar, umbilical y cerebral55.
SARS-CoV-2: En los casos de lesiones tipo perniosis, se observa un infiltrado perivascular moderado a intenso, superficial y profundo, con endotelitis, extravasación hemática y, en un porcentaje menor, presencia de trombos de fibrina56 (fig. 13, abajo derecha). Estas lesiones son más frecuentes en pacientes con clínica sistémica menos grave57. En las lesiones livedoides e isquémicas acrales (fig. 13, arriba), más asociadas a pacientes con cuadros clínicos graves que requieren ingreso, pueden verse trombos hialinos tanto en vasos de dermis papilar como en vasos arteriales de mayor tamaño, localizados en la unión dermo-hipodérmica58 (fig. 13, abajo izquierda). Adicionalmente, puede verse necrosis de las glándulas ecrinas. Aunque la RT-PCR de COVID suele ser negativa en ambos tipos de lesiones, algunos autores han observado positividad inmunohistoquímica para Spike3 (una proteína de la cápsula del coronavirus), en glándulas ecrinas de lesiones tipo perniosis59.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.