El diagnóstico diferencial clínico entre los hemangiomas congénitos (HC) y los infantiles (HI) es complicado pero esencial para el tratamiento. El marcador inmunohistoquímico GLUT-1 ayuda a distinguirlos, sin embargo, la biopsia no es habitual. Se diseñó un estudio retrospectivo incluyendo los HI y a los HC diagnosticados en un hospital terciario en un periodo de 3 años, con el objetivo de describir y comparar los principales aspectos clínicos, epidemiológicos y terapéuticos. Se incluyeron un total de 107 hemangiomas, 34 HC (NICH/PICH/RICH), 70 HI y 3 pendientes de clasificar. El HI superficial de cabeza y cuello fue el tumor más frecuente. El tronco fue la localización más frecuente de los HC. Los factores de riesgo estudiados fueron más frecuentes en el grupo de los HI. Para los HI, el tipo de respuesta obtenida fue independiente de las variables (sexo, fecundación in vitro, profundidad, localización y tipo de tratamiento).
Distinguishing between congenital and infantile hemangiomas is challenging, but essential for appropriate treatment. The immunohistochemical marker glucose transporter type 1 is helpful, but biopsies are uncommon in this setting. The aim of this retrospective study was to describe and compare epidemiological, clinical, and treatment characteristics of congenital and infantile hemangiomas diagnosed at a tertiary care hospital over 3 years. We studied 107 hemangiomas: 34 congenital hemangiomas (rapidly involuting, partially involuting, and noninvoluting), 70 infantile hemangiomas, and 3 hemangiomas pending classification. Superficial infantile hemangiomas of the head and neck were the most prevalent tumors. Congenital hemangiomas were most often located on the trunk. Studied risk factors were more common in patients with infantile hemangiomas. In this group of patients, treatment response was independent of sex, in vitro fertilization, lesion depth and location, and type of treatment.
El hemangioma infantil (HI) constituye el tumor vascular benigno1 más frecuente en la infancia2,3. Típicamente los HI presentan 3 fases de crecimiento secuenciales (proliferativa rápida, estabilidad e involución lenta), dejando ocasionalmente secuelas estéticas y funcionales2. Algunos pacientes presentan una llamada lesión precursora, que puede dificultar el diagnóstico diferencial con tumores vasculares biológicamente diferentes como los hemangiomas congénitos (HC). La distinción entre ambas entidades es esencial para establecer una adecuada estrategia terapéutica1,2. El marcador inmunohistoquímico GLUT-1, positivo en todas las fases evolutivas de los HI y negativo en los HC, ayuda a distinguir ambos, sin embargo, la biopsia es una prueba no habitual, reservada para casos seleccionados2,3. En muchos casos, el proceso diagnóstico se hace de forma diferida, basándose en una correcta evaluación clínica, apoyada en pruebas de imagen.
El objetivo principal del presente estudio fue describir y comparar los principales aspectos clínicos, epidemiológicos y terapéuticos de los HC y los HI diagnosticados en un hospital terciario.
Material y métodosSe realizó un estudio observacional retrospectivo incluyendo a los pacientes con HC y HI diagnosticados en la unidad de dermatología pediátrica del Hospital Universitario Dr. Peset de València entre diciembre de 2019 y diciembre de 2022. Ante la ausencia de estudio histopatológico, la clasificación en HC o HI se realizó atendiendo a diferentes factores, de forma que la identificación de la lesión durante el periodo gestacional, la existencia de una lesión completamente formada en el momento del nacimiento y la ausencia de fases bien delimitadas de crecimiento ayudó a clasificar las lesiones como HC, mientras que la ausencia del tumor al nacimiento, la existencia de una lesión precursora y la identificación de fases bien diferenciadas de crecimiento apoyó el diagnóstico de HI. Se describieron los subtipos de hemangioma2,4,5 y sus características, la agrupación sindrómica (PHACES, LUMBAR) o no de los HI, los datos sociodemográficos (incluyendo factores de riesgo y comorbilidades maternas), la estrategia de tratamiento utilizada6 para los HI (abstención terapéutica, maleato de timolol 0,5% en solución oftálmica7 o propranolol 3,75mg/ml solución oral8,9) y las complicaciones surgidas durante el mismo. La elección de tratamiento oral se realizó atendiendo al tamaño significativo de la lesión, la localización en área facial o con riesgo de deformidad, el número de lesiones y/o el riesgo de ulceración. La respuesta terapéutica se categorizó como nula (<30%), parcial (30-80%) o completa (80-100%) en función del porcentaje de aclaramiento. Se compararon ambos grupos entre sí, y con la evidencia disponible más reciente. Las variables cuantitativas se expresaron en forma de media y desviación típica, y las cualitativas como porcentajes. Planteamos un modelo de regresión para, en el caso de los HI, analizar la influencia de las variables sexo (masculino o femenino), localización (cabeza y cuello, tronco, extremidades superiores y extremidades inferiores/periné), tipo de hemangioma (superficial, profundo o mixto), procedencia o no de fecundación in vitro (FIV) y tipo de tratamiento utilizado (propranolol o timolol), en la respuesta obtenida. Se consideró como significativo un valor de p<0,05. Para el análisis se utilizó la versión 21.0 del programa IBM SPSS (Armonk, NY, EE. UU.).
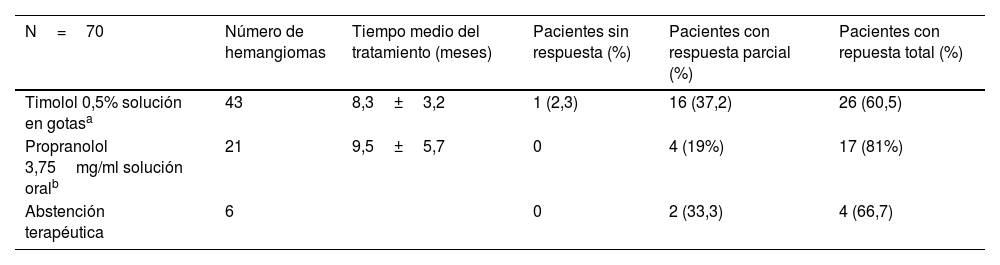
ResultadosSe incluyeron un total de 81 pacientes (53 mujeres y 28 varones) con 107 hemangiomas en total, de los cuales 34 fueron HC y 70 HI. El número medio de hemangiomas fue de 1,3±0,8. En 3 lesiones no se pudo confirmar el diagnóstico de HC o HI por pérdida de seguimiento. La localización más frecuente de los HI fue el territorio cefálico (42,8%) y en el grupo de los congénitos el área comprendida por miembros inferiores/periné (32,3%). En ambos grupos el sexo femenino fue el predominante (un 64% y un 64,8% en los HC y HI respectivamente). Las características de los hemangiomas y los datos sociodemográficos de ambos grupos aparecen detallados de forma comparativa en la tabla 1. De forma complementaria a la exploración clínica, en 55 (67,5%) pacientes se realizó un estudio ecográfico modo B y Doppler y en 10 (12,4%) de ellos una resonancia magnética, esta última condicionada por la localización (lesiones centrofaciales o cervical anterior) y/o con el objetivo de descartar un potencial disrafismo o alteraciones cerebrales asociadas2. En 5 (6,2%) pacientes se solicitó una ecografía abdominal por el número de lesiones y en ninguno de ellos se objetivó la presencia de lesiones hepáticas2. El porcentaje de acierto diagnóstico en base a la sospecha inicial fue del 92,1%, con un intervalo medio de 2,7±1,2 meses hasta la confirmación del mismo. La diabetes gestacional (6,2%) y la preeclampsia materna (4,9%) fueron algunos de los factores de riesgo más repetidos en las gestantes, cuya edad media fue de 32,8±6,5 y 34±5,6 en el grupo de los HC y los HI respectivamente (tabla 1). Hasta 8 (23,5%) pacientes con HC recibieron tratamiento con timolol tras consensuarlo con sus progenitores, sin obtener respuesta en ninguno de ellos. Ninguno de los HC fue sometido a tratamiento quirúrgico. En el caso de los HI, se decidió abstención terapéutica en 6 de ellos, atendiendo a criterios de tamaño, evolución y/o localización, y deseo de los padres. De los 64 HI tratados, 21 (32,8%) recibieron tratamiento con propranolol y 43 (67,2%) con timolol durante un tiempo medio de 9,5±5,7 y 8,3±3,2 meses respectivamente. La respuesta terapéutica obtenida en los HI en función de la estrategia utilizada se muestra resumida tabla 2.
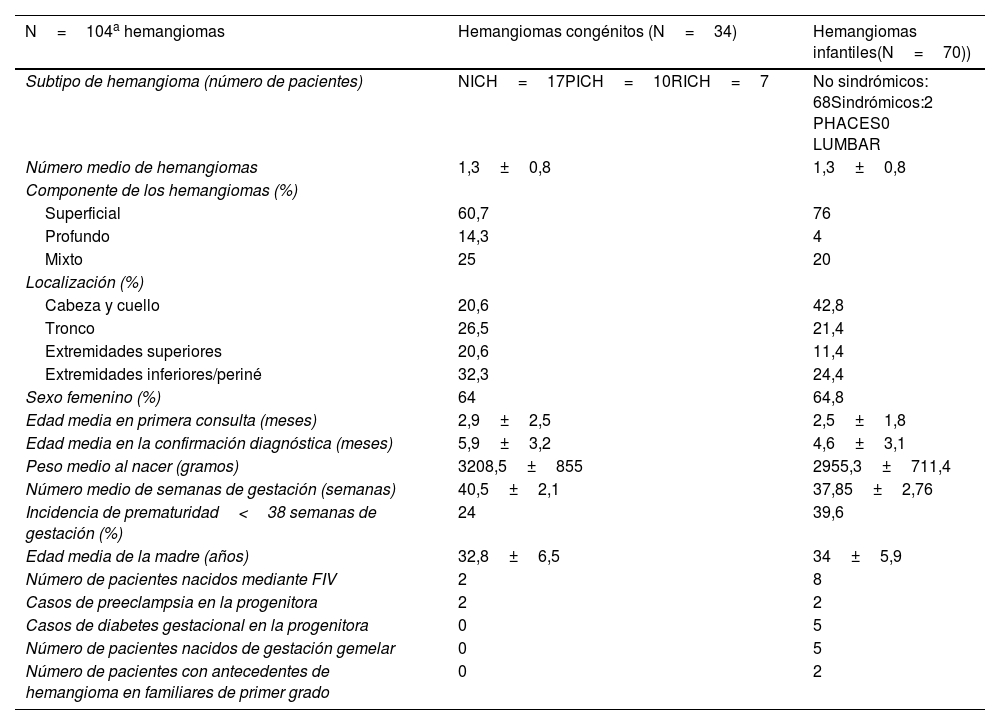
Comparativa de las principales características clínicas, sociodemográficas y factores de riesgo asociados entre el grupo de los hemangiomas infantiles y el de los hemangiomas congénitos
| N=104a hemangiomas | Hemangiomas congénitos (N=34) | Hemangiomas infantiles(N=70)) |
|---|---|---|
| Subtipo de hemangioma (número de pacientes) | NICH=17PICH=10RICH=7 | No sindrómicos: 68Sindrómicos:2 PHACES0 LUMBAR |
| Número medio de hemangiomas | 1,3±0,8 | 1,3±0,8 |
| Componente de los hemangiomas (%) | ||
| Superficial | 60,7 | 76 |
| Profundo | 14,3 | 4 |
| Mixto | 25 | 20 |
| Localización (%) | ||
| Cabeza y cuello | 20,6 | 42,8 |
| Tronco | 26,5 | 21,4 |
| Extremidades superiores | 20,6 | 11,4 |
| Extremidades inferiores/periné | 32,3 | 24,4 |
| Sexo femenino (%) | 64 | 64,8 |
| Edad media en primera consulta (meses) | 2,9±2,5 | 2,5±1,8 |
| Edad media en la confirmación diagnóstica (meses) | 5,9±3,2 | 4,6±3,1 |
| Peso medio al nacer (gramos) | 3208,5±855 | 2955,3±711,4 |
| Número medio de semanas de gestación (semanas) | 40,5±2,1 | 37,85±2,76 |
| Incidencia de prematuridad<38 semanas de gestación (%) | 24 | 39,6 |
| Edad media de la madre (años) | 32,8±6,5 | 34±5,9 |
| Número de pacientes nacidos mediante FIV | 2 | 8 |
| Casos de preeclampsia en la progenitora | 2 | 2 |
| Casos de diabetes gestacional en la progenitora | 0 | 5 |
| Número de pacientes nacidos de gestación gemelar | 0 | 5 |
| Número de pacientes con antecedentes de hemangioma en familiares de primer grado | 0 | 2 |
Evaluación de la respuesta terapéutica en los hemangiomas infantiles en función de la estrategia utilizada
| N=70 | Número de hemangiomas | Tiempo medio del tratamiento (meses) | Pacientes sin respuesta (%) | Pacientes con respuesta parcial (%) | Pacientes con repuesta total (%) |
|---|---|---|---|---|---|
| Timolol 0,5% solución en gotasa | 43 | 8,3±3,2 | 1 (2,3) | 16 (37,2) | 26 (60,5) |
| Propranolol 3,75mg/ml solución oralb | 21 | 9,5±5,7 | 0 | 4 (19%) | 17 (81%) |
| Abstención terapéutica | 6 | 0 | 2 (33,3) | 4 (66,7) |
No se reportaron efectos adversos graves durante el periodo evaluado. Una paciente con un hemangioma glúteo ulcerado10 precisó de tratamiento combinado con dosis bajas de propranolol (1,5mg/kg/día) y láser vascular, con aceptable resultado estético. En las 2 pacientes con síndrome de PHACES, tras un examen cardiológico completo se inició tratamiento con propranolol a dosis de 1mg/kg/día, llevando a cabo una escalada más lenta11, y en ningún caso sobrepasando los 2mg/kg/día. No se obtuvieron diferencias significativas en el tipo de respuesta obtenida (total o parcial) en función del sexo, la localización en profundidad, la localización topográfica, la procedencia o no de gestación FIV, y el tipo de tratamiento utilizado (material suplementario).
DiscusiónEn nuestra serie, las características clínicas y sociodemográficas de ambos tipos de hemangiomas son muy similares a las reportadas en la literatura, si bien destaca el elevado porcentaje de HC (31,8%). Pese a que tradicionalmente la presencia de un halo blanco perilesional y de telangiectasias gruesas se han catalogado como un hallazgo clínico cuasi distintivo de los HC, en nuestra experiencia no es tan exclusivo, pudiendo verse también en los HI2. En ambos grupos existe un predominio del sexo femenino, hecho descrito en la literatura para los NICH y los HI, pero no para los RICH/PICH, donde habitualmente no hay diferencias entre sexos4,5,12. Los tumores con componente superficial exclusivo fueron los más numerosos independientemente del tipo de hemangioma, si bien el porcentaje de hemangiomas con componente profundo aislado fue mayor en el grupo de los HC (el 14% frente al 4% en los HI). La localización predominante de los HI fue el polo cefálico (42,8%) y la de los HC el área comprendida por extremidades inferiores/ periné (32,3%), este hecho contrasta con lo reportado en la literatura, donde la localización predominante en ambos tipos de hemangioma fue el polo cefálico2,5. La edad media en la primera consulta fue semejante en ambos grupos, pero el tiempo hasta la confirmación diagnóstica fue mayor en el grupo de los HC (1,3±0,1 meses más). En consonancia con la evidencia disponible, el bajo peso al nacimiento, la incidencia de prematuridad, el porcentaje de pacientes nacido por FIV, la edad de gestación avanzada y algunos de los factores de riesgo recogidos (preeclampsia, diabetes gestacional) fueron más frecuentes en el grupo de los HI2,12.
En el caso de los HI, el porcentaje de respuesta completa al tratamiento con timolol y propranolol fue ligeramente superior al obtenido en los ensayos clínicos6–8,13; este hecho podría explicarse porque catalogamos como respuesta completa un porcentaje de aclaramiento del 80-100%, a lo que se uniría la ausencia de la aleatorización en la práctica clínica real, seleccionando para cada tipo de hemangioma el tratamiento a priori más adecuado. El tipo de respuesta fue independiente de variables como el sexo, la localización, la profundidad, la procedencia o no de gestación FIV y el tipo de tratamiento utilizado. Este hecho contrasta con lo referido en la literatura, donde la respuesta superior se ve en los hemangiomas superficiales6. Recientemente algunos autores han planteado que la eficacia del timolol podría verse incrementada al combinarse con láser, llegando a alcanzar una eficacia similar al propranolol14. Para aquellos pacientes con intolerancia al propranolol, atenolol15 y nadolol16 podrían representar una alternativa, este último avalado por trabajos que demuestran su no inferioridad con propranolol y un mejor perfil de seguridad. En nuestra experiencia, un paciente con hiperreactividad bronquial tuvo una respuesta completa y tolerancia óptima tras tratamiento con atenolol, pero estaba fuera del periodo de seguimiento y no fue incluido en el estudio. En casos refractarios también se ha reportado la potencial utilidad de sirolimus en el tratamiento17. En los HC, el uso de timolol, además de una estrategia inefectiva, podría favorecer la aparición de efectos adversos; por otro lado, se ha planteado que las alteraciones en GNAQ/GNAS11 y las vías moleculares relacionadas podrían suponer una diana terapéutica futura18.
Entre las principales limitaciones del estudio se encuentran el carácter retrospectivo y el pequeño tamaño muestral19. En conclusión, hemos descrito las diferencias observadas en las principales características de los HC y HI diagnosticados en un hospital terciario, con el objetivo de aportar datos que ayuden a diferenciar ambas entidades, revisando la última evidencia disponible.
FinanciaciónEste trabajo no ha recibido financiación para su redacción o publicación.
Conflicto de interesesLos autores declaran no tener conflictos de interés que afecten a la publicación de este manuscrito.
A la doctora Cecilia Alonso Díez, por su colaboración en el diseño de la base de datos.