Imiquimod tópico ha sido utilizado como monoterapia o tratamiento adyuvante fuera de indicación para el lentigo maligno (LM). Nuestro objetivo es describir las modalidades de tratamiento, los resultados clínicos y el manejo de la recidiva en los pacientes que reciben imiquimod para lentigo maligno.
Se incluyó en este estudio a los pacientes de nuestra unidad con lentigo maligno o lentigo maligno melanoma tratados con imiquimod 5% en régimen de monoterapia o junto con cirugía.
Se seleccionaron 14 casos (el 85,7% de lentigo maligno y el 14,3% de lentigo maligno melanoma). Ocho pacientes (57,1%) recibieron imiquimod sin cirugía, y seis (42,9%) fueron sometidos a resección antes de iniciar el tratamiento. Durante el periodo de seguimiento, reapareció la pigmentación en seis pacientes (cuatro con hiperpigmentación postinflamatoria y dos recidivas). Las recidivas fueron tratadas con un margen de resección muy estrecho (1 mm) y retratamiento con imiquimod 5%.
Todas las modalidades de imiquimod reflejaron buena tolerancia de efectos secundarios y bajas tasas de recidiva. Imiquimod parece ser una opción muy versátil para tratar LM en candidatos idóneos.
Topical imiquimod has been used off-label as monotherapy or adjuvant treatment for lentigo maligna. Our aim is to describe treatment modalities, clinical outcomes, and management of recurrence in patients receiving imiquimod for lentigo maligna.
Patients from our unit with lentigo maligna or lentigo maligna melanoma treated with imiquimod 5% as monotherapy or in combination with surgery were included in this study.
Fourteen cases were recruited (85.7% lentigo maligna and 14.3% lentigo maligna melanoma). Eight patients (57.1%) received imiquimod without surgery, and six (42.9%) underwent narrow excision before beginning treatment. During the follow-up period, pigmentation reappeared in 6 patients (4 postinflammatory hyperpigmentation and 2 relapses). Relapses were managed with very narrow excision (1 mm margin) and retreatment with imiquimod 5%.
All imiquimod modalities showed well-tolerated side effects and low recurrence rates, with long periods of follow-up. Imiquimod appears to be a versatile option for treating LM in suitable candidates.
El lentigo maligno (LM) es la fase preinvasiva del lentigo maligno melanoma (LMM)1, considerándose la cirugía el tratamiento estándar2,3. Las principales técnicas no quirúrgicas para LM son radioterapia, láser, crioterapia e imiquimod2,4.
Imiquimod ha sido utilizado fuera de indicación para LM, como monoterapia o tratamiento adyuvante1–9. Sin embargo, existe escasa información acerca de los signos post-tratamiento inmediatos, o la detección y manejo de las recidivas. Nuestro objetivo es describir a nuestros pacientes tratados con imiquimod para LM, con respecto a las modalidades de tratamiento, los resultados clínicos, las recidivas y los efectos adversos asociados.
Pacientes y métodosIncluimos a todos los pacientes de 2006 a 2019 de la Unidad de Melanoma de nuestro hospital con confirmación histológica de LM o LMM, tratados con imiquimod 5%, en solitario o como adyuvante.
A todos los pacientes se les había prescrito imiquimod tópico, una vez al día, aplicado sobre la lesión y 1 cm alrededor de la misma, y 1 cm alrededor de la cicatriz en lesiones resecadas. La duración del tratamiento varió de cinco a 11 semanas, hasta lograr al menos el nivel deseado de inflamación (eritema con erosiones y costras) y, de no lograrse, se añadió tazaroteno gel al 0,05% para incrementarla. Un dermatólogo (JB) realizó el seguimiento de los pacientes cada dos semanas durante el periodo de tratamiento, y posteriormente cada seis meses. En cada visita, se sometió a los pacientes a una estrecha exploración clínica, controles fotográficos y dermatoscopia digital.
Las variables recopiladas fueron los datos clínicos (sexo, edad, localización), estatus quirúrgico, régimen de imiquimod, reacción inflamatoria, duración del seguimiento, y reaparición de la pigmentación (recidiva o hiperpigmentación postinflamatoria).
En todos los casos informamos a los pacientes que la prescripción de imiquimod era fuera de indicación, así como de los diferentes tratamientos alternativos disponibles. Se obtuvo consentimiento informado de todos los pacientes.
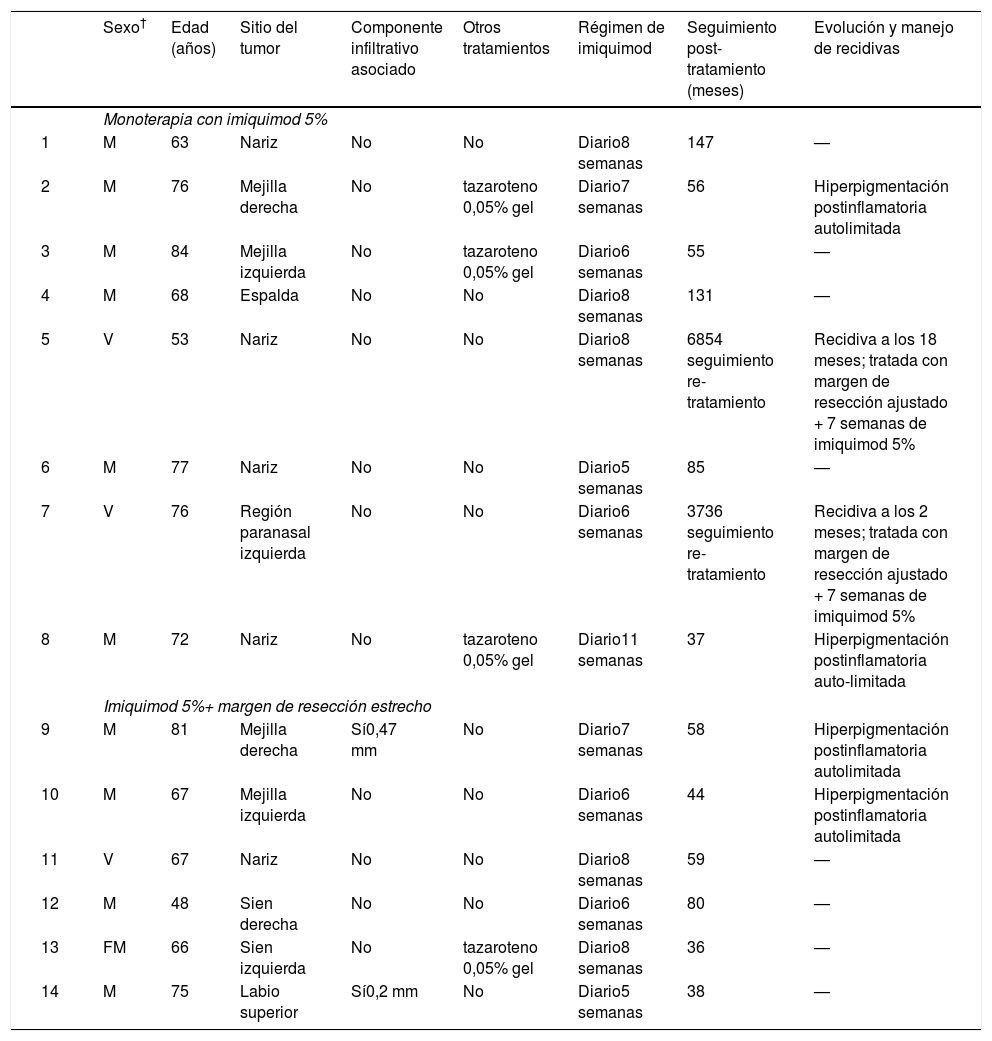
ResultadosIncluimos 14 casos en nuestro estudio. La tabla 1 presenta las características de la muestra. Once pacientes (78,6%) eran mujeres. La edad media al inicio de la enfermedad fue de 69,5 años. Las lesiones aparecieron con más frecuencia en la nariz (35,7%) y mejillas (28,6%). Doce participantes (85,7%) tenían diagnóstico histológico de LM y dos de LMM (14,3%).
Serie de casos de imiquimod en lentigo maligno: modalidades de tratamiento y características de los pacientes
| Sexo† | Edad (años) | Sitio del tumor | Componente infiltrativo asociado | Otros tratamientos | Régimen de imiquimod | Seguimiento post-tratamiento (meses) | Evolución y manejo de recidivas | |
|---|---|---|---|---|---|---|---|---|
| Monoterapia con imiquimod 5% | ||||||||
| 1 | M | 63 | Nariz | No | No | Diario8 semanas | 147 | — |
| 2 | M | 76 | Mejilla derecha | No | tazaroteno 0,05% gel | Diario7 semanas | 56 | Hiperpigmentación postinflamatoria autolimitada |
| 3 | M | 84 | Mejilla izquierda | No | tazaroteno 0,05% gel | Diario6 semanas | 55 | — |
| 4 | M | 68 | Espalda | No | No | Diario8 semanas | 131 | — |
| 5 | V | 53 | Nariz | No | No | Diario8 semanas | 6854 seguimiento re-tratamiento | Recidiva a los 18 meses; tratada con margen de resección ajustado + 7 semanas de imiquimod 5% |
| 6 | M | 77 | Nariz | No | No | Diario5 semanas | 85 | — |
| 7 | V | 76 | Región paranasal izquierda | No | No | Diario6 semanas | 3736 seguimiento re-tratamiento | Recidiva a los 2 meses; tratada con margen de resección ajustado + 7 semanas de imiquimod 5% |
| 8 | M | 72 | Nariz | No | tazaroteno 0,05% gel | Diario11 semanas | 37 | Hiperpigmentación postinflamatoria auto-limitada |
| Imiquimod 5%+ margen de resección estrecho | ||||||||
| 9 | M | 81 | Mejilla derecha | Sí0,47 mm | No | Diario7 semanas | 58 | Hiperpigmentación postinflamatoria autolimitada |
| 10 | M | 67 | Mejilla izquierda | No | No | Diario6 semanas | 44 | Hiperpigmentación postinflamatoria autolimitada |
| 11 | V | 67 | Nariz | No | No | Diario8 semanas | 59 | — |
| 12 | M | 48 | Sien derecha | No | No | Diario6 semanas | 80 | — |
| 13 | FM | 66 | Sien izquierda | No | tazaroteno 0,05% gel | Diario8 semanas | 36 | — |
| 14 | M | 75 | Labio superior | Sí0,2 mm | No | Diario5 semanas | 38 | — |
† sex: M: mujer, V: varón.
Ocho pacientes (57,1%) recibieron imiquimod sin cirugía. De ellos, tres (37,5%) requirieron tazaroteno gel al 0,05%. Seis pacientes (42,9%, 4 LM y 2 LMM) fueron sometidos a resección de margen estrecho (incluyendo el componente infiltrativo de LMM) y seguidamente recibieron tratamiento con imiquimod. Un paciente recibió tazaroteno.
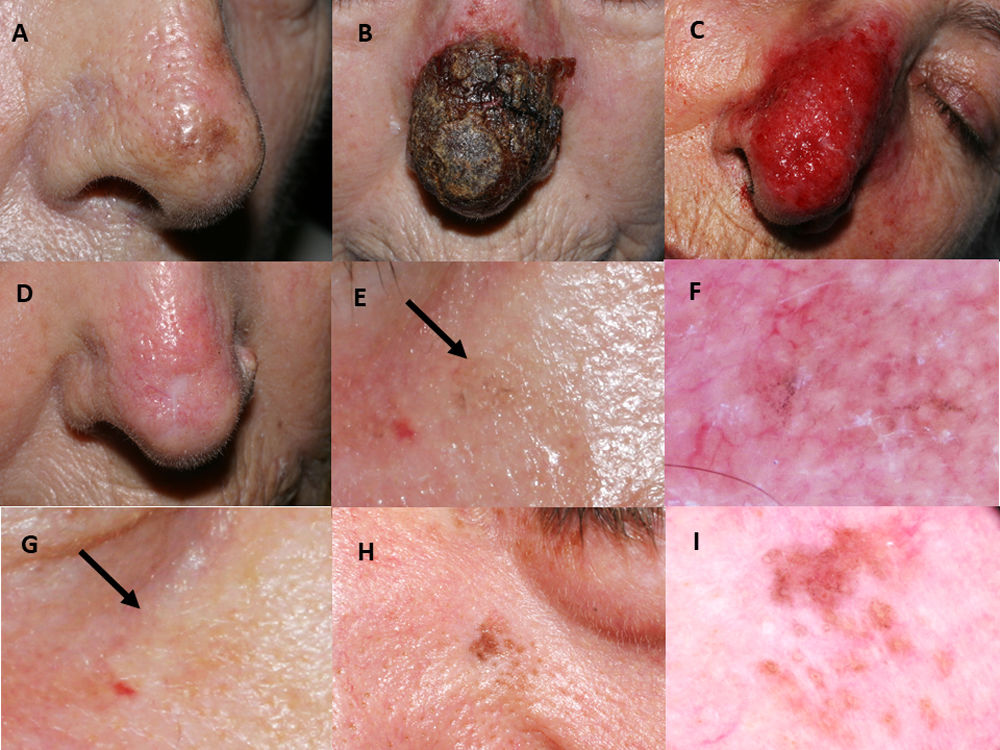
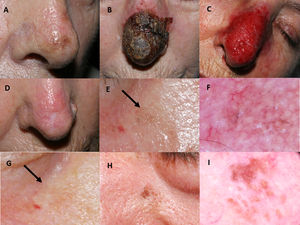
Imiquimod fue aplicado durante una media de siete semanas. Un efecto adverso frecuente fue la aparición de eritema intenso con costras (fig. 1A-D). Cuatro pacientes (28,6%) tuvieron conjuntivitis no infecciosa y un caso presentó un ectropión transitorio debido a la inflamación. Los léntigos solares desaparecieron en las zonas de piel tratada.
Tratamiento con imiquimod de lentigo maligno localizado en la punta de la nariz de una paciente de 77 años de edad (paciente 1, tabla 1): A) Pretratamiento; B) Reacción inflamatoria intensa durante el tratamiento, con costra hemorrágica negra espesa; C) Eritema intenso y edema tras eliminar las costras; D) Resolución tras la finalización del tratamiento. Aparece una cicatriz residual debido a la biopsia cutánea previa. Mujer de 76 años de edad, quien recibió tratamiento con imiquimod 5% en régimen de monoterapia para lesión de lentigo maligno en mejilla derecha con hiperpigmentación postinflamatoria autolimitada (paciente 2, tabla 1): E) Ligera pigmentación gris, flecha negra; F) En esta fotografía dermatoscópica aparecen estructuras anulares-granulares grisáceas alrededor de los folículos (salpicado); G) Desaparición espontánea de la pigmentación tras diversas semanas, flecha negra. Varón de 76 años de edad con recidiva de lentigo maligno transcurridos dos meses de la finalización del tratamiento con imiquimod 5% en régimen de monoterapia (paciente 7, tabla 1): H) Pigmentación moteada marrón de distribución irregular en la región paranasal izquierda; I) Fotografía dermatoscópica que muestra pigmentación marrón perifolicular asimétrica.
El seguimiento post-tratamiento medio fue de 66,4 meses. Se observaron cuatro casos de hiperpigmentación postinflamatoria (fig. 1E-G), que se resolvieron espontáneamente en pocas semanas. Además, detectamos dos recidivas histológicamente confirmadas, ambas en pacientes con régimen de monoterapia de imiquimod. El tiempo medio hasta la recidiva fue de 10 meses. Las recidivas (fig. 1H-I) fueron manejadas exitosamente con un margen de extirpación de un milímetro, y retratamiento con imiquimod durante siete semanas.
DiscusiónActualmente imiquimod no ha sido aprobado para el tratamiento de LM, aunque ha sido descrito como tratamiento fuera de indicación para lesiones incompletamente extirpadas2,3. Imiquimod no es una monoterapia recomendada en los casos de LMM debido al riesgo de metástasis3, pero es una opción tras la extirpación del componente infiltrativo. En nuestros pacientes, imiquimod mostró alta eficacia en las diversas modalidades de tratamiento, siendo escasas las recidivas observadas (2/14 pacientes).
Nuestros resultados son consistentes con los datos reportados sobre la eficacia de imiquimod para LM. Dos revisiones sistemáticas sobre imiquimod como monoterapia, describieron una tasa de respuesta clínica del 78%8,10. Una revisión sistemática de tratamientos no quirúrgicos para LM reportó tasas de recidiva del 11,5% para radioterapia, el 24,5% para imiquimod, y el 34,4% para la terapia de láser4. Un estudio con imiquimod en solitario o como tratamiento adyuvante reportó una tasa de respuesta clínica del 72,7 y el 94,4%, respectivamente3.
Creemos que imiquimod podría ser útil en pacientes con LM que rechazan una cirugía completa, debido a la no aceptación de sus resultados cosméticos, o aquellos pacientes con comorbilidades. Nosotros proponemos la resección de la lesión dermatoscópicamente visible sin márgenes. Si dicha zona fuera demasiado grande, extirpamos la zona más oscura únicamente. Por último, prescribimos imiquimod 5%. De otro modo, en los pacientes que rechazan cualquier cirugía, utilizamos imiquimod como monoterapia. El régimen del tratamiento con imiquimod varía de dos a 84 semanas, según los estudios reportados en la literatura5,8,10. Nuestro objetivo inicial fue lograr una reacción inflamatoria intensa, realizando seguidamente tratamiento continuo durante diversas semanas, con una duración total de seis a ocho semanas. Se añadió tazaroteno tópico al 0,05% cuando la reacción inflamatoria inicial fue insuficiente. El seguimiento quincenal con eliminación de las costras durante el tratamiento mejoró la absorción de imiquimod, tranquilizó al paciente y mejoró el cumplimiento del tratamiento.
El seguimiento dermatoscópico estrecho es esencial para detectar tempranamente las recidivas. Una pigmentación pardusca sugiere recidiva cuando aparece durante los primeros dos años de tratamiento, aunque a mayor plazo podría ser indicativa de nuevos lentigos solares en la zona. En nuestros pacientes, otro hallazgo dermatoscópico orientativo de recidiva fue la distribución perifolicular de la pigmentación. Un color de fondo azul-grisáceo es indicativo de hiperpigmentación postinflamatoria transitoria, que se produce transcurridas unas pocas semanas de tratamiento, y guarda relación histológica con melanofagia.
La microscopía confocal de reflectancia (MCR) es una buena alternativa a los estudios histológicos para monotorizar la lesión. Nosotros creemos que el seguimiento estrecho con fotografía clínica y dermatoscópica digital puede constituir un sustituto válido de la MCR, cuando no se dispone de esta.
El manejo de la recidiva de LM con imiquimod es controvertido. Nuestra serie incluyó dos casos de recidiva local re-tratados conservadoramente con margen estrecho de resección e imiquimod, con buenos resultados.
Las limitaciones principales del estudio incluyen la ausencia de grupo control, el pequeño número de pacientes, y la heterogeneidad de las modalidades de tratamiento. Ello restringe la generalización de nuestros resultados, aunque la práctica clínica real es así. Los puntos fuertes de nuestro estudio residen en el hecho de que el seguimiento de los pacientes fue realizado durante un periodo extenso (de tres a 12 años) por el mismo dermatólogo, y la existencia de controles fotográficos cada seis meses para monitorización. Ello permitió la rápida detección de las recidivas y la documentación de los cambios post-inflamatorios tempranos y transitorios. Nuestros datos también contribuyen a la evidencia científica sobre las diferentes modalidades, en ausencia de ensayos clínicos aleatorizados prospectivos. De igual modo, permite que los clínicos consideren diversas opciones, cuando no pueden practicarse resecciones adecuadas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.