El déficit de vitamina D se asocia con un mayor riesgo de padecer varias enfermedades, incluido el cáncer. Molecularmente, esta parece tener un efecto antineoplásico. Sin embargo, el papel que juega en la patogénesis del cáncer no está bien esclarecido y hay resultados dispares en los estudios publicados. El objetivo del presente fue determinar si unos niveles de vitamina D deficientes en el momento del diagnóstico del melanoma aumentaba el riesgo de desarrollar un cáncer no cutáneo (CNC).
Material y métodoSe diseñó un estudio retrospectivo de 663 pacientes diagnosticados de melanoma entre el 1 de enero de 2011 y el 31 de octubre de 2022. El efecto de cada una de las variables seleccionadas en el desarrollo de un CNC durante el seguimiento tras el diagnóstico del melanoma se realizó mediante el estudio de supervivencia con el método de Kaplan-Meier y las diferencias se evaluaron con la prueba de los rangos logarítmicos. Se elaboraron modelos uni y multivariados de riesgos proporcionales de Cox para cuantificar el efecto de cada valor de las variables de estudio en el tiempo para desarrollar un CNC.
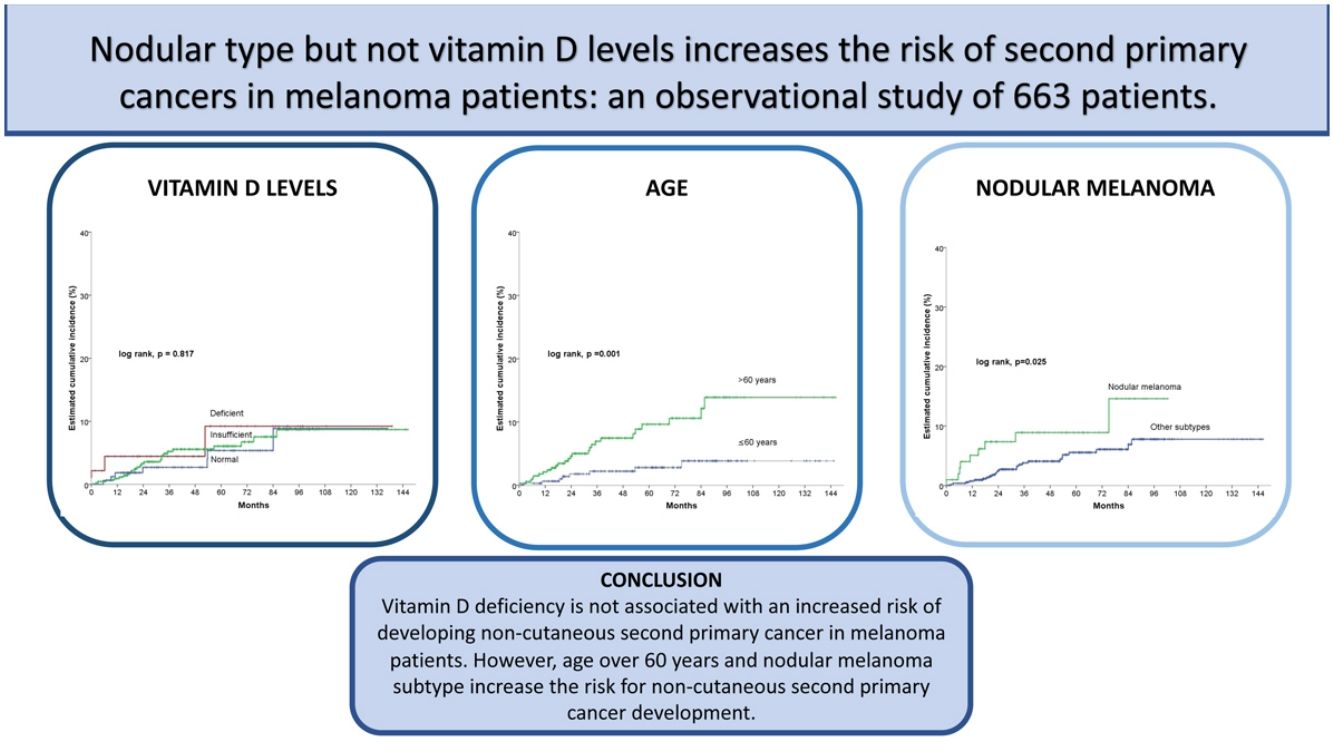
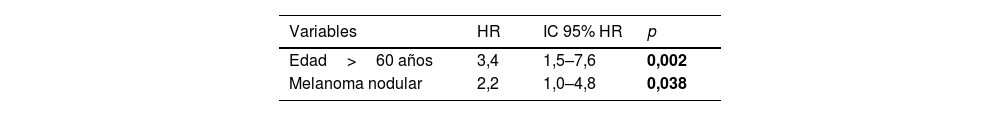
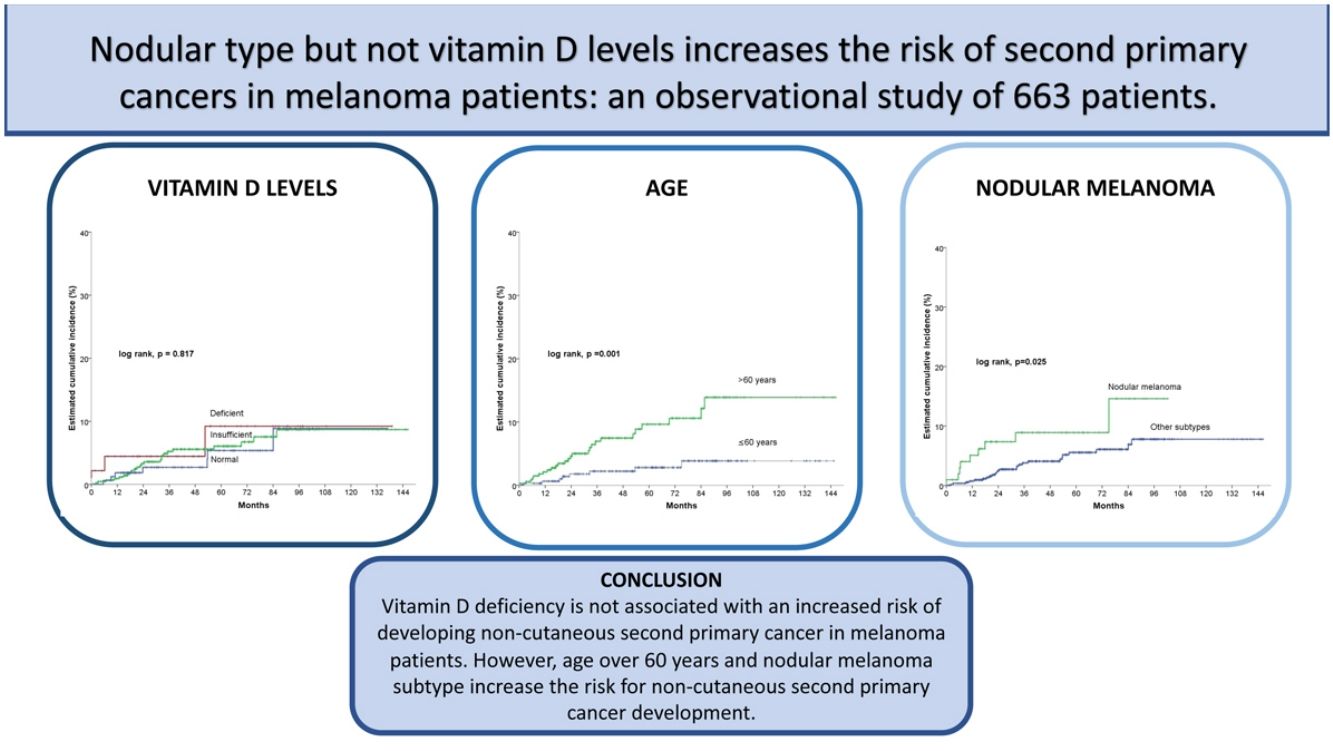
ResultadosDe los 663 pacientes, 34 desarrollaron un CNC tras el melanoma. No hubo diferencias estadísticamente significativas entre los grupos definidos por los niveles de vitamina D (log-rank, p = 0,761). Sin embargo, una edad > 60, el estadio III/IV, y el tipo nodular se asociaron significativamente al desarrollo de un CNC. Tras el análisis multivariado, solo la edad > 60 (hazard ratio [HR] 3,4; intervalo de confianza [IC] 95% HR:1,5-7,6) y el subtipo nodular de melanoma (HR 2,2; IC 95% HR:1,0-4,8) se mantuvieron en el modelo predictivo final.
ConclusionesNuestros resultados sugieren que unos niveles de vitamina D deficientes en el diagnóstico de melanoma no se asocian a un mayor riesgo de desarrollar un CNC. Sin embargo, en una edad > 60 y el subtipo nodular sí que aumentan el riesgo de desarrollar un CNC.
Vitamin D deficiency associates with the risk of developing many diseases, including cancer. At the molecular level, vitamin D appears to have an antineoplastic effect. However, the role of vitamin D deficiency in cancer pathogenesis remains unelucidated and numerous studies have resulted in discordant results. This study aimed to determine whether vitamin D deficiency during melanoma diagnosis increases the risk of developing non-cutaneous second primary cancers (SPC).
Materials and methodsA retrospective study on 663 patients diagnosed with melanoma between 1 January 2011 and 31 October 2022. The effect of each variable on the development of a subsequent non-cutaneous cancer was performed using Kaplan–Meier curves and differences were assessed by log-rank tests. Cox proportional hazard univariate and multivariate models were used to quantify the effect of each variable in the time to develop a non-cutaneous neoplasia.
ResultsOut of 663 patients, 34 developed a non-cutaneous SPC. There was no statistically significant association between vitamin D levels and non-cutaneous SPC development (log-rank, p=0.761). Age>60 years, stage III/IV, and nodular melanoma subtype were significantly associated with the development of a SPC. After multivariate analysis, only age>60 years (HR 3.4; HR CI 95%: 1.5–7.6) and nodular melanoma subtype (HR 2.2; HR CI 95%: 1.0–4.8) were included in the final model.
ConclusionsOur results suggest that vitamin D deficiency is not associated with an increased risk of developing non-cutaneous SPC in melanoma patients. However, age over 60 years and nodular melanoma subtype increase the risk for non-cutaneous SPC development.
El papel de la vitamina D en el metabolismo del calcio y la homeostasis ósea es conocido y su deficiencia es causa de raquitismo y osteoporosis. La deficiencia de vitamina D se asocia con el riesgo de desarrollar múltiples patologías, ya que puede causar enfermedades cardiovasculares, esclerosis múltiple, artritis reumatoide, diabetes mellitus tipo I y cáncer1.
La mayoría de las células nucleadas expresan el receptor de la vitamina D. Numerosos tejidos, además del riñón, expresan 1-alfa-hidroxilasa, la enzima responsable de la conversión de la vitamina D en su forma activa, 1,25-(OH)2D3, que actúa a nivel genómico uniéndose al receptor VDR/RXR y participando en múltiples vías moleculares implicadas en la inmunomodulación, la proliferación, la diferenciación y la apoptosis celular2.
En las últimas décadas, los análisis epigenómicos y transcriptómicos, así como numerosos estudios experimentales en diferentes tipos de cáncer, han aportado datos fiables que, en conjunto, indican una acción protectora de la vitamina D frente a varios tipos de cáncer3,4.
La vitamina D parece ejercer efectos antineoplásicos tanto directamente, controlando la diferenciación, proliferación y apoptosis de las células neoplásicas, como indirectamente, regulando las células estromales e inmunitarias del microambiente tumoral5 y disminuyendo así el riesgo de metástasis4,6.
Sin embargo, la deficiencia de vitamina D en la patogénesis tumoral sigue siendo controvertida. Numerosos estudios han informado de la relación entre la deficiencia de vitamina D y el desarrollo de diferentes neoplasias, con resultados contradictorios. Los estudios epidemiológicos observacionales mostraron que un estado bajo de vitamina D es un factor de riesgo para diferentes tipos de cáncer y sugieren que la suplementación con vitamina D3 podría prevenir el desarrollo de cáncer. Sin embargo, los ensayos clínicos controlados aleatorizados no han podido confirmar estos hallazgos para la población general5.
Una revisión de 2021 mostró que, aunque los estudios observacionales indican en muchos casos que los niveles bajos de vitamina D se asocian a un mayor riesgo de cáncer, los estudios aleatorizados muestran que la administración de suplementos vitamínicos reduce ligeramente la mortalidad total por cáncer, pero no su incidencia7.
En nuestra experiencia, la deficiencia de vitamina D se asoció con melanomas más agresivos8,9. Además, en una revisión sistemática reciente, la deficiencia de vitamina D, definida con unos niveles<20ng/mL, se ha asociado con un mayor grosor del Breslow y un peor pronóstico en pacientes diagnosticados de melanoma y, por el contrario, no se asoció con una mayor incidencia de melanoma10.
Se sabe que los pacientes que sobreviven a un melanoma tienen un mayor riesgo de desarrollar un segundo cáncer primario maligno no cutáneo11.
En 2022, un análisis de 120,299 pacientes de la base de datos SEER mostró una mayor incidencia de cánceres primarios secundarios (CPS) en pacientes con melanoma cutáneo no acral, melanoma lentiginoso acral, melanoma mucoso y melanoma uveal en comparación con la población general12.
La evidencia de una asociación entre la deficiencia de vitamina D y el CPS no cutáneo en pacientes diagnosticados de melanoma es incierta. Por lo tanto, creemos que esta cuestión requiere más investigación, ya que no hay suficientes estudios que aporten pruebas científicas de que la deficiencia de vitamina D en el momento del diagnóstico de melanoma sea un factor de riesgo para desarrollar segundas neoplasias malignas no cutáneas. Así pues, merece la pena analizar esta hipótesis.
Materiales y métodosDiseño del estudioSe realizó un estudio analítico, observacional, longitudinal y retrospectivo basado en una cohorte de 663 pacientes diagnosticados de melanoma entre el 1 de enero de 2011 y el 31 de octubre de 2022 en nuestro centro. Los criterios de selección fueron pacientes adultos diagnosticados de melanoma con niveles de vitamina D disponibles e información sobre el desarrollo o no de CPS no cutáneo. Toda la información procedía de la base de datos del centro.
Variables de estudioLa variable de resultado fue el desarrollo de un CPS no cutáneo tras el diagnóstico de un primer melanoma cutáneo. El CPS no cutáneo se definió como el cáncer no cutáneo que se había presentado dos o más meses después del diagnóstico de un melanoma. Esta variable también se consideró como evento para estimar la incidencia acumulada y para ello se recuperaron de la base de datos la fecha de diagnóstico del melanoma y la fecha de diagnóstico del CPS. Los pacientes que no desarrollaron un CPS fueron censurados en la fecha del último seguimiento o muerte.
La variable principal fue el nivel de vitamina D en el momento del diagnóstico del melanoma, definiendo tres categorías según su valor: deficiente (<10ng/mL), insuficiente (10-29,99ng/mL) y normal (30-100ng/mL). En el estudio se incluyeron como covariables las siguientes características: sexo, edad (≤60 o >60 años), antecedentes familiares de melanoma, antecedentes familiares de otro cáncer, edad en el momento del diagnóstico del melanoma primario y edad en el momento del diagnóstico del CPS no cutáneo, estadio del melanoma (I-II, III-IV), número de nevos (<20, ≥20), tipo histológico (lentigo maligno melanoma [LMM], melanoma de extensión superficial [MES], melanoma nodular [MN], melanoma lentiginoso acral [MLA]), antecedentes personales de otro cáncer no cutáneo, presencia de angiomas seniles, antecedentes personales de cáncer de piel no melanoma (carcinoma basocelular o escamoso) y exposición al sol (≤20 años, >20 años).
Metodología estadísticaPara las variables continuas se utilizaron medidas de tendencia central, como la media y la desviación estándar o la mediana y el rango intercuartílico, en función de su distribución. En cambio, para las variables categóricas, se utilizó el número absoluto de observaciones en cada categoría y su porcentaje sobre el número total de observaciones para determinar la distribución y la proporción de la población. Las diferencias entre las distribuciones de cada covariable según los grupos de pacientes se evaluaron mediante tablas de contingencia y, como prueba de contraste, la prueba χ2 de Pearson o la prueba exacta de Fisher, en su caso.
La incidencia acumulada de desarrollo de un CPS se estimó mediante el método de Kaplan-Meier, y el análisis univariante para cada variable se comprobó mediante la prueba de rangos logarítmicos.
Se utilizaron modelos de regresión de riesgos proporcionales (PH) de Cox univariantes y multivariantes para cuantificar la asociación entre las covariables y el desarrollo de un CPS no cutáneo. Todas las covariables con un valor p<0,1 en los modelos univariantes se introdujeron en el análisis multivariante por pasos hacia atrás. Se consideró un resultado estadísticamente significativo para un p-valor<0,05 en todas las pruebas. El análisis estadístico se realizó con IBM SPSS versión 20.0.
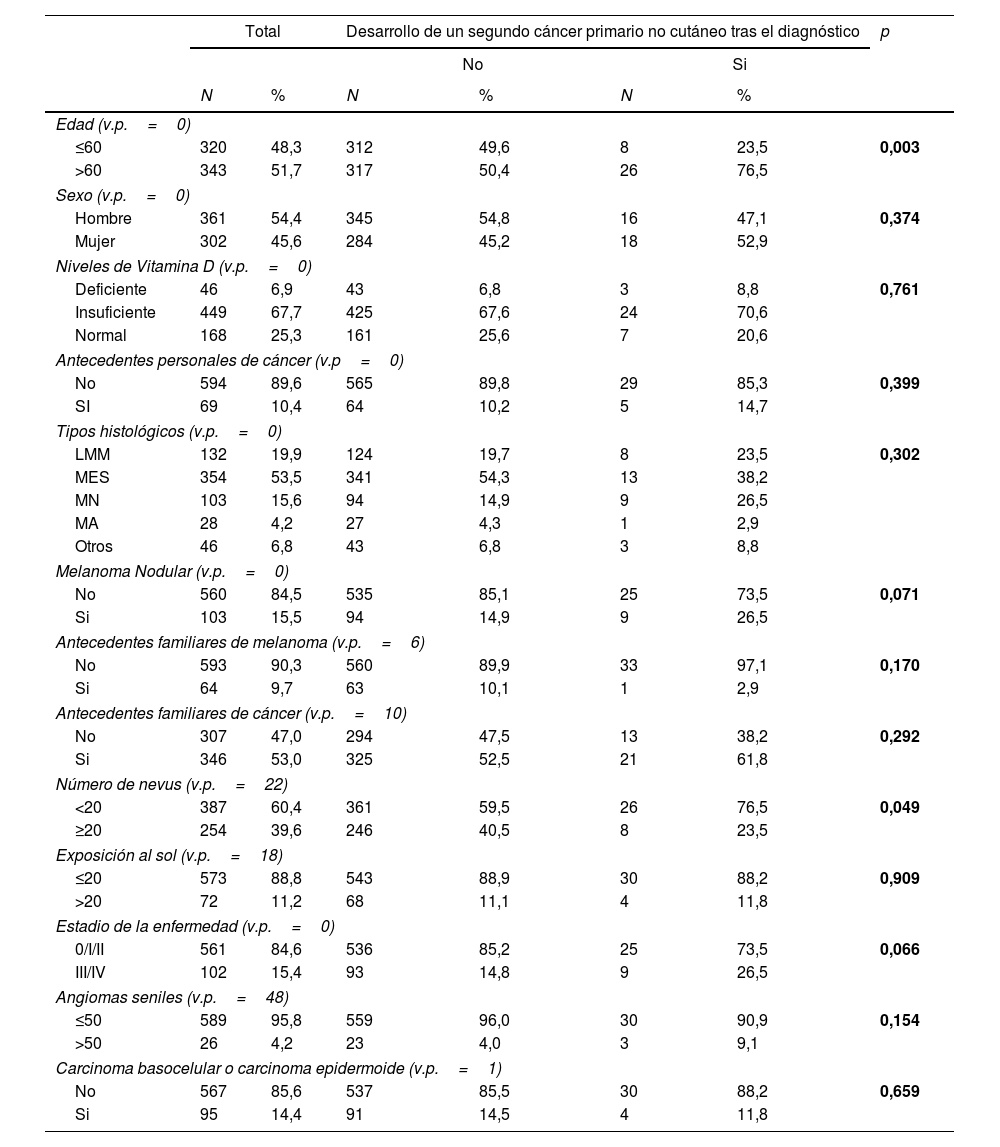
ResultadosEl estudio incluyó a 663 pacientes, 34 de los cuales desarrollaron un CPS no cutáneo tras el diagnóstico de melanoma. Entre los pacientes había 361 (54,4%) hombres y 302 (45,6%) mujeres. La mediana de edad en el momento del diagnóstico fue de 61 años (rango intercuartílico=48-72 años). 46 (6,9%) pacientes presentaban unos niveles deficientes de vitamina D, y 449 (67,7%) niveles insuficientes.
Quinientos sesenta y un pacientes (84,6%) presentaban un melanoma localizado (estadios 0, I y II) y 102 (15,4%) tenían metástasis en el momento del diagnóstico (estadios III o IV). Se objetivaron más de 50 angiomas seniles en 26 pacientes (4,2%), y antecedentes personales de cáncer de piel no melanoma en 95 de los pacientes (4,4%).
En la tabla 1 se detallan las características de la población y las tablas de contingencia de los grupos de estudio.
Características de la población estudiada
| Total | Desarrollo de un segundo cáncer primario no cutáneo tras el diagnóstico | p | |||||
|---|---|---|---|---|---|---|---|
| No | Si | ||||||
| N | % | N | % | N | % | ||
| Edad (v.p.=0) | |||||||
| ≤60 | 320 | 48,3 | 312 | 49,6 | 8 | 23,5 | 0,003 |
| >60 | 343 | 51,7 | 317 | 50,4 | 26 | 76,5 | |
| Sexo (v.p.=0) | |||||||
| Hombre | 361 | 54,4 | 345 | 54,8 | 16 | 47,1 | 0,374 |
| Mujer | 302 | 45,6 | 284 | 45,2 | 18 | 52,9 | |
| Niveles de Vitamina D (v.p.=0) | |||||||
| Deficiente | 46 | 6,9 | 43 | 6,8 | 3 | 8,8 | 0,761 |
| Insuficiente | 449 | 67,7 | 425 | 67,6 | 24 | 70,6 | |
| Normal | 168 | 25,3 | 161 | 25,6 | 7 | 20,6 | |
| Antecedentes personales de cáncer (v.p=0) | |||||||
| No | 594 | 89,6 | 565 | 89,8 | 29 | 85,3 | 0,399 |
| SI | 69 | 10,4 | 64 | 10,2 | 5 | 14,7 | |
| Tipos histológicos (v.p.=0) | |||||||
| LMM | 132 | 19,9 | 124 | 19,7 | 8 | 23,5 | 0,302 |
| MES | 354 | 53,5 | 341 | 54,3 | 13 | 38,2 | |
| MN | 103 | 15,6 | 94 | 14,9 | 9 | 26,5 | |
| MA | 28 | 4,2 | 27 | 4,3 | 1 | 2,9 | |
| Otros | 46 | 6,8 | 43 | 6,8 | 3 | 8,8 | |
| Melanoma Nodular (v.p.=0) | |||||||
| No | 560 | 84,5 | 535 | 85,1 | 25 | 73,5 | 0,071 |
| Si | 103 | 15,5 | 94 | 14,9 | 9 | 26,5 | |
| Antecedentes familiares de melanoma (v.p.=6) | |||||||
| No | 593 | 90,3 | 560 | 89,9 | 33 | 97,1 | 0,170 |
| Si | 64 | 9,7 | 63 | 10,1 | 1 | 2,9 | |
| Antecedentes familiares de cáncer (v.p.=10) | |||||||
| No | 307 | 47,0 | 294 | 47,5 | 13 | 38,2 | 0,292 |
| Si | 346 | 53,0 | 325 | 52,5 | 21 | 61,8 | |
| Número de nevus (v.p.=22) | |||||||
| <20 | 387 | 60,4 | 361 | 59,5 | 26 | 76,5 | 0,049 |
| ≥20 | 254 | 39,6 | 246 | 40,5 | 8 | 23,5 | |
| Exposición al sol (v.p.=18) | |||||||
| ≤20 | 573 | 88,8 | 543 | 88,9 | 30 | 88,2 | 0,909 |
| >20 | 72 | 11,2 | 68 | 11,1 | 4 | 11,8 | |
| Estadio de la enfermedad (v.p.=0) | |||||||
| 0/I/II | 561 | 84,6 | 536 | 85,2 | 25 | 73,5 | 0,066 |
| III/IV | 102 | 15,4 | 93 | 14,8 | 9 | 26,5 | |
| Angiomas seniles (v.p.=48) | |||||||
| ≤50 | 589 | 95,8 | 559 | 96,0 | 30 | 90,9 | 0,154 |
| >50 | 26 | 4,2 | 23 | 4,0 | 3 | 9,1 | |
| Carcinoma basocelular o carcinoma epidermoide (v.p.=1) | |||||||
| No | 567 | 85,6 | 537 | 85,5 | 30 | 88,2 | 0,659 |
| Si | 95 | 14,4 | 91 | 14,5 | 4 | 11,8 | |
v.p.: valores perdidos.
LMM: lentigo maligno melanoma; MES: melanoma de extensión superficial; MN: melanoma nodular; MA: melanoma acral.
valor-p <0.05
Al analizar la distribución de las variables independientes estudiadas en los grupos definidos por la presencia o ausencia de un CPS no cutáneo, encontramos que el grupo que había desarrollado un CPS no cutáneo tenía una proporción significativamente mayor de pacientes mayores de 60 años (76,5% frente a 50,4%; p=0,003) y pacientes con 20 o menos nevos (76,5% frente a 59,5%; p=0,049), y una tendencia a presentar un melanoma nodular (26,5% frente a 14,9%; p=0,071) y un estadio avanzado (III/IV) (26,5% frente a 14,8%; p=0,066).
No se encontraron diferencias estadísticamente significativas para las variables sexo, niveles de vitamina D, antecedentes personales de cáncer, tipo histológico, antecedentes familiares de melanoma, antecedentes familiares de cáncer, exposición solar, angiomas seniles y antecedentes de carcinoma basocelular o epidermoide.
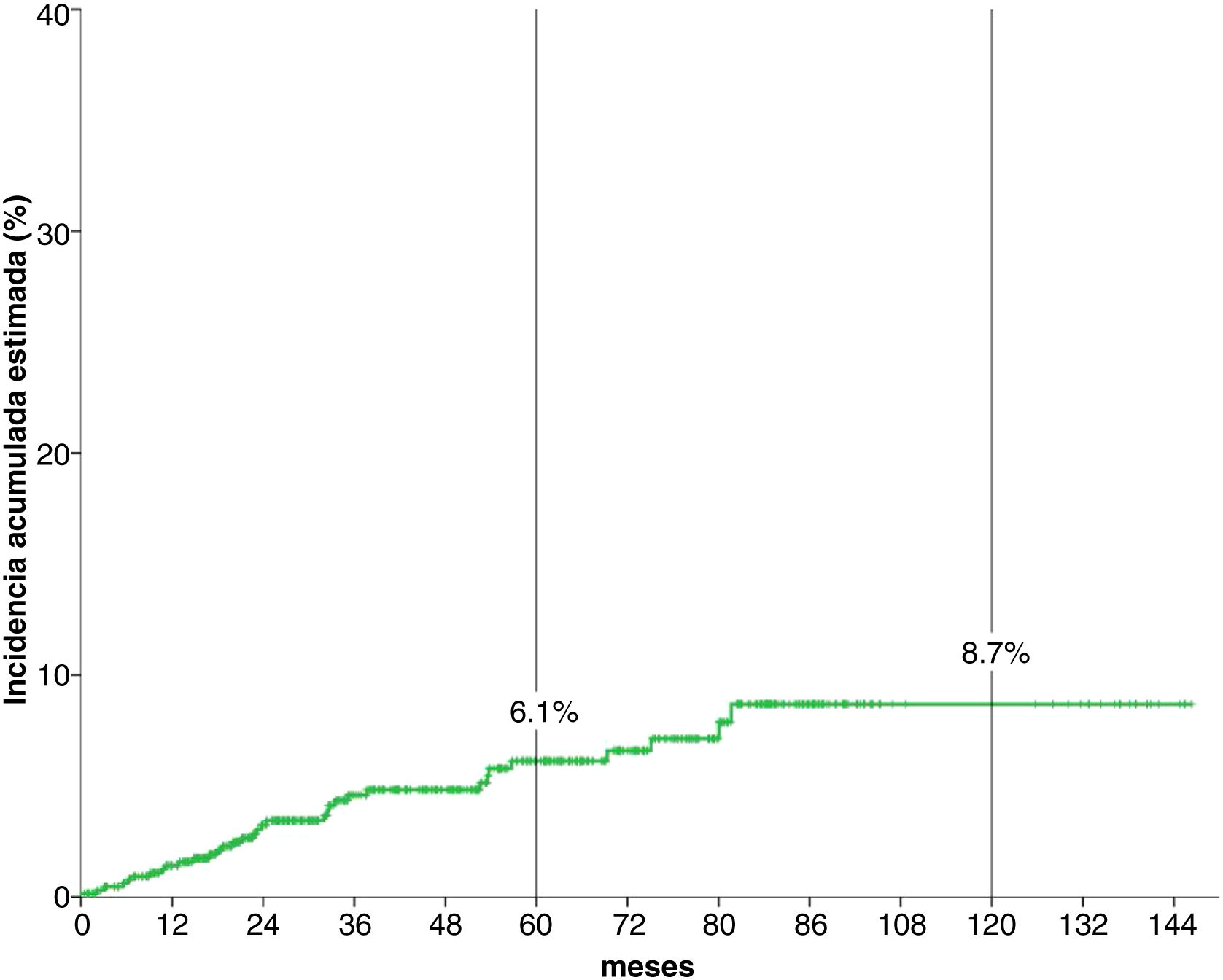
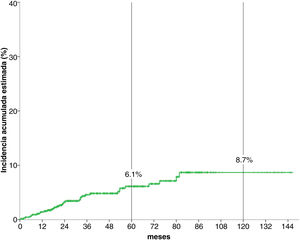
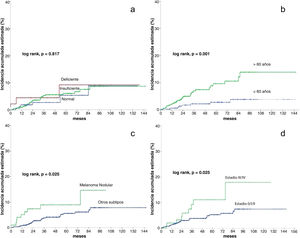
Análisis de la incidencia acumuladaTras una mediana de seguimiento de 51,3 meses, 34 (5,1%) pacientes desarrollaron un CPS no cutáneo. La fig. 1 muestra que la incidencia esetimada global de CPS no cutáneo a los cinco años del 6,1%, y a los diez años, del 8,7%.
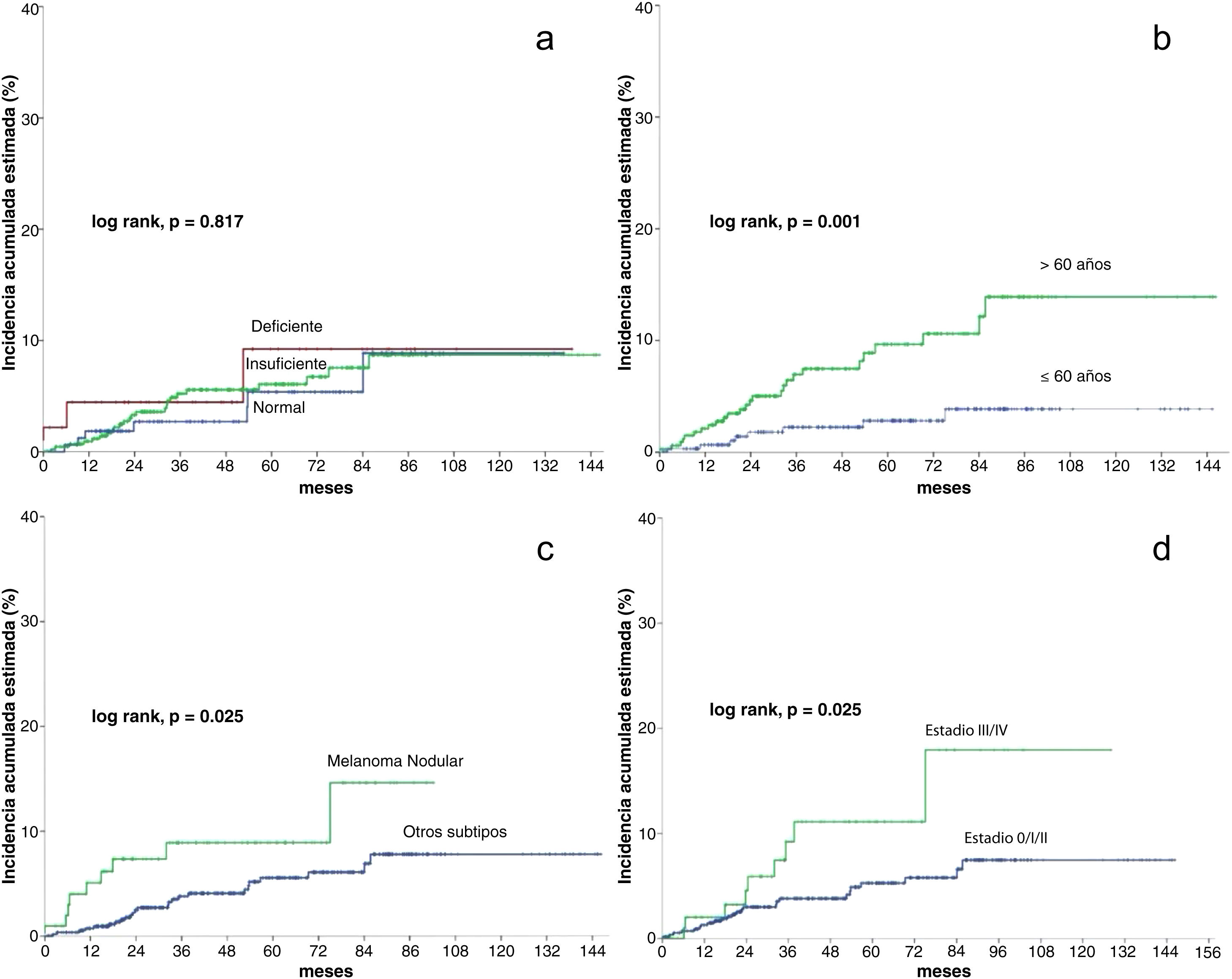
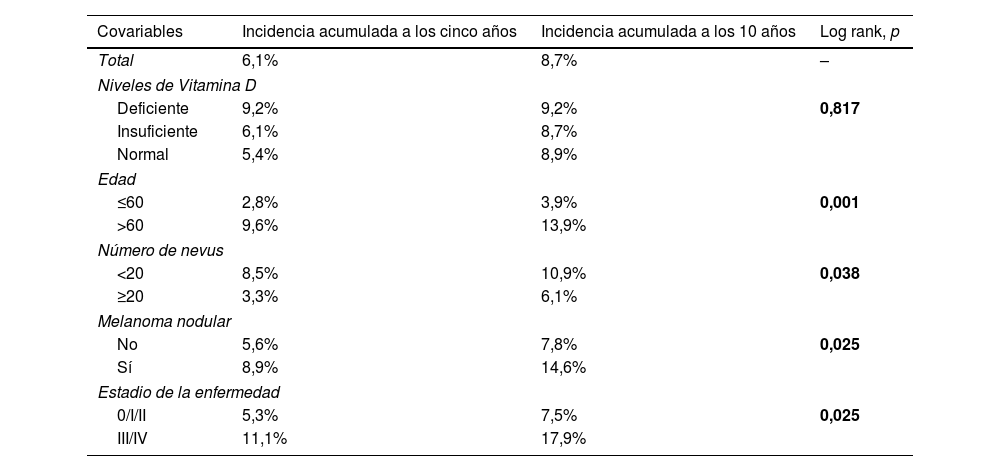
En el análisis estadístico univariante, la incidencia acumulada estimada a 5 y 10 años de CPS no cutáneo fue del 9,2% para los pacientes con niveles deficientes de vitamina D, del 6,1% y 8,7% para los pacientes con unos niveles insuficientes, respectivamente, y del 5,4 y 8,9% en los pacientes con unos niveles suficientes, respectivamente, mostrando que los niveles de vitamina D no diferían significativamente en el tiempo de supervivencia para el desarrollo de un CPS no cutáneo (log-rank, p=0,817) (fig. 2a). Entre las variables restantes, se observaron diferencias significativas para la edad, el número de nevos, el melanoma nodular y el estadio III/IV (tabla 2).
Modelo de supervivencia univariante para la supervivencia acumulada estimada (método de Kaplan-Meier)
| Covariables | Incidencia acumulada a los cinco años | Incidencia acumulada a los 10 años | Log rank, p |
|---|---|---|---|
| Total | 6,1% | 8,7% | – |
| Niveles de Vitamina D | |||
| Deficiente | 9,2% | 9,2% | 0,817 |
| Insuficiente | 6,1% | 8,7% | |
| Normal | 5,4% | 8,9% | |
| Edad | |||
| ≤60 | 2,8% | 3,9% | 0,001 |
| >60 | 9,6% | 13,9% | |
| Número de nevus | |||
| <20 | 8,5% | 10,9% | 0,038 |
| ≥20 | 3,3% | 6,1% | |
| Melanoma nodular | |||
| No | 5,6% | 7,8% | 0,025 |
| Sí | 8,9% | 14,6% | |
| Estadio de la enfermedad | |||
| 0/I/II | 5,3% | 7,5% | 0,025 |
| III/IV | 11,1% | 17,9% | |
Los pacientes mayores de 60 años tuvieron una incidencia significativamente mayor de un CPS no cutáneo (log rank, p=0,001). En los pacientes>60 años, la incidencia acumulada a los 5 y 10 años fue del 9,6% y el 13,9%, respectivamente. Y del 2,8% y el 3,9% para los pacientes≤60 años (fig. 2b).
En cuanto a la presencia de melanoma nodular (log-rank, p=0,025), la incidencia en los pacientes con un melanoma nodular fue del 8,9% a los cinco años y del 14,6% a los diez años, mientras que los pacientes sin melanoma nodular tuvieron una incidencia acumulada a los 5 y 10 años del 5,6% y el 7,8%, respectivamente (fig. 2c).
Respecto al estadio (log rank, p=0,025), los pacientes con estadio III/IV tuvieron una incidencia acumulada a los 5 y 10 años del 11,1% y el 17,9%, respectivamente. Por el contrario, los pacientes con estadio 0/I/II tuvieron una incidencia acumulada a los 5 años del 5,3% y del 7,5% a los diez años (fig. 2d).
Tras el análisis multivariable de riesgos proporcionales de Cox, sólo la edad>60 años (HR 3,4; IC 95% HR 1,5-7,6; p=0,002) y el melanoma nodular (HR 2,2; IC 95% HR 1,0-4,8; p=0,038) mantuvieron su asociación significativa con el desarrollo de un CPS no cutáneo (tabla 3).
DiscusiónHemos realizado un estudio analítico, observacional, longitudinal y retrospectivo basado en una cohorte de 663 pacientes diagnosticados de melanoma para evaluar la relación entre los niveles de vitamina D medidos en el momento del diagnóstico y el desarrollo de una segunda neoplasia maligna no cutánea. Los resultados han demostrado que la deficiencia de vitamina D en el momento del diagnóstico de melanoma no aumenta el riesgo de desarrollar una segunda neoplasia maligna no cutánea. Sin embargo, analizando diferentes variables como el sexo, la edad, los antecedentes de melanoma y otras neoplasias, hemos observado que presentar el melanoma a una edad superior a los 60 años y el subtipo de melanoma nodular se asocian a un mayor riesgo de desarrollar segundas neoplasias malignas no cutáneas.
Aunque algunos estudios habían asociado previamente una menor edad en el momento del diagnóstico del melanoma con un mayor riesgo de desarrollar segundos cánceres primarios13, numerosos estudios recientes han demostrado que una mayor edad aumenta el riesgo de múltiples tumores primarios, Adam C. Krajewski et al. realizaron un estudio prospectivo en 222 pacientes de edad > o = 65 años diagnosticados de melanoma y observaron que, tras una mediana de seguimiento de 5 años, alrededor del 10% desarrollaron un segundo melanoma, y el 4% desarrollaron tres o más melanomas, lo que pone de manifiesto la importancia de un seguimiento estrecho en estos pacientes14. En nuestro estudio, la edad superior a 60 años se asoció de forma estadísticamente significativa con un aumento de otros tumores primarios no cutáneos.
La relación entre el envejecimiento y la incidencia de cáncer está bien establecida, y el envejecimiento representa uno de los factores de riesgo más críticos para el desarrollo de tumores. Esta edad y el cáncer comparten algunos mecanismos biológicos complejos, como la inestabilidad genómica con una acumulación progresiva de daño genético, unas alteraciones epigenéticas (debidas principalmente a la exposición prolongada a carcinógenos ambientales) y un debilitamiento progresivo de los mecanismos de oncosupresión vinculados a la inmunosenescencia15,16.
La asociación entre el melanoma nodular y el riesgo de segundas neoplasias cutáneas malignas es un hallazgo incidental e inesperado en nuestro estudio. El melanoma nodular es, por definición histológica, un subtipo de melanoma que no muestra una fase de crecimiento radial y no muestra proliferación melanocítica intradérmica más allá de tres crestas epidérmicas en cada margen de la masa tumoral17. El melanoma nodular se ha asociado a un peor pronóstico debido a un grosor de Breslow generalmente mayor en el momento del diagnóstico. Presenta procesos biológicos intrínsecamente más agresivos que el melanoma de extensión superficial18.
Desde un punto de vista molecular, el melanoma nodular muestra una mayor frecuencia de mutación en NRAS que el melanoma de extensión superficial, aunque no se han demostrado diferencias en la tasa de mutación BRAF en este subtipo de melanoma. Además, el MN parece mostrar una menor prevalencia de genes somáticos mutados que el MES17,18. El melanoma nodular también muestra una mayor frecuencia de mutaciones en el promotor de TERT que otros subtipos19,20.
Dado que los pacientes con un melanoma nodular tienen una tasa de mortalidad más elevada, cabría esperar que el riesgo de segundas neoplasias malignas se redujera en este subgrupo de pacientes debido a la menor tasa de supervivencia. Sin embargo, en un estudio de 2022, Yen T. Luu et al., utilizando la base de datos Surveillance, Epidemiology, and End Results (SEER), demostraron que los supervivientes de MN, en comparación con otros histotipos, tenían un riesgo un 27% mayor de desarrollar segundas neoplasias malignas primarias21. Este resultado parece coincidir con el nuestro, pero actualmente faltan más datos de apoyo en la literatura.
Las posibles causas son muchas y aún están por dilucidar. La susceptibilidad genética individual puede desempeñar un papel importante en la predisposición a estos tumores, al igual que los factores de riesgo ambientales o inmunológicos.
Además, los pacientes con MN tienden a tener tumores más gruesos y, por tanto, una mayor tasa de tratamiento que los pacientes con otros tipos de melanoma. No se puede excluir que la terapia pueda desempeñar un papel importante en el desarrollo de un CPS; sin embargo, en este estudio no se recogieron datos sobre la terapia de los pacientes.
Algunas limitaciones y puntos fuertes del presente estudio merecen consideración. En primer lugar, nuestro estudio incluye datos de un único centro, por lo que la población estudiada puede no representar a la población general. Además, la muestra analizada es numéricamente limitada, ya que considera 663 pacientes, de los cuales sólo 34 desarrollaron una segunda neoplasia primaria. En segundo lugar, dado que los valores de vitamina D se recogieron durante un periodo relativamente corto, el tiempo de seguimiento de los pacientes también es limitado (51,3 meses de media). En cuanto a los niveles de vitamina D, se utilizaron los rangos establecidos para el metabolismo óseo, pero éstos podrían variar en función del desarrollo tumoral. No se realizó un análisis del punto de corte de vitamina D. Otra limitación de nuestro estudio es la falta de caracterización del tipo de neoplasias primarias secundarias desarrolladas por los pacientes. Por último, en cuanto a la correlación entre un CPS no cutáneo y el melanoma nodular, al tratarse de un hallazgo incidental e inesperado, no tuvimos en cuenta otras variables, como las características moleculares, el sustrato genético y las terapias actuales de estos pacientes, que podrían aportar información importante y que representan hasta la fecha un campo inexplorado digno de mayor estudio.
Por otro lado, el hecho de que los datos se obtuvieran prospectivamente de un único centro, con valores analizados por el mismo laboratorio, hizo posible la obtención de una colección de datos homogénea.
En conclusión, según nuestro estudio, la deficiencia de vitamina D no se asocia a un mayor riesgo de desarrollar un CPS no cutáneo en pacientes con melanoma. Al mismo tiempo, la edad superior a 60 años y el melanoma nodular parecen tener un valor predictivo positivo para desarrollar un CPS no cutáneo.
Se necesitan más estudios para caracterizar la relación entre el MN y el CPS no cutáneo y para comprender los complejos mecanismos biológicos subyacentes. No obstante, nuestros datos confirman la importancia de un seguimiento estrecho de estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.