La hidradenitis supurativa (HS) es una enfermedad cutánea crónica que causa lesiones en las que se encuentran altos niveles de interleucina (IL)-23 y células TH-17 colaboradoras, siendo adalimumab el único tratamiento aprobado. Guselkumab, un anticuerpo que se une a la subunidad p19 de la IL-23 extracelular, ha sido aprobado para tratar la psoriasis de moderada a severa, siendo limitada la evidencia sobre su eficacia en el tratamiento de la HS.
ObjetivosEvaluar la efectividad y la seguridad de guselkumab para el tratamiento de la HS de moderada a severa, en condiciones de práctica clínica.
MétodosSe llevó a cabo un estudio observacional retrospectivo y multicéntrico en 13 hospitales españoles que incluyó pacientes adultos con HS tratados con guselkumab, dentro de un programa de uso compasivo (de marzo de 2020 a marzo de 2022). Se registraron al inicio y a las 16, 24 y 48semanas de tratamiento los datos referentes a las características demográficas y clínicas de los pacientes, los resultados reportados por el paciente (Numerical Pain Rating Scale [NPRS] y Dermatology Life Quality Index [DLQI]), puntuaciones de escalas realizadas por el facultativo (International Hidradenitis Suppurativa Severity Score System [IHS4], HS Physical Global Score [HS-PGA] e Hidradenitis Suppurativa Clinical Response [HiSCR]).
ResultadosSe incluyeron un total de 69 pacientes, de los cuales la mayoría (84,10%) tenían HS severa (HurleyIII) y habían sido diagnosticados hacía más de 10años (58,80%). Dichos pacientes habían sido sometidos a múltiples terapias no biológicas (media: 3,56) o biológicas (media: 1,78), y casi el 90% de los tratados con biológicos habían recibido adalimumab. Se observó una reducción significativa de las puntuaciones IHS4, HS-PGA, NPRS y DLQI desde el inicio hasta las 48semanas del tratamiento con guselkumab (total: p<0,01). Se logró HiSCR en el 58,33% y el 56,52% de los pacientes, a las 16 y 24semanas, respectivamente. A nivel global, 16 pacientes discontinuaron el tratamiento, en su mayoría debido a ineficacia (n=7) o pérdida de eficacia (n=3), no observándose episodios adversos graves.
ConclusionesNuestros resultados indican que guselkumab puede ser una alternativa terapéutica segura y efectiva para los pacientes con HS severa que no responden a otros biológicos.
Hidradenitis suppurativa (HS) is a chronic skin condition causing lesions in which high levels of interleukin (IL)-23 and T-helper17 cells are found. Adalimumab remains the only approved treatment. Guselkumab, an antibody targeting the p19 protein subunit of extracellular IL-23, is approved for the treatment of moderate-severe psoriasis, but evidence on its efficacy in treating HS is limited.
ObjectivesTo assess the effectiveness and safety of guselkumab in treating moderate-severe HS under clinical practice conditions.
MethodsA multicentre retrospective observational study was carried out in 13 Spanish hospitals including adult HS patients treated with guselkumab within a compassionate use programme (March 2020-March 2022). Data referred to patient demographic and clinical characteristics at treatment initiation (baseline), patient-reported outcomes (Numerical Pain Rating Scale [NPRS] and Dermatology Life Quality Index [DLQI]), physician scores (International Hidradenitis Suppurativa Severity Score System [IHS4], HS Physical Global Score [HS-PGA] and Hidradenitis Suppurativa Clinical Response [HiSCR]) were recorded at baseline and at 16, 24, and 48weeks of treatment.
ResultsA total of 69 patients were included. Most (84.10%) had severe HS (HurleyIII) and had been diagnosed for over ten years (58.80%). The patients had been subjected to multiple non-biological (mean: 3.56) or biological (mean: 1.78) therapies, and almost 90% of those treated with biologics had received adalimumab. A significant decrease in IHS4, HS-PGA, NPRS, and DLQI scores was observed from baseline to 48weeks of guselkumab treatment (all P<.01). HiSCR was achieved in 58.33% and 56.52% of the patients at 16 and 24weeks, respectively. Overall, 16 patients discontinued treatment, mostly due to inefficacy (n=7) or loss of efficacy (n=3). No serious adverse events were observed.
ConclusionsOur results indicate that guselkumab may be a safe and effective therapeutic alternative for patients with severe HS that fail to respond to other biologics.
La hidradenitis supurativa (HS) es una enfermedad cutánea inflamatoria crónica que se caracteriza por nódulos recurrentes dolorosos, abscesos, tractos sinusales/fístulas que supuran pus, y formación de cicatrices1. Los pacientes presentan principalmente dolor severo, restricciones de movimiento y mal olor de las secreciones1. Los factores genéticos y ambientales promueven la activación inmune y la infiltración celular, originando una inflamación excesiva y prolongada1,2. Hasta la fecha, el manejo de la HS se basa en el tratamiento antibiótico o antiinflamatorio, aunque adalimumab es el único agente terapéutico que ha sido aprobado para el tratamiento de esta situación por parte de la Agencia Europea del Medicamento (EMA)1,2. Adalimumab es un anticuerpo humano que bloquea el factor de necrosis tumoral y que ha demostrado lograr respuesta clínica a la hidradenitis supurativa (HiSCR), mejorar la calidad de vida (QoL) y reducir el número y la duración de los brotes, con un perfil de tolerabilidad predecible1,2. Considerando el impacto de la HS en la vida del paciente, y el número limitado de tratamientos disponibles, existe una necesidad no satisfecha de encontrar terapias eficaces y seguras para esta enfermedad.
Se observó infiltración de lesiones cutáneas de HS con macrófagos, expresando niveles incrementados de interleucina (IL)-23, un gran impulsor de la inflamación crónica que rige la maduración de las célulasT cooperadoras17 (Th17)1,3, que son conocidas por ser productoras de las citocinas que desencadenan inflamación masiva y autoinmunidad4. El eje IL-23/Th17 está implicado en la patogenia de los trastornos autoinflamatorios tales como HS, psoriasis y enfermedad de Crohn4,5. Guselkumab, un tratamiento aprobado para la psoriasis de moderada a severa, es un anticuerpo monoclonal humano, una inmunoglobulina G1λ que se une a la subunidad p19 de IL-23, impidiendo la señalización intracelular y con ello la activación y producción de citocinas6. Considerando el papel clave del eje de señalización IL-23/Th17 en la HS, guselkumab podría ser una alternativa terapéutica adecuada para la enfermedad, aunque la evidencia sobre su eficacia para tratar la misma proviene de informes de casos individuales o series de casos que incluyen menos de diez pacientes7-11. Un estudio aleatorizado de fase2 que evaluó guselkumab en la HS de moderada a severa fue finalizado en la semana16, dado que no se encontraron diferencias estadísticamente significativas en cuanto a eficacia, en comparación con el placebo12. Sobre la base de esto, evaluamos la efectividad y la seguridad de guselkumab para tratar la HS de moderada a severa en pacientes, en el contexto del uso compasivo del fármaco en España.
Materiales y métodosDiseño y pacientes del estudioSe llevó a cabo un estudio observacional retrospectivo multicéntrico que incluyó a pacientes adultos de HS tratados con guselkumab en la práctica clínica, realizado en 13 hospitales españoles de marzo de 2020 a marzo de 2022. Los pacientes recibieron guselkumab mediante uso compasivo.
El estudio fue realizado con arreglo a la Declaración de Helsinki, y fue aprobado por un comité de ética independiente.
El criterio de valoración primario fue la efectividad de guselkumab en términos del cambio observado en las escalas International Hidradenitis Suppurativa Severity Score System (IHS4) e Hidradenitis Suppurativa-Physician Global Assessment (HS-PGA) transcurridas 16, 24, y 48semanas de tratamiento, así como el porcentaje de pacientes que logró HiSCR a las 16 y 24semanas. Analizamos también el cambio de la QoL mediante el Dermatology Life Quality Index (DLQI), así como la Numerical Pain Rating Scale (NPRS), y calculamos el porcentaje de pacientes que lograron una reducción de DLQI≥4 puntos (considerada una diferencia mínima clínicamente importante [MCID] en cuanto a DLQI)13 y una puntuación NPRS<3 puntos a las 16 y 24semanas. También evaluamos la incidencia de episodios adversos (EA).
Análisis estadísticoSe utilizaron medidas de tendencia central y dispersión para describir las variables continuas, y frecuencias y porcentajes para las variables cualitativas. El cambio de las puntuaciones IHS4, HS-PGA, NPRS y DLQI entre el valor basal y las semanas de tratamiento 4, 16, 24 o 48 se calculó utilizando una prueba t de Student. Se utilizó la corrección de Bonferroni para reducir el error de tipoI.
Se analizaron las características clínicas asociadas al logro de HiSCR, el 55% de reducción de IHS4 (IHS4-55) y MCID en DLQI a las 16 y 24semanas, utilizando modelos de regresión logística bivariante. Todos los análisis se realizaron utilizando el paquete estadístico SAS© versión 9.4 (SAS Institute Inc., NC, EE.UU.).
ResultadosSe incluyó en el estudio a un total de 69 pacientes de HS. La tabla 1 muestra las características demográficas y clínicas basales de los pacientes. La edad media fue de 44años, siendo varones el 50,7%. Cerca del 60% de los pacientes habían sido diagnosticados de HS desde hacía más de diez años. La mayoría de los pacientes tenían HS severa (estadioIII de Hurley, 84,1%), fenotipo inflamatorio (61,8%) y una media de 4,3 zonas afectadas. En general, el 47,5% de los pacientes experimentaron más de 12 brotes de HS al año, habiendo sido tratados previamente con una media de 1,8 biológicos, principalmente adalimumab (88,2%), ustekinumab (33,8%) e infliximab (29,4%). Los pacientes habían sido sometidos a una media de 3,4 cirugías.
Características demográficas y clínicas basales de los pacientes
| Parámetro | Valor |
|---|---|
| n | 69 |
| Edad, media (DE) | 44,59 (14,2) |
| Sexo, n (%) | |
| Varones | 35 (50,7%) |
| Mujeres | 34 (49,3%) |
| IMC, media (DE) | 28,8 (7,6) |
| Datos relacionados con la HS | |
| Antecedentes familiares de HS, n (%) | 20 (29,9) |
| Antecedentes clínicos de acné, n (%) | 28 (40,6) |
| Tiempo desde el diagnóstico en años, n (%)a | |
| < 5 | 13 (19,1) |
| 5-10 | 15 (22,1) |
| > 10 | 40 (59,8) |
| Estadificación de Hurley, n (%) | |
| I | 1 (1,5) |
| II | 10 (14,5) |
| III | 58 (84,1) |
| Fenotipo, n (%) | |
| Inflamatorio | 42 (61,8) |
| Folicular | 3 (4,4) |
| Mixto | 23 (33,8) |
| Zonas corporales afectadas, media (DE) | 4,3 (2,1) |
| Lesiones, media (DE) | |
| Nódulos inflamatorios | 3 (3,2) |
| Abscesos | 2,5 (2,3) |
| Tractos sinusales/fístulas supurativos | 2,6 (2,1) |
| N.° total de lesiones | 8,1 (5,5) |
| Número anual de brotes >12, n (%) | 29 (47,5) |
| Tratamiento previos de HS | |
| N.° de tratamientos previos, media (DE) | |
| Biológicos | 1,8 (1,1) |
| No biológicos | 3,6 (2,6) |
| Tratamientos biológicos previos, n (%) | |
| Adalimumab | 60 (88,2) |
| Ustekinumab | 23 (33,8) |
| Infliximab | 20 (29,4) |
| Otrosb | 17 (24,9) |
| Número de cirugías previas, media (DE) | 3,35 (3,47) |
| Cirugías previas, n (%) | |
| Destechado | 19 (28,8) |
| Extirpación simple | 40 (60,6) |
| Extirpación amplia | 27 (41,5) |
El tratamiento con guselkumab y terapias combinadas se resume en la tabla 2. Muchos pacientes recibieron guselkumab 100mg (66,2%) al inicio, en la semana4 y seguidamente cada ocho semanas. La mayoría de los pacientes (69%) recibieron también otras terapias sistémicas, tales como antibióticos orales, principalmente doxiciclina (42,9%), metformina (19%) y dapsona (10,5%).
Posología de guselkumab y medicaciones concomitantes para HS
| Tratamiento | n (%) |
|---|---|
| Posología de guselkumab, n (%) | |
| 100mg al inicio, semana 4 y cada 8 semanas | 45 (66,2) |
| 100mg cada 4 semanas | 20 (29,4) |
| Otros | 3 (4,4) |
| Medicación concomitante, n (%) | 40 (69,0) |
| Antibióticos | |
| Doxiciclina | 12 (42,9) |
| Otros | 16 (57,1) |
| Infiltración de corticosteroides | 19 (32,8) |
| Metformina | 11 (19,0) |
| Dapsona | 6 (10,5) |
| Colchicina | 1 (1,8) |
| Anticonceptivos | 5 (8,9) |
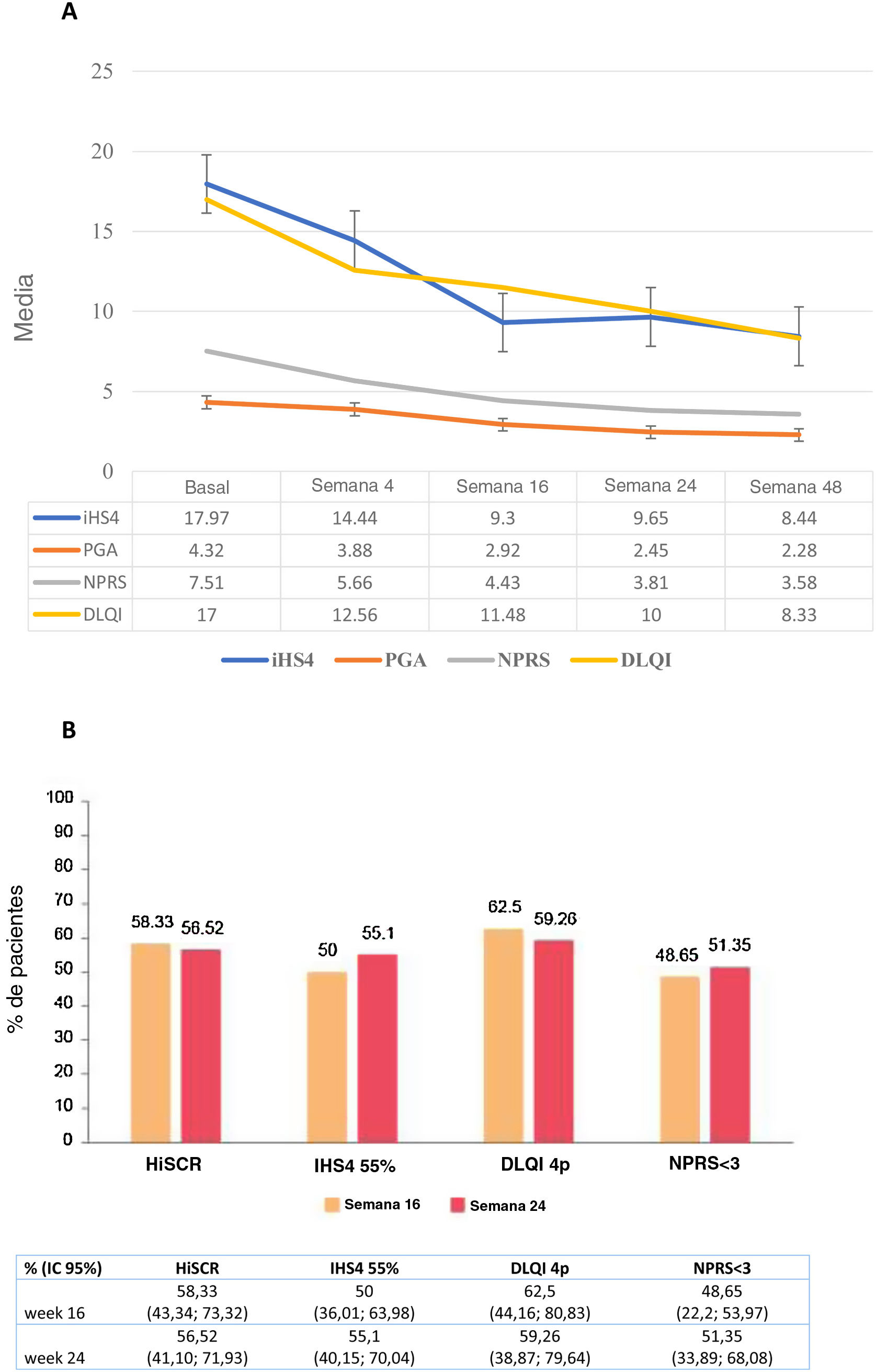
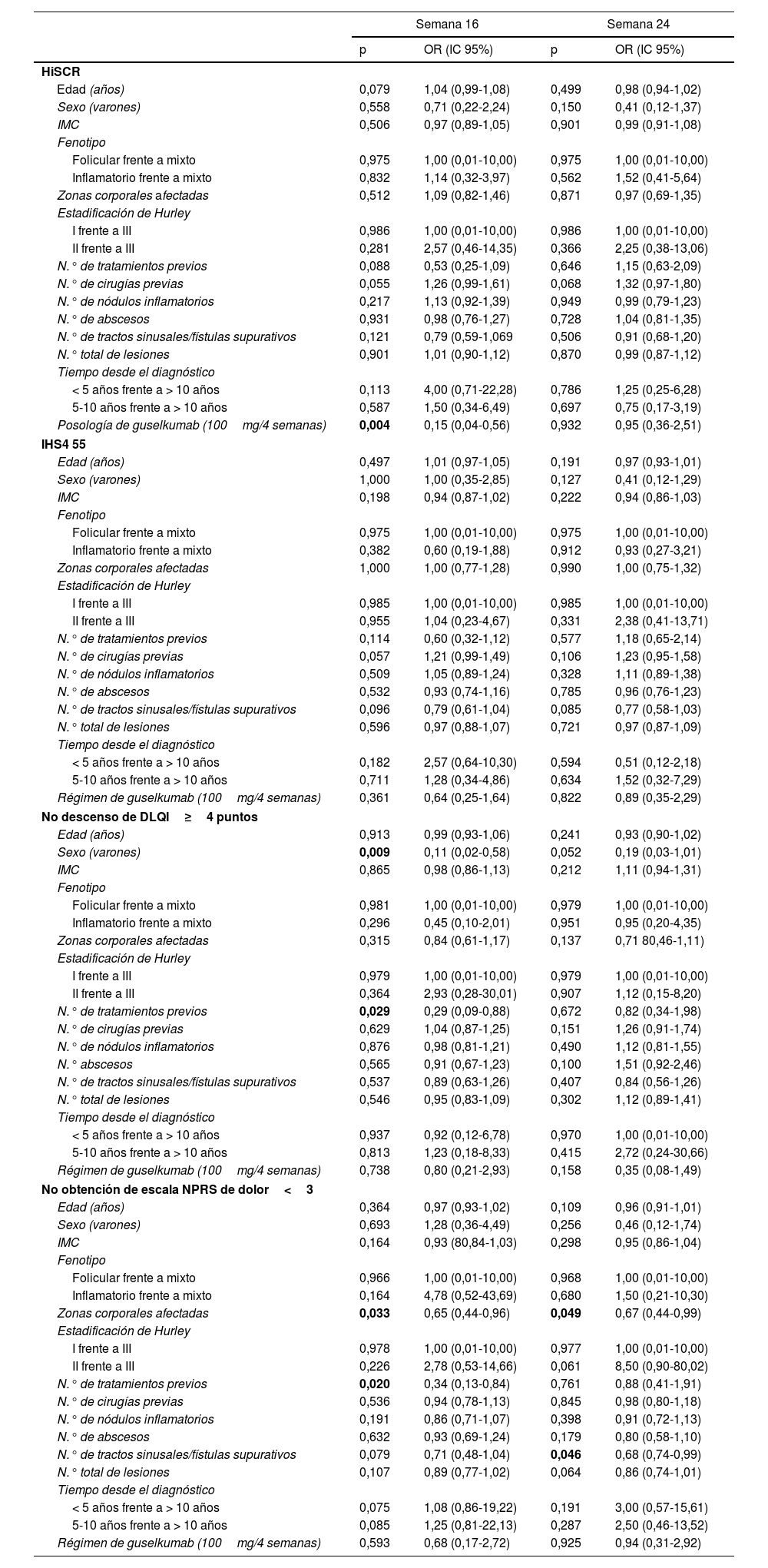
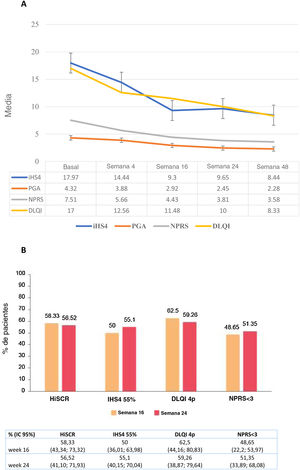
Se observó una reducción significativa de las puntuaciones IHS4, HS-PGA, NPRS y DLQI desde el valor basal en la semana 16 (total: p<0,0001), la semana24 (total: p<0,0001) y la semana48 (total: p<0,0001) (fig. 1A). El logro de HiSCR, IHS4-55, MCID en DLQI (una reducción de DLQI≥4 puntos), y una puntuación NPRS<3 se registró en el 58,3, el 50, el 62,5 y el 48,7% de los pacientes en la semana16, y en el 56,5, el 55,1, el 59,3 y el 51,4% en la semana24, respectivamente (fig. 1B). Se encontró una asociación estadísticamente significativa entre la dosis de guselkumab de 100mg/4 semanas y el logro de HiSCR (OR=0,15; IC95%: 0,04-0,56; p=0,004) a la semana16, pero no a la semana24. La posibilidad de una reducción de DLQI≥4 puntos (MCDI) a la semana16 fue inferior en los varones (OR=0,11; IC95%: 0,02-0,58; p=0,009) y aquellos que habían recibido un mayor número de biológicos (OR=0,29; IC95%: 0,09-0,88; p=0,029). Con respecto al dolor, NPRS<3 puntos fue significativamente más difícil de lograr en los pacientes con un mayor número de tratamientos biológicos administrados (OR=0,34; IC95%: 0,13-0,84; p=0,020) a las 16 semanas, y con mayor número de fístulas (OR=0,68; IC95%: 0,74-0,99; p=0,046) a las 24semanas. El mayor número de zonas corporales afectadas estuvo asociado a una menor probabilidad de obtener una NPRS<3 a las 16semanas (OR=0,65; IC95%: 0,44-0,96; p=0,033) y a las 24semanas (OR=0,67; IC95%: 0,44-0,99; p=0,049) (tabla 3).
Factores significativamente asociados al logro de HiSCR, 55% de IHS4 y no reducción de DLQI≥4 puntos u obtención de NPRS<3 puntos
| Semana 16 | Semana 24 | |||
|---|---|---|---|---|
| p | OR (IC 95%) | p | OR (IC 95%) | |
| HiSCR | ||||
| Edad (años) | 0,079 | 1,04 (0,99-1,08) | 0,499 | 0,98 (0,94-1,02) |
| Sexo (varones) | 0,558 | 0,71 (0,22-2,24) | 0,150 | 0,41 (0,12-1,37) |
| IMC | 0,506 | 0,97 (0,89-1,05) | 0,901 | 0,99 (0,91-1,08) |
| Fenotipo | ||||
| Folicular frente a mixto | 0,975 | 1,00 (0,01-10,00) | 0,975 | 1,00 (0,01-10,00) |
| Inflamatorio frente a mixto | 0,832 | 1,14 (0,32-3,97) | 0,562 | 1,52 (0,41-5,64) |
| Zonas corporales afectadas | 0,512 | 1,09 (0,82-1,46) | 0,871 | 0,97 (0,69-1,35) |
| Estadificación de Hurley | ||||
| I frente a III | 0,986 | 1,00 (0,01-10,00) | 0,986 | 1,00 (0,01-10,00) |
| II frente a III | 0,281 | 2,57 (0,46-14,35) | 0,366 | 2,25 (0,38-13,06) |
| N.° de tratamientos previos | 0,088 | 0,53 (0,25-1,09) | 0,646 | 1,15 (0,63-2,09) |
| N.° de cirugías previas | 0,055 | 1,26 (0,99-1,61) | 0,068 | 1,32 (0,97-1,80) |
| N.° de nódulos inflamatorios | 0,217 | 1,13 (0,92-1,39) | 0,949 | 0,99 (0,79-1,23) |
| N.° de abscesos | 0,931 | 0,98 (0,76-1,27) | 0,728 | 1,04 (0,81-1,35) |
| N.° de tractos sinusales/fístulas supurativos | 0,121 | 0,79 (0,59-1,069 | 0,506 | 0,91 (0,68-1,20) |
| N.° total de lesiones | 0,901 | 1,01 (0,90-1,12) | 0,870 | 0,99 (0,87-1,12) |
| Tiempo desde el diagnóstico | ||||
| < 5 años frente a > 10 años | 0,113 | 4,00 (0,71-22,28) | 0,786 | 1,25 (0,25-6,28) |
| 5-10 años frente a > 10 años | 0,587 | 1,50 (0,34-6,49) | 0,697 | 0,75 (0,17-3,19) |
| Posología de guselkumab (100mg/4 semanas) | 0,004 | 0,15 (0,04-0,56) | 0,932 | 0,95 (0,36-2,51) |
| IHS4 55 | ||||
| Edad (años) | 0,497 | 1,01 (0,97-1,05) | 0,191 | 0,97 (0,93-1,01) |
| Sexo (varones) | 1,000 | 1,00 (0,35-2,85) | 0,127 | 0,41 (0,12-1,29) |
| IMC | 0,198 | 0,94 (0,87-1,02) | 0,222 | 0,94 (0,86-1,03) |
| Fenotipo | ||||
| Folicular frente a mixto | 0,975 | 1,00 (0,01-10,00) | 0,975 | 1,00 (0,01-10,00) |
| Inflamatorio frente a mixto | 0,382 | 0,60 (0,19-1,88) | 0,912 | 0,93 (0,27-3,21) |
| Zonas corporales afectadas | 1,000 | 1,00 (0,77-1,28) | 0,990 | 1,00 (0,75-1,32) |
| Estadificación de Hurley | ||||
| I frente a III | 0,985 | 1,00 (0,01-10,00) | 0,985 | 1,00 (0,01-10,00) |
| II frente a III | 0,955 | 1,04 (0,23-4,67) | 0,331 | 2,38 (0,41-13,71) |
| N.° de tratamientos previos | 0,114 | 0,60 (0,32-1,12) | 0,577 | 1,18 (0,65-2,14) |
| N.° de cirugías previas | 0,057 | 1,21 (0,99-1,49) | 0,106 | 1,23 (0,95-1,58) |
| N.° de nódulos inflamatorios | 0,509 | 1,05 (0,89-1,24) | 0,328 | 1,11 (0,89-1,38) |
| N.° de abscesos | 0,532 | 0,93 (0,74-1,16) | 0,785 | 0,96 (0,76-1,23) |
| N.° de tractos sinusales/fístulas supurativos | 0,096 | 0,79 (0,61-1,04) | 0,085 | 0,77 (0,58-1,03) |
| N.° total de lesiones | 0,596 | 0,97 (0,88-1,07) | 0,721 | 0,97 (0,87-1,09) |
| Tiempo desde el diagnóstico | ||||
| < 5 años frente a > 10 años | 0,182 | 2,57 (0,64-10,30) | 0,594 | 0,51 (0,12-2,18) |
| 5-10 años frente a > 10 años | 0,711 | 1,28 (0,34-4,86) | 0,634 | 1,52 (0,32-7,29) |
| Régimen de guselkumab (100mg/4 semanas) | 0,361 | 0,64 (0,25-1,64) | 0,822 | 0,89 (0,35-2,29) |
| No descenso de DLQI≥4 puntos | ||||
| Edad (años) | 0,913 | 0,99 (0,93-1,06) | 0,241 | 0,93 (0,90-1,02) |
| Sexo (varones) | 0,009 | 0,11 (0,02-0,58) | 0,052 | 0,19 (0,03-1,01) |
| IMC | 0,865 | 0,98 (0,86-1,13) | 0,212 | 1,11 (0,94-1,31) |
| Fenotipo | ||||
| Folicular frente a mixto | 0,981 | 1,00 (0,01-10,00) | 0,979 | 1,00 (0,01-10,00) |
| Inflamatorio frente a mixto | 0,296 | 0,45 (0,10-2,01) | 0,951 | 0,95 (0,20-4,35) |
| Zonas corporales afectadas | 0,315 | 0,84 (0,61-1,17) | 0,137 | 0,71 80,46-1,11) |
| Estadificación de Hurley | ||||
| I frente a III | 0,979 | 1,00 (0,01-10,00) | 0,979 | 1,00 (0,01-10,00) |
| II frente a III | 0,364 | 2,93 (0,28-30,01) | 0,907 | 1,12 (0,15-8,20) |
| N.° de tratamientos previos | 0,029 | 0,29 (0,09-0,88) | 0,672 | 0,82 (0,34-1,98) |
| N.° de cirugías previas | 0,629 | 1,04 (0,87-1,25) | 0,151 | 1,26 (0,91-1,74) |
| N.° de nódulos inflamatorios | 0,876 | 0,98 (0,81-1,21) | 0,490 | 1,12 (0,81-1,55) |
| N.° abscesos | 0,565 | 0,91 (0,67-1,23) | 0,100 | 1,51 (0,92-2,46) |
| N.° de tractos sinusales/fístulas supurativos | 0,537 | 0,89 (0,63-1,26) | 0,407 | 0,84 (0,56-1,26) |
| N.° total de lesiones | 0,546 | 0,95 (0,83-1,09) | 0,302 | 1,12 (0,89-1,41) |
| Tiempo desde el diagnóstico | ||||
| < 5 años frente a > 10 años | 0,937 | 0,92 (0,12-6,78) | 0,970 | 1,00 (0,01-10,00) |
| 5-10 años frente a > 10 años | 0,813 | 1,23 (0,18-8,33) | 0,415 | 2,72 (0,24-30,66) |
| Régimen de guselkumab (100mg/4 semanas) | 0,738 | 0,80 (0,21-2,93) | 0,158 | 0,35 (0,08-1,49) |
| No obtención de escala NPRS de dolor<3 | ||||
| Edad (años) | 0,364 | 0,97 (0,93-1,02) | 0,109 | 0,96 (0,91-1,01) |
| Sexo (varones) | 0,693 | 1,28 (0,36-4,49) | 0,256 | 0,46 (0,12-1,74) |
| IMC | 0,164 | 0,93 (80,84-1,03) | 0,298 | 0,95 (0,86-1,04) |
| Fenotipo | ||||
| Folicular frente a mixto | 0,966 | 1,00 (0,01-10,00) | 0,968 | 1,00 (0,01-10,00) |
| Inflamatorio frente a mixto | 0,164 | 4,78 (0,52-43,69) | 0,680 | 1,50 (0,21-10,30) |
| Zonas corporales afectadas | 0,033 | 0,65 (0,44-0,96) | 0,049 | 0,67 (0,44-0,99) |
| Estadificación de Hurley | ||||
| I frente a III | 0,978 | 1,00 (0,01-10,00) | 0,977 | 1,00 (0,01-10,00) |
| II frente a III | 0,226 | 2,78 (0,53-14,66) | 0,061 | 8,50 (0,90-80,02) |
| N.° de tratamientos previos | 0,020 | 0,34 (0,13-0,84) | 0,761 | 0,88 (0,41-1,91) |
| N.° de cirugías previas | 0,536 | 0,94 (0,78-1,13) | 0,845 | 0,98 (0,80-1,18) |
| N.° de nódulos inflamatorios | 0,191 | 0,86 (0,71-1,07) | 0,398 | 0,91 (0,72-1,13) |
| N.° de abscesos | 0,632 | 0,93 (0,69-1,24) | 0,179 | 0,80 (0,58-1,10) |
| N.° de tractos sinusales/fístulas supurativos | 0,079 | 0,71 (0,48-1,04) | 0,046 | 0,68 (0,74-0,99) |
| N.° total de lesiones | 0,107 | 0,89 (0,77-1,02) | 0,064 | 0,86 (0,74-1,01) |
| Tiempo desde el diagnóstico | ||||
| < 5 años frente a > 10 años | 0,075 | 1,08 (0,86-19,22) | 0,191 | 3,00 (0,57-15,61) |
| 5-10 años frente a > 10 años | 0,085 | 1,25 (0,81-22,13) | 0,287 | 2,50 (0,46-13,52) |
| Régimen de guselkumab (100mg/4 semanas) | 0,593 | 0,68 (0,17-2,72) | 0,925 | 0,94 (0,31-2,92) |
Los valores en negrita son aquellos con significación estadística.
El tratamiento de guselkumab se discontinuó en 16 pacientes (23,2%), tras un tiempo de tratamiento medio de 7,81meses (DE±5,06). La causa más común de discontinuación fue la ineficacia o la pérdida de eficacia (62,5%). Solo 39 pacientes (56,5%) llegaron a las 48semanas de tratamiento con guselkumab. No se observaron EA graves (tabla 4).
Efectos adversos y motivos para discontinuar el tratamiento
| Parámetro | Valor |
|---|---|
| Interrumpieron el tratamiento con guselkumab, n (%) | 16 (23,2) |
| Motivos de interrumpir el tratamiento, n (%) | |
| Ineficacia | 7 (43,8) |
| Pérdida de eficiencia | 3 (18,8) |
| Acontecimiento adverso | 3 (18,8) |
| Otro | 3 (18,8) |
| Acontecimientos adversos, n | 7 |
| Acontecimientos adversos graves, n | 0 |
Nuestro estudio sugiere que el tratamiento de la HS de moderada a severa con guselkumab conduce a reducciones significativas de la severidad de la HS (IHS4, HiSCR) y el dolor (NPRS), con una mejora de la QoL del paciente (DLQI). Aunque las características del paciente y la severidad de la enfermedad no parecen estar asociadas al logro de IHS4-55, se encontró una asociación entre el mayor número de fístulas y las zonas afectadas, y la falta de logro de una reducción ≥4 puntos en DLQI (MCID) a las 16semanas, y el logro de NPRS<3 a las 16 y 24semanas. También parece que los varones, y aquellos pacientes que habían recibido previamente más biológicos, tuvieron menor probabilidad de lograr MCID en DLQI (reducción de ≥4 puntos) a las 16semanas. Los pacientes tratados con 100mg de guselkumab cada cuatro semanas tuvieron menor probabilidad de lograr HiSCR a las 16semanas, pero no transcurridas 24semanas. Dichos pacientes podrían haber tenido una HS más severa, requiriendo ajustes del régimen terapéutico y de la duración, aunque esto no se evaluó.
Los datos sobre la efectividad de guselkumab para tratar la HS son escasos, y se basan en un pequeño número de informes que implican pocos pacientes, o pacientes individuales. En un estudio realizado en España, cuatro pacientes de HS que no respondieron a otros biológicos fueron tratados con 100mg de guselkumab cada cuatro semanas, mostrando una mejora de la enfermedad transcurridas 12semanas en los dos casos, con una reducción moderada de las puntuaciones IHS4, NPRS y DLQI, y sin cambios en cuanto a HS-PGA, ni EA significativos11. El uso de guselkumab 100mg al inicio, transcurridas 4semanas y seguidamente cada 8semanas (el régimen más común utilizado en nuestra serie) causó también a una mejora de la HS en 5/8 pacientes en otro estudio. Sin embargo, tres pacientes no reflejaron mejora en los primeros 2-4meses, lo cual sugiere que podría ser necesario más tiempo para lograr la máxima eficacia8.
Guselkumab ha mostrado su efectividad a la hora de tratar a los pacientes de HS con otras comorbilidades, tales como la enfermedad de Crohn7,14. De manera interesante, se ha reportado también que guselkumab reduce las lesiones de HS y resuelve una reacción psoriasiforme paradójica y sacroileítis tras el tratamiento con adalimumab de la HS en un paciente que experimentó una reducción de la zona de psoriasis y el índice de severidad, y en el que se observó una reducción adicional de las lesiones de HS a lo largo de diez meses de seguimiento15. Junto con estos resultados, nuestros hallazgos sugieren que guselkumab puede ser una opción terapéutica efectiva y segura para la HS de moderada a severa, mejorando otras situaciones concomitantes y proporcionando un tratamiento alternativo para los pacientes que no responden a adalimumab. Este es el primer estudio que reporta una gran serie de pacientes de HS tratados con guselkumab.
Nuestro estudio tiene limitaciones, incluyendo su naturaleza retrospectiva. A pesar del gran número de individuos incluidos, solo 39 pacientes continuaron el tratamiento transcurridas 48semanas. Podría ser necesario realizar mejoras del plan terapéutico y el seguimiento de los pacientes para mitigar las lesiones adicionalmente, en especial en casos severos. Para abordar esta cuestión deberían realizarse más estudios.
En conclusión, nuestros resultados sugieren que guselkumab puede ser una alternativa terapéutica segura y efectiva para los pacientes con HS de moderada a severa que no responden a otras terapias.
Conflicto de interesesLos autores cumplen los criterios de autoría recomendados por el International Committee of Medical Journal Editors (ICMJE), no habiendo recibido pago alguno con relación al desarrollo del presente artículo.
R. Rivera-Díaz ha recibido honorarios por participar en comités de asesoramiento y ensayos clínicos de AbbVie, Boehringer-Ingelheim, Janssen, Leo Pharma, Eli Lilly, Novartis y UCB; ha recibido respaldo financiero por asistir a reuniones y/o viajes de Almirall, Janssen, Novartis y Eli Lilly, y su institución recibió un ecógrafo de AbbVie. B. Díaz Ley recibió pagos u honorarios por conferencias y acontecimientos educativos de AbbVie, Almirall, Amgen, Boehringer-Ingelheim, Janssen-Cilag, Leo Pharma, Lilly, Novartis, Pfizer Sandoz y UCB; ha recibido respaldo financiero por asistir a reuniones y/o viajes de AbbVie, Almirall, Cantabria Labs, Janssen-Cilag, Leo Pharma, Lilly, Novartis, Pfizer y UCB, y ha participado como miembro de comités asesores de AbbVie, Almirall, Amgen, Boehringer-Ingelheim, Janssen-Cilag, Leo Pharma, Lilly, Novartis, Pfizer y UCB. E. Vilarrasa ha recibido pagos u honorarios por participar en conferencias y acontecimientos educativos de AbbVie, Almirall, Amgen, Boehringer-Ingelheim, Janssen-Cilag, Leo Pharma, Lilly, Novartis, Pfizer Sandoz y UCB; ha recibido respaldo financiero por asistir a reuniones y/o viajes de AbbVie, Almirall, Cantabria Labs, Janssen-Cilag, Leo Pharma, Lilly, Novartis, Pfizer y UCB, y ha participado como miembro de comités asesores de AbbVie, Almirall, Amgen, Boehringer-Ingelheim, Janssen-Cilag, Leo Pharma, Lilly, Novartis, Pfizer y UCB. A. Martorell ha recibido pagos u honorarios por participar en conferencias y acontecimientos educativos de AbbVie, Almirall, Amgen, Boehringer-Ingelheim, Janssen-Cilag, Leo Pharma, Lilly, Novartis, Pfizer y UCB; ha recibido respaldo financiero por asistir a reuniones y/o viajes de AbbVie, Almirall, Janssen-Cilag, Leo Pharma, Lilly, Novartis, Pfizer y UCB, y ha participado como miembro de comités asesores de AbbVie, Almirall, Amgen, Boehringer-Ingelheim, Janssen-Cilag, Leo Pharma, Lilly, Novartis, Pfizer y UCB. El resto de autores no ha reportado conflicto de intereses.
A todos los pacientes que accedieron a que se utilizaran sus datos para mejorar nuestro conocimiento sobre esta enfermedad.