La disección ganglionar completa (DGC) era la práctica estándar en pacientes con melanoma y biopsia selectiva del ganglio centinela (BSGC) positiva hasta que, en 2016 y 2017 se publicaron los resultados de dos ensayos clínicos que no demostraron que mejorase la supervivencia específica por melanoma (SEM). Sin embargo, continúa realizándose en algunos escenarios. No existen estudios que recojan el manejo ganglionar tras BSGC positivo en la práctica clínica en nuestro medio.
ObjetivosDeterminar la evolución de la indicación de la DGC en pacientes con BSGC positiva, así como las características que se asocian a su realización.
Material y métodosEstudio observacional retrospectivo multicéntrico que incluye pacientes con melanoma cutáneo y ganglio centinela positivo diagnosticados entre los años 2017-2022 en ocho centros españoles y uno italiano.
ResultadosSe incluyeron 430 pacientes, 54% hombres, 358 (75,1%) tenían entre 45-80 años, de ellos, 133 casos (31%) presentaban un Breslow>4mm, 206 casos (49,1%) estaban ulcerados, en 213 casos (55,7%) la metástasis ganglionar era>1mm. Se realizó la linfadenectomía aislada o seguida de adyuvancia en 146 pacientes (34,1%). Tras una regresión logística multivariante, los factores asociados a la realización de DGC fueron el subtipo histológico melanoma lentiginoso acral (MLA), un tamaño de metástasis ganglionar>1mm, la extensión extracapsular y el hospital participante. La edad>80 años se asoció inversamente.
ConclusiónMientras que ha disminuido la frecuencia de realización de la DGC en pacientes con melanoma y BSGC positiva, ha aumentado la indicación del tratamiento sistémico adyuvante en estos pacientes. Sin embargo, se sigue indicando la DGC en pacientes con características de alto riesgo.
Complete lymph node dissection (CLND) was the standard practice for patients with melanoma and a positive sentinel lymph node biopsy (SLNB) until the results of 2 clinical trials published in 2016 and 2017 demonstrated that it did not improve melanoma-specific survival (MSS). However, it continues to be performed in some scenarios. No studies have ever been published on lymph node management after a positive SLNB in the routine clinical practice in our setting.
ObjectivesTo determine the evolution of the indication for CLND in patients with a positive SLNB, as well as the characteristics associated with its performance.
Material and methodsWe conducted a multicenter retrospective observational study with patients with skin melanoma and positive sentinel lymph nodes diagnosed from 2017 through 2022 at 8 Spanish centers and 1 Italian center.
ResultsA total of 430 patients were included, 54% men, with 358 (75.1%) aged between 45 and 80 years. A total of 133 cases (31%) exhibited Breslow thickness > 4mm, 206 cases (49.1%) were ulcerated, and in 213 cases (55.7%), lymph node metastasis was > 1mm. Isolated lymphadenectomy or followed by adjuvant therapy was performed in 146 patients (34.1%). After multivariate logistic regression, the factors associated with the performance of CLND were the acral lentiginous melanoma histological subtype, lymph node metastasis size > 1mm, extracapsular spread, and the participant hospital. Age > 80 years was inversely associated.
ConclusionWhile the frequency of CLND in patients with melanoma and positive SLNB has decreased, the indication for systemic adjuvant therapy in these patients has increased. However, CLND is still indicated in patients with high-risk characteristics.
El tratamiento de los pacientes con melanoma y biopsia selectiva del ganglio centinela (BSGC) positiva ha cambiado drásticamente tras la publicación de dos ensayos clínicos que desaconsejaban la realización de la disección ganglionar completa (DCG) al demostrar una ausencia de beneficio en la supervivencia específica por melanoma (SEM)1,2. Las guías de manejo del melanoma han recogido este cambio en sus recomendaciones, si bien no de forma homogénea3–6. Así, pese a que en la práctica clínica se ha reducido de forma significativa la realización de la DCG en estos pacientes7–12, se sigue recomendando y realizando en algunos contextos clínicos considerados de alto riesgo, como la presencia de invasión linfovascular o inmunosupresión. También se ha mantenido la DCG en la presencia de características clínicas para las que existe una evidencia menor, por estar infrarrepresentados en los ensayos clínicos mencionados, como son la presencia de extensión extracapsular de la metástasis ganglionar, la afectación de tres o más ganglios, el tamaño de la metástasis ganglionar superior a 1mm, la localización del melanoma en la cabeza y cuello o la afectación de dos o más regiones linfáticas13–15.
El cambio en el tratamiento quirúrgico de los pacientes con metástasis regionales ha coincidido con el aumento de la supervivencia, tanto libre de recaída como específica por melanoma, conseguido durante la última década gracias a los nuevos tratamientos adyuvantes16–19. Entre las opciones recomendadas en las guías para pacientes en estadio III se encuentran el dabrafenib más trametinib para los pacientes con BRAF (serina/treonina proteína quinasa B-raf) V600 mutado (no financiado en España) y el nivolumab o pembrolizumab con independencia del estado del BRAF (solo financiados en España en estadios IIIC y IIID en el periodo del estudio)6,20.
En nuestro medio no disponemos de estudios que analicen el tratamiento quirúrgico de los pacientes con melanoma con una positividad en la BSGC en los últimos años. El conocimiento de la práctica clínica podría contribuir a una mayor optimización de los recursos sanitarios. En el presente estudio se planteó como objetivo principal conocer la evolución y estado actual de la indicación de la DGC en los pacientes con melanoma y BSGC positiva. Como objetivos secundarios se analizaron las características clínicas y patológicas que se asociaron a la realización de una DGC, así como analizar si la DGC modifica la supervivencia de estos pacientes.
Material y métodosParticipantes y diseño del estudioSe diseñó un estudio observacional multicéntrico retrospectivo incluyendo pacientes de nueve hospitales de referencia que colaboran en estudios sobre el ganglio centinela en estos pacientes y que recibe el nombre de SENTIMEL21. Los hospitales participantes son Hospital Clínic, Barcelona (España); University Hospital Città della Salute e della Scienza di Torino, Turín (Italia); Instituto Valenciano de Oncología, Valencia (España), Hospital Germans Trias i Pujol, Badalona (España); Hospital Universitario de Salamanca, Salamanca (España); Hospital Universitario de A Coruña, A Coruña (España); Complejo Asistencial Universitario de León, León (España); Hospital de La Fe, Valencia (España); Hospital de la Princesa, Madrid (España).
Se incluyeron a los pacientes atendidos con posterioridad a la publicación de los resultados del ensayo clínico MSLT-II1 entre el 1 de enero del 2017 y 31 de enero 2022. Fueron incluidos todos los pacientes con melanoma cutáneo a los que se les detectó metástasis por melanoma en la biopsia selectiva del ganglio centinela (BSGC). El protocolo previo a la realización de BSGC es similar en los hospitales participantes e incluye el despistaje de afectación ganglionar mediante ecografía locorregional y, en los melanomas superiores a T3b, también de metástasis mediante pruebas de imagen (TAC/PET-TAC/RMN).
El estudio fue aprobado por el Comité de Ética de la Investigación con Medicamentos (CEIM) del Hospital Universitario de León (Código N.° 23112, fecha 28/7/2023). Se utilizaron las guías STROBE para reporte de estudios observacionales22.
En cuanto a las variables, para el objetivo principal del estudio se consideró si se había realizado o no la DGC. Para los estudios de supervivencia, se consideró el tiempo hasta la recaída local, definida como recidiva de melanoma en la cicatriz del primario y hasta 2 cm de esta, la recaída ganglionar regional o el fallecimiento. Se consideraron censurados aquellos pacientes que no hubieran presentado el evento correspondiente en la última fecha en la que hubiera constancia de la situación clínica del paciente.
El resto de variables incluidas fueron el año de diagnóstico del tumor primario, el hospital de procedencia, la edad (categorizada a<45, 45-60,> 60-80 y>80 años), el sexo al nacimiento del paciente, el estado funcional mediante la escala de la Eastern Cooperative Oncology Group (ECOG), localización (cabeza y cuello, tronco, extremidades superiores, extremidades inferiores, manos-pies, otros), inmunosupresión, grosor tumoral (≤1, 1,1-2, 2,1-4 y> 4mm), ulceración, índice mitótico23 (0-1, 2-5 y>6 mitosis/mm2), invasión linfovascular, microsatelitosis, tipo histológico (lentigo maligno melanoma [LMM], melanoma de extensión superficial [MES], melanoma nodular [MN], melanoma lentiginoso acral [MLA], desmoplásico, otros), número de ganglios centinelas extirpados (1-2,3-4 y>4), número de ganglios centinelas positivos (1, ≥2), tamaño de la metástasis ganglionar según los criterios de Rotterdam24 (< 0,1, 0,1-1 y>1mm), extensión extracapsular y número de regiones ganglionares afectadas (1 vs.> 1). Para el análisis de regresión logística se agruparon dentro de las variables tipo histológico la forma desmoplásica y el LMM junto con la variable otros por un número escaso. De igual forma se agruparon en una sola categoría los hospitales con menos de 50 pacientes incluidos (variable llamada grupo conjunto).
Estudio estadísticoEn el estudio descriptivo se usó la X2 o test de Fisher como medida de asociación de las variables categóricas y la t de Student para las cuantitativas. Se usó una regresión logística para analizar las variables asociadas a la realización de la DGC. En un primer paso se evaluó la asociación de cada variable con la variable resultado mediante una regresión logística univariante. Todas las variables que se asociaron a la variable resultado con significación estadística (p<0,1) se incluyeron en un modelo de regresión logística bivariantes por pasos hacia atrás (comando xi: stepwise en STATA). Se realizó una prueba de Hosmer-Lemeshow para analizar la bondad del ajuste. Se consideró en el modelo una significación de p<0,05. Finalmente, se analizó el efecto de la realización de la DGC, tipos de tratamientos y el estadio del paciente en la supervivencia libre de recidiva local (SLRL), libre de recidiva nodal (SLRN) o linfática, específica de la enfermedad (SEE) y global (SG). Se representaron las diferentes gráficas según el método de Kaplan-Meier y se analizó la diferencia en la supervivencia mediante la prueba del logaritmo de los rangos. Todos los análisis se realizaron con Stata v.14.2 (Stata Corp. 2015. Stata Statistical Software: Release 14, College Station, TX, USA: StataCorp LP).
ResultadosSe incluyeron un total de 449 pacientes a los que se realizó una BSGC con resultado positivo, de los cuales se eliminaron 19 casos por tener datos incompletos referentes a fechas, error de inclusión, sin seguimiento o una localización en mucosas (fig. 1). Se analizaron 430 pacientes, cuyos datos descriptivos se encuentran en la tabla 1. Con respecto al género, fueron más frecuente en hombres (n=233 [54,2%]) que en mujeres. El grupo de edad más frecuente fue el comprendido entre los 60 y 80 años (n=169 [39,3%]) seguido del comprendido entre los 45 y 60 años (n=154 [35,8]). El grupo de pacientes ancianos>80 años fue el más infrecuente (n=35 [8,1%]). Este grupo de edad fue en el que menos se realizó la DGC (solo en 4 [11,4%]; p=0,02). El tronco fue la localización más frecuente (n=179 [41,7%]) seguido de la localización en miembros inferiores (n=81 [18,9%]) cabeza y cuello (n=75 [17,5%]). En cuanto al grosor, un 37,3%(n=157) tenían un Breslow entre 2,1 a 4mm, mientras que los tumores finos ≤ 1mm suponían un 6,89% de la muestra (n=29). Se evidenció una tendencia a la mayor realización de la DGC proporcional al grosor al igual que al estadio patológico T. El subtipo histológico más frecuente fue el MES (n=214 [53,6%]) y el MN (n=115 [28,8%]). Con respecto a las metástasis en el GC, la mayoría de los casos presentaron un ganglio metastásico único (n=305 [70,9%]) y el tamaño de la metástasis ganglionar fue>1mm en el 55,8% (n=213). Se observó un aumento de la DGC tanto en los casos con ≥2 ganglios positivos como en los de tamaño de la metástasis a partir 0,1mm.
Características de los pacientes con melanoma cutáneo con biopsia selectiva del ganglio centinela positivo categorizado entre la realización de la disección ganglionar completa vs. observación (n=430)
| Variable | DGC (%a) | Observación (%a) | Total (%b) | Valor p |
|---|---|---|---|---|
| Sexo | ||||
| Hombre | 77 (33,1) | 156 (66,9) | 233 (54,2) | 0,6 |
| Mujer | 69 (33) | 128 (67) | 197 (45,2) | |
| Edad (años) | ||||
| <45 | 24 (33,3) | 48 (66,7) | 72 (16,7) | 0,02 |
| 45-60 | 56 (38,4) | 98 (63,4)) | 154 (35,8) | |
| >60-80 | 62 (36,7) | 107 (63,3) | 169 (39,3) | |
| >80 | 4 (11,4) | 31 (88,6) | 35 (8,1) | |
| ECOG | ||||
| 0 | 113 (38,2) | 183 (61,8) | 296 (84,6) | 0,17 |
| 1 | 11 (26,2) | 31 (73,8) | 42 (12) | |
| 2 | 5 (55,6) | 4 (44,4) | 9 (2,6) | |
| 3 | 2 (66,7) | 1 (33,3) | 3 (0,8) | |
| Localización | ||||
| Cabeza y cuello | 24 (32) | 51 (68) | 75 (17,5) | 0,5 |
| Tronco | 61 (34,1) | 118 (65,9) | 179 (41,7) | |
| MMSS | 11 (25) | 33 (75) | 44 (10,3) | |
| MMII | 29 (35,8) | 52 (64,2) | 81 (18,9) | |
| Manos/pies | 20 (43,5) | 26 (56,5) | 46 (10,7) | |
| Otros | 1 (25) | 3 (75) | 4 (0,9) | |
| (perdidos n=1) | ||||
| Inmunosupresión | ||||
| No | 102 (42,5) | 138 (57,5) | 241 (97,6) | 0,7 |
| Sí | 3 (50) | 3 (50) | 6 (2,4) | |
| (perdidos n=153) | ||||
| Grosor tumoral (mm) | ||||
| ≤1 | 6 (20,7) | 23 (79,3) | 29 (6,9) | 0,04 |
| 1,01-2 | 28 (27,4) | 74 (72,6) | 102 (24,2) | |
| 2,01-4 | 53 (33,8) | 104 (66,2) | 157 (37,3) | |
| > 4 | 56 (42,1) | 77 (57,9) | 133 (31,6) | |
| (perdidos n=9) | ||||
| Estadio T | ||||
| T1a | 1 (33,3) | 2 (66,7) | 3 (0,7) | 0,03 |
| T1b | 5 (19,2) | 21 (80,8) | 26 (6,2) | |
| T2a | 18 (23,1) | 60 (76,2) | 78 (18,5) | |
| T2b | 10 (41,7) | 14 (58,3) | 24 (5,7) | |
| T3a | 29 (42) | 40 (56) | 69 (16,4) | |
| T3b | 24 (27,3) | 64 (72,7) | 88 (20,9) | |
| T4a | 18 (43,9) | 23 (56,1) | 41 (9,7) | |
| T4b | 38 (41,3) | 54 (58,7) | 92 (21,8) | |
| Ulceración | ||||
| No | 67 (31,6) | 146 (68,5) | 213 (50,8) | 0,5 |
| Sí | 71 (34,5) | 135 (65,5) | 206 (49,2) | |
| (perdido n=11) | ||||
| Mitosis (mitosis/mm2) | ||||
| 0-1 | 20 (28,6) | 50 (71,4) | 70 (17,2) | 0,7 |
| 2-5 | 56 (33,3) | 112 (66,7) | 168 (41,3) | |
| ≥6 | 58 (34,3) | 111 (65,7) | 169 (41,5) | |
| (perdidos n=23) | ||||
| Invasión vascular | ||||
| No | 92 (30,6) | 209 (69,4) | 301 (81,6) | 0,9 |
| Sí | 25 (36,8) | 43 (63,2) | 68 (18,4) | |
| (perdido n=61) | ||||
| Microsatelitosis | ||||
| No | 105 (29,8) | 247 (70,2) | 352 (91) | 0,1 |
| Sí | 15 (42,9) | 20 (57,1) | 35 (9) | |
| (perdidos n=43) | ||||
| Subtipo histológico | ||||
| MES | 62 (29) | 152 (71) | 214 (53,6) | 0,1 |
| MN | 46 (40) | 69 (60) | 115 (28,8) | |
| MLA | 18 (43,9) | 23 (56,1) | 41 (10,3) | |
| Otros | 9 (31) | 20 (69) | 29 (7,3) | |
| (perdido n=31) | ||||
| N° ganglios extirpados | ||||
| 1-2 | 46 (32,6) | 95 (67,4) | 141 (33,2) | 0,6 |
| 3-4 | 74 (35,2) | 136 (64,8) | 210 (49,5) | |
| ≥ 4 | 21 (28,8) | 52 (71,2) | 73 (17,2) | |
| (perdidos n=6) | ||||
| N° ganglios positivos | ||||
| 1 | 93 (30,5) | 212 (69,5) | 305 (70,9) | 0,02 |
| ≥ 2 | 53 (42,4) | 72 (57,6) | 125 (29,1) | |
| Tamaño metástasis en GC (mm) | ||||
| ≤ 0,1 | 2 (6,3) | 30 (93,7) | 32 (8,4) | <0,001 |
| > 0,1-1 | 27 (19,7) | 110 (80,3) | 137 (35,9) | |
| > 1 | 89 (41,8) | 124 (58,2) | 213 (55,8) | |
| (perdido n=44) | ||||
| Extensión extracapsular | ||||
| No | 115 (30,3) | 265 (69,7) | 380 (94,3) | <0,001 |
| Sí | 16 (69,6) | 7 (30,4) | 23 (5,7) | |
| (perdidos n=27) | ||||
| N° regiones ganglionares | ||||
| 1 | 135 (33,5) | 268 (66,5) | 403 (93,6) | 0,6 |
| > 1 | 10 (34,5) | 16 (61,5) | 26 (6,1) | |
| Grupos de tratamiento | ||||
| Observación solo | - | - | 138 (32,2) | |
| Linfadenectomía | - | - | 49 (11,4) | |
| Linfadenectomía+adyuvancia | - | - | 97 (22,7) | |
| Adyuvancia solo | - | - | 144 (33,7) | |
| (perdido n=2) | ||||
| Año | ||||
| 2017 | 32 (56,1) | 25 (43,9) | 57 (13,3) | <0,001 |
| 2018 | 29 (33,3) | 58 (66,7) | 87 (20,2) | |
| 2019 | 38 (41,3) | 54 (58,7) | 92 (21,4) | |
| 2020 | 21 (24,4) | 65 (75,6) | 86 (20) | |
| 2021 | 25 (27,8) | 65 (72,2) | 90 (21) | |
| 2022 | 1 (5,6) | 17 (94,4) | 18 (4,2) | |
| Centro Hospitalario | ||||
| Hospital Barcelona | 26 (20,5) | 101 (79,5) | 127 (29) | <0,001 |
| Hospital Turín | 51 (51) | 49 (49) | 100 (23,3) | |
| Hospital Valencia (IVO) | 15 (26,3) | 42 (73,7) | 57 (3,3) | |
| Hospital Badalona | 14 (25) | 42 (75) | 56 (13) | |
| Hospital Salamanca | 17 (60,7) | 11 (39,3) | 28 (6,5) | |
| Hospital A Coruña | 7 (30,4) | 16 (69,6) | 23 (5,3) | |
| Hospital León | 5 (29,4) | 12 (70,6) | 17 (3,9) | |
| Hospital Valencia (La Fe) | 4 (28,6) | 10 (71,4) | 14 (3) | |
| Hospital Madrid | 7 (87,5) | 1 (12,5) | 8 (1,9) | |
Se expresa el porcentaje entre las distintas categorías de la variable.
ECOG: Eastern Cooperative Oncology Group; DGC: Disección ganglionar completa.
MES: melanoma de extensión superficial; MN: melanoma nodular; MLA: melanoma lentiginoso acral; MMSS: miembros superiores; MMII: miembros inferiores; GC: ganglio centinela; IVO: Instituto Valenciano de Oncología.
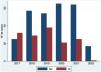
De forma global, en todo el periodo del estudio, el grupo más numeroso fue el de los 144 pacientes (33,7%) que recibieron tratamiento adyuvante únicamente. Se realizó la DGC aisladamente en 49 pacientes (11,4% de los casos), y la combinación de DGC con tratamiento adyuvante en 97 casos (22,7%). En 138 pacientes se decidió observación (32,2%) (tabla 1). La distribución por estadios se muestra en la figura 1 (Material suplementario). Sin embargo, es importante resaltar que estas proporciones se modificaron a lo largo de los años de estudio. De hecho, la realización de DGC en estos pacientes con GC positivo fue mayoritaria al principio del periodo de estudio en 2017 siendo marginal en el año más reciente, 2022 (fig. 2). De igual forma, se modificó el tratamiento de estos pacientes, siendo muy evidente que la DGC decreció durante el periodo de estudio mientras que la adyuvancia adquirió un papel preponderante (fig. 3).
En el análisis univariante, las variables que se asociaron a la realización de la DGC fueron un grosor tumoral de más de 4mm (OR=2,7 [IC 95% 1,1-7,1); p=0,04), el tipo histológico melanoma nodular (OR=1,7 [IC 95% 1,1-2,8]; p=0,03), un número de ganglios positivos de dos o más (OR=1,7 [IC 95% 1,1-2,6]; p=0,013), un tamaño de metástasis ganglionar de más de 1mm (OR=11,4 [IC 95% 2,6-49];p=0,001), el hospital de Turín (OR=4 [IC 95% 2,2-7,2]; p=0,001), el grupo conjunto (OR=3,1 [IC 95% 1,7-5,7]; p=0,001) y la presencia de extensión extracapsular (OR=5,2 [IC 95% 2,1-13,1];p=<0,001). La edad mayor de 80 años se asoció inversamente a la realización de la DGC (OR=0,3 [IC 95% 0,1-0,9]; p=0,02). Tras el análisis de regresión logística multivariante las variables asociadas de forma independiente a la realización de la DGC fueron la edad>80 años (OR=0,3 [IC 95% 0,1-1]; p=0,05), el subtipo histológico MLA (OR=2,94 [IC 95% 1,95-6,92]; p=0,01), el tamaño de la metástasis de más de 1mm (OR=7,91 [IC 95% 1,71-36,47]; p=0,008), la extensión extracapsular de la metástasis en el GC (OR=4,81 [IC 95% 1,51-15,28]; p=0,008) y por último el hospital de Turín (OR=4,4 [IC 95% 2,11-9,32]; p<0,001), y el grupo conjunto (OR=3,34[IC 95% 1,58-7,08; p<0,001), se asociaron a una mayor realización de la DGC (tabla 2).
Regresión logística uni y multivariante de los factores asociados a la realización de la disección ganglionar completa tras una biopsia del ganglio centinela positiva
| Análisis univariante | Análisis multivariante | |||
|---|---|---|---|---|
| Variable | OR (IC 95%) | Valor p | OR (IC 95%) | Valor p |
| Sexo | ||||
| Hombre | 1 | |||
| Mujer | 1,1 (0,7-1,6) | 0,84 | ||
| Edad (años) | ||||
| <45 | 1 | 1 | ||
| 45-60 | 1,3 (0,7-2,3) | 0,46 | 1,3 (0,6-2,8) | 0,84 |
| >60-80 | 1,3 (0,7-2,3) | 0,44 | 1,3 (0,7-2,8) | 0,44 |
| >80 | 0 | 0,02 | 0,3 (0,1-1) | 0,05 |
| ECOG | ||||
| 0 | 1 | |||
| 1 | 0,5 (0,2-1,1) | 0,13 | ||
| 2 | 1,8 (0,5-7) | 0,37 | ||
| 3 | 2,9 (0,3-32,8) | 0,38 | ||
| Localización | ||||
| Cabeza y cuello | 1 | |||
| Tronco | 1,1 (0,6-2,2) | 0,57 | ||
| MMSS | 0,8 (0,3-1,9) | 0,61 | ||
| MMII | 1,2 (0,6-2,4) | 0,6 | ||
| Manos/pies | 1,6 (0,7-3,6) | 0,21 | ||
| Otros | 0,7 (0,1-7,3) | 0,78 | ||
| Inmunosupresión | ||||
| No | 1 | |||
| Sí | 1,3 (0,3-6,8) | 0,72 | ||
| Grosor tumoral (mm) | ||||
| ≤1 | 1 | |||
| 1,01-2 | 1,3 (0,5-3,6) | 0,61 | - | |
| 2,01-4 | 1,9 (0,7-5,1) | 0,18 | - | |
| >4 | 2,7 (1,1-7,1) | 0,04 | - | |
| Ulceración | ||||
| No | 1 | |||
| Sí | 1,7 (0,8-1,8) | 0,45 | ||
| Mitosis (mitosis/mm2) | ||||
| 0-1 | 1 | |||
| 2-5 | 1,3 (0,7-2,4) | 0,42 | ||
| ≥6 | 1,4 (0,8- 2,6) | 0,25 | ||
| Invasión vascular | ||||
| No | 1 | |||
| Sí | 1,3 (0,7-2,3) | 0,35 | ||
| Microsatelitosis | ||||
| No | 1 | |||
| Sí | 1,8 (0,8-3,7) | 0,13 | ||
| Subtipo histológico* | ||||
| MES | 1 | |||
| MN | 1,7 (1,1-2,8) | 0,03 | 0,6 (1,3-2,8) | 0,49 |
| MLA | 2 (1-4,2) | 0,051 | 2,9 (1,9-6,9) | 0,01 |
| Otros | 1,1 (0,5-2,5) | 0,86 | 1,3 (0,8-10,1) | 0,74 |
| N° ganglios extirpados | ||||
| 1-2 | 1 | |||
| 3-4 | 0,9 (0,6-1,6) | 0,92 | ||
| ≥4 | 0,7 (0,4-1,4) | 0,34 | ||
| N° ganglios positivos | ||||
| 1 | 1 | |||
| ≥2 | 1,7 (1,1-2,6) | 0,013 | - | |
| Tamaño metástasis en GC (mm) | ||||
| ≤0,1 | 1 | |||
| >0,1-1 | 4 (0,9-18,1) | 0,08 | 1,5 (0,3-8) | 0,65 |
| >1 | 11,4 (2,6-49) | 0,001 | 7,9 (1,7-36,4) | 0,008 |
| Extensión extracapsular | ||||
| No | 1 | 1 | ||
| Sí | 5,2 (2,1-13,1) | <0,001 | 4,8 (1,5-15,3) | 0,008 |
| N° regiones ganglionares | ||||
| 1 | 1 | |||
| >1 | 1,2 (0,5-2,8) | 0,61 | ||
| Hospital | ||||
| Barcelona | 1 | 1 | ||
| Turín | 4 (2,2-7,2) | <0,001 | 4,4 (2,1-9,3) | <0,001 |
| Badalona | 1,3 (0,6-2,7) | 0,51 | 1,6 (0,7-3,8) | 0,27 |
| IVO | 1,4 (0,7-2,8) | 0,39 | 1,1 (0,4-2,6) | 0,85 |
| Grupo conjunto* | 3,1 (1,7-5,7) | <0,001 | 3,3 (1,6-7,1) | <0,001 |
ECOG: Eastern Cooperative Oncology Group; OR: Odd Ratio; IC: Intervalo de confianza; MMSS: miembros superiores; MMII: miembros inferiores; MES: melanoma de extensión superficial; MN: melanoma nodular; MLA: melanoma lentiginoso acral; GC: ganglio centinela; IVO: Instituto Valenciano de Oncología.
El análisis univariante no mostró diferencias para las diversas supervivencias (SLRL, SLRN, SEE y SG) entre los pacientes sometidos a DGC vs. observación, cuando se analizó por tipo de tratamiento (fig. 4) se observó una peor supervivencia para los pacientes sometidos a DGC solo en comparación con el resto (p=0,04). Las diferencias de supervivencia por estadios se pueden observar en la figura 2 (Material suplementario).
DiscusiónEste es el primer estudio que describe el tratamiento de los pacientes con melanoma y BSGC positiva en una selección de centros del sur de Europa (España e Italia). Se ha evidenciado un notable descenso de las DGC realizadas y de forma inversa el uso cada vez más frecuente de adyuvancia en estos pacientes.
A partir de los ensayos Multicenter Selective Lymphadenectomy Trial-II (MSLT-II) y German Dermatologic Cooperative Oncology Group-Selective Lymphadenectomy. Trial (DeCOG-SLT), existe una clara evidencia de que la realización de la DGC en pacientes con un resultado positivo en la BSGC carece de beneficio en cuanto a la supervivencia específica de enfermedad respecto al seguimiento ganglionar ecográfico rutinario1,2. Existe incluso un reciente metaanálisis donde, de forma paradójica el grupo observación tendría cierta ventaja en la supervivencia a los tres y cinco años. Los resultados son compatibles y se explicarían por la forma de diseminación e historia natural del melanoma cuya diseminación hematógena es independiente de la diseminación linfática y no progresiva u ordenada como se hipotetizaba durante los años 9025–27.
Los datos de este estudio también se han descrito en estudios previos observacionales realizados en otros países, entre los que destacan un estudio multicéntrico internacional7 y dos estudios con grandes muestras poblacionales de la National Cancer Database de EE. UU.8,12, y que reflejan un descenso significativo de la realización de DGC en los últimos años28.
Los ensayos clínicos de referencia no están exentos de críticas como que la mayoría de los pacientes incluidos (∼ 70%) presentaban una carga tumoral pequeña (< 1mm), por lo que no quedan bien representados aquellos pacientes que podemos denominar de alto riesgo de recurrencia como los pacientes con carga tumoral grande en el ganglio centinela, los que presentan extensión extracapsular, el tener más de tres ganglios afectados, más de dos regiones afectadas, o incluso la localización en la región de cabeza y cuello. Por ejemplo, la localización en cabeza y cuello es inexistente en el DeCOG-SLT y está infrarrepresentada en el MSLT-II observaron una tendencia a la mejoría de la supervivencia en el grupo sometido a la DGC, pero sin que alcanzara la significación estadística (HR 1,60 [0,96-2,66]; p=0,07) con 113 vs. 128 en los grupos de disección vs. observación.
Nuestro estudio al ser de práctica clínica refleja de forma más aproximada las características más frecuentes en este grupo de pacientes con BSGC positiva. Así, más de la mitad de los pacientes presentaban una carga tumoral en el ganglio>1mm. Este y otros factores de alto riesgo como la extensión extracapsular se asociaron a la realización de la DGC junto con tener un melanoma grueso> 4mm. De forma opuesta, los pacientes ancianos>80 años se sometieron con una menor frecuencia a la realización de la disección. En la literatura, la mayoría de los estudios publicados también han encontrado asociación entre la realización de DGC y la edad del paciente de forma inversa8,10–12. Otros factores relacionados que se repiten son el número de ganglios afectados y el tamaño tumoral7,11. La localización se ha asociado a una mayor ejecución de la DGC, así la localización en cabeza y cuello se asocia con la elaboración de la linfadenectomía, mientras que la localización en miembros inferiores se asocia inversamente7,12. Resulta controvertido de forma especial la toma de decisiones en los pacientes con la localización del melanoma en la región de la cabeza y cuello, no solo por los resultados ya comentados del MLST-II sino porque los resultados de los estudios observacionales disponibles en esta localización son contradictorios29–31. Otras opiniones a favor de la DGC en esta localización sería obtener un buen control regional de la enfermedad ya que una recaída podría conllevar una gran morbilidad32. Además, la DGC de los ganglios cervicales conlleva una menor morbilidad que en otras localizaciones como la axilar y sobre todo la inguinal que pueden alcanzar hasta 50% de complicaciones incluidas infección, seroma y linfedema. Sin embargo, la mayor tasa de complicaciones tras la DGC inguinal probablemente explique la tendencia a no realizar la DGC en melanomas localizados en miembros inferiores que encuentran varios estudios33.
No se han encontrado diferencias en la supervivencia entre los pacientes sometidos a DGC y el grupo de observación de forma univariante, sin embargo, sería interesante en el futuro comparar la supervivencia entre los sometidos a la DGC vs. observación de los pacientes con melanoma y BSGC positivo que podríamos denominar de alto riesgo (extensión extranodal, carga tumoral alta, más de tres ganglios afectados, más de dos regiones linfáticas afectadas y la localización en cabeza y cuello)13–15. Aunque, la tendencia actual asume que el comportamiento biológico y el fundamento de la observación frente a la DGC es independiente de esas características.
Se ha observado una variabilidad entre hospitales a la hora de recomendar la DGC en estos pacientes, lo que refleja la diferencia temporal en la adaptación a las recomendaciones de los diferentes centros, además de las diferencias en disponibilidad de ensayos clínicos, seguimiento radiológico adecuado o ser centros de referencia12.
Nuestro estudio muestra el papel preponderante del tratamiento adyuvante en los últimos años, pues casi el 60% de los pacientes recibieron tratamiento sistémico adyuvante. Más de la mitad de ellos, no fueron sometidos a DGC, sobre todo en los últimos años del estudio. Este dato también coincide con los patrones de tratamiento descritos en la literatura7,8,11.
Antes incluso de la publicación de los datos del MSLT-II y DeCOG-SLT, se publicaron los resultados de estudios que demostraron una mejoría en la supervivencia libre de recaída en melanoma con BSGC positivo tratados con inmunoterapia adyuvante12,16,17. Sin embargo, estos estudios solo incluyeron pacientes que se habían sometido a DGC, por lo que inicialmente continuó indicándose la técnica. Un nuevo estudio sobre la eficacia de la terapia sistémica adyuvante en pacientes con melanoma y BSGC positivo a los que no se les realizó la DGC, demostró una mejora en la supervivencia libre de recaída del 67% a los 24 meses en el brazo sometido a la adyuvancia19.
Como limitaciones del estudio cabe destacar que se trata de un estudio retrospectivo en su naturaleza, que el tamaño muestral es menor respecto a otros estudios similares, así como la diferencia en el número de casos incluidos entre hospitales. Sin embargo, como fortaleza, la distribución geográfica de los centros de referencias que han participado le dan un valor generalizable y actual del mismo. Además, se trata del único estudio de estas características realizado en centros del área mediterránea.
Como conclusión, a partir de la reciente evidencia recogida en las actuales versiones de las guías clínicas, ha habido un importante descenso en la realización de la DGC en los pacientes con melanoma y BSGC positiva. Este estudio demuestra este mismo descenso en hospitales de referencia de nuestra área. A la vez, se pone de relieve un aumento en el uso de la terapia adyuvante en este tipo de pacientes, sobre todo a partir del año 2019. Sin embargo, la DGC continúa realizándose en algunos casos en la práctica clínica, ya que no se ha eliminado totalmente su recomendación en las guías por la existencia de grupos de alto riesgo donde no queda claro el papel que pueda tener la disección linfática. Serían necesarios más estudios para evaluar el efecto de la DGC en grupos de alto riesgo de melanoma con BSGC positiva.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro para los centros participantes salvo la investigación realizada por el grupo de Melanoma en el Hospital Clínic de Barcelona cuenta con el apoyo del Centro de Investigación Biomédica en Red de Enfermedades Raras del Instituto de Salud Carlos III, España; AGAUR 2017_SGR_1134 y el Programa CERCA de la Generalitat de Catalunya, España; una Subvención de Investigación de la «Fundación Científica de la Asociación Española Contra el Cáncer» GCB15152978SOEN, España; la Comisión Europea en el marco del Sexto Programa Marco, Contrato No. LSHC-CT-2006-018702 (GenoMEL), por la Comisión Europea en el marco del Séptimo Programa Marco, Diagnoptics; la Comisión Europea en el marco del Programa Marco HORIZON2020, iTobos y Qualitop; y la Comisión Europea en el marco del Programa Horizon Europe, HORIZON-MISS-2021-CANCER-02, MELCAYA (referencia 101096667). Esta investigación contó en parte con subvenciones del Fondo de Investigaciones Sanitarias P.I. 18/00419 y 22/01467, España. Parte del trabajo se llevó a cabo en el Centro Esther Koplowitz, Barcelona.
Conflicto de interesesLos autores no tienen conflicto de intereses relacionados con la presente publicación.