Los procesos linfoproliferativos (PLP) positivos para el virus de Epstein Barr (VEB) con afectación cutánea son una serie de entidades poco frecuentes que engloban desde procesos indolentes a linfomas agresivos. Los procesos linfoproliferativos B (PLP B) afectan principalmente a pacientes inmunocomprometidos y los procesos linfoproliferativos T (PLP T) son más frecuentes en determinadas regiones geográficas como Asia, América Central y Sudamérica. Desde la última clasificación de la clasificación de consenso común de la Organización Mundial de la Salud y de la Organización Europea para la Investigación y el Tratamiento del Cáncer (WHO/EORTC) de los linfomas cutáneos en 2018 se han producido cambios significativos para estas entidades en las nuevas clasificaciones de las neoplasias hematológicas. En esta revisión sistemática se incluyen las principales características clínicas, histológicas, inmunofenotípicas y moleculares de los PLP B y T VEB+ que pueden afectar a la piel al diagnóstico. Entre los PLP B se incluyen linfomas primarios cutáneos como la úlcera mucocutánea positiva para el virus de Epstein Barr (UMC VEB+) y linfomas sistémicos que pueden presentarse con afectación cutánea como la granulomatosis linfomatoide (GL), el linfoma difuso de células grandes B asociado a virus de Epstein Barr, No especificado (LCGBD VEB+, NOS) el linfoma plasmablástico (LPB), el linfoma primario de cavidades con presentación extracavitaria (EC-PEL) VEB+, el proceso linfoproliferativo polimorfo B VEB+ o los PLP postrasplante (PLPPT). Dentro de los PLP T, la mayoría están englobados dentro de los PLP y linfomas de células T/NK de la infancia, así como el linfoma T/NK extranodal y formas aún más excepcionales como el linfoma T de célula centrofolicular VEB+ y el linfoma intravascular de célula T/NK. El diagnóstico diferencial de estas entidades es un reto para clínicos y patólogos por lo que disponer de evidencia científica de calidad en este campo es de gran importancia para evitar el sobretratamiento.
Epstein Barr virus (EBV) positive B lymphoproliferative disorders (LPD) with cutaneous involvement include a series of rare entities that go from indolent processes to aggressive lymphomas. B-cell EBV+ LPD mainly affect immunocompromised patients while T-cell EBV+ LPD are more prevalent in specific geographic regions such as Asia, Central America, and South America. Since the latest WHO-EORTC classification of cutaneous lymphomas in 2018, significant changes have been included in the new classifications of hematological malignancies. This systematic review summarizes the main clinical, histological, immunophenotypic and molecular characteristics of B- and T-cell EBV+ LPD that may compromise the skin at diagnosis. B-cell EBV+ LPD include primary cutaneous lymphomas such as EBV-Mucocutaneous Ulcer, as well as systemic lymphomas affecting the skin at diagnosis that may present such as lymphomatoid granulomatosis (LG), EBV diffuse large B cell lymphoma, NOS, plasmablastic lymphoma (PBL), Extracavitary primary effusion lymphoma (EC-PEL) EBV+, EBV-positive polymorphic B cell LPD, and post-transplant lymphoproliferative disorders (PTLD). Regarding T-cell EBV+ LPD, most of these entities are categorized within T/NK-cell lymphoproliferative processes and lymphomas of childhood, including extranodal T/NK lymphoma, and even more exceptional forms such as EBV-positive T-cell centrofollicular lymphoma and intravascular T/NK-cell lymphoma. Diagnosis is based on integrating the clinical, histological, immunohistochemical, and genetic criteria discussed throughout this article. Differential diagnosis is a challenge for dermatologists and pathologists, so having scientific evidence available in this field is of paramount importance because overtreatment must be carefully avoided.
La clasificación de los linfomas ha evolucionado considerablemente en los últimos años. Desde la clasificación de consenso común de la Organización Mundial de la Salud y de la Organización Europea para la Investigación y el Tratamiento del Cáncer (WHO/EORTC) de 20181, han aparecido recientemente publicadas no solo una, sino dos nuevas clasificaciones/consenso de expertos para las neoplasias hematolinfoides2,3, junto con la recién publicada clasificación de la WHO de las neoplasias cutáneas4. El avance en las técnicas diagnósticas, así como los nuevos descubrimientos sobre la patogénesis y genética de estas entidades, con las implicaciones pronosticas y terapéuticas que esto acarrea, han supuesto cambios sustanciales tanto en la clasificación como en la definición de alguna de ellas. Esta revisión sistemática se centra en los procesos linfoproliferativos (PLP) y linfomas B y T relacionados con el virus de Epstein Barr (VEB) que pueden presentarse con afectación cutánea, abordándose también el rol del VEB en la linfomagénesis. La metodología seguida en la revisión puede consultarse en el Anexo5,101, así como en la figura 1, donde se aporta un resumen de la metodología de la revisión sistemática. Asimismo, en el Anexo se recogen las principales características clinicopatológicas de las entidades desarrolladas en este artículo. Finalmente, en Anexo se resumen las equivalencias en la nomenclatura de estos procesos entre las distintas clasificaciones vigentes, así como con sus predecesoras. Para facilitar la lectura, en el texto solo aparecen las entidades tal y como están nombradas en la clasificación del consenso internacional (ICC).
ResultadosEl rol del virus de Epstein Barr en la linfomagénesisEn las últimas décadas se ha tratado de esclarecer el papel que juega la infección por ciertos virus en la aparición de los linfomas cutáneos7. El VEB fue el primer virus asociado a tumores descrito en el ser humano, descubriéndose en 1964 en el linfoma de Burkitt8. Se trata de un gamma herpes virus, altamente extendido con una prevalencia en la población mundial mayor del 90%9. Tras la primoinfección, persiste de por vida en las células B de memoria10. La mayoría de los individuos infectados controlan la infección mediante respuestas inmunes citotóxicas de células NK o linfocitos T CD8+; solo un pequeño número desarrollan infección crónica por VEB y sus patologías asociadas, lo que es más frecuente en presencia de deficiencias inmunitarias, predisposición genética o factores ambientales10. El VEB presenta diferentes tipos de infección latente que dependen en gran medida del estado inmunitario del huésped y que se caracterizan por la expresión de un número limitado de genes del virus, siendo diferentes en los distintos tumores asociados a infección por VEB (tabla 1).
Latencias VEB y su relación con los procesos linfoproliferativos B y T VEB+ y el estado inmune
| Latencia | Marcadores | Patología | Inmunocompromiso |
|---|---|---|---|
| 0 | EBER, BARTS y miRs | PBL* | SÍ |
| I | EBER y EBNA1 | PBLEC-PEL | SÍSÍ |
| II | EBER, EBNA1, LMP1, LMP2A y LMP2B | UMC-VEB+LCGBD VEB+, NOSGL*PBL*PLPPT*PLP HVAlergia severa a picadura de mosquitoLinfoma extranodal de células T/NK | SÍNOSÍSÍSÍNONOSÍ |
| III | EBER, EBNA1, EBNA2, EBNA3A, EBNA3B, EBNA3C, EBNA leader protein (LP), LMP1, LMP2A y LMP2B | UMC-VEB+GLPLPPTLCGBD VEB+ | SÍSÍSÍSÍ |
En los estados de latencia del VEB pueden expresarse hasta seis antígenos nucleares del VEB (EBNA1, 2, 3A, 3B, 3C y LP), tres proteínas latentes de membrana (LMP1, 2A y 2B), y dos ARN codificados del VEB (EBER 1 y 2). En la tabla se muestra la relación de dichos marcadores con el estado de latencia, la patología linfoproliferativa asociada y la existencia o ausencia de inmunocompromiso en dicha patología.
Procesos linfoproliferativos que pueden presentar otro tipo de latencias y/o marcadores de manera menos habitual.
EBER: EBV-encode small RNA; EBNA: EBV nuclear antigen; BARTS: BamHI fragment A rightward transcript; LMP: latent membrane protein; miRs (microARNs); UMC-VEB+: úlcera mucocutánea VEB+; LCGBD VEB+, NOS: Linfoma de células grandes B difuso asociado al virus de Epstein Barr positivo, No especificado; GL: granulomatosis linfomatoide; LPB: linfoma plasmablástico; EC-PEL: linfoma primario de cavidades de presentación extracavitaria; PLPPT: procesos linfoproliferativos postrasplante; PLP HV: proceso linfoproliferativo hydroa vacciniforme.
Los mecanismos exactos por los que la infección latente por VEB inicia la transformación y progresión neoplásica en las células linfoides no están establecidos, aunque hay una serie de factores predisponentes. Para cada entidad y localización tumoral existen diferencias en los perfiles de expresión génica, metabolismo tumoral, transducción de señales, mecanismos de escape inmunitario y composición del microambiente tumoral en función de si está asociada o no a infección por VEB11.
Dicho esto, parece que los linfomas VEB+ pueden desarrollar muchos mecanismos de escape inmune por lo que en algunos casos podrían beneficiarse de tratamientos de inmunoterapia como pueden ser anticuerpos antiproteína 1 de muerte celular programada/ligando 1 de muerte celular programada, pequeñas moléculas cuyas dianas son productos de genes de latencia del VEB, vacunas celulares e incluso terapia de células T con receptores quiméricos de antígenos (CAR-T) frente a antígenos del VEB11,12.
Procesos linfoproliferativos y linfomas B relacionados con el virus de Epstein Barr y afectación cutáneaEstas entidades forman un espectro clínico-patológico que va desde procesos indolentes y autolimitados hasta procesos muy agresivos. En la mayoría de estos procesos, la inmunosupresión puede tener un papel decisivo en su patogénesis.
Úlcera mucocutánea positiva para el virus de Epstein BarrDescrita por primera vez en 2010 en una serie de 26 pacientes13, es la única considerada como un PLP primario cutáneo y se recoge ya como entidad definitiva en las clasificaciones más recientes. Especialmente la clasificación de la ICC de 20223 especifica que debe tratarse de lesiones únicas y que, en pacientes con dos o más lesiones, es preferible utilizar otros términos como «PLP polimorfo B VEB+» o, cuando sea apropiado dadas sus características clínico-patológicas, linfoma B difuso de células grandes asociado a VEB, No especificado (LCGBD VEB+, NOS).
Epidemiología y patogénesisMás frecuente en mujeres14, con edades promedio de 66,4 años15. Ocurre en el contexto de una pérdida de control sobre la infección latente por VEB motivada por distintos tipos de inmunosupresión: inmunosenescencia por edad avanzada por pérdida del repertorio de células T y de su funcionalidad16, o bien inmunosupresión iatrogénica en el contexto de enfermedades autoinmunes, trasplantes de órganos sólidos, trasplantes alogénicos de precursores hematopoyéticos (TAPH) o en la infección por el virus de la inmunodeficiencia humana (VIH)17. El fármaco más frecuentemente asociado en la literatura con este PLP es el metotrexato, seguido de otros como la azatioprina, ciclosporina, imatinib, tacrolimus, inhibidores del factor de necrosis tumoral alfa y micofenolato17. Otros factores de riesgo para su desarrollo son la inflamación crónica de la mucosa o la enfermedad inflamatoria intestinal18.
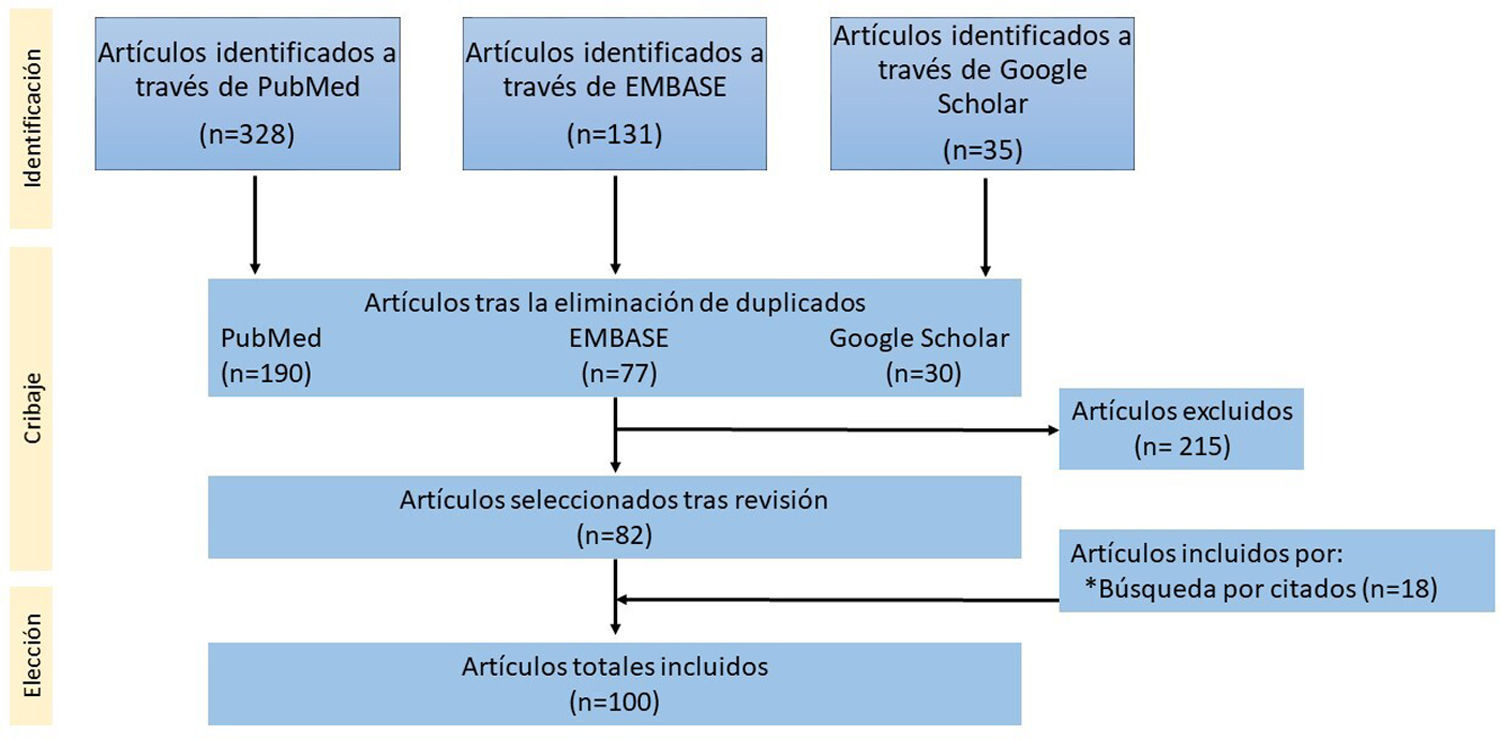
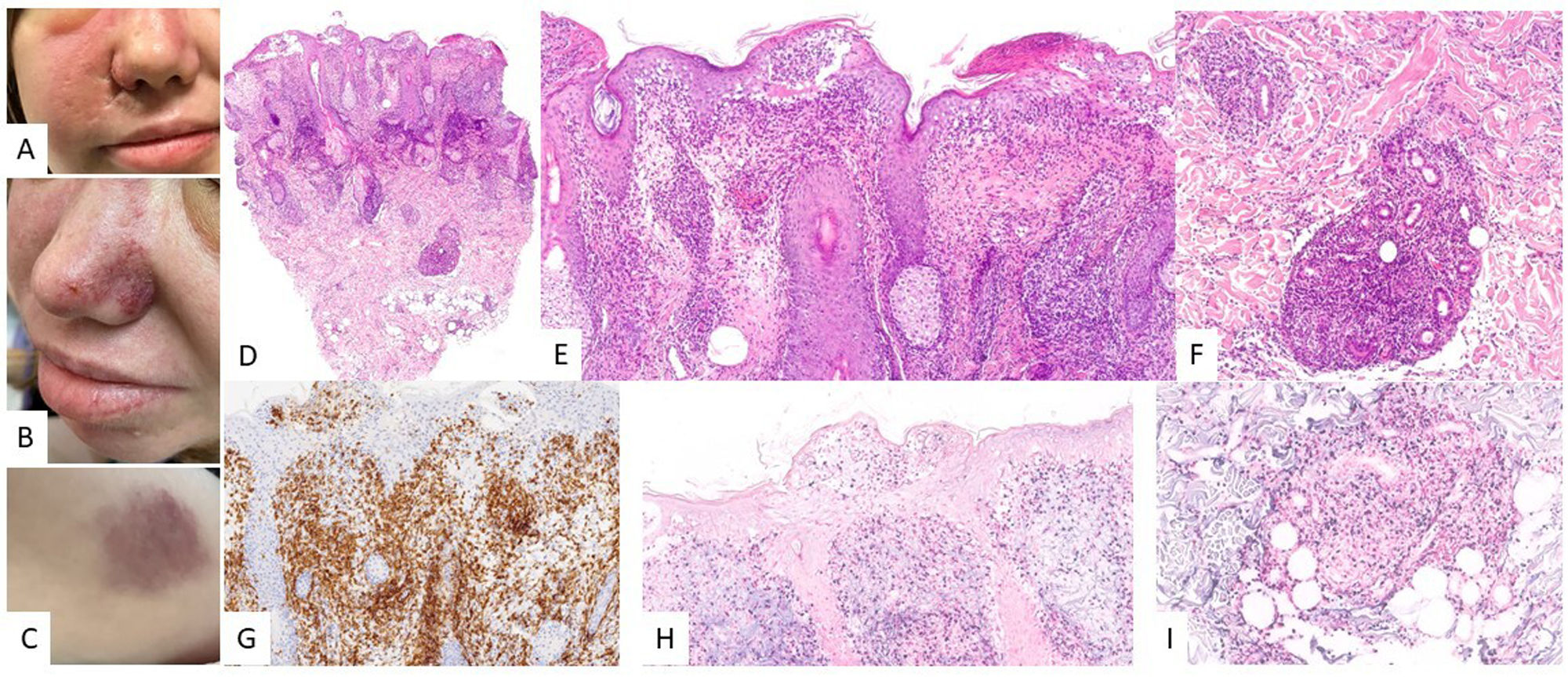
Características clínicasSe presenta en forma de úlcera, como lesión única en piel o mucosas (fig. 2). El curso clínico es poco agresivo, describiéndose incluso remisión espontánea de las lesiones14. Los pacientes generalmente tienen una carga viral de ADN de VEB muy baja o inexistente en sangre periférica (SP), lo que es útil en el diagnóstico diferencial con el LCGBD VEB+, NOS19. Hay casos excepcionales en los que se ha descrito un curso intermitente-recurrente sin progresión posterior20.
Úlcera mucocutánea VEB+ (UMC-VEB+). (A) Imagen clínica consistente en úlcera aislada con zonas necróticas y eritema circundante localizada en cara anterior de muslo izquierdo. (B) Con un pequeño aumento se observa un infiltrado dérmico que afecta con intensidad porción profunda, de patrón nodular (HE, 2X). (C) Con mayor aumento, el infiltrado es heterogéneo, con elementos atípicos de hábito sternbergoide (HE, 20X). (D) Parte del infiltrado es positivo para CD30 (20X); y (E) positivo para EBER (20X).
Las biopsias muestran úlceras superficiales con acantosis epidérmica o de la mucosa adyacente que puede acompañarse de cambios pseudoepiteliomatosos13. El infiltrado inflamatorio y tumoral presente en la base de la úlcera es heterogéneo, con células Hodgkin-like plasmacitoides apoptóticas y necrosis, altamente características de estas lesiones14 (fig. 2). Además, es típico encontrar un anillo de células T CD3 positivas en la base. El inmunofenotipo de los inmunoblastos Hodgkin-like es PAX5+ con intensidad variable, OCT2+, MUM1+, BOB1+ y CD45+/-. Hasta un 33% de los casos puede existir una expresión parcial o ausente de CD2013. Además, estas células son típicamente positivas para CD30 (fig. 2) con coexpresión de CD15 en un porcentaje significativo de los casos19. EBER es positivo en estas células Hodgkin-like, así como en otras células incluyendo linfocitos pequeños (fig. 2) y a veces incluso en células epiteliales adyacentes6,14. En algunas series se ha descrito expresión de PDL1 por parte de las células tumorales6. Se detecta clonalidad B en menos del 50% de los pacientes y es frecuente encontrar clonalidad u oligoclonalidad T debido a la inmunosenescencia y otros defectos inmunitarios14.
Actualización en su tratamientoMuchos casos presentan remisión espontánea o se resuelven tras retirar la inmunosupresión. En pacientes ancianos sin otros factores de inmunosupresión hay descritas buenas respuestas a rituximab intravenoso en monoterapia14. Otros tratamientos publicados son regímenes de poliquimioterapia como la combinación de rituximab con ciclofosfamida, hidroxidaunorrubicina, sulfato de vincristina y prednisona (R-CHOP) o la radioterapia18.
Linfoma B difuso de células grandes asociado a virus de Epstein Barr, No especificadoEsta entidad fue descrita por primera vez en 2003 en una serie de pacientes no inmunosuprimidos, mayores de 60 años. Se manifestaba característicamente con afectación extraganglionar predominante21. Estos pacientes parecían tener peor pronóstico que otros LCGBD VEB negativos (VEB-). En la clasificación de la WHO de 2008 fue incluida como una entidad provisional bajo la denominación LCGBD VEB+, del anciano22. Con el tiempo aparecieron casos en pacientes más jóvenes por lo que fue renombrada como LCGBD VEB+, NOS en la clasificación de la WHO de 2016.
Epidemiología y patogénesisSu prevalencia es mayor en África, Asia y América Latina. Se ha descrito en un amplio rango de edades, pero es más frecuente en individuos de más de 50 años y a menudo con afectación extraganglionar (40% de los casos). A diferencia de los pacientes de edad avanzada, en los pacientes jóvenes (< 45 años) es más habitual la enfermedad ganglionar y suelen tener mejor pronóstico14.
Características clínicasLas lesiones cutáneas suelen consistir en placas, nódulos o tumores, generalmente no ulcerados, localizadas en extremidades inferiores19 (fig. 3). En general, es común la enfermedad avanzada al diagnóstico y suelen tener carga viral de VEB elevada en SP23. Recientemente se ha publicado una revisión sistemática que compara 17 casos de este linfoma con presentación cutánea, con 21 casos de LCGBD primario cutáneo, tipo piernas (TP), en la que se pone de manifiesto las diferencias clínico-patológicas de ambas entidades, así como un peor pronóstico para el LCGBD VEB+, NOS (32 meses de mediana de supervivencia global, frente a 88 meses en los TP)29. Los pacientes con LCGBD VEB+, NOS tienen de forma significativa mayor edad al diagnóstico, es más frecuente que las lesiones sean no nodulares y que haya más número de lesiones y localizaciones cutáneas29.
Linfoma B difuso de células grandes asociado al virus de Epstein Barr, No especificado. (A) Imagen clínica que muestra placa indurada infiltrada eritemato-violácea en región superior de muslo derecho en paciente anciana. (B) Con un pequeño aumento se observa infiltrado dérmico en porción superficial y profunda, de patrón nodular (HE, 2X). (C) Con mayor aumento, el infiltrado es heterogéneo con presencia de células grandes de morfología atipica y habito sternbergoide. (HE, 20X). Estas células son (D) positivas para CD30 (2X), (E) EBER (2X) y (F) CD20 (2X).
Existe un espectro morfológico de presentación, con casos monomorfos, con un infiltrado en sábana de linfocitos grandes atípicos sin células inflamatorias reactivas, y casos polimorfos, en los que se objetiva un infiltrado inflamatorio de células reactivas con número variable de linfocitos grandes atípicos dispuestos de manera salpicada (fig. 3). En la piel son más frecuentes los infiltrados monomorfos24. Se debate sobre el papel que pueda tener la histología en el pronóstico de la enfermedad. En adultos no parece tener implicación pronóstica14, mientras que en pacientes jóvenes (< 45 años) el patrón polimorfo implica mejor pronóstico14. Por otro lado, hasta un 22,7% de los casos con afectación cutánea muestran patrón angiocéntrico. Fenotípicamente, la mayoría de los linfocitos atípicos son positivos para CD20, CD79a, MUM1 y CD30, siendo la expresión de bcl2 y bcl-6 más variable24. La positividad para CD30 (fig. 3) y EBER (fig. 2F) son las principales diferencias de inmunofenotipo con el TP24. PD-L1 y PD-L2 están frecuentemente expresados en pacientes jóvenes comparados con los más ancianos y sugiere un mecanismo de evasión del sistema inmune25.
A diferencia del LCGBD VEB-, en el LCGBD VEB+, NOS26 suelen identificarse mutaciones en las vías de factor nuclear kappa beta (NF-KB), sito de integración relacionado con Wingless (WNT) y la vía de la interleucina 6 y las janus-cinasas-transductores de la señal y activadores de la transcripción (IL6/JAK/STAT)27. Asimismo, el análisis integrado de secuenciación del genoma completo y la secuenciación dirigida con amplicón distingue claramente este tipo de tumor del LCGBD VEB-, debido a mutaciones frecuentes en ARID1A (45%), KMT2A/KMT2D (32/30%), ANKRD11 (32%) o NOTCH2(32%)27.
Actualización en su tratamientoEstos casos responden peor a los regímenes de quimioterapia típicamente utilizados como R-CHOP. Algunos ensayos clínicos con anticuerpos anti-CD30 como el como el brentuximab combinado con rituximab y ciclofosfamida, doxorrubicina y prednisolona (BV-R-CHP), o anti CD-79b como polatuzumab vedotin, combinado con R-CHP parecen haber tenido buenos resultados, por lo que polatuzumab R-CHP podría convertirse en el tratamiento de elección en estos pacientes28,29.
Granulomatosis linfomatoideLa granulomatosis linfomatoide (GL) es un PLP B infrecuente asociado al VEB descrito por primera vez en 1972. Siendo al inicio considerado como un linfoma T periférico por el predominio de linfocitos T acompañantes30, ahora se sabe que se trata de un linfoma B31. Típicamente, este linfoma afecta a los pulmones y con menor frecuencia al sistema nervioso central (SNC), la piel, los riñones o el hígado18.
Epidemiología y patogénesisTiene ligera predilección por el sexo masculino (2:1) y suele presentarse entre la cuarta y sexta décadas de la vida, siendo muy raro en niños18. Su patogenia no está claramente establecida, pero se han postulado diversas causas como el potencial oncogénico del VEB. También se ha visto en relación con enfermedades autoinmunes crónicas o inmunodeficiencias, tanto congénitas como adquiridas, como una forma de PLP postrasplante (PLPPT), o iatrogénicas, con relación a fármacos inmunosupresores como la azatioprina, el metotrexato o el imatinib18,19.
Características clínicasLa enfermedad se considera extraganglionar siendo excepcional la afectación nodal o de la médula ósea. La presentación típica incluye tos, disnea y dolor torácico. En ocasiones puede acompañarse de síntomas sistémicos como fiebre, mialgias, malestar o pérdida de peso, así como neuropatía periférica. Las lesiones cutáneas pueden aparecer en cualquier estadio de la enfermedad y se han descrito como manifestación inicial en hasta 1/3 de los pacientes. Existe variedad clínica y morfológica en las lesiones descritas. Lo más común es la presencia de nódulos eritematosos en ocasiones subcutáneos en tronco y extremidades simulando una paniculitis. También es posible la presencia de múltiples placas induradas, lesiones tipo liquen escleroso o incluso simulando un linfoma NK nasal con ulceración de la zona y nódulos crateriformes difusos32,33. Históricamente se ha asociado con mal pronóstico, pero la introducción de nuevos tratamientos ha incrementado la esperanza de vida de estos pacientes19,34.
Histología y características molecularesLa histología de las lesiones cutáneas puede diferir de la que se observa en otros órganos32. En la piel es típico hallar un infiltrado linfocitario o linfohistiocitario con presencia variable de células gigantes multinucleadas, dando una imagen de paniculitis con granulomas poco estructurados. Estos infiltrados tienen una distribución característicamente angiocéntrica o perivascular. En otros casos, las lesiones cutáneas son más similares a las encontradas en otros órganos como el pulmón y aparecen como un proceso angiodestructivo con necrosis fibrinoide e inmunoblastos CD20 y EBER positivos de disposición perivascular. El VEB es más difícil de demostrar en las lesiones cutáneas y es mejor biopsiar lesiones no ulceradas ya que la necrosis dificulta la detección del virus32. Los linfocitos T acompañantes son abundantes y suelen expresar CD8 y marcadores citotóxicos. Las células grandes muestran positividad para CD30 en hasta el 50% de los casos y el CD15 es característicamente negativo32.
Existe un esquema para la gradación de los casos basado en el contaje de las células VEB+35. En la piel no se recomienda gradar la enfermedad, ya que diferentes lesiones pueden tener un número distinto de células EBER+.
El reordenamiento es clonal en aproximadamente un 25% de los casos, con resultado variable en función del grado (solo un 8% de lesiones grado 1 son clonales frente al 69% de las de grado 3)36.
Actualización en su tratamientoNo existen en la actualidad guías de consenso para el manejo de estos pacientes. En casos iatrogénicos relacionados con inmunosupresión y de bajo grado, se recomienda la disminución de la inmunosupresión o el cese del fármaco inmunosupresor18. Se han utilizado inmunoterapias como el INF-alfa o inmunoglobulinas para fomentar la acción antiviral del sistema inmune37. Las lesiones de grado 3 se tratan con regímenes de poliinmunoquimioterapia (R-CHOP) similares a los utilizados en el LCGBD VEB+, NOS e incluso puede plantearse el TAPH o autólogo38.
Linfoma plasmablásticoEsta entidad fue descrita por primera vez bajo el nombre de linfoma plasmablástico (LPB) en 199739, siendo incluida en 2001 en la clasificación de la WHO como una variante agresiva y poco frecuente de LCGBD40. Por otro lado, la presentación primaria cutánea del LPB (LPBpc) es extremadamente rara, con los primeros casos reportados entre 2004 y 200541,42.
Epidemiología y patogénesisClásicamente se ha considerado una enfermedad asociada al VIH, constituyendo hasta el 2,6% de linfomas asociados al VIH43,44. Actualmente se considera que el LPB también puede estar relacionado con cualquier otro estado de inmunosupresión.
El pronóstico de este tipo de linfoma es bastante pobre, a pesar de la administración de tratamientos quimioterapéuticos. Cabe destacar que se ha visto una vinculación de la presencia de VEB con un mejor pronóstico de la enfermedad con respecto a aquellos casos en que la detección de VEB fue negativa44,45. En los casos de LPB con afectación únicamente cutánea, el pronóstico es más favorable46,47.
Características clínicasLa forma más habitual de presentación es extranodal, primordialmente en cavidad oral seguido del tracto gastrointestinal. Menos frecuentes son los casos con afectación ganglionar, pulmonar, de cavidad nasal y piel42,44,48.
A nivel cutáneo suele debutar en extremidades inferiores en forma de uno o varios nódulos eritematovioláceos con tendencia a ulcerarse47,48. Otras formas de presentación cutánea menos frecuentes pueden ser abscesos escrotales recurrentes49, fístulas enterocutáneas50 o úlceras perineales51. Aproximadamente la mitad de los casos con clínica cutánea presentan ya enfermedad sistémica al diagnóstico48.
Histología y características molecularesLa mayoría de los casos se caracterizan por un infiltrado difuso en todo el espesor de la dermis, conformado por plasmablastos42,43.
A nivel inmunohistoquímico, típicamente los marcadores de células B y CD45 son negativos. Por el contrario, estas células son positivas para CD138, CD38, MUM1/IRF4 y PRDM1/BLIMP142,43,48. EBER es positivo en más de un 60% de los casos42,48 y el índice de proliferación suele ser muy elevado (Ki67>90%). En ocasiones puede existir expresión marcadores de células T aberrante, dificultando el diagnóstico diferencial42,52.
Actualización en su tratamientoNo existe un consenso para su tratamiento. Habitualmente se emplean diferentes regímenes quimioterápicos, siendo CHOP uno de los más empleados53. También se han probado otras combinaciones con regímenes basados en fosfato de etopósido, prednisona, sulfato de vincristina, ciclofosfamida y clorhidrato de doxorrubicina (EPOCH), basados en ciclofosfamida, sulfato de vincristina, clorhidrato de doxorrubicina, dexametasona, metotrexato y citarabina (HiperCVAD) o basados en ciclofosfamida, vincristina, doxorubicina, y metotrexato a altas dosis, alternado con ifosfamida, etopósido y citarabina (CODOX-M/ICAV)43,53, con respuesta variable. Actualmente se están realizando ensayos clínicos con bortezomib, ganciclovir y terapias CAR-T43.
En el caso del LPBpc puede plantearse la escisión quirúrgica junto con radioterapia adyuvante como tratamiento más conservador, o quimioterapia si las lesiones son múltiples45.
Linfoma primario de cavidades de presentación extracavitaria VEB+El linfoma primario de cavidades de presentación extracavitaria, reconocido por primera vez en la clasificación de la WHO de 200154,55, es un tipo de linfoma de células B no Hodgkin raro y agresivo que está definido por la presencia de virus del herpes humano tipo 8 (VHH8). La coinfección por VEB es relativamente frecuente55.
Epidemiología y patogénesisAfecta más frecuentemente a personas con VIH, pero también puede darse en otros estados de inmunocompromiso como en pacientes de edad avanzada inmunosenescentes o en trasplantados de órgano sólido2,56. Aquellos pacientes VIH+ o de edad avanzada suelen ser VHH8+ y VEB+56.
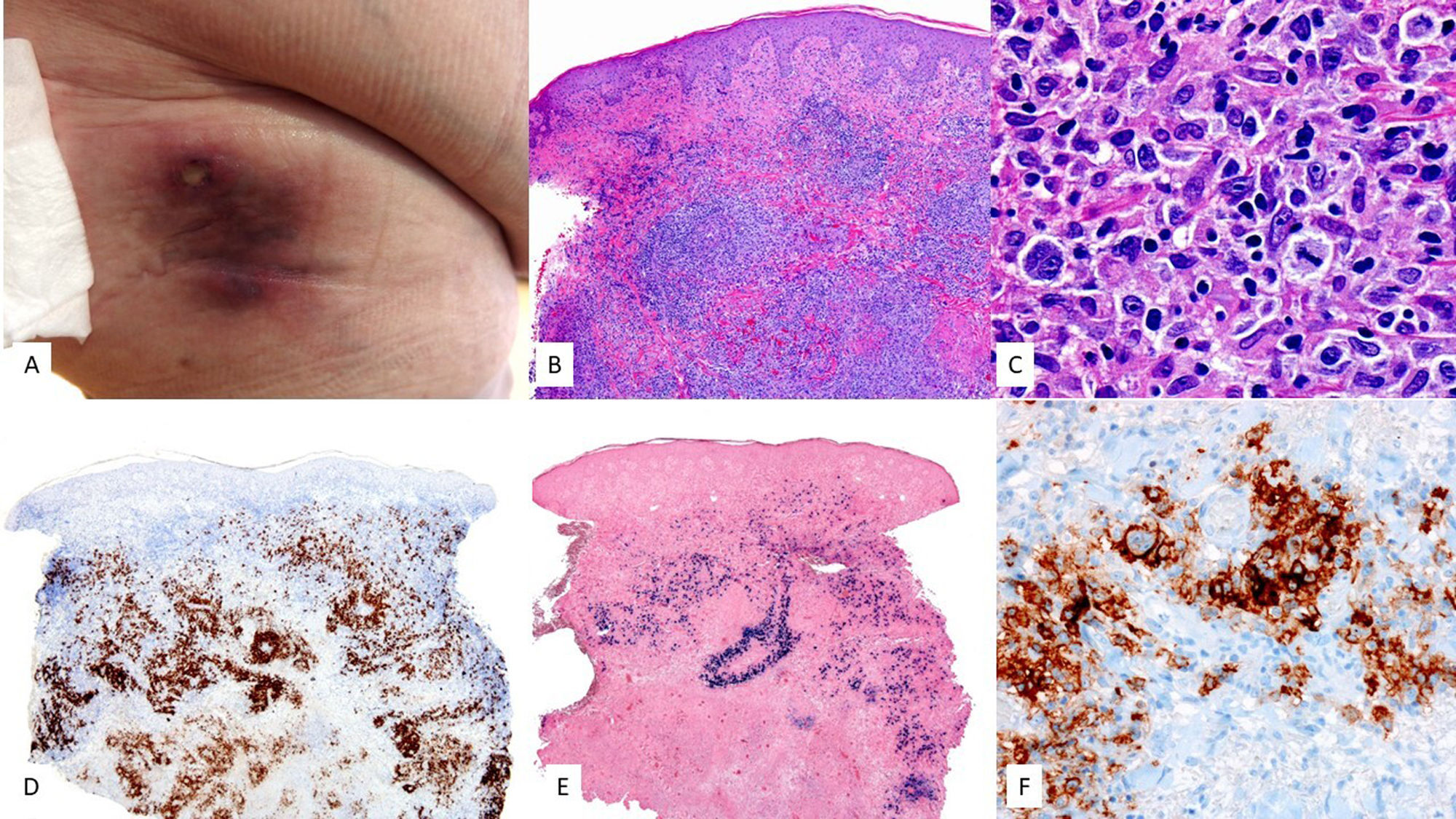
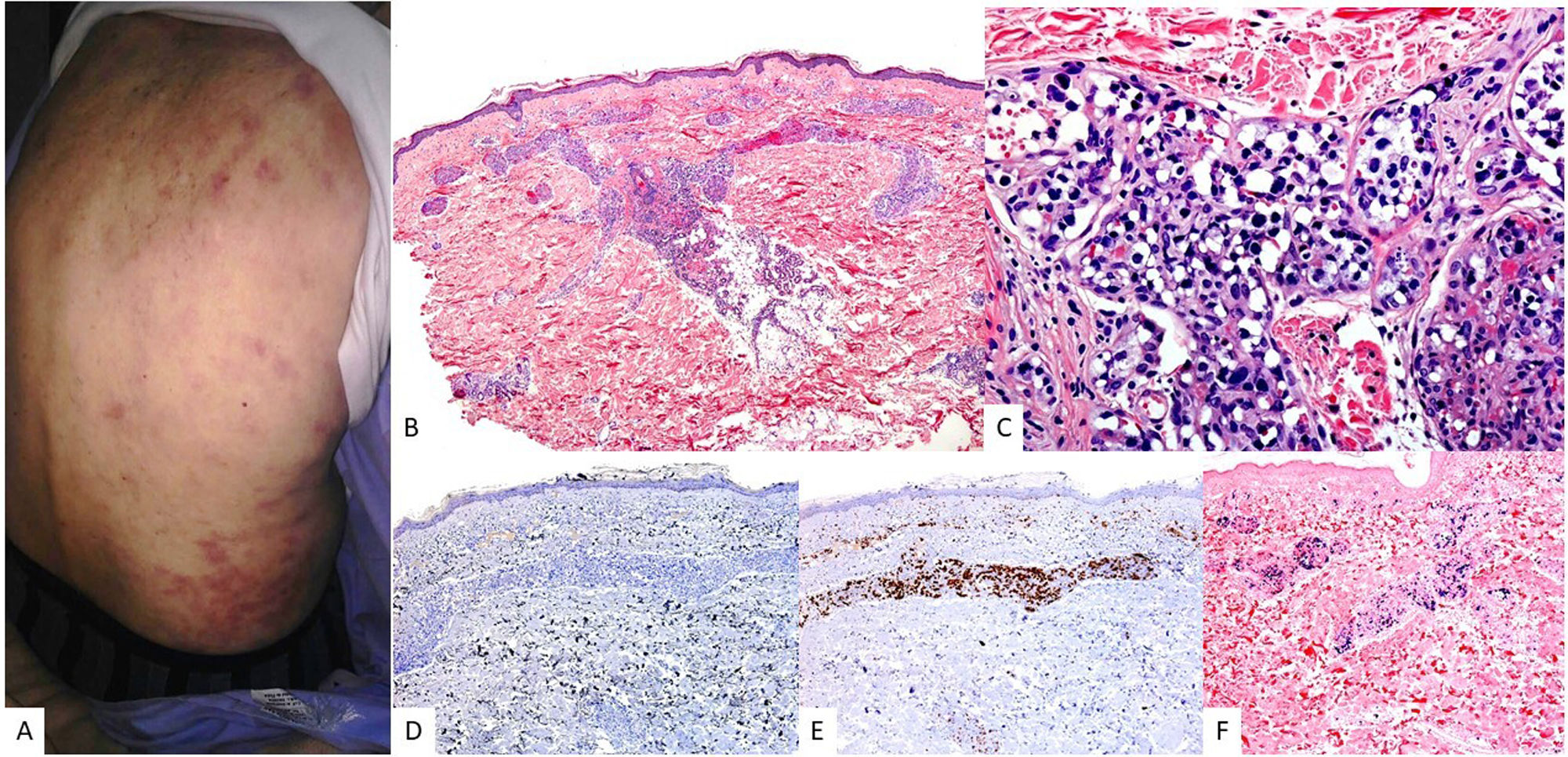
Características clínicasEn su forma clásica se caracteriza por afectar derrames de cavidades como pleura, peritoneo y pericardio. Sin embargo, existe una variante sólida extracavitaria (EC) con afectación ganglionar y extranodal, fundamentalmente de tracto gastrointestinal y piel56. En la piel, con menos de 15 casos publicados, se manifiesta como nódulos subcutáneos57, paniculitis like58 o sarcoma de Kaposi like59 (fig. 4).
PEL extracavitario VEB+. (A) Imagen clínica que muestra masa subcutánea con eritema en piel periumbilical. (B) A gran aumento, el infiltrado tumoral esta constituido por elementos de talla grande y habito plasmablástico (HE, 20X). En el estudio inmunohistoquímico realizado, estas células son (C) negativas para CD20 (2X) y (D) negativas para CD3 (2X). Por el contrario, muestran positividad para (E) CD138 (2X), (F) VHH8 (2X) y (G) EBER (2X), asi como (H) expresión monotipica para cadenas ligeras kappa (2X). (I) Cadenas ligeras lambda (2X).
Presenta infiltrados difusos de células grandes y pleomórficas con características inmunoblásticas o plasmablásticas. (fig. 4) Por definición, es VHH8+ y expresa latency associated nuclear antigen (LANA). Estas células tumorales carecen de marcadores de célula B, así como marcadores de centro germinal como CD10 y BCL6, por el contrario, son positivas para marcadores de células plasmáticas como MUM1, BLIMP1, CD38 y CD13856 (fig. 4). No son frecuentes mutaciones del oncogén MYC56, a diferencia de lo que ocurre en el LPB. El VEB puede estar presente.
Actualización en su tratamientoSe emplean regímenes de poliquimioterapia como CHOP, junto con terapia antirretroviral (TAR), siendo esta última de gran relevancia, observándose un peor pronóstico en aquellos pacientes que no emplearon TAR en su tratamiento56.
Otros PLP B con afectación cutáneaProcesos linfoproliferativos postrasplante B con afectación cutáneaDesde un punto de vista biológico, es destacable que prácticamente todos los PLP relacionados con VEB pueden aparecer en el estado de inmunosupresión que sucede en el trasplante60. El riesgo de desarrollarlos se relaciona con el nivel y la duración de la inmunosupresión requerida para el trasplante, así como la edad y el estatus serológico para VEB del receptor19. Los pacientes naïve para VEB que adquieren la infección tras el trasplante son los que más riesgo tienen de desarrollar un PLPPT. Aproximadamente un 22% de estos pacientes con PLPPT pueden tener afectación cutánea, la mayoría de los descritos tras un trasplante renal61. Los PLPPT polimorfos son por definición de células B y prácticamente todos positivos para VEB, mientras que el término monomorfos puede utilizarse para diferentes formas de linfoma de células B o T y pueden ser o no VEB+. En la literatura los casos descritos en series de PLPPT cutáneos se presentan clínicamente como lesiones maculo-papulares, nódulos o tumores con o sin ulceración asociada62. Una forma inusual de estos PLPPT de células B cutáneos es el linfoma B de la zona marginal VEB+63.
Procesos linfoproliferativos polimorfos B asociado al virus de Epstein Barr positivo, No especificadoIntroducido en la clasificación de la ICC de 20223, se propone utilizar este término para proliferaciones linfoides B con o sin inmunodeficiencia conocida que no encajan en las entidades reconocidas. También se puede utilizar cuando no se tiene la certeza diagnóstica por el pequeño tamaño de la biopsia o su baja calidad.
Procesos linfoproliferativos y linfomas T relacionados con el virus de Epstein Barr con afectación cutáneaEn la piel, los PLP derivados de linfocitos T o células NK positivos para VEB son muy poco frecuentes, representando en su conjunto menos del 2% de los linfomas primarios cutáneos1, con una incidencia superior en población asiática e individuos naturales de América Central y Sudamérica que sugiere cierta predisposición genética. A diferencia de lo que ocurre con los linfomas B VEB+, el estado de inmunosupresión no parece tener un papel determinante en el desarrollo de estos linfomas64.
Procesos linfoproliferativos y linfomas de células T/NK de la infanciaSegún la 5ª edición de la clasificación de la WHO2 y la ICC de neoplasias linfoides maduras3, se consideran cuatro grupos principales dentro de esta familia: el proceso linfoproliferativo hydroa vacciniforme (PLP HV), la alergia grave a picaduras de mosquito, la enfermedad sistémica crónica activa por VEB (CAEBV) tipo CAEBVD y el linfoma T VEB+ sistémico de la infancia. En particular los tres primeros tienen riesgo de evolucionar a linfomas sistémicos y/o síndrome hemofagocítico, por lo que un diagnóstico precoz es crucial. Por otro lado, la monitorización de la carga de VEB en sangre no parece discriminar entre las distintas formas clínicas y/o el pronóstico de la enfermedad65. Tampoco existe una aproximación terapéutica homogénea para las entidades de este grupo. En las siguientes líneas se discuten las que presentan afectación cutánea.
Proceso linfoproliferativo hydroa vacciniformeEl concepto y la definición del PLP HV, introducido en las clasificaciones más recientes2,3, han cambiado considerablemente desde que la enfermedad fue descrita por primera vez en 186266. Inicialmente considerada un trastorno cutáneo raro idiopático y fotosensible, ahora se reconoce como una proliferación linfoide VEB-positiva de células T y NK con un amplio espectro de presentación en cuanto a agresividad y curso clínico.
Epidemiología y patogénesisSi bien es más prevalente entre niños y adolescentes asiáticos o de América Latina, se han descrito también casos aislados en adultos y en caucásicos67. La presencia de reordenamientos clonales del receptor de células T (TCR) es frecuente, sin impacto en el pronóstico. Por otro lado, la búsqueda de alteraciones genéticas dirigida a encontrar mutaciones drivers en esta entidad ha sido poco explorada, pero recientemente se han descrito mutaciones en STAT3, IKBKB, ELB, CHD7 y KMT2D68. Estos resultados tienen que ser confirmados en cohortes más largas. En otro caso se ha encontrado relación con una mutación del gen DOCK869.
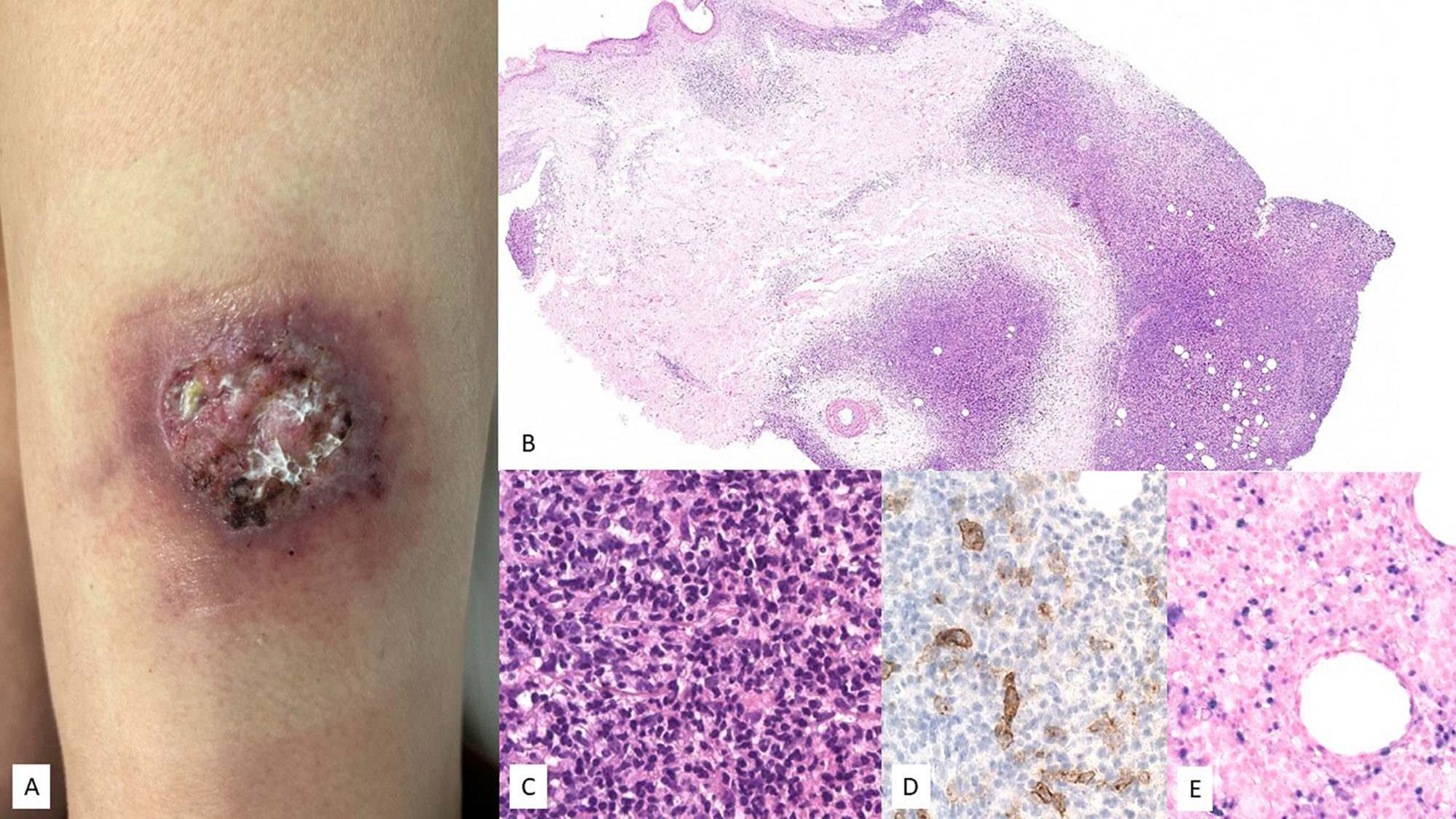
Características clínicasSe contemplan dos formas clínicas, con diferencias en el curso clínico y el pronóstico de la enfermedad14. Por un lado, la forma clásica se comporta como una enfermedad benigna y autolimitada con remisión espontánea durante la adolescencia. Afecta predominantemente a pacientes de raza blanca, con ausencia de síntomas sistémicos. Las erupciones pápulo-vesiculares son típicas en la piel expuesta al sol y desaparecen después de la fotoprotección70. Por otro lado, la forma sistémica, originalmente descrita como «linfoma cutáneo T angiocéntrico de la infancia»71, es más prevalente en asiáticos e hispanos. Los pacientes pueden desarrollar lesiones cutáneas en piel expuesta y no expuesta al sol, y tienen un curso clínico prolongado con lesiones cutáneas más graves, en comparación con la forma clásica, a las que se pueden añadir síntomas sistémicos y transformación a linfoma. En una de las primeras series publicadas se presentaba a cuatro niños varones entre tres y 12 años con edema facial persistente, necrosis y cicatrices varioliformes (fig. 5). Posteriormente, se han publicado otras series que han permitido reconocer un espectro de presentación más amplio de la enfermedad72-78. A las formas de presentación más típicas se han añadido otras más atípicas, como la afectación del área periorbitaria u ocular, en forma de hinchazón, edema marcado y congestión conjuntival, que se ha relacionado con una evolución muy desfavorable75,79,80. Otra manifestación poco frecuente es la afectación de la mucosa oral81.
Proceso linfoproliferativo hydroa vacciniforme. (A-C) Imagen clínica de la cara de una paciente donde se observa importante edema malar y lesiones en forma de placas eritemato-violáceas, asi como alguna pequeña cicatriz varioliforme de lesiones previas. (D-F) HE, 2X y 10X. A pequeño aumento se observa un punch cutáneo con infiltración linfoide superficial y profunda, con epidermotropismo. A mayor aumento se observa formación de vesículas espongióticas con necrosis de queratinocitos (E), así como infiltrados perianexiales (F). La población tumoral es positiva para CD2 (G, 10X), y EBER (H e I, 10X).
Se han descrito diferentes patrones histológicos73. Algunos casos pueden presentar vesiculación espongiótica intraepidérmica con necrosis de la epidermis. En otros, se describen infiltrados perianexiales o una combinación de ambos (fig. 5). Patrones angiodestructivos no están siempre presentes y no pueden considerarse como una condición sine qua non para el diagnóstico72,74. Otro hallazgo descrito es la presencia de infiltración neural por parte de las células tumorales71. Finalmente, algunos casos pueden afectar el tejido subcutáneo, lo que puede plantear el diagnóstico diferencial con un linfoma subcutáneo de tipo paniculítico67. En cuanto a las características citomorfológicas, los infiltrados pueden estar compuestos de forma monomorfa por linfocitos de talla pequeña a mediana o ser heterogéneos, donde los linfocitos atípicos se entremezclan con otros elementos reactivos como pueden ser histiocitos, células plasmáticas y eosinófilos. En el estudio inmunohistoquímico, las células neoplásicas tienen un fenotipo de células T/NK citotóxicas, con expresión de EBER en una proporción de estas, así como expresión de TIA-1, granzima B y perforina (fig. 5). En su mayoría, las células son CD8+. Con menos frecuencia, hay casos CD4 o CD4/CD8 o con un fenotipo NK. Se ha dicho que estos últimos casos tienden a simular un linfoma T paniculítico14. CD30 se expresa a menudo y, según algunos autores, su expresión podría estar asociada con un curso clínico más agresivo71,82. La expresión de PD-L1ha sido poco estudiada, con muy pocas células positivas entre el infiltrado, en su mayoría correspondientes a linfocitos pequeños reactivos67.
Actualización en su tratamientoEn formas leves, algunos pacientes han respondido a terapia antiviral83,84. En casos avanzados, la inmunoterapia o la quimioterapia pueden tener algún papel, si bien el único tratamiento curativo es el TAPH.
Alergia grave a picaduras de mosquitoEl concepto y la definición de la alergia grave a picaduras de mosquito no han cambiado en las últimas revisiones de las clasificaciones.
Epidemiología y patogénesisSe trata de un PLP de células NK VEB+ muy poco frecuente. Como en el caso del PLP HV, la etiopatogenia es desconocida. A nivel molecular, no se han descrito relacionadas con este proceso alteraciones concretas, si bien no existen hasta la fecha estudios realizados a este fin.
Características clínicasSe caracteriza por presentar fiebre alta y síntomas cutáneos locales tras la picadura de un mosquito, en forma de eritema, ampollas, úlceras o necrosis que dejan cicatrices profundas85. Los pacientes muestran IgE elevada en suero, así como títulos elevados de ADN del VEB y aumento de células NK en SP. Aunque se trata de un proceso generalmente autolimitado, existe un riesgo aumentado de desarrollar un síndrome hemofagocítico y/o progresar a un linfoma T/NK sistémico o leucemia agresiva de células NK.
HistologíaMicroscópicamente, las lesiones cutáneas muestran cambios similares al PLP HV, con necrosis local más extensa y mayor frecuencia de angiodestrucción. El infiltrado es más polimorfo, con linfocitos de diverso tamaño, algunos atípicos, que se acompañan de histiocitos y abundantes eosinófilos. Las células tienen un fenotipo de células NK, con expresión de CD3ɛ y CD56, así como expresión de TIA-1, granzima B y perforina.
Actualización en su tratamientoNo existe un tratamiento estándar. Omalizumab ha demostrado su eficacia en la prevención de episodios anafilácticos en un paciente con alergia severa a picadura de mosquito86.
Enfermedad sistémica crónica activa por el virus de Epstein BarrEsta entidad ha sido renombrada en las últimas revisiones de las clasificaciones de las neoplasias linfoides cambiando el término «infección» por «enfermedad» (WHO 5ª edición e ICC 2022)2,3, al considerar que solo una escasa proporción de individuos con infección crónica activa por VEB desarrollan la enfermedad (Anexo).
Epidemiología y patogénesisSu incidencia también es superior en población asiática e individuos naturales de América Central y Sudamérica. A nivel molecular, se han identificado mutaciones somáticas recurrentes en DDX3X, KMT2D, BCOR/BCORL1, KDM6A y TET2. En el estudio más grande realizado con 83 CAEBV, al menos una de estas mutaciones se hallaba presente en el 58% de los casos. De especial interés son las mutaciones en DDX3X, también identificadas en otros linfomas, lo que sugiere que la adquisición de mutaciones en este gen puede iniciar la linfomagénesis. Otro grupo ha reportado la presencia de deleciones intragénicas en BamHI así como en otros genes necesarios para la producción de partículas virales. Se postula que estas deleciones están relacionadas con la reactivación del ciclo lítico y previenen la producción viral y la lisis celular. Finalmente, también se ha observado que una parte de los pacientes muestran defectos menores en la inmunidad celular que podrían alterar el papel de las células T/NK infectadas por el VEB en el reconocimiento de antígenos exógenos87.
Características clínicasSe trata de un proceso de tres o más meses de evolución en el que los pacientes muestran niveles de ADN del VEB en SP elevados, así como una infiltración tisular por linfocitos T/NK infectados por el virus en ausencia de inmunodeficiencia. Aproximadamente la mitad de los pacientes muestran síntomas similares a la mononucleosis infecciosa, como fiebre, linfadenopatías y hepatoesplenomegalia. El curso clínico es variable pero prolongado, y en la mayor parte de los casos la enfermedad progresa. La linfohistiocitosis hemogafocítica es una complicación con mal pronóstico.
HistologíaLa afectación cutánea es variable, desde manifestaciones similares a la alergia severa a las picaduras de mosquito hasta presentaciones más tipo HV, por lo que el estudio histológico de las lesiones no es específico. También se han publicado casos en forma de paniculitis88,89.
Actualización en su tratamientoEl pronóstico de los pacientes con CAEVB es pobre, y la edad avanzada de presentación parece ser un factor pronóstico adverso. El tratamiento debe abordar el proceso inflamatorio y también el tumoral. Dicho tratamiento debe ser iniciado antes de que la enfermedad haya progresado a linfoma o a un síndrome hemofagocítico. El único tratamiento curativo es el trasplante de progenitores hematopoyéticos, y el papel de la quimioterapia queda limitado a llegar al trasplante con la menor cantidad de enfermedad posible. Por otro lado, dada la activación de STAT3 en esta enfermedad, se ha probado la eficacia de ruxolitinib en un ensayo clínico, con resultados prometedores90.
Linfoma extranodal de células T/NKEn las últimas revisiones de las clasificaciones de las neoplasias linfoides (WHO 5ª edición e ICC 2022) se ha eliminado el indicador «tipo nasal» a esta entidad (Anexo).
Epidemiología y patogénesisA diferencia de los PLP y linfomas de células T/NK de la infancia, este linfoma afecta casi exclusivamente a adultos, con una edad media de 44 a 54 años y una proporción de hombres a mujeres de 2-3:1. A pesar de que se desconoce el papel exacto del VEB en la patogenia de la enfermedad, la positividad para dicho virus se considera imprescindible para su diagnóstico. Por otro lado, se han descrito múltiples alteraciones genéticas en este tipo de linfoma, siendo la deleción 6q21-25 la más frecuente. En esta región se albergan distintos genes supresores de tumores como PRDM1, PTPRK, FOXO3, HACE1. Otras alteraciones recurrentes incluyen ganancias en 1q21-q44, 2q y 7q y pérdidas en 17p15-22. De forma adicional, en estudios de expresión génica se ponen de manifiesto desregulaciones en distintas vías de la oncogénesis (ciclo celular/apoptosis, NFKB, NOTCH y JAK/STAT), así como alteraciones en genes de forma individual (MYC, RUNX3 y EZH2). Más recientemente, se ha demostrado en otros casos presencia de mutaciones activadoras o en genes reguladores de la epigenética, como PRDM1, BCOR, DDX3X, STAT3 y TP5387,91.
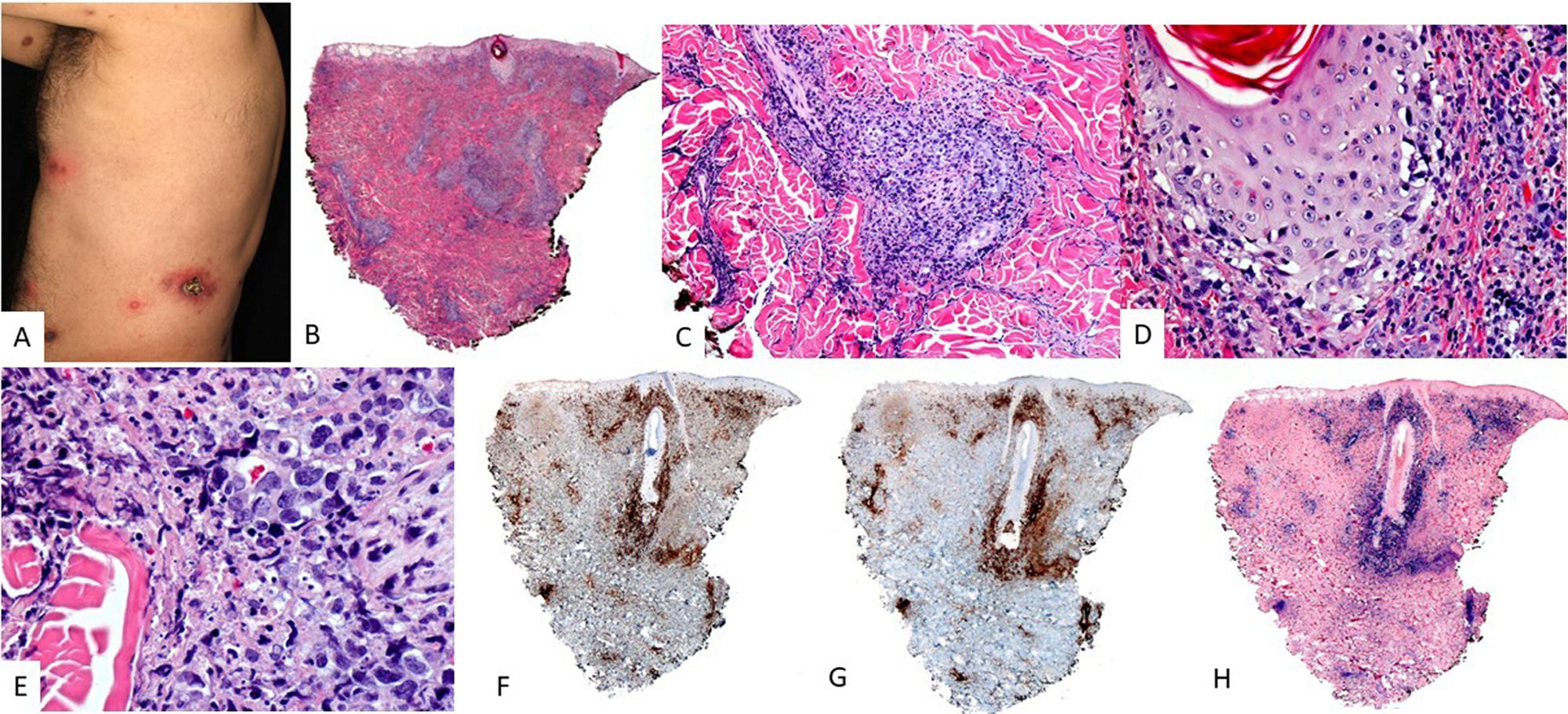
Características clínicasEs característica la afectación de cavidad nasal, nasofaringe o tracto aerodigestivo superior, desarrollando lesiones ulcerativas y destructivas con erosión ósea. Las formas extranasales son mucho menos comunes, siendo los órganos más involucrados la piel, el tracto gastrointestinal, los testículos y los tejidos blandos. Las lesiones cutáneas suelen estar localizadas en extremidades inferiores en forma de múltiples nódulos, con úlceras de centro necrótico (fig. 5A). Otras veces, simulan lesiones de paniculitis. Tiene mal pronóstico y suele diagnosticarse en estadio avanzado.
HistologíaEn la piel se observa una afectación de la dermis a expensas de una infiltración intersticial o nodular (fig. 6). Las células tumorales son de talla intermedia a grande con distribución alrededor de los vasos sanguíneos, infiltrando y destruyendo las paredes, asociándose con necrosis fibrinoide, fragmentación de la lámina elástica y trombosis (fig. 6). Estos infiltrados pueden extenderse al tejido celular subcutáneo, imitando procesos inflamatorios tipo paniculitis.
Linfoma de células T/NK extranodal. (A) En la imagen clínica destacan múltiples nódulos con centro necrótico y halo eritematoso distribuidos en tronco. (B) (HE, 2X): a pequeño aumento se observa un infiltrado dérmico en porcion superficial y profunda, con relación a vasos (C, 4X) y anejos con epidermotropismo (D, 10X). A mayor aumento (E, 20X) este infiltrado se constituye por elementos atípicos de talla grande. Estas células son positivas para CD3 (F, 2X), CD56 (G, 2X) y EBER (H, 2X).
Las células tumorales muestran un fenotipo de célula T/NK, con positividad para CD56, CD3ɛ y CD2, así como positividad variable para FAS, FASL, CD25, CD38 y CD30. Por el contrario, estas células no muestran expresión de CD3 de superficie, ni de CD4 y CD5. En un escaso porcentaje de los casos, la población tumoral muestra un fenotipo de célula T CD8+ citotóxica con reordenamientos monoclonales del TCR.
Actualización en su tratamientoLa quimioterapia basada en L-asparaginasa es el pilar del tratamiento, pero generalmente la respuesta es mala. Otras dianas terapéuticas que se han empezado a explorar son los inhibidores de PD1/PDL-1 así como fármacos moduladores de la vía de JAK/STAT y NF-κB87.
Linfoma T periférico primario cutáneo con fenotipo centrofolicularSe trata de una entidad pobremente caracterizada, de difícil correspondencia con las entidades descritas hasta la fecha y recientemente incluida en la 5ª clasificación de la WHO como una entidad separada (Anexo). De acuerdo con la serie más larga, estos casos parecen compartir características biológicas con los linfomas nodales de fenotipo T centrofolicular92. Muy pocos son los casos publicados VEB+93 y parecen tener peor pronóstico y un curso clínico más agresivo. A pesar de la escasa casuística, se mencionan en esta revisión para conocimiento del lector y para enfatizar su importancia en diagnóstico diferencial con la afectación cutánea del linfoma T follicular helper (TFH) de tipo angioinmunoblástico.
Epidemiología y patogénesisHay descrita mayor prevalencia en hombres, con una edad media de presentación de 67 años. Molecularmente, muestran mutaciones en RHOA y TET2 como alteraciones más frecuentes. En la mayor parte de los casos se detecta un reordenamiento clonal.
Características clínicasEn piel aparecen múltiples nódulos o pápulas como enfermedad aislada en muchos casos, pero con posibilidad de evolucionar a un linfoma sistémico.
HistologíaSe han descrito distintos patrones, desde infiltrados densos y profundos a una afectación superficial en banda, o incluso un patrón perivascular. Citológicamente, los infiltrados se constituyen de linfocitos de talla intermedia a grande y con núcleo irregular. Fenotípicamente, las células tumorales son T, con expresión de CD4 y de forma variable también positividad para Bcl6, CD10, CXCL13 y PD1. Los casos EBER positivos pueden diferenciarse fácilmente del resto de entidades descritas en este manuscrito, ya sea por el fenotipo de las células tumorales como por las características clínicas de presentación. El diagnóstico diferencial principal en este caso es con una afectación cutánea por un linfoma TFH de tipo angioinmunoblástico.
Actualización en su tratamientoEl manejo clínico es variable según los casos, si bien la mayor parte de los pacientes reciben quimioterapia. En los casos con alteraciones moleculares como las del linfoma TFH de tipo angioinmunoblástico pueden beneficiarse de las nuevas terapias dirigidas, como los inhibidores de la histona deacetilasa y los agentes hipometilantes.
Linfoma intravascular de células T/NKDesde su descripción inicial en 1959 como angioendotheliomatosis proliferans systemisata, menos de 30 casos han sido publicados en la literatura91,94-99. A diferencia del linfoma intravascular de células B, en la actualidad no se considera una entidad diferenciada y aún se discute si se trata de una forma de leucemia agresiva NK o de un linfoma extranodal de célula T/NK91.
Epidemiología y patogénesisLas alteraciones moleculares descritas sugieren una etiopatogenia multifactorial, con implicación de genes relacionados con reguladores de la epigenética91: genes de histonas (HIST1H2AN, HIST1H2BE, HIST1H2BN y H3F3A) y genes relacionados con metilación (TET2 y DNMT1). Además, algunos datos apuntan también a la alteración en el proceso de splicing alternativo (HRAS, MDM2 y VEGFA). Finalmente, se ha demostrado en algunos casos expresión intensa de PD1, hecho que puede estar relacionado con la infección por VEB100.
Características clínicasAdemás del SNC, la piel es uno de los órganos más afectados. Si bien se ha sugerido que aquellos casos con afectación cutánea exclusiva parecen tener mejor pronóstico que los casos con afectación multiorgánica96, las diferencias no son estadísticamente significativas y se sigue considerando como una enfermedad agresiva que responde mal a la quimioterapia. En la piel se presenta de forma inespecífica como manchas o placas eritematovioláceas en tronco y extremidades (fig. 7A).
Linfoma de células T/NK cutáneo intravascular. (A) En la imagen clínica se muestran múltiples máculas y placas equimóticas distribuidas en tronco, algunas con distribución lineal o agrupada. (B) (HE, 2X): con un pequeño aumento se observa un infiltrado dérmico con afectación de vasos del plexo superficial y profundo. A mayor aumento (C,10X) este infiltrado se sitúa dentro de los vasos. Se halla constituido por elementos de talla grande atípicos, con marcado hipercromatismo nuclear. Estas células son negativas para CD20 (D, 4X); por el contrario, son positivas para CD3 (E, 4X) y EBER (F, 4X).
Se caracteriza por una proliferación, limitada a la luz de los vasos, de células linfoides de talla intermedia a grande de fenotipo T/NK, con presencia de VEB (EBER+) (fig. 7B-F).
Actualización en su tratamientoEn la actualidad, no existe un tratamiento quimioterápico estandarizado, si bien si queda claro que la pauta CHOP tradicional es insuficiente.
Conflicto de interesesLa autora Lucía Prieto ha colaborado en formación impartida por kiowa y takeda. El resto de los autores declaran no tener ningún conflicto de intereses.
A la Dra. Socorro María Rodríguez Pinilla por su contribución para las imágenes de las figuras 2, 3, 5 y 6.