La irrupción de la inteligencia artificial (IA) a nivel mundial ha supuesto un antes y un después en nuestras vidas, generando grandes mejoras en diferentes sectores, como el de la automoción y el agroalimentario, entre otros, lo que ha llevado a denominarla la cuarta revolución industrial. La AI, capaz de aprender de forma automatizada y de ayudar al profesional a mejorar sus procesos, promete cambiar el ámbito sanitario tal y como lo conocemos mediante: 1) aplicaciones capaces de generar salud en la población general a partir del uso de información de calidad y de segmentación de consejos basados en modelos de predicción; 2) modelos capaces de generar algoritmos de predicción a partir de datos anonimizados procedentes de información clínica, a fin de mejorar la prevención primaria; 3) sistemas de análisis de imagen capaces de dar a los profesionales de la salud un soporte extra en la toma de decisiones, mejorando la prevención secundaria; y 4) aplicación de robótica combinada en la mejora de procesos ligados al ámbito de salud y bienestar.
Sin embargo, la falta de conocimiento tanto en este tipo de tecnología, como en los términos y la metodología de validación de la misma, hace que la clase médica dude en si esta revolución supone una amenaza o una oportunidad para la profesión. En el presente artículo de revisión pretendemos introducir una serie de aspectos básicos de la IA aplicada a la dermatología, así como los principales avances sucedidos en este campo en los últimos 5 años.
The worldwide explosion of interest in artificial intelligence (AI) has created a before-and-after moment in our lives by generating great improvements in such sectors as the automotive and food production industries. AI has even been called the fourth industrial revolution. Machine learning through AI is helping to improve professional processes and promises to transform the health care sector as we know it in various ways: 1) through applications able to promote health in the general population by providing high-quality information and offering advice for different segments of the population based on prediction models; 2) by developing prediction models based on anonymized clinical data, for preventive purposes in primary care; 3) by analyzing images to provide additional decision-making support for health care providers, for improving specialist care at the secondary level; and 4) through robotics applied to processes that promote health and well-being. However, the medical profession harbors doubts about whether this revolution is a threat or an opportunity owing to a lack of understanding of AI technology and the methods used to validate its applications. This article outlines basic aspects of AI as it is applied in dermatology and reviews the main advances achieved in the last 5 years.
Tal y como decía Marie Curie: «No hay que temer nada en la vida, solo hay que entenderlo. Ahora es el momento de entender más, para que podamos temer menos». Y es que, por regla general, tememos aquello que desconocemos, y alrededor de este desconocimiento suele surgir una capa de misterio y leyenda.
Por ello, en el presente artículo de revisión pretendemos introducir una serie de aspectos básicos de la IA aplicada a la dermatología, así como diferentes ejemplos de cómo la IA puede llegar a ser aplicada en nuestra especialidad.
Nuestro objetivo es animar a todos los especialistas en dermatología a profundizar más en esta nueva subespecialidad a aprender y a liderar su desarrollo, actualmente abandonado en manos de ingenieros que en muchos casos restan importancia a un correcto diagnóstico médico, o le dan un enfoque inadecuado que limita que dicha innovación nos pueda ser realmente de utilidad.
El presente artículo ha sido desarrollado por médicos especialistas en dermatología médico-quirúrgica y venereología que han tenido experiencia directa o indirecta en este nuevo campo de salud, y que pretenden dar luz a aquellos aspectos más relevantes para entender lo que la IA puede significar en su futuro médico.
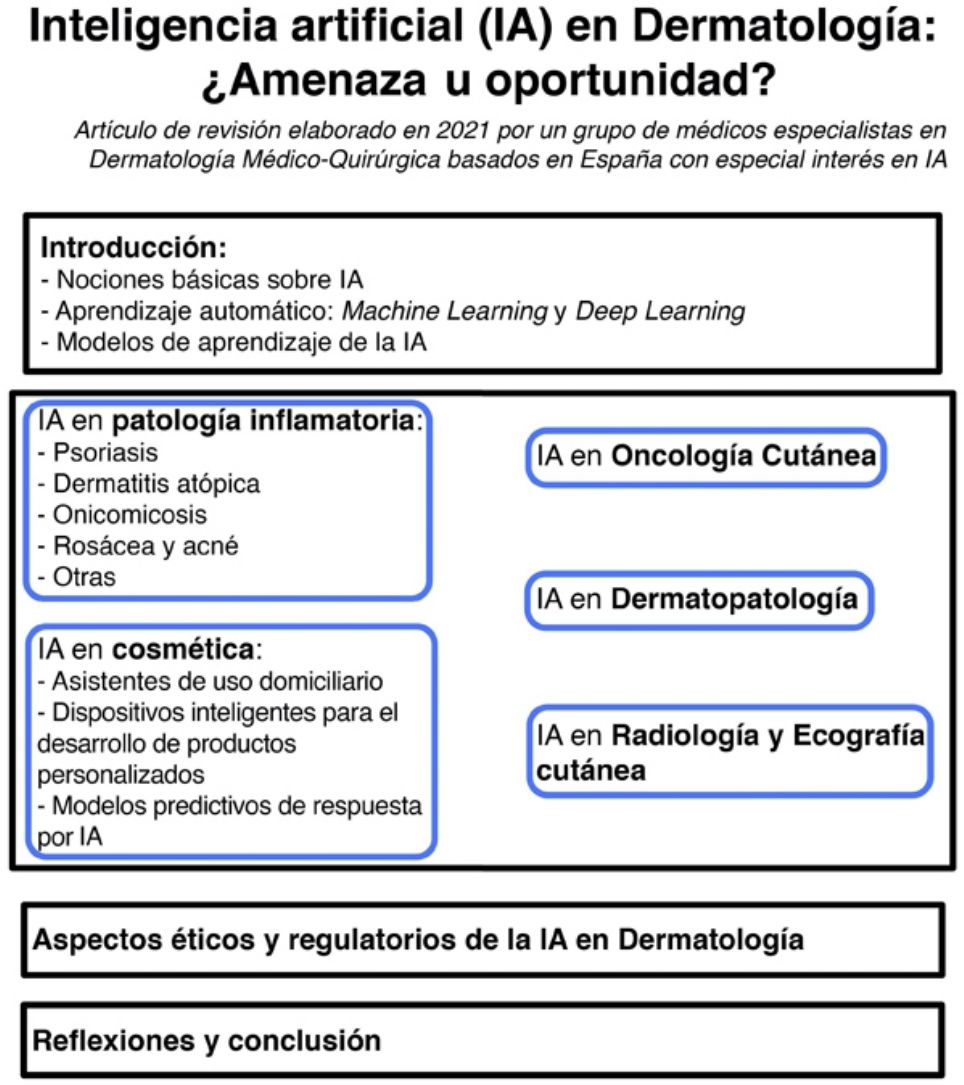
Unas nociones básicas de inteligencia artificialEs muy habitual leer y escuchar —en presentaciones médicas, podcasts y entrevistas— noticias acerca de IA, aprendizaje automático y redes neuronales, entre otros términos.
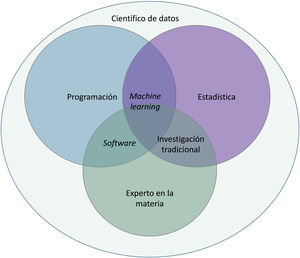
Básicamente, la IA es una tecnología desarrollada capaz de imitar las funciones cognitivas del ser humano1. Dentro de ella diferenciamos 3 tipos fundamentales, que se incluyen en la tabla 1.
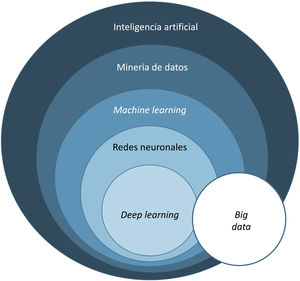
El término big data se refiere al conjunto de datos o combinaciones de conjuntos de datos cuyo tamaño (volumen), complejidad (variabilidad) y velocidad de crecimiento dificultan su captura, gestión, procesamiento o análisis mediante tecnologías y herramientas convencionales, tales como ordenadores personales, bases de datos relacionales y herramientas estadísticas convencionales (como, por ejemplo, el software SPSS®)1. Este tipo de análisis permite gestionar ingentes cantidades de datos y generar modelos de predicción útiles para nuestra práctica clínica como, por ejemplo, predecir qué perfil de paciente va a sufrir más procesos infecciosos en el área quirúrgica a fin de tomar medidas preventivas.
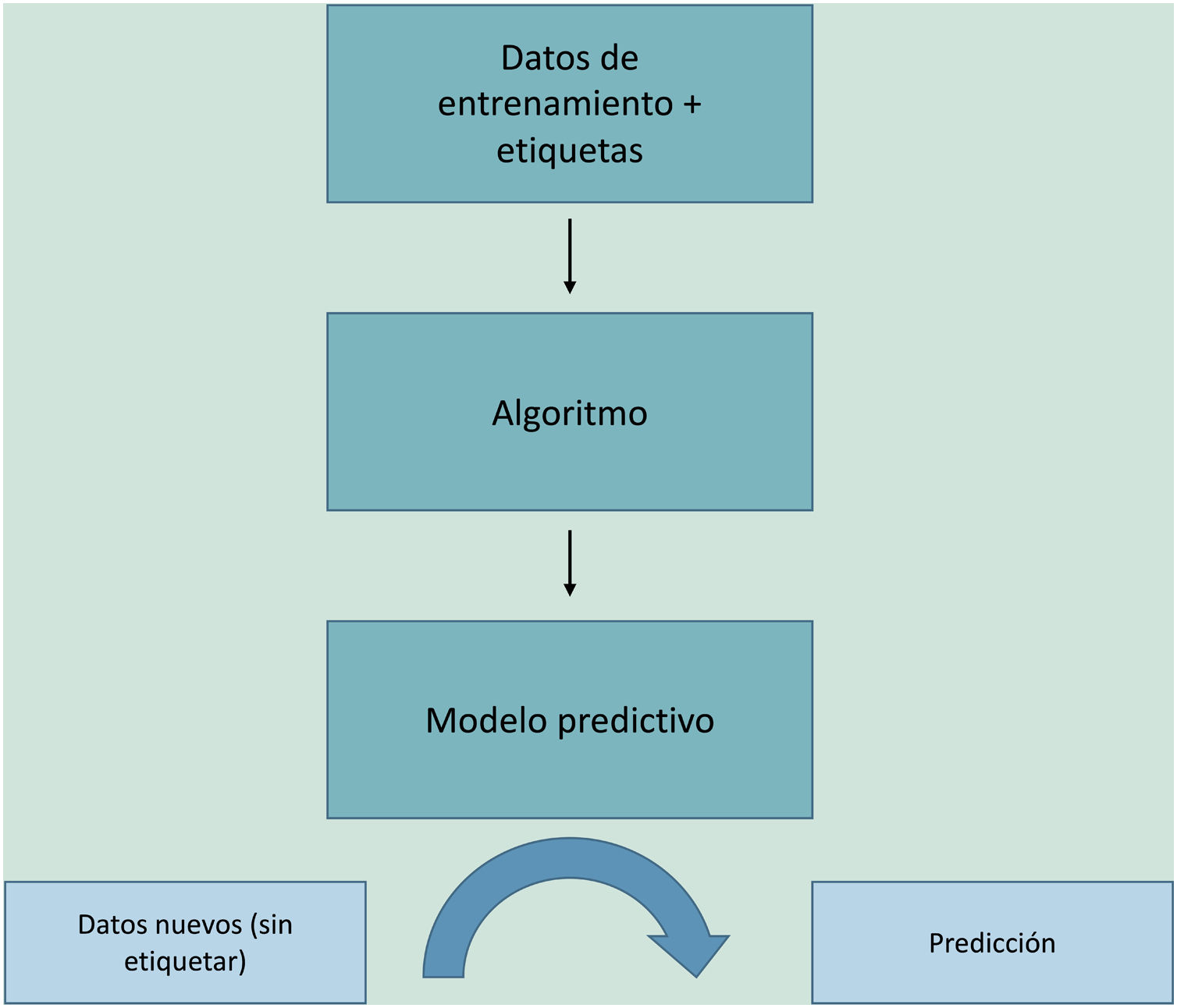
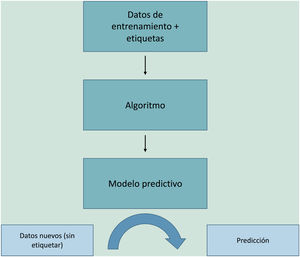
El aprendizaje automático o machine learning (ML) es un tipo de IA que proporciona a las computadoras la capacidad de aprender desde los datos, sin ser programadas explícitamente (fig. 1). Esta tecnología se encuentra en el corazón de la IA y de la gestión del big data, y por ello ha despertado gran interés en los últimos años y es en la que profundizaremos un poco más, dado que se trata de la modalidad más utilizada en dermatología, junto al deep learning2.
Aprendizaje automático: machine learning y deep learningUna de las ramas de la inteligencia artificial de mayor aplicación en medicina es el aprendizaje automático o ML, que consiste en el análisis independiente de datos gracias a la generación de algoritmos de toma de decisiones propios2–4. Esta tecnología permite la identificación de patrones para realizar clasificaciones y distintas predicciones.
El ML funciona alimentando un algoritmo con datos de entrada que recogen observaciones del pasado y construye un modelo para predecir y clasificar nuevas observaciones no conocidas por el algoritmo, imitando un proceso cognitivo humano (fig. 2).
Dentro de los modelos de ML más populares dentro del ámbito sanitario están las redes neuronales convolucionales (o CNN, del inglés convolutional neural networks), que imitan el funcionamiento de las neuronas cerebrales. Las CNN están formadas por capas de variables interconectadas entre sí con unos pesos que el algoritmo va calculando y ajustando mediante iteraciones (repeticiones) de un proceso que se conoce como «descenso del gradiente».
En dermatología habitualmente utilizamos múltiples variables, por lo que se necesitan múltiples «neuronas» para tejer una red de conexiones que nos generen información útil. Así, cuando hablamos de un sistema que basa su información en más de una capa de información, nos referimos al deep learning (DL) o aprendizaje profundo. Este tipo de redes generan excelentes resultados, siempre y cuando cumplamos con sus 2 premisas fundamentales: cantidad y calidad de datos (big data), tanto de imagen como de información (fig. 3).
Modelos de aprendizaje de la inteligencia artificialLa inteligencia artificial (ML, DL) puede ser entrenada principalmente de 3 modos: supervisado, no supervisado y por refuerzo.
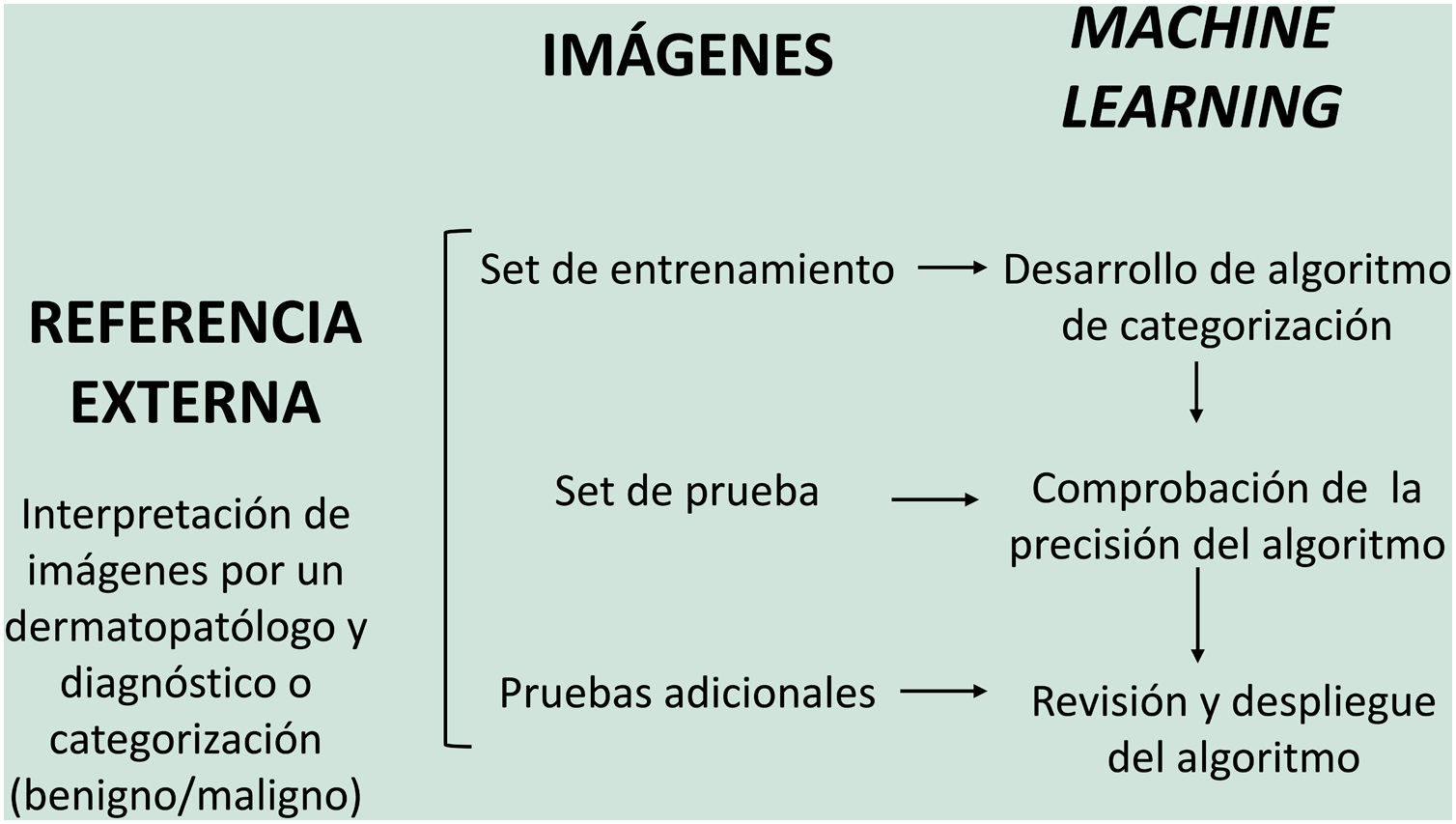
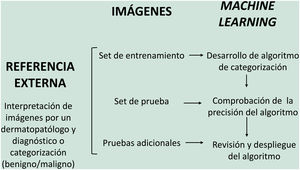
En el modelo de aprendizaje supervisado el algoritmo de IA se entrena con un conjunto de ejemplos etiquetados por el experto en los que los resultados de salida son conocidos. Este es el modelo que encontramos habitualmente en aplicaciones dermatológicas, cuyo contenido de entrenamiento son imágenes etiquetadas con su diagnóstico o parámetro de entrenamiento seleccionado5,6. A modo de ejemplo de este modelo de aprendizaje supervisado en el campo de la dermatopatología en la primera fase se «enseña» a la máquina a reconocer características y patrones concretos, y regiones de interés, validados en este caso por un dermatopatólogo (por ejemplo, características y patrones asociados a lesiones melanocíticas benignas frente a lesiones malignas [fig. 4]). Estas características y patrones basales constituyen la llamada verdad fundamental (en inglés ground truth). En una segunda fase, gracias a estos algoritmos de DL, la máquina es capaz de reconocer estos patrones y regiones de interés en lesiones no analizadas previamente, y realizar un diagnóstico de benignidad o malignidad en función de estos algoritmos propios4,5.
El modelo no supervisado se basa en datos sin etiquetar en el que la estructura y el resultado de salida son desconocidos a priori. Básicamente este tipo de algoritmos buscan patrones de agrupación (clústeres) para sujetos que por sus características en las diferentes variables que les definen muestran similitudes7. No existen demasiadas aplicaciones de este tipo de IA en dermatología debido a que en la mayoría de las situaciones son algoritmos aplicados a imágenes. Este tipo de modelo suele utilizarse en situaciones en las que se quieren llevar a cabo predicciones o en caso de necesitar clasificadores rápidos para la realización de minería de datos8. Un ejemplo de aprendizaje no supervisado sería la generación clasificadores de «melanoma versus no melanoma» a partir del entrenamiento de un modelo que agrupe/clasifique las imágenes, mediante patrones detectados por el propio algoritmo8.
Inteligencia artificial aplicada a la enfermedad inflamatoriaLos algoritmos de DL se han utilizado con fines de clasificación en diferentes enfermedades inflamatorias dermatológicas. A continuación, presentamos algunas de las más relevantes.
PsoriasisLos algoritmos basados en IA pueden resultar útiles tanto para realizar una evaluación clínica más precisa como para ayudar a desarrollar protocolos terapéuticos personalizados y predicciones de resultados9.
El primer programa de IA diseñado para la psoriasis fue creado por Guo et al. en 201410. Su objetivo era predecir el desarrollo de psoriasis utilizando perfiles de expresión genética basados en microarray de 2 conjuntos de datos. El clasificador binario utilizado logró una precisión global del 99,81%.
Se han propuesto varios intentos de desarrollo de un programa de IA que ayude a evaluar la gravedad de la psoriasis11–13. En uno de los últimos modelos los autores utilizaron 3 clasificadores estándar diferentes (máquinas de soporte vectorial (support vector machine), árbol de decisión (decision tree) y redes neuronales artificiales (artificial neural network) para estratificar el riesgo y evaluar 3 atributos principales: color, textura y espectros de orden superior. Para entrenar a este clasificador se utilizaron 670 imágenes de psoriasis. Los clasificadores realizaron una segmentación de las lesiones y las clasificaron en las clases sana o enferma. Este modelo alcanzó una precisión del 99,84%, una sensibilidad del 99,76% y una especificidad del 99,99%. Dado que el tamaño de la muestra era pequeño, los resultados podrían haberse visto afectados por sobreajuste (overfitting).
Otros estudios tratan de desarrollar un sistema para estratificar la gravedad de la psoriasis utilizando el Psoriasis Area and Severity Index (PASI), evaluando el área afectada14,15, la descamación16, la induración y el color17 y el eritema de forma aislada18.
Nuevos estudios han logrado mejorar la detección automática de lesiones de psoriasis mediante el uso de la segmentación basada en clústeres (cluster based segmentation) junto con técnicas de inteligencia de enjambre (swarm intelligence techniques)19.
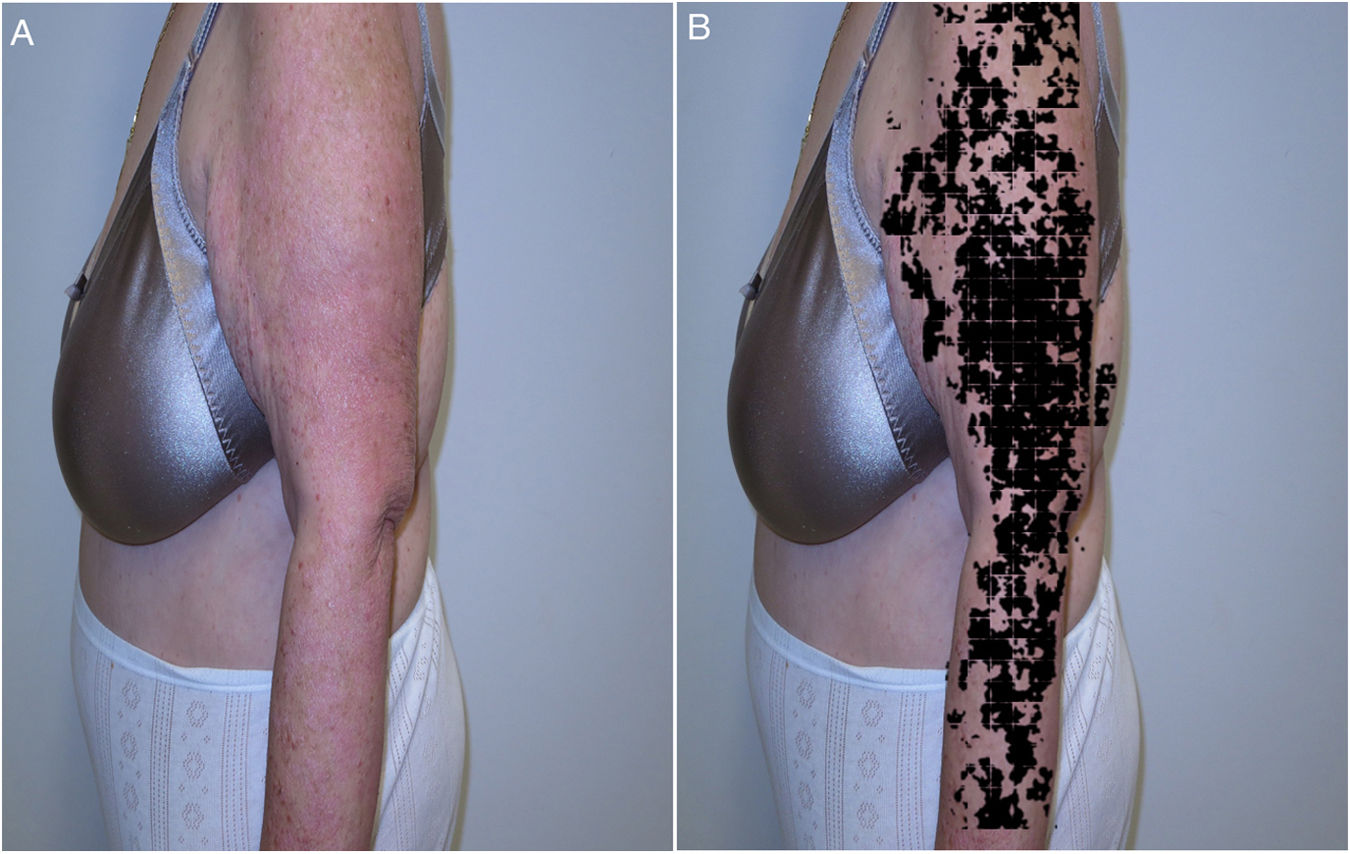
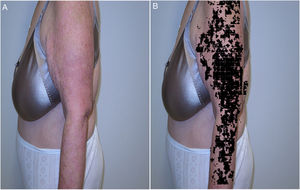
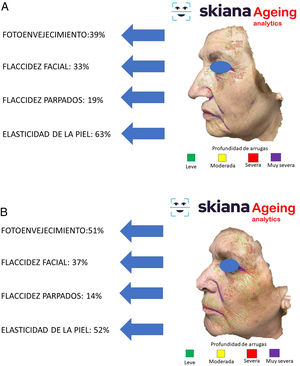
Recientemente, y siguiendo alguno de los modelos anteriores, se presentaron los resultados del proyecto IMAPSORS, incluidos dentro del proyecto SKIANA®, cuya tecnología ha sido cofinanciada por la Comisión Europea, encaminado a generar información cuantificable de la piel del paciente psoriásico a partir de la toma de imagen mediante dispositivos móviles de uso personal. Los resultados obtenidos en la capacidad de detección de psoriasis y en la definición de la gravedad de forma automatizada en forma de PASI y BSA, tanto cuantitativa como cualitativamente, abre la puerta a una mejora en la definición de la gravedad y en la detección precoz de las formas moderada y grave (figs. 5A y B)20.
También se han desarrollado programas de IA para evaluar y optimizar el tratamiento de la psoriasis, en concreto para determinar la respuesta a largo plazo a los tratamientos biológicos. El primero de estos estudios se basó en 2 modelos de aprendizaje automático (machine learning) que estudiaban la expresión genética de biopsias cutáneas21. Estos modelos fueron capaces de predecir la respuesta PASI 75 después de 12 semanas de tratamiento, evaluando el perfil molecular del tratamiento a corto plazo (2-4 semanas). Otro estudio utilizó el análisis de multi-omics en pacientes en tratamiento con etanercept, encontrando indicadores de respuesta al tratamiento en genes y vías asociadas con la señalización del factor de necrosis tumoral y el complejo mayor de histocompatibilidad22.
Aunque el estudio de la expresión génica en muestras de biopsias resulta prometedor, se han ensayado métodos que permiten evitar el carácter invasivo de esta técnica. En ese sentido, se desarrolló un modelo predictivo a partir de medidas bioquímicas en sangre23. Sin embargo, modelos más simples basados en el índice PASI resultaron mejores predictores, por lo que serán necesarios más estudios en este sentido.
Otro estudio reciente utilizó un programa para la predicción de la respuesta de los pacientes con psoriasis a la terapia biológica utilizando parámetros de información básica de salud, como la edad de inicio de la psoriasis y el peso del paciente24.
Los modelos de IA también pueden utilizarse para descubrir potenciales tratamientos fuera de ficha técnica para la psoriasis y otras enfermedades inflamatorias, mediante modelos que utilizan la información de palabras de artículos científicos y la clasificación de enfermedades para identificar potenciales fármacos25.
También se han utilizado programas de IA para estudiar las comorbilidades de la psoriasis. Uno de estos programas identificó predictores de enfermedad coronaria en pacientes con psoriasis, entre los que se encontraban la obesidad, la dislipidemia y la inflamación26.
Otra comorbilidad que afecta a aproximadamente a un 25% de los pacientes con psoriasis es la artritis psoriásica, para cuyo desarrollo no existe aún un método eficaz de predicción. Se ha desarrollado un programa de IA a través del genotipo de pacientes con psoriasis y artritis psoriásica, diferenciando entre ambas enfermedades en función de 200 marcadores genéticos y alcanzando un área bajo la curva ROC de 0,82. Este es el primer estudio que muestra una predicción robusta del desarrollo de artritis psoriásica utilizando solo información genética27.
Dermatitis atópicaLa IA en la dermatitis atópica podría servir de ayuda tanto en el diagnóstico como en el tratamiento personalizado y la predicción de su resultado. También podría ser útil para ayudar a estandarizar y reducir el tiempo de evaluación de los pacientes.
La investigación en IA en el campo de la dermatitis atópica está, no obstante, en sus comienzos.
Se ha diseñado un algoritmo de ML que identificaba dermatitis atópica desde registros electrónicos de salud28. Para ello, se utilizó un procesador de lenguaje natural que permitió incorporar tanto datos estructurados como no estructurados. Utilizando 562 notas clínicas los diseñadores lograron un valor predictivo positivo del 84% y una sensibilidad del 75%.
Otro grupo desarrolló una red neuronal artificial para la detección de dermatitis atópica frente a piel sana utilizando información de imágenes29. No obstante, el número de muestras utilizado fue bajo, dado que se trataba de un estudio exploratorio.
OnicomicosisUn estudio reciente30 comparó a un grupo de dermatólogos con una CNN para la detección de onicomicosis. Se utilizaron 49.567 imágenes para entrenar al clasificador para distinguir entre onicomicosis y uñas normales. En su validación este clasificador obtuvo una sensibilidad del 82,7-96,7% y una especificidad del 69,3-96,7%. El área bajo la curva ROC fue del 0,82-0,98. La capacidad del clasificador para diferenciar uñas sanas de uñas con onicomicosis fue estadísticamente superior que la de los dermatólogos en este estudio.
Rosácea y acnéLa evaluación clínica de los pacientes con rosácea, al igual que ocurre en otras enfermedades inflamatorias, a menudo presenta una importante variabilidad intra e interobservador. Por ello, Binol et al. desarrollaron un programa de IA basado en el uso de CNN con el fin de realizar una evaluación cuantitativa y reproducible de las lesiones, después de haber sido entrenado con más de un millón de imágenes. Estos autores definen así mismo lo que denominan regiones de interés anatómico, que son aquellas áreas faciales altamente susceptibles de rosácea, lo que produce un descenso significativo de los falsos positivos en la identificación de lesiones de rosácea31.
Del mismo modo, el procesamiento digital de imágenes ha sido utilizado para la detección automática de lesiones de acné, con la intención de realizar una contabilización más precisa y reproducible. Min et al. desarrollaron un sistema que contabiliza de forma automática 5 subtipos de lesiones (pápulas, nódulos, pústulas, comedones cerrados y comedones abiertos) y los compararon con el recuento manual por un dermatólogo experto. En las lesiones evaluadas en 25 pacientes encontraron una sensibilidad y una especificidad mayor del 70%32. Otros estudios han utilizado la segmentación de lesiones de acné descomponiendo la imagen en un número de regiones homogéneas basadas en la similitud de su color33.
Dado que la gravedad del acné es el principal determinante en la elección de tratamiento, estos métodos de evaluación basados en el procesamiento de imágenes podrían ayudar a tomar una mejor decisión terapéutica. Así mismo, su desarrollo podría suponer un potencial marcado ahorro de tiempo para el clínico.
En 2019 Seité et al. desarrollaron una aplicación de smartphone basada en IA que gradúa y clasifica los tipos de lesiones de acné (comedoniano, inflamatorio, hiperpigmentación posinflamatoria, etc.). Aparte de las ventajas en cuanto a la evaluación de las lesiones, se postula que el uso de estas aplicaciones vinculado a geolocalización también podría ayudar a evaluar el impacto de factores externos en el desencadenamiento, la duración y la gravedad del acné, como las condiciones climáticas y la polución34.
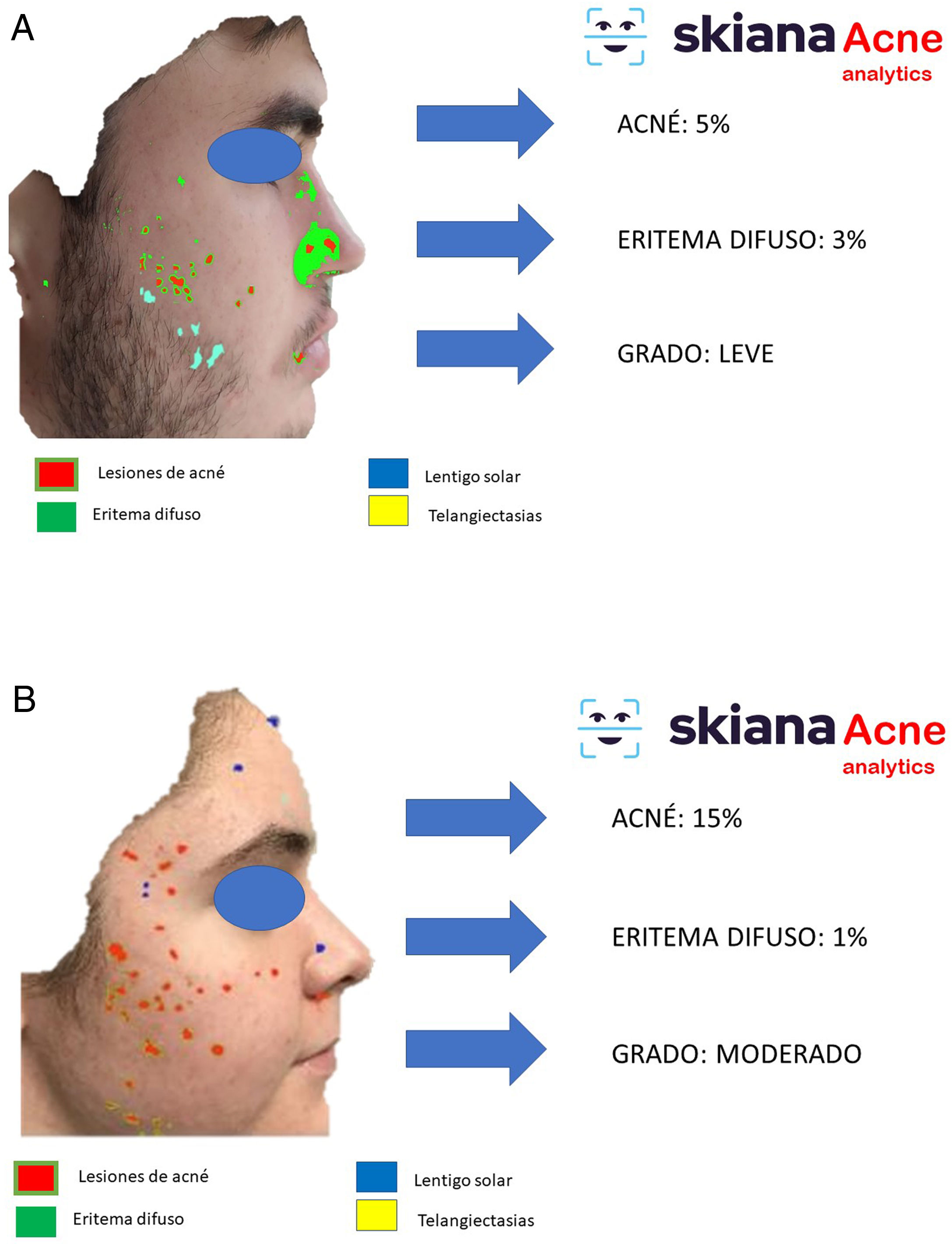
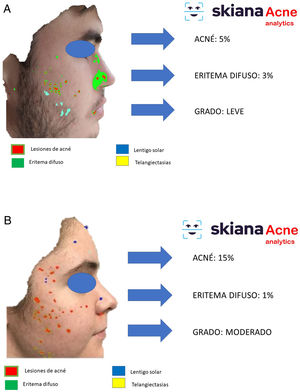
En 2020 Martorell et al. desarrollaron un modelo de IA de detección de lesiones de acné en el área facial dentro de la aplicación de smartphone SkianaCare®, que permite definir su gravedad, así como el punto de corte a partir del cual el tratamiento sistémico debería complementar al tratamiento médico por el grado (GEA) de acné (figs. 6A y B). Así, sobre una serie de 101 pacientes se detectó una precisión del 97,8% en la capacidad de definición de grado de gravedad. A su vez, la correlación clínica y de imagen estableció la necesidad de incorporar tratamiento sistémico, principalmente en forma de retinoide oral, a partir del GEA 3 en la región facial35.
Otras enfermedades inflamatoriasOtros programas de IA se han diseñado para el diagnóstico de diferentes enfermedades dermatológicas inflamatorias, como el liquen plano, la pitiriasis liquenoide o la dermatomiositis a partir de imágenes digitales36–39. Huang et al. desarrollaron un clasificador de múltiples enfermedades (basándose en la evaluación de 34 atributos como eritema, descamación, bordes definidos o irregulares, etc.) capaz de diferenciar varias enfermedades cutáneas como la psoriasis, el liquen plano o la dermatitis seborreica39.
Para el estudio de la dermatomiositis, además de la evaluación de imágenes de la piel, se han empleado imágenes de ultrasonido del músculo para diferenciar entre músculo normal, dermatomiositis, polimiositis y miositis por cuerpos de inclusión38.
Aplicación de la inteligencia artificial en oncología cutáneaEn el ámbito del cáncer cutáneo cabe mencionar algunas de las publicaciones que abordaban el potencial de los —entonces— nuevos sistemas informáticos.
En la primera indexada, de 1986, se hablaba de cómo los ordenadores podían automatizar el diagnóstico de tumores faciales y la emisión de recomendaciones40. Otra de 1992 subrayaba la utilidad del análisis de imagen computarizado para dar apoyo diagnóstico a profesionales con menos experiencia en el ámbito del melanoma41.
Desde entonces, y de forma más clara en la última década, ha habido un crecimiento exponencial de las publicaciones sobre IA en la asistencia a pacientes con cáncer cutáneo. En este período podrían definirse 2 etapas que, si bien no están perfectamente delimitadas, permiten aproximarse al desarrollo de la aplicación de la IA en el cáncer cutáneo.
Una primera etapa, en la que se recibe la herencia de los años anteriores, se asienta el desarrollo teórico y se realizan múltiples intentos prácticos progresivos. En esta se podría afirmar que se terminaban de poner a punto los sistemas basados en el uso de IA.
Durante ella se publicó la fiabilidad y factibilidad del uso de macrofotografías digitales convencionales para que un sistema informático distinguiera entre lesiones melanocíticas y no melanocíticas42. También se observó que la combinación de información clínica y de imagen ayudaba al diagnóstico del carcinoma basocelular43. Otras muchas publicaciones de índole similar subrayaron que a través de la combinación de diferentes fuentes de información (historia clínica exhaustiva, imágenes obtenidas a través de sistemas diversos…) se alcanza una mayor precisión en el diagnóstico automatizado. Incluso se pudo ver cómo era posible usar la IA en el control de márgenes quirúrgicos de biopsias intraoperatorias44.
Podrían también incluirse en esta etapa los modelos pronósticos automatizados. Por ejemplo, los algoritmos computacionales que permiten predecir la progresión metastásica del melanoma cutáneo basados en los datos de expresión genética y microRNA45.
Una segunda etapa, más reciente, ha significado la puesta en práctica de sistemas de IA en las consultas (y fuera de ellas) con diferentes funciones.
Una de las publicaciones con mayor difusión, de 2017, proponía la utilización de algoritmos de DL para la clasificación de lesiones tumorales. En concreto, compararon el grado de concordancia diagnóstica entre el sistema automatizado y un grupo de médicos especialistas en dermatología a la hora de distinguir queratosis seborreicas de carcinomas queratinocíticos y nevos benignos de melanoma, con resultados prometedores para su uso en el apoyo al diagnóstico. Estos algoritmos podrían conformar una herramienta que maximizaría el alcance de los dermatólogos fuera de la consulta46.
Se ha propuesto el uso de algoritmos de análisis de imagen automatizados para apoyar las decisiones terapéuticas (extirpación versus observación) en el manejo de lesiones pigmentadas47, o para dar una primera orientación al dermatólogo que posteriormente tomaría la última decisión en función del contexto clínico48. Es particularmente interesante el uso que se ha dado a las imágenes obtenidas a través de aplicaciones móviles de descarga gratuita, a partir de los cuales algunos autores han propuesto algoritmos para detectar cambios en lesiones pigmentadas que podrían predecir una progresión a melanoma49.
Con especial interés en las lesiones pigmentadas y melanoma, uno de los grupos de investigación más prolíficos ha sido el liderado por dermatólogos de Heidelberg. En sus investigaciones emplean sistemas basados en su mayoría en CNN. Los primeros artículos, de Haenssle, obtuvieron resultados preliminares superiores a especialistas en dermatología a la hora de reconocer melanoma mediante dermatoscopia en condiciones experimentales8. Por otro lado, el grupo liderado por Brinker ha seguido poniendo de manifiesto un rendimiento excelente de los sistemas basados en CNN para diferenciar melanomas de nevos melanocíticos dermatoscópicamente50,51, combinando fotos clínicas y dermatoscópicas52, o con imágenes histopatológicas53. En condiciones de uso más aproximadas a la realidad, e incluyendo en el diagnóstico lesiones tumorales de diferente índole (no solo melanoma), han llegado a obtener resultados cercanos a los de los dermatólogos54.
Otros grupos han mostrado buenos resultados en identificar, a partir de imágenes dermatoscópicas, melanomas mediante sistemas de DL55 o melanomas acrales mediante sistemas de CNN56.
Estos sistemas y aproximaciones se pueden aprovechar en la explotación de datos para generar modelos predictivos de la respuesta a inmunoterapia en casos de melanoma metastásico57. Incluso se están empleando análisis de expresión génica y microRNA con algoritmos de ML para la distinción molecular entre nevos melanocíticos y melanoma58.
Respecto al cáncer cutáneo no melanoma, parece que la utilidad de los sistemas basados en IA presenta un grado de evidencia menos robusto59. En cualquier caso, se han empleado con éxito sistemas de CNN en la detección automatizada a partir de fotografías clínicas de cánceres queratinocíticos faciales60 y queratosis actínicas61.
Inteligencia artificial en dermatopatologíaEl diagnóstico histológico de las lesiones cutáneas está sujeto a un importante componente de subjetividad dependiente del observador. En concreto, lesiones inflamatorias poco específicas, tumores cutáneos pobremente diferenciados, o enfermedades en las que se considera un espectro de alteraciones que incluyen desde lesiones benignas hasta malignas, incluyendo casos borderline o de características límite generan importantes dudas diagnósticas, con divergencia de opiniones incluso entre dermatopatólogos expertos. Quizás uno de los mejores ejemplos sea el diagnóstico histológico de las lesiones melanocíticas: la diferencia entre un nevus displásico y un melanoma in situ es sutil, y no es infrecuente que dermatopatólogos experimentados consideren diagnósticos diferentes ante una misma lesión2–4.
En dermatopatología el uso de la IA como herramienta diagnóstica comenzó a finales del siglo pasado, con el proyecto TEGUMENT62 (fig. 4). Sin embargo, ha sido más recientemente cuando varios trabajos han comenzado a avalar (de manera aún muy preliminar) su potencial uso práctico como apoyo para el diagnóstico histológico.
La IA ha demostrado una alta precisión en la realización de varias funciones esenciales de diagnóstico histológico, como el recuento de mitosis y la evaluación de positividad en pruebas inmunohistoquímicas63. Por otro lado, los algoritmos de aprendizaje profundo demostraron una precisión de casi el 100% en pruebas de clasificación binaria para lesiones cutáneas tumorales, y de casi el 80% para la clasificación de las mismas en 4 categorías (basaloide, escamoso, melanocítico y otros)63.
Respecto al diagnóstico diferencial entre nevus y melanoma las CNN han sido evaluadas por distintos estudios63,64. En 2019 Hekler et al. demostraron una discordancia global de un 19% entre una CNN y un dermatopatólogo experto, siendo este un porcentaje similar al existente entre dermatopatólogos expertos62. También en 2019 Hart et al. demostraron una precisión de en torno al 90% para la clasificación binaria entre nevus de Spitz y nevus convencional65. Más recientemente, en 2021, las CNN demostraron una sensibilidad, especificidad y precisión cercanas a las de 18 dermatopatólogos expertos en la evaluación de 50 lesiones melanocíticas, discriminando entre nevus y melanomas64.
Una de las principales limitaciones en el uso de las CNN en dermatopatología es su reducido sistema de clasificación: mientras que los dermatopatólogos entrenados son capaces de reconocer múltiples variantes morfológicas y realizar amplios diagnósticos diferenciales, los modelos de CNN actuales utilizan principalmente sistemas de clasificación binarios (indican si una imagen es positiva o no para un diagnóstico) y pierden precisión al introducir más categorías66. De hecho, apenas hay estudios en dermatopatología de lesiones no tumorales, donde el diagnóstico diferencial es, en muchas ocasiones, más amplio y subjetivo. Por otro lado, debido a que la verdad fundamental de la fase de aprendizaje de estos sistemas es establecida por uno o varios dermatopatólogos, y puesto que muchas entidades carecen de criterios diagnósticos que sean absolutamente precisos, esta verdad basal o fundamental no está completamente exenta de subjetividad4.
Por ello, y a pesar de estos resultados preliminares prometedores, es necesaria la ampliación (más allá de sistemas binarios) y la validación de los sistemas de inteligencia artificial antes de que pueda generalizarse su uso en dermatopatología práctica.
Probablemente, estos sistemas podrán ser utilizados en el futuro para la automatización de tareas reproducibles, y como técnica de cribado, convirtiéndose en una ayuda diagnóstica para mejorar no solo el trabajo diario del dermatopatólogo, sino también en una herramienta importante en investigación e incluso divulgación educativa.
Inteligencia artificial aplicada a la cosméticaEl campo de la dermatología cosmética ha sido uno de los sectores en los que se han desarrollado múltiples modelos basados en soluciones innovadoras. Actualmente existen en el mercado desde modelos de planificación virtual para tratamientos cosméticos con neuromoduladores y el tratamiento con rellenos cosméticos, así como el uso de robótica en la automatización de diferentes tratamientos con láser67.
Asistentes de uso domiciliarioLa aplicación de las nuevas tecnologías ha generado múltiples estrategias cuyo objetivo final es empoderar a los pacientes mediante información y generación de contenidos personalizados, a fin de facilitar las decisiones en cuanto al cuidado de la piel y del cabello.
Muchas empresas han creado cuestionarios inteligentes sobre el cuidado de la piel y el cabello que incluyen preguntas sobre la demografía del paciente, las características de la piel y el cabello y resultados estéticos deseados para generar recomendaciones personalizadas.
En esta línea, la startup de nombre PROVEN Beauty®, con sede en California, ha utilizado el ML para ofrecer a los consumidores productos cosméticos personalizados para el cuidado de la piel. Este algoritmo utiliza información de una gran base de datos de cuidado de la piel, llamado Beauty Genome Project, que incluye más de 8 millones de opiniones de clientes, más de 100.000 productos para el cuidado de la piel actualmente en el mercado, 20.000 ingredientes y más de 4.000 artículos científicos revisados por pares sobre la piel y los ingredientes para el cuidado de la piel68.
La realidad aumentada es otra tecnología que permite una personalización de las rutinas de cuidado de la piel y del cabello. En estos casos se va un paso más allá de los modelos basados en cuestionario al incorporar imágenes del paciente en el proceso de toma de decisiones. En este sentido, la empresa L’Oreal® oferta 2 aplicaciones web de realidad aumentada en línea que son gratuitas para todos los usuarios. La primera aplicación ofrece análisis de piel en línea a través del sitio web de Vichy® Skin Consult AI®, una aplicación que genera simulación de cuidado de la piel y antienvejecimiento con capacidad para detectar, cuantificar y predecir cambios en la piel69. Este «espejo virtual» aplica tecnología de visión por ordenador para simular los resultados que se pueden obtener a través del uso de productos de belleza y cosméticos. Este proyecto fue desarrollado con el apoyo de dermatólogos a fin de evaluar afecciones de la piel como discromía, sequedad y arrugas. Tras subir una imagen, el sistema genera información al consumidor acerca de la calidad de su piel, sus aspectos a mejorar y recomendaciones sobre el régimen de productos personalizado. Los aspectos analizados incluyen las líneas infraorbitarias, elasticidad, líneas finas generalizadas y arrugas profundas, falta de luminosidad, hiperpigmentación y poros. Sin embargo, las principales limitaciones del sistema incluyen: 1) el sesgo de recomendación basado en un conjunto limitado de productos; 2) la pérdida de información en el análisis de imagen por la ausencia de análisis de imágenes laterales; 3) la falta de posibilidad de autoseguimiento; y 4) la falta de información generada por el usuario impide generar recomendaciones personalizadas no solo basadas en el aspecto físico del usuario.
En la misma línea, la aplicación gratuita para smartphones de nombre Skin360®, de Neutrogena®, utiliza la cámara del teléfono inteligente del usuario para evaluar la piel en busca de manchas oscuras, ojeras, arrugas, cambios de textura y líneas de expresión. Esta evaluación proporciona una «puntuación Skin360» y ofrece al usuario sugerencias para productos para el cuidado de la piel basados en los 5 parámetros referidos. El paciente también tiene la capacidad de realizar un seguimiento de la mejora con los productos recomendados durante días, semanas y meses con evaluaciones cutáneas de seguimiento a través de la aplicación. Además de dicha puntuación, la aplicación también rastrea los hábitos de estilo de vida del paciente que pueden influir en la salud de la piel (sueño, ejercicio, estrés y registro diario de su uso del producto)70.
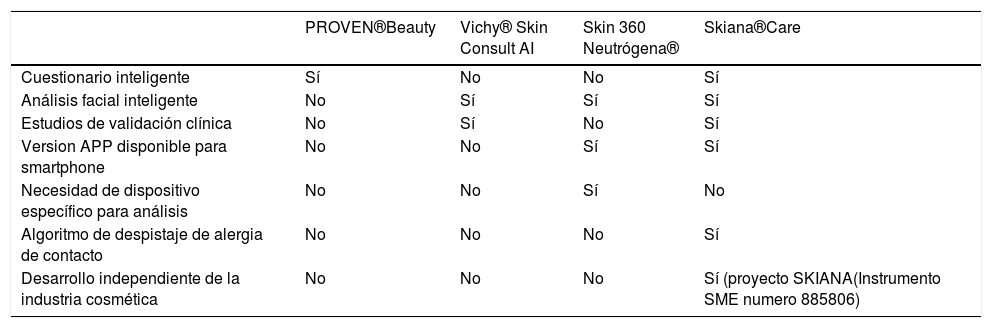
En la misma línea de las anteriores, pero bajo el liderazgo de médicos expertos en dermatología, y siguiendo como objetivos el potenciar el autocuidado de la piel del paciente a través del refuerzo cosmético y el reducir el exceso de productos desechados por parte del usuario por la dificultad en la selección del producto afín a la piel de cada sujeto, en el año 2020 Martorell et al. desarrollan la primera aplicación independiente de la industria cosmética, bajo el soporte la Comisión Europea dentro del proyecto de Salud y AI Skiana® (Ayudas Europeas SME I 2020, Grant n.°885806) tabla 1.
Subtipos de inteligencia artificial (IA)
| Tipo de IA | Definición | Aplicación | Ejemplos |
|---|---|---|---|
| Estrecha o débil | Metodología de aprendizaje que se focaliza en una tarea única | La mayor parte de los algoritmos de IA de salud se desarrollar con IA estrecha | Modelos automatizados de diagnóstico de neumonía en radiografía de tórax |
| General | Modelo que equipara la función de IA a las capacidades humanas | Actualmente enfocada a la gestión de la incertidumbre | Modelos predictivos en salud |
| Super IA | Campo futurible en el que la IA superaría la capacidad humana en todos los campos | Se trata de la IA mostrada en muchas superproducciones como la verdadera IA, que no es más que ciencia ficción en la sociedad actual | Films orientados a la IA: Terminator, Yo Robot, etc. |
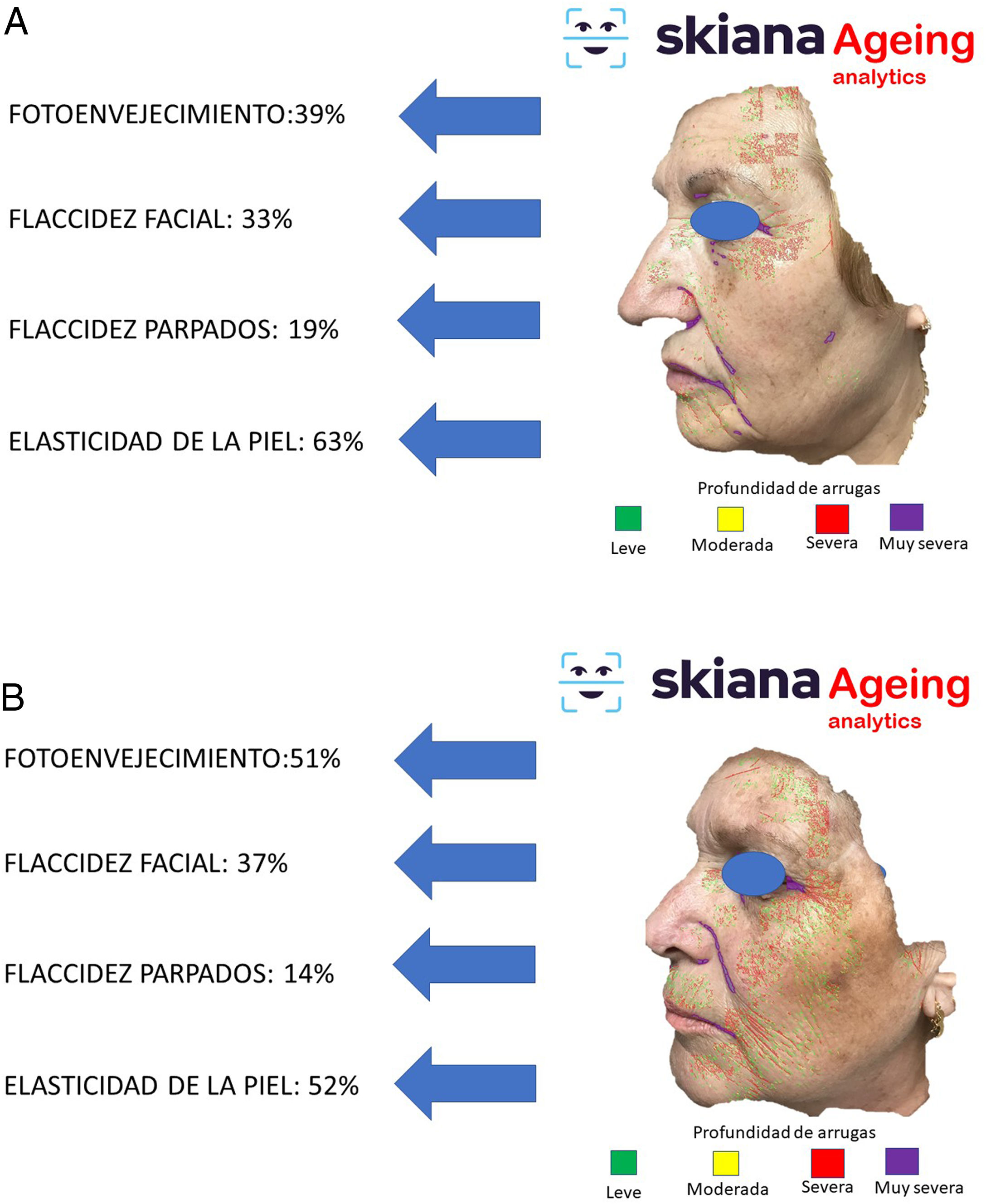
Este asistente virtual personal, el primero de su generación libre de conflictos de cualquier empresa farmacéutica y cosmética, desarrollado en la nube y disponible en las tiendas de aplicaciones de Android® y Apple® bajo el nombre de Skiana®Care busca, mediante la combinación de un breve cuestionario inteligente y de información, obtenida a partir del análisis facial, generada a partir de algoritmos propios de IA, generar salud a través de la piel. Sus principales misiones incluyen: 1) generación de campañas de prevención de cáncer de piel y educación en salud, a través de consejos dermosaludables; 2) captación del usuario final a través de la generación de informes objetivos disponibles en sus dispositivos móviles que incluyen información del estado de salud de la piel. Estos datos incluyen desde la cuantificación de fotoenvejecimiento, flacidez, elasticidad, a cambios de la textura de la piel como la cuantificación de lesiones de acné (figs. 6 y 7); 3) generación del paciente experto en el cuidado de la piel, a partir de información personalizada del estado de su piel y de la formación en cosmética, incluyendo información de productos cosméticos, a fin de ayudarle a un mejor cuidado; y 4) posicionamiento de la especialidad de dermatología y venereología como la referencia en el campo del cuidado integral de la la piel35.
Las principales ventajas e inconvenientes de los diferentes asistentes virtuales se resumen en la tabla 2.
Principales diferencias existentes entre los asistentes virtuales cosméticos presentes actualmente
| PROVEN®Beauty | Vichy® Skin Consult AI | Skin 360 Neutrógena® | Skiana®Care | |
|---|---|---|---|---|
| Cuestionario inteligente | Sí | No | No | Sí |
| Análisis facial inteligente | No | Sí | Sí | Sí |
| Estudios de validación clínica | No | Sí | No | Sí |
| Version APP disponible para smartphone | No | No | Sí | Sí |
| Necesidad de dispositivo específico para análisis | No | No | Sí | No |
| Algoritmo de despistaje de alergia de contacto | No | No | No | Sí |
| Desarrollo independiente de la industria cosmética | No | No | No | Sí (proyecto SKIANA(Instrumento SME numero 885806) |
La aplicación de estas tecnologías al ámbito de la robótica, con el desarrollo de dispositivos capaces de desarrollar productos cosméticos personalizados en casa a partir de la información obtenida por los softwares anteriores, será el siguiente paso en cosmética, con empresas como Procter & Gamble® (dispositivo Opté Precision Skincare System®)71 y L’Oréal® (dispositivo Perso®)72, pioneras en desarrollo de este tipo de aparatos caseros.
De igual modo, el uso de estos algoritmos en soportes profesionales que permiten tomas de imagen con diferentes parámetros de luz, como Visia® (Canfield® Inc.) o Lifeviz®micro (Quantificare® Inc.), ayudarán al profesional de la cosmética a mejorar el cuidado de sus pacientes en las consultas73.
Modelos predictivos de respuesta por inteligencia artificialLa aplicación del modelo de DL y de generación de redes neuronales permiten mejorar la efectividad y seguridad en la realización de procedimientos cosméticos.
Ejemplos en este sentido incluyen la aplicación de DL para definir la mejor opción de tratamiento cosmético según la profundidad de arrugas faciales74–76. También se ha evaluado la oportunidad del DL en predecir la respuesta clínica a terapias con láser. En esta línea, Cazzaniga et al. aplicaron esta tecnología en la predicción de la duración de tratamiento de láser de excímeros para pacientes con vitíligo, con resultados prometedores77. Así, con datos de su ensayo clínico, su modelo logró una precisión general del 66,46% en predecir el tiempo de repigmentación en los respondedores. Dado que el tratamiento puede ser lento y costoso, un modelo predictivo para la respuesta clínica y la duración del tratamiento ayudaría tanto a los pacientes como a los proveedores en la decisión de seguir un tratamiento. Los modelos de resultado clínico también podrían aplicarse a otras luces y modalidades láser para el tratamiento de afecciones como cicatrices del acné, discromía o trastornos vasculares para ayudar a establecer unas expectativas reales al paciente interesado.
Inteligencia artificial en radiología y ecografía cutáneaDentro de las técnicas de imagen radiológica tanto la TC como la radiografía simple y la RM son utilizadas fundamentalmente en el contexto de la estadificación o el seguimiento de melanoma. La ventaja que tienen estas técnicas es que son fácilmente estandarizables, y la existencia de grandes bases de datos de imágenes que permiten el entrenamiento de los algoritmos.
Las técnicas basadas en radiaciones ionizantes, como la TC en el paciente dermatológico, se han utilizado en la detección de metástasis de melanoma. En el estudio de Aissa et al.78, a través de técnicas de ML y sustracción vascular, los algoritmos encontraron metástasis adicionales en un 54,3% de los casos. Sin embargo, como los autores concluyen, el diagnóstico de metástasis adicionales no hubiera afectado el manejo del paciente.
En relación con la RM se ha usado la IA para la detección y diagnóstico de las lesiones; Kniepp et al.79 revisaron 189 metástasis cerebrales, incluyendo de melanoma, y mediante algoritmos de árboles de decisión combinados con datos clínicos demostraron una capacidad de diferenciar las metástasis de otros tumores (carcinoma epidermoide, carcinoma microcítico de pulmón) superior a los radiólogos, con un área por debajo de la curva de 0,82. Este uso de la imagen radiológica para inferir el diagnóstico histológico de las lesiones es lo que se ha venido a denominar radiómica, y va un paso más allá de la detección de imágenes o su segmentación.
La ecografía cutánea es una técnica que ofrece ventajas sobre otras técnicas de imagen al ser inocua, rápida y disponible a pie de cama del paciente79. Sin embargo, la ecografía, considerada como fuente de datos para la IA, presenta varias limitaciones, fundamentalmente la ausencia de grandes bancos de imágenes ecográficos utilizables para el entrenamiento de los algoritmos y su validación y las características intrínsecas de las ecografías que no suelen estar tan estandarizadas como en el caso de la TC o la RM.
A pesar de ello, en los últimos años el desarrollo de la IA en la ecografía ha empezado a aportar evidencias respecto a cómo aplicarla en los 3 grandes problemas de la ecografía, y en concreto de la ecografía cutánea: la clasificación, la regresión y la segmentación80.
ClasificaciónLa mayoría de los algoritmos de clasificación se han aplicado al diagnóstico ecográfico de lesiones en mama o lesiones hepáticas81,82. Aunque hay un gran número de publicaciones que intentan reducir los rasgos clave para el diagnóstico asistido por IA83, el número de imágenes suele ser inferior a 300, y realizadas en un centro y con una base diferente de validación en cada estudio, por lo que los resultados no suelen ser comparables84.
Desde el punto de vista comercial algunos algoritmos desarrollados para el diagnóstico asistido se han desarrollado fundamentalmente en ecografía mamaria y tiroidea85-87. El algoritmo sugiere un «riesgo» de malignidad de la lesión seleccionada por el ecografista, pero no indica diagnóstico concreto de la lesión estudiada. No obstante, estos algoritmos no han sido validados por ninguna agencia regulatoria.
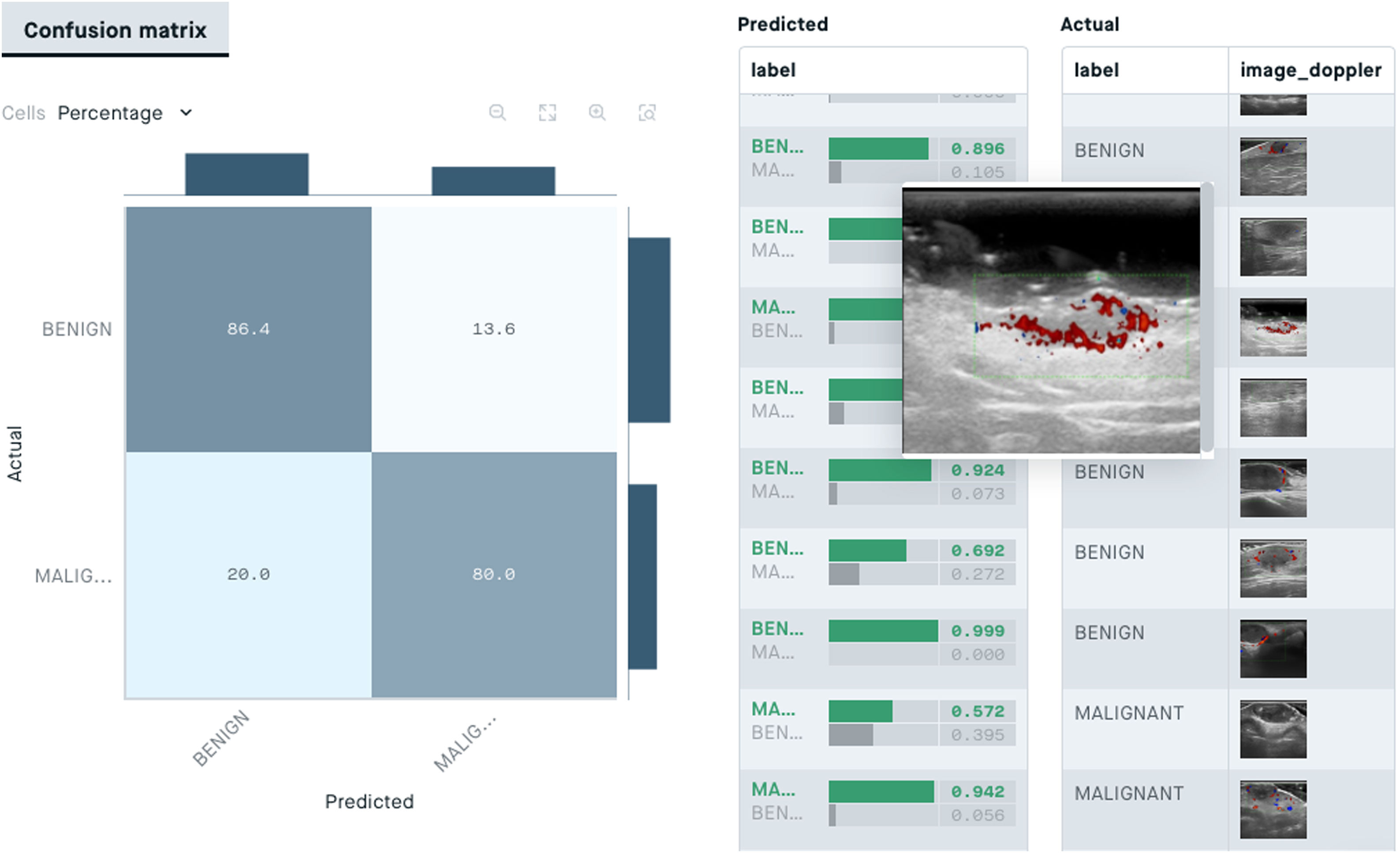
Desde el punto de vista de la ecografía cutánea los algoritmos de clasificación podrían ser útiles en el diagnóstico asistido por IA de lesiones cutáneas. En un estudio reciente de Alfageme et al. un algoritmo con arquitectura predeterminada basada en DL, entrenada con un banco de 235 imágenes ecográficas de lesiones cutáneas benignas y malignas, fue capaz de clasificar correctamente las lesiones de forma similar a un evaluador experto humano (77,1% versus 74,1%) al que se le mostró el mismo banco de imágenes88.
Respecto a las lesiones melanocíticas y con equipos de muy alta frecuencia, el grupo de Romanelli et al. ha publicado también con sondas de 70MHz y aplicando algoritmos basados en DL la capacidad de diferenciar nevus melanocíticos de melanoma con una exactitud del 76,9%, con una sensibilidad y especificidad para el diagnóstico de melanoma del 80% y el 74% respectivamente89.
Queda por determinar en ecografía cutánea cuáles son las características óptimas de los bancos de imagen apropiados para esta aplicación en cuanto a equipos, resolución y su similitud con las lesiones inflamatorias, que pueden dificultar la aplicabilidad de estos algoritmos en entornos clínicos.
RegresiónLa regresión implica la estimación de valores continuos en lugar de clases discretas de datos. El aprendizaje profundo se ha aplicado a la regresión, por ejemplo, para estimar la orientación de las fibras musculares a partir de imágenes ecográficas o la edad gestacional90,91. Respecto a la ecografía cutánea los algoritmos de regresión podrían ser útiles para evaluar el tiempo de evolución de las lesiones cutáneas, la determinación automática del Breslow ecográfico o en algoritmos aplicados al estudio del envejecimiento cutáneo y su tratamiento92.
SegmentaciónLa segmentación es la delimitación de los límites estructurales ecográficos de una lesión. La segmentación automatizada en ecografía es un reto, ya que las imágenes ecográficas a menudo se ven afectadas por el centelleo, las sombras y la falta de límites, así como por las compensaciones entre la frecuencia, la profundidad y la resolución de los ultrasonidos durante la adquisición de la imagen93.
Se han desarrollado variados enfoques de segmentación en ecografía incluyendo métodos basados en el umbral de intensidad, conjuntos de niveles y contornos activos94. Los enfoques basados en la intensidad son sensibles al ruido y a la calidad de la imagen95. Los contornos activos y los conjuntos de niveles requieren una inicialización que puede afectar a los resultados. La mayoría de los enfoques convencionales no están totalmente automatizados.
Los métodos de segmentación basados en ML suelen implicar 2 pasos: primero, una clasificación por píxeles de la estructura deseada, seguida de un paso de limpieza o suavizado, ya que la clasificación por píxeles es «ruidosa» desde el punto de vista ecográfico. En artículos recientes varios enfoques de clasificación han investigado con enfoques propios y la aplicación de varios tipos de redes neuronales, incluyendo el DL96.
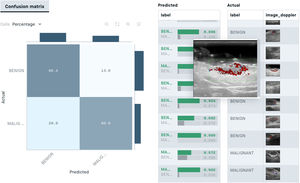
En ecografía cutánea los algoritmos de segmentación podrían ser útiles en la detección de metástasis ganglionares o para la delimitación ecográfica de lesiones cutáneas (fig. 8).
Aspectos éticos y regulatorios de la inteligencia artificial en dermatologíaQuizás no somos del todo conscientes, pero nos hallamos ante una situación realmente singular, ya que nunca en la historia de la humanidad se ha podido recopilar tal volumen de información.
El Internet de las cosas y el big data contribuyen a alimentar los algoritmos de IA y ML. Cuanto más complejos sean, mayor será su capacidad predictiva, de ahí que todos los esfuerzos se centren en correlacionar infinidad de variables para acertar las previsiones. El objetivo inconfesable es el de lograr el «demonio de Laplace», una máquina que sea capaz de predecir cualquier escenario de una forma absolutamente determinista97. Por todo ello la IA se está comenzando a estudiar también dentro de la bioética.
En este sentido hay que destacar que el Parlamento Europeo, al proponer una Carta sobre robótica, comenzó enumerando los principios de la bioética como reglas a seguir para los ingenieros en robótica, y la recopilación de las reglas éticas que deben regir la IA se ha denominado «Principios de Asilomar para la inteligencia artificial»98.
En cualquier caso, el marco ético de las aplicaciones de IA en la práctica dermatológica siempre debe reflejar los principios básicos de la ética médica: autonomía, beneficencia, no maleficencia y justicia. Pero en el caso concreto de la IA este marco ético además debería incluir apartados específicos, como el de transparencia y responsabilidad99.
El principio de autonomía se refiere a que el paciente tiene el derecho a tomar sus propias decisiones. En la asistencia médica el consentimiento informado es lo que se utiliza para asegurar el principio de autonomía, pero las imágenes dermatológicas no solo contienen información en forma de píxeles, sino también información sobre la salud (al menos cuando la imagen está vinculada a la historia clínica del paciente), como los datos demográficos o información institucional. Cuando esas imágenes se utilizan para entrenar algoritmos de IA, los consentimientos informados deberían ser adaptados para este propósito, de modo que permitan ese uso continuado.
Los principios de beneficencia y no maleficencia van de la mano y son muy obvios en la asistencia médica convencional, pero pueden existir ciertas contradicciones en el caso de la IA, ya que los algoritmos se pueden beneficiar de la estratificación por múltiples parámetros, mejorando la fiabilidad diagnóstica y, por tanto, mejorando el bienestar del paciente, pero al mismo tiempo esa segmentación se podría utilizar con fines comerciales.
El principio de justicia requiere una distribución justa de los bienes y servicios médicos. El desarrollo de IA debería promover la justicia, eliminando ciertas discriminaciones y previniendo ciertos sesgos implícitos, como se comentará más adelante.
Finalmente, los principios de transparencia y responsabilidad pueden ser traídos por el principio de explicabilidad. Si un sistema de IA falla o provoca un daño deberíamos ser capaces de determinar las razones subyacentes y todo el proceso debería ser auditable. Seguramente esto último es la principal limitación ética de la IA, ya que estos sistemas se consideran una especie de «caja negra» en la que quizá se puedan llegar a comprender los procesos lógicos y matemáticos en los que se basa el algoritmo, pero nos las transformaciones posteriores de todos esos datos, de manera que el resultado es, en realidad, impredecible100.
Y todo ello enlaza con el debate de la responsabilidad, cuando los sistemas de IA desencadenen de manera autónoma decisiones diagnósticas o terapéuticas nos podemos preguntar quién será el responsable si el sistema falla101. La pregunta es extrapolable a otros ámbitos y esta discusión se puso de manifiesto en marzo de 2018 con el primer accidente de un coche autónomo con desenlace fatal en Temple (Arizona, EE. UU.). ¿La culpa fue de quien iba dentro del coche? ¿Del fabricante del vehículo? ¿O del desarrollador del software? La respuesta no es sencilla y por todo ello es necesario que se desarrollen regulaciones y legislación al respecto para que no exista esa inseguridad jurídica. Cuando la IA se aplica en medicina todo ello cobra aún mayor relevancia102.
Existe otra cuestión importante, y es que los algoritmos pueden perpetuar los sesgos de los humanos debido precisamente a su naturaleza de «caja negra». Cuando el algoritmo es entrenado con datos que contienen sesgos, por no incluir poblaciones infrarrepresentadas, las disparidades existentes se ven replicadas o reforzadas103. Si los datos de capacitación del algoritmo no son lo suficientemente inclusivos y equilibrados, el sistema podría aprender a tomar decisiones injustas (esto es muy evidente en los sistemas de reconocimiento facial, más fiables en varones blancos que en mujeres negras)104.
En dermatología, aunque las aplicaciones de IA son múltiples, en estas fases iniciales se ha puesto el foco en el diagnóstico de las lesiones pigmentadas, sobre todo en el melanoma. La realidad es que, de momento, la mayoría de programas de IA y ML están aprendiendo principalmente con imágenes de fototipos claros. Por ejemplo, en el International Skin Imaging Collaboration: Melanoma Project, uno de los más utilizados, de código abierto y acceso público, la mayor parte de los pacientes corresponden a fototipos bajos de poblaciones estadounidenses, europeas y australianas, lo que hace que el algoritmo sea muy poco fiable ante lesiones en pieles negras. Paradójicamente, los pacientes afroamericanos que padecen melanoma suelen comenzar en fases más avanzadas con peores tasas de supervivencia. En este sentido, el algoritmo solo mejoraría la detección precoz en pieles claras, sin beneficiar a los pacientes de piel negra, empeorando de manera evidente los sesgos que ya se observan en la sociedad104. La solución no es sencilla, pero es simple: debe existir un esfuerzo para entrenar al algoritmo en todos los tipos de piel.
Desde un punto de vista normativo y regulatorio varias organizaciones ya han publicado declaraciones para la puesta en marcha de aplicaciones de IA en el campo de la medicina. Todo esto es especialmente complejo, partiendo de la base de que, a pesar de que la legislación exige la ausencia de ambigüedad, ni siquiera existe a día de hoy una definición clara de lo que significa el término «inteligencia artificial».
El segundo punto crucial para los legisladores es si considerar o no el software de IA utilizado en medicina como un dispositivo médico (no es lo mismo aquellos programas que analizan datos para tener un mayor conocimiento de una enfermedad que los que toman decisiones diagnósticas o terapéuticas en pacientes individuales). En este sentido, podemos diferenciar entre la visión europea y la norteamericana105.
En Europa la norma que rige es la Regulation on medical devices, que se aplica desde mayo de 2020 y que revoca la Directiva 93/42/EEC106. Al tratarse de un reglamento (a diferencia de una directiva), se aplica directamente en el territorio europeo sin necesidad de pasar por la aprobación de los distintos estados miembros. Esta normativa requiere que los fabricantes se aseguren de que los dispositivos que producen cumplan con una serie de requisitos esenciales que dependerán del riesgo potencial de cada uno y que, en ocasiones, precisarán de la acreditación de un organismo independiente.
En Estados Unidos el organismo regulador es la US Food and Drug Administration, desde que a finales de 2016 se le atribuyera jurisdicción sobre el software utilizado en el ámbito sanitario en la 21st Century Cures Act107, con una lectura más restrictiva en lo que se refiere a la introducción de software de diagnóstico no supervisado.
Pero, además, todas estas herramientas que se nutren de una cantidad ingente de datos tienen otras implicaciones relativas a la privacidad y protección de estos datos y a la ciberseguridad. Como consecuencia de estas potenciales amenazas la Unión Europea decidió actualizar esta legislación, y el Reglamento General de Protección de Datos (GDPR) está en vigor desde el 24 de mayo de 2018, sustituyendo la normativa anterior, y obliga a obtener el consentimiento del usuario, quien debe conocer la finalidad de su utilización, prohibiéndose explícitamente el marketing de estos datos por terceras partes108. En Estados Unidos la seguridad relacionada con la información en temas de salud compete al Health Insurance Portability and Accountability Act.
En 2018 la Comisión Europea estableció el High Level Experts Groupon Artificial Intelligence, con el objeto de apoyar la implementación de la estrategia europea de IA, incluyendo la elaboración de recomendaciones para el desarrollo futuro de las normas que regulen los aspectos éticos, legales y sociales de la IA.
En función de los derechos fundamentales y principios éticos, estas guías tienen 7 requerimientos clave que cualquier sistema de IA debería cumplir para ser fiable: 1) no debe ir en detrimento de la autonomía humana; 2) robustez técnica y seguridad; 3) privacidad y gobernanza de datos; 4) transparencia; 5) diversidad, no discriminación y equidad; 6) respeto al medioambiente; y 7) rendición de cuentas109.
La IA va a desempeñar un importante papel en los próximos años en nuestra especialidad, y necesitamos estar regidos por principios éticos, como los principios de beneficencia y respeto hacia nuestros pacientes. Debemos recordar que un dermatólogo no es un simple intérprete de imágenes, y que nuestras funciones también incluyen muchos otros aspectos que no pueden ser llevados a cabo por máquinas.
ConclusionesEstamos viviendo y viviremos toda una revolución de la IA en dermatología, con sistemas de diversa índole y enfoque y con un potencial indudable.
Una revisión bibliográfica reciente afirma que los sistemas de IA basados en redes neuronales (ya sea en sus modalidades profunda o convolucional) tienen una capacidad de reconocimiento superior a la de los dermatólogos110. Aunque es una afirmación que puede discutirse y contextualizarse, sí es cierto que existe un perfeccionamiento técnico progresivo de los sistemas de IA.
Por una parte, los sistemas de análisis automatizado de imagen convencionales han quedado ampliamente superados por los sistemas de redes neuronales usados en esta última década111.
Por otra parte, se está consiguiendo que los sistemas puedan procesar gran cantidad de información adicional para lograr «razonar» de forma análoga a como lo hace un dermatólogo (por ejemplo, comparando con las otras lesiones pigmentadas del paciente para evitar diagnósticos de sospecha falseados ante un contexto de predominio de nevos atípicos)112.
Tras analizar las opiniones de los diferentes autores, creemos que el avance de estas tecnologías se debe hacer de forma progresiva, segura y basada en la generosidad de la comunidad dermatológica, pues para mejorar la fiabilidad de estos sistemas es imprescindible contar con bases de datos de imágenes e información clínica amplias, públicamente accesibles113. Serán un indudable apoyo a otros médicos si no existe acceso al dermatólogo o recursos para acercarlo. No obstante, consideramos que el futuro no pasa por que los sistemas de IA sustituyan al dermatólogo, sino que se conviertan en una oportunidad para mejorar la práctica clínica gracias a las múltiples ventajas que esta nos puede ofrecer.
En definitiva, lo óptimo es que exista una simbiosis IA-dermatólogo para tomar las mejores decisiones para nuestros pacientes, siendo conscientes de que lo ideal es una combinación de la inteligencia humana con la IA114, preservando una fluida relación médico-paciente32. Para ello resulta imprescindible cambiar la tendencia actual, y que el médico especialista en dermatología tome la iniciativa en el desarrollo y en la orientación de los productos de IA enfocados a cubrir las necesidades actualmente no cubiertas en nuestra práctica clínica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
El Dr Antonio Martorell ha recibido honorarios en relación a su participación en advisory boards y en simposios satélite de las siguientes compañias:AbbVie,Amgen, Janssen, UCB, Lilly, Novartis, LEO Pharma, Sandoz y MSD.