Los filtros ultravioleta (UV) se han convertido en compuestos de uso diario para millones de personas. Sin embargo, algunos de ellos no son biodegradables al 100% y las plantas de tratamiento de aguas residuales muchas veces no son capaces de filtrarlos correctamente. Todo ello está llevando a su diseminación ambiental y a la detección de distintos filtros UV en el suelo, las aguas continentales, los océanos y en múltiples organismos (algas, corales, peces, mamíferos, incluso aves terrestres). Además, algunos filtros UV, especialmente la benzofenona-3 y el octocrileno se han mostrado tóxicos en estos organismos. Entre sus efectos tóxicos destacamos el blanqueamiento de los corales y problemas metabólicos, enzimáticos y de capacidad reproductiva en prácticamente cualquier organismo. Existen datos preliminares sobre la posible bioacumulación de estos filtros UV en humanos, al detectarse en muestras de orina y leche materna. Sin embargo, el estudio del impacto medioambiental de los filtros UV presenta muchas limitaciones.
UV filters are used daily by millions of people. Not all of these filters, however, are 100% biodegradable, and many wastewater treatments plants are ill-equipped to filter them properly. As a result, UV filters are increasingly reaching the environment. Various types have been detected in soil, continental water, oceans, and numerous organisms, including algae, corals, fish, mammals, and even land birds. In addition, some filters, benzophenone-3 and octocrylene in particular, are toxic to these organisms. Toxic effects include coral bleaching and interference with metabolic, enzymatic, and reproductive activities in practically all organisms. Preliminary data suggest that UV filters may be bioaccumulating in humans, as they have been detected in urine and breast milk. It should be noted, however, that research into the environmental impact of UV filters holds challenges and limitations.
La radiación ultravioleta (UV) es el factor de riesgo fundamental para el desarrollo de cáncer de piel no melanoma y está implicada también en la patogenia del melanoma1–6. Además, el envejecimiento cutáneo prematuro está asociado a la exposición a radiación UV4.
La fotoprotección es la estrategia preventiva principal para disminuir el riesgo de desarrollar cáncer de piel y lograr un envejecimiento saludable, y dado que el cáncer cutáneo es el cáncer más prevalente en población caucásica, la importancia de la fotoprotección es indiscutible7. En los últimos años se ha generalizado el uso de filtros solares como parte esencial de la fotoprotección, especialmente en las sociedades occidentales8. Según su modo de acción los filtros solares se clasifican en orgánicos, inorgánicos y biológicos9. Los filtros orgánicos son los más utilizados y pueden proteger tanto para los rayos UVA como para los UVB1,10. Las fórmulas fotoprotectoras comercializadas suelen incluir una mezcla de filtros UV orgánicos e inorgánicos con 20 o más componentes, para que el espectro de protección sea suficiente11,12, pero, además, estos filtros se encuentran en otro tipo de productos como perfumes, tintes para el pelo y plásticos.
En los últimos años se han publicado estudios que muestran la gran acumulación de filtros UV en distintos ecosistemas y el efecto tóxico sobre los mismos de varios de ellos. Esto es debido no solo al uso generalizado de cremas solares en determinados entornos como las playas, sino también a que algunos de estos filtros no se eliminan fácilmente con técnicas comunes de las estaciones depuradoras de aguas residuales (EDAR), contaminando así las aguas residuales que desaguan en ríos y mares13–16.
Se han detectado cantidades importantes de filtros UV como la benzofenona 3 (BP-3) y el salicilato de etilhexilo (EHS) en distintas fuentes de agua del mundo y sedimentos (ríos, playas, mares, lagos, etc.)17. Hay estudios que además sugieren que los filtros UV pueden persistir durante mucho tiempo en el agua y en los sedimentos, y que las mareas y corrientes pueden transportarlos a grandes distancias18,19, y como era de esperar, muchos de estos compuestos, como el octocrileno (OC) y la BP-3 también se han encontrado (a veces en concentraciones muy elevadas) en organismos vivos como algas, corales, peces e incluso mamíferos. En este sentido, cada vez disponemos de más evidencia sobre el efecto tóxico de los filtros UV en estos organismos, lo que secundariamente puede derivarse en problemas en la cadena alimenticia20, y por consiguiente en su entorno en general14.
Actualmente, además, debemos tener muy presente los efectos del calentamiento global. Por un lado, la temperatura media del agua está subiendo, causando efectos negativos en muchos ecosistemas, especialmente en los marinos. Por otro, se está produciendo un incremento del número de días soleados en todo el mundo, con lo que es posible que se aumente el uso de los filtros UV, con la consiguiente acumulación y producción de mayor toxicidad en estos ecosistemas20.
En función de todo lo anteriormente expuesto, el objetivo principal de este estudio fue el de revisar de una manera exhaustiva y crítica la evidencia disponible sobre el impacto medioambiental de los filtros UV.
MétodosSe realizó una extensa revisión narrativa de la literatura en distintas bases de datos bibliográficas para analizar la evidencia que existe sobre el impacto de los filtros UV en el medioambiente. Para ello se definieron los siguientes criterios de inclusión: 1) artículos que analizaran filtros UV (independientemente de tipo de filtro y su composición); 2) artículos que reportaran su impacto sobre el medioambiente (flora, fauna, cadena alimentaria, agua, etc.); 3) no se pusieron restricciones a las variables de resultado; y 4) se aceptó cualquier diseño de estudio, a excepción de los artículos de opinión. Se excluyeron los artículos publicados en otro idioma que no fuese inglés o español.
Se revisaron las siguientes bases de datos bibliográficas desde su creación hasta julio de 2021: Pubmed, Dialnet, Google avanzado y Trip. En cada una de ellas se realizaron distintas estrategias de búsqueda, en la que se utilizó lenguaje controlado y libre con palabras clave como photoprotection, environment, future o filters UV.
La selección de los artículos se realizó en 3 fases, y estas se llevaron a cabo por una única revisora. En un primer paso las citas resultantes de las estrategias de búsqueda se cribaron con la lectura del título. Todas aquellas que no cumplían los criterios de inclusión se eliminaron. Con las citas que quedaron se procedió al mismo cribado con los resúmenes. Tras ello, se terminó el proceso de selección con la lectura en detalle de los artículos. Aquellos que cumplieron con los criterios de inclusión se aceptaron definitivamente. Por último, se realizó una búsqueda secundaria de los artículos incluidos mediante la lectura de la bibliografía de todos ellos.
La misma revisora que realizó la selección de artículos recogió los datos de los estudios incluidos. La calidad de los estudios incluidos se evaluó con la escala de Oxford de 201121. Se generaron tablas de evidencia y de resultados.
Se realizó una síntesis cualitativa de los datos recogidos.
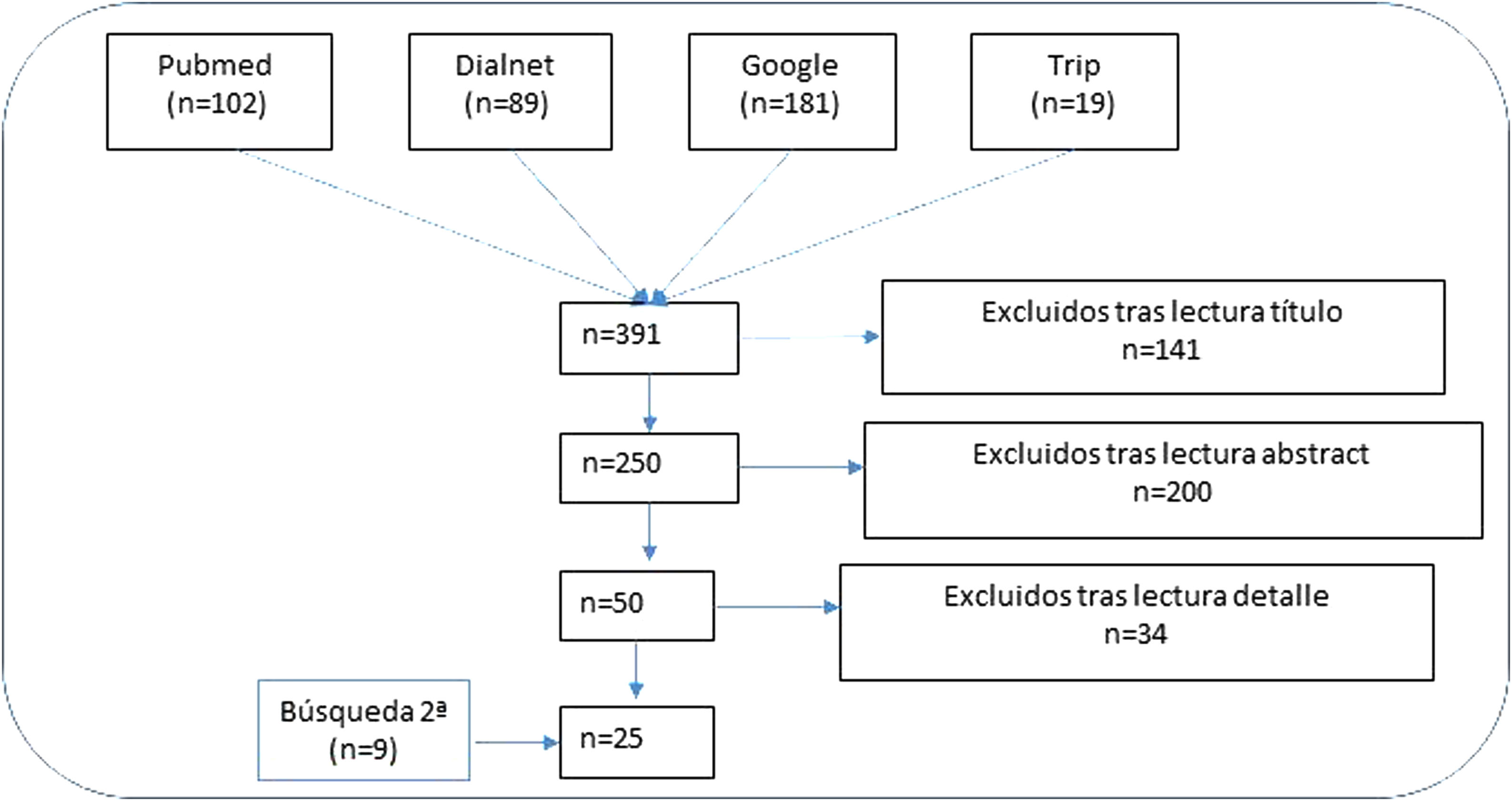
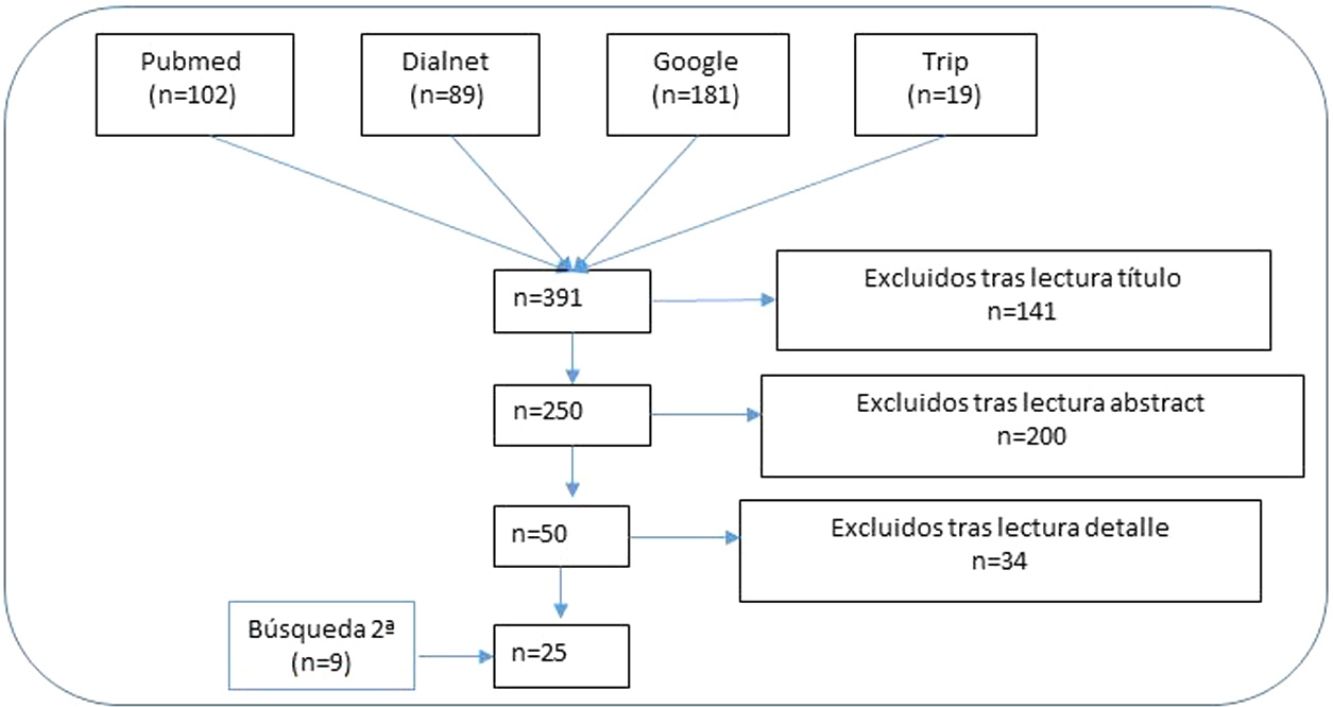
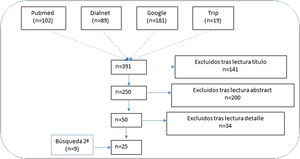
ResultadosRevisión narrativa de la literaturaSe recuperaron 391 artículos con las estrategias de búsqueda en las bases de datos bibliográficas, de los que se eliminaron 141 tras el primer cribado (figura 1). Con la lectura de los resúmenes se eliminaron 200 más. Finalmente, una vez leídos en detalle los artículos resultantes de los 2 procesos de selección anteriores se excluyeron 34 artículos y se incluyeron 25 (9 provenientes de la búsqueda secundaria)11,15,22–44.
A continuación describimos los principales resultados de los estudios de la revisión y de otros datos relacionados encontrados en los mismos.
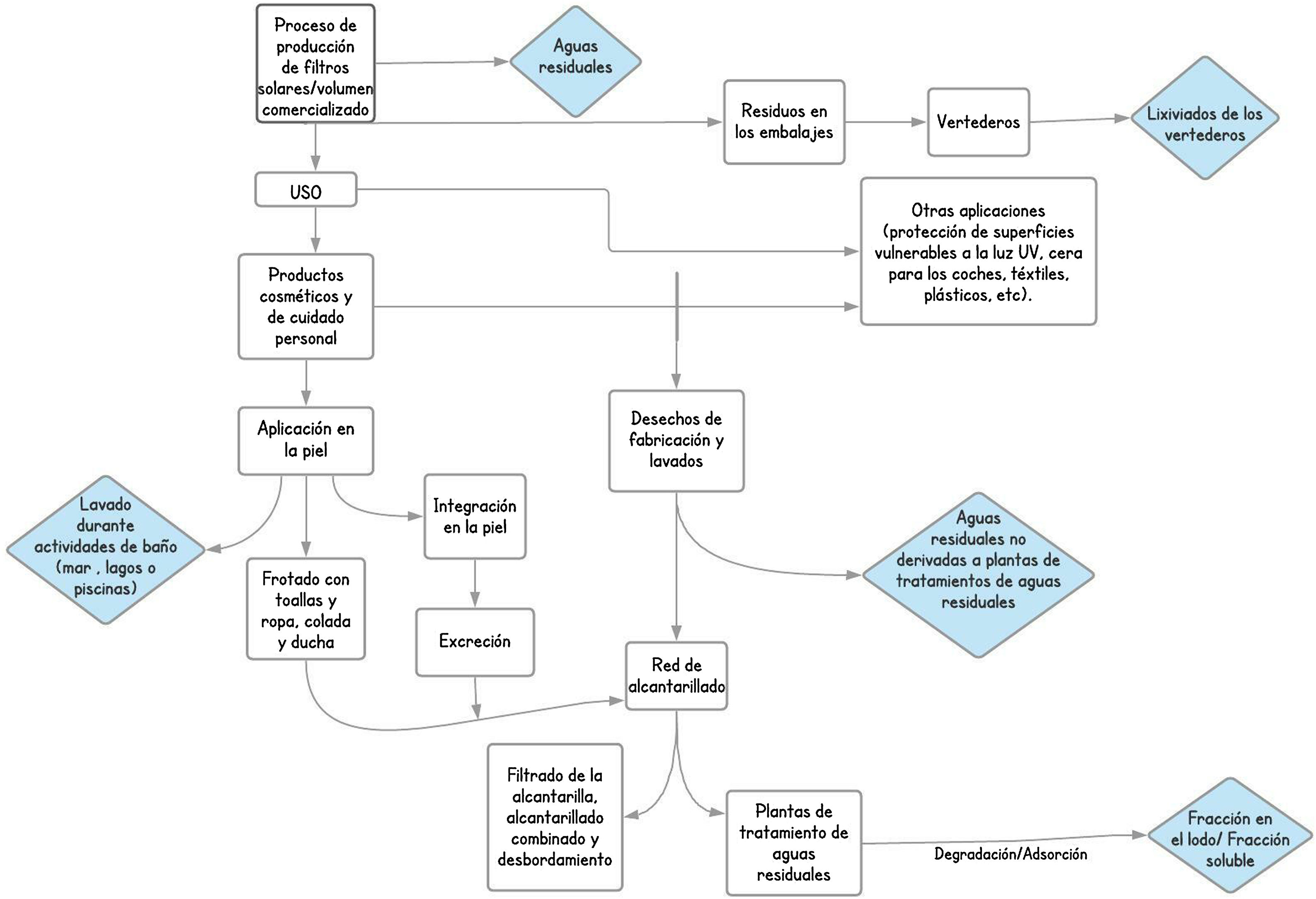
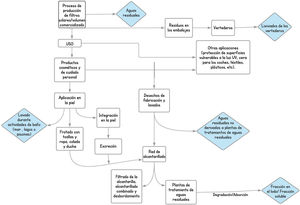
Impacto de los filtros ultravioleta en el medioambienteLas tablas 1 y 2 muestran las características, resultados y conclusiones principales de los 25 estudios analizados en esta revisión11,15,22–44. La figura 2 muestra las principales vías de entrada de los filtros UV en el medio ambiente.
Principales características de los estudios
| Estudio/diseño | Organismo/entorno | Especie/s | Entorno | Filtros UV | Tiempo exposición | Variables | Calidad |
|---|---|---|---|---|---|---|---|
| Araújo et al.22, in vitro | Lenguado (larva) | Solea senegalensis | Portugal | 4-MBC | 96horas | MortalidadCrecimientoDeformidadesAlteraciones en el comportamiento y biomarcadores | Oxford 4 |
| Christen et al.43, in vitro | Carpita cabezona | Pimephales promelas | Osage Catfisheries Inc. (Osage Beach, EE. UU.) | EHMC | 14 días | Metabolismo sexual (trascripción hormonal, características sexuales secundarias, histología gonadal) | Oxford 4 |
| Danovaro et al.11, in vivo e in vitro | Coral (duro) | Acropora sp.Acropora pulchra | Regiones tropicales: océanos Atlántico, Índico y Pacífico y mar Rojo | BMDBMBP-3EHS4-MBCOCEHMC | 48horas96horas | BlanqueamientoExpulsión de mucosas de corales (zooxantelas y tejido de coral) | Oxford 3b |
| Downs eta l.23, in vitro | Coral (plánula) | S. pistillataP. damicornisA. cervicornisM. annularisM. cavernosaP. asteroidesP. divaricata | HawáiIslas Vírgenes EE. UU. | BP-2BP-3 | 24horas | MortalidadDeformidadBlanqueamientoExpulsión mucosas (zooxantelas y tejido de coral)Daño ADN | Oxford 4 |
| Du et al.40, in vitro | Microalgas de agua dulce | Chlorella vulgarisDaphnia magnaBrachydanio rerio | Instituto de hidrobiología (Wuhan, China) | BP-3BP-4BP-3+BP-4 | 96horas | MortalidadCrecimiento | Oxford 4 |
| Fel et al.24, in vitro | Coral (duro) | Stylophora pistillata | Golfo de Aqaba (mar Rojo) | OCBMDBM | >100horas | Blanqueamiento | Oxford 4 |
| Fong et al.42, in vitro | Pez cebra (embriones) | Danio albolineatus | Hong Kong | BP-2 | 5días | Desarrollo neurológico y formación facial | Oxford 4 |
| Grabicova et al.44, in vitro | Trucha arcoíris | Oncorhynchus mykiss | Baja Bohemia (República Checa) | PBSA | 21 y 42 días | Cambios enzimáticos y parámetros bioquímicosCambios en el hígado y las gónadas | Oxford 4 |
| Gago25, tesis doctoral (3 estudios) | Ecosistema acuático (agua de río, peces de río y delfines marinos) | Luciobarbus sclateriCyprinus carpioPontoporia blainvillei (delfín franciscano) | Río EbroRío GuadalquivirCosta marina brasileña | BP-1BP-3OCOD-PABA4-HBEHMC | Ver estudios de la tesis doctoral | Presencia de filtros UV en sedimentos de ríoPresencia de filtros UV en tejidos de peces de río y delfines de mar | Oxford 2b |
| Giraldo et al.26, in vitro | Microalga marinaMejillónErizo de mar | Isochrysis galbanaM. galloprovincialiP. lividus | Ría de Vigo | OCOD-PABA | 48horas | EmbriogénesisTasa de crecimiento | Oxford 4 |
| He et al.27, in vitro | Coral (duro) | Seriatopora caliendrumPocillopora damicornis | TaiwánHong Kong | EHMCOC | 7 días | MortalidadReacción total del pólipoBlanqueamiento | Oxford 4 |
| He et al.28, in vitro | Coral (duro)Coral (plánula) | Seriatopora caliendrumPocillopora damicornis | TaiwánHong Kong | BP-1BP-3BP-4BP-8 | 14 días | MortalidadBlanqueamiento | Oxford 4 |
| Liu_201529, in vitro | Carpa dorada | Carassius auratus | Nanjing (China) | BP-1BP-2BP-3BP-4 | De 7 a 28 días | Cambios biomarcadoresCambios histológicos | Oxford 4 |
| Mitchelmoreet al. 30, in vitro | Ecosistema acuático (agua de mar, corales) | – | Oahu (Hawái, EE. UU.) | BP-3HSOCOS | - | Presencia de filtros UV en agua de mar y sedimentosPresencia de filtros UV en tejidos de corales | Oxford 4 |
| Molins-Delgado et al.15, transversal | Huevos de aves silvestres | Aves falconiformes (Circus aeruginosus, Falco tinnunculus)Aves ciconiiformes (Ciconia ciconia)Aves charadriiformes (Chroicocephalus genei, Chrococephalus ridibundus, Gelochelidon nilotica)Aves anseriformes (Anas Strepera) | Parque natural de Doñana | BP-1BP-34-HB4-DHBOD-PABAUVP | - | Presencia de filtros UV en huevos | Oxford 3a |
| Paredes et al.31, in vitro | Microalga marinaErizo de marMejillónOtro crustáceo | Isochrysis galbanaParacentrotus lividusMytilus galloprovincialisSiriella armata | A Coruña | BP-3EHMCBP-44-MBC | 48horas | Tamaño de larvasCrecimiento | Oxford 4 |
| Rodríguez López32, in vitro | Microalga marina | Tetraselmis suecica | A Coruña | OCBP-3+OC | 144horas | Crecimiento celularActividad celularConcentración de pigmentos | Oxford 4 |
| Schlumpf et al.33, observacional prospectivo | Ratas recién nacidas | Rata Long-Evans | Zurich (Suiza) | BP-3HS4-MBCEHMCOD-PABABMDBM | 4días | Cambios en el tamaño del úteroCambios de peso corporal | Oxford 2b |
| Seoane34, in vitro | Microalga marina | Tetraselmis suecica | A Coruña | BP-3 | 24horas | Cambios celulares | Oxford 4 |
| Sieratowicz_201141, in vitro | Microalga marinaCrustáceo | Desmodesmus subspicatusDaphnia magna | Florsheim, Alemania | BP-3EHMC3-BC4-MBC | 72horas | CrecimientoReproducciónLongitud de adultos | Oxford 4 |
| Soto y Rodríguez-Fuentes35, in vitro | Pez sargento | Abudefduf saxatilis | Quintana Roo (Méjico) | BP-3OSEHMC | 96horas | MortalidadEfectos estrogénicos | Oxford 4 |
| Stien et al.36, in vitro | Coral (duro) | Pocillopora damicornis | Oman | OC | 7 días | Cambios metabólicosCambios función mitocondrial | Oxford 4 |
| Stien et al.37, in vitro | Coral (duro) | Pocillopora damicornis | Oman | OCMBBTBP-3BMDBMDHHBEHSHSBEMTDBTET | 7 días | Reacción total del pólipoCambios metabólicos | Oxford 4 |
| Thorel et al.38, in vitro | Microalga marinaCrustáceo | Tetraselmis sp.Artemia salina | AquarHéak Aquaculture (Ars-en-Ré, Francia) | BP-3BEMTBMDBMMBBTEHSDHHBDBTETHSOC | 7 días | MortalidadCrecimientoMorfología celular | Oxford 4 |
| Wijgerde et al.39, in vitro | Coral (duro) | Acropora tenuisStylophora pistillata | Zoo de Burgers (Arnhem, Países Bajos) | BP-3 | 14 días | MortalidadCrecimientoFotosíntesisAlteraciones microbiomaBlanqueamiento | Oxford 4 |
ADN: ácido desoxirribonucleico; BEMT: bis-etilhexiloxifenol metoxifenil triacina; BMDBM: butilo metoxidibenzoilmetano; BP: benzofenona; DBT: dietilexil butamida triazona; DHHB: dietilamino hidroxibenzol hexil benzoato; EHMC: metoxicinamato de etilhexilo; EHS: salicilato de etilhexilo; ET: etilhexil triazona; EE. UU.: Estados Unidos de América; HS: homosalato; MBBT: bis-benzotriazolil tetrametilbutilfenol metileno; OC: octotrileno; OD-PABA: octil-dimetil-PABA; OS: octilsalato; PBSA: ácido 2-fenil-5-bencimidazol sulfónico; UVP: 2-(2-benzotriazolil)-4-metilfenol; 3-BC: 3-benzilidina camphor; 4-DHB: 4,4′-dihidroxibenzofenona; 4-HB: hidroxibenzofenona; 4-MBC: 4-metil-bencilideno camfor.
Principales resultados y conclusiones de los estudios incluidos sobre el impacto medioambiental de los filtros ultravioleta
| Estudio | Resultados y conclusiones |
|---|---|
| Araújo et al.22 | La exposición de larvas de lenguado a 4-MBC se asoció a mayor mortalidad, malformaciones, alteraciones en el comportamiento como nadar menos en periodos de luz y alteraciones enzimáticas |
| Christen et al.43 | EHMC influyó en el desarrollo sexual a distintos niveles con acción antiestrogénica, cambios histológicos en ovarios y testículos, y disminución de espermatozoides y ovocitos |
| Danovaro et al.11 | Los fotoprotectores que contienen parabenos, cinamatos, benzofenonas y derivados del alcanfor contribuyen al blanqueamiento del coral duro de forma rápida, incluso a concentraciones bajas, mediante la promoción de infecciones virales |
| Downs et al.23 | La BP-3 pueden producir deformidades en la plánula de coral, blanqueamiento, lesiones en el ADN, osificación y mayores tasas de mortalidad a mayor concentración de BP-3 |
| Du et al.40 | La BP-3 se asoció a disminución de crecimiento y mortalidad de forma dosis dependiente en las microalgas estudiadasLa toxicidad con la BP-4 fue bajaLa toxicidad de BP-3+BP-4 fue antagónica |
| Fel et al.24 | En la exposición crónica a tóxicos, solo las concentraciones altas de OC y BMDBM se asociaron a blanqueamiento del coral y su efecto fue menos tóxico en comparación con el óxido de cinc, los herbicidas y el tributilín |
| Fong et al.42 | BP-2 se asoció a problemas neurológicos y deformidades faciales en el pez |
| Grabicova et al.44 | PBSA aumentó la actividad de ciertos citocromos P450, y provocó cambios en parámetros bioquímicos y en la actividad enzimática. Sin embargo, no se observaron cambios patológicos en el hígado o las gónadas |
| Gago Ferrero25 | Presencia de residuos de distintos filtros UV en forma de traza en sedimentos de río (hasta en un 95% de las muestras), algunos en concentraciones muy altas como OCAlta concentración de filtros UV (BP-3, OC y EHMC) en peces de ríoPresencia de filtros UV en delfines marinos en hasta el 70% de las muestrasSugieren la poca capacidad de las estaciones de tratamiento de aguas residuales urbanas para la depuración de filtros UV |
| Giraldo et al.26 | OC y OD-PABA resultaron tóxicos (alteraciones en desarrollo y crecimiento) en microalgas, mejillones y erizos de mar incluso a concentraciones bajas |
| He et al.27 | EHMC y OC, dependiendo del coral, pueden producir toxicidad (sobre todo concentraciones más elevadas) en términos de mortalidad y blanqueamiento con porcentajes que varían del 33,3%y el 83,3% |
| He et al.28 | La presencia (dependiendo de las concentraciones) de BP-1, BP-3 y BP-8 se asoció a un riesgo moderado-alto para la conservación de corales. La BP-1 y BP-8 fueron más tóxicas para los corales que la BP-3 y BP-4 |
| Liu et al.29 | Las BP (1, 2, 3, 4) provocan una reducción de las actividades de las enzimas antioxidantes hepáticas en la carpa dorada (estrés oxidativo), así como lesiones hepáticas |
| Mitchelmore et al.30 | Presencia de 8 filtros UV en el mar, sedimentos marinos y en el tejido de coralEl filtro UV más detectado fue el BP-3 y su concentración más alta en zonas de mayor densidad de afluencia de personas |
| Molins-Delgado et al.15 | Presencia de filtros UV en todas las muestras de huevos de avesSe sugiere que las madres se contaminaron al ingerir alimentos, por la poca capacidad de las estaciones de tratamiento de aguas residuales urbanas para la depuración de filtros UV |
| Paredes et al.31 | BP-3, EHMC, BP-4, 4-MBC resultaron tóxicos en todas las especies estudiadas, especialmente 4-MBC y EHMC |
| Rodriguez López32 | La OC no presenta alteraciones en el crecimiento celular ni en la concentración de pigmentos de la microalga estudiada en concentraciones entre 2,5 y 5 mg·l−1BP-3 inhibe el crecimiento celular y reduce la cantidad de carotenoides de la microalgaLa combinación de OC y BP-3 no provoca cambios en el crecimiento celular pero sí aumenta la concentración celular de carotenoides |
| Schlumpf et al.33 | BP-3, EHMC y 4-MBC provocaron cambios en el tamaño uterino de las ratas dosis dependientesNo hubo cambios significativos en el peso corporal |
| Seoane34 | BP-3 causó un aumento en la tasa de crecimiento y en la actividad esterasa, una disminución del tamaño celular y alteraciones en la fotosíntesis |
| Sieratowicz et al.41 | BP-3, EHMC, 3-BC y 4-MBC se asociaron a reducción del crecimiento pero no en la producción de neonatos ni en la longitud de los adultos |
| Soto et al.35 | Interacción leve o nula entre los filtros UV y los receptores estrogénicos de los pecesNo asociación con mortalidad |
| Stien et al.36 | La OC se asoció a disfunción mitocondrial en corales y a pólipos cerrados |
| Stien et al.37 | De los filtros UV estudiados OC, EHS y BP-3 se asociaron a distintos cambios metabólicos y disfunción mitocondrial |
| Thorel et al.38 | De los filtros UV analizados HS, BMDBM y OC se asociaron a mayor mortalidad, siendo OC el más tóxico, HS, BP-3 y EHS a descenso en el crecimiento y BMDBM, BP-3 y HS a cambios en la morfología celular |
| Wijgerde et al.39 | La exposición semicrónica a BP-3 se asoció a mortalidad acelerada, disminución de la fotosíntesis, cambios en el microbioma y blanqueamientoSe sugiere que tiene un efecto adicional al producido por el incremento de la temperatura |
ADN: ácido desoxirribonucleico; BMDBM: butilo metoxidibenzoilmetano; BP: benzofenona; EHMC: metoxicinamato de etilhexilo; EHS: salicilato de etilhexilo; HS: homosalato; OC: octotrileno; OD-PABA: octil-dimetil-PABA; PBSA: ácido 2-fenil-5-bencimidazol sulfónico; UV: ultravioleta; 3-BC=3-benzilidina camphor; 4-MBC=4-metil-bencilideno camfor;
La mayoría de los estudios incluidos son estudios in vitro (aunque también hay algunos in vivo), estudios de diferentes partes del mundo, de calidad moderada y de corta duración11,15,33. Se ha estudiado el impacto ambiental de los filtros UV en distintos organismos, incluyendo microalgas (marinas y de agua dulce)11,26,31,32,40,41, crustáceos26,31,34,38,41, moluscos26,31, corales23,24,27,28,30,36,37,39, peces22,25,29,35,42–44 y mamíferos25,33, muchos en sus formas embrionarias o larvarias, la mayoría provenientes de ambientes acuáticos, sobre todo marinos. Sin embargo, también se ha encontrado evidencia en organismos terrestres (aves y ratas)15,33. Aunque hay una gran variedad de filtros analizados la BP-311,15,23,25,28–31,33–35,37–41 y el OC11,24–27,30,32,36–38 son los filtros UV más estudiados. Los tiempos de exposición a estos filtros UV fueron variables, desde las 24 horas23,34 a 42 días44. Destacamos en este punto la gran variabilidad de las dosis de filtros UV analizadas y las características de los ensayos, lo que limita enormemente su comparabilidad. En general, la mayoría de los estudios analizaron los efectos de los filtros UV en concentraciones de 100μg/l a 5mg/l, y en los estudios in vitro las exposiciones fueron sobre todo agudas, y pocos estudios analizaron exposiciones subagudas o crónicas24,39. Igualmente, las variables analizadas relacionadas con la toxicidad son diversas, y tremendamente heterogéneas las medidas, criterios y puntos de corte aplicados. Los estudios incluidos analizaron la mortalidad, las tasas de crecimiento, el blanqueamiento de los corales, la embriogénesis y el desarrollo de formas larvarias, las alteraciones metabólicas y endocrinas (muchas relacionadas con la reproducción), las deformidades, etc.
Las microalgas, tanto marinas como de agua dulce, han sido organismos estudiados. En ellas destacamos que la BP-3, el OC, el metoxicinamato de etilhexilo (EHMC), la benzofenona-4 (BP-4), la 4-metil-bencilideno camfor (4-MBC) y el octil-dimetil-PABA (OD-PABA) se asociaron a alteraciones en el crecimiento, la BP-3, el OC, el homosalato (HS) y el butilo metoxidibenzoilmetano (BMDBM) a mayor mortalidad y el BP-3 a problemas en la fotosíntesis26,31,32,40,41.
El impacto de los filtros UV en los corales ha sido ampliamente analizado23,24,27,28,30,36,37,39. Los efectos tóxicos, sobre todo de BP-3, OC, EHMC y BP-4 se han constatado en arrecifes de coral en todo el mundo, estimándose anualmente que 14.000 toneladas de protector solar (algunos que contienen hasta un 10% de BP-3) son transferidas por los nadadores a los arrecifes de coral11,23,30. Uno de los efectos más estudiados es el blanqueamiento del coral11,20,27,28,30,39. El blanqueamiento del coral se produce por la pérdida de las algas unicelulares simbióticas esenciales, las llamadas zooxantelas (Symbiodinium spp.), que viven dentro de las puntas de coral vivo que se están desarrollando, llamadas a su vez pólipos de coral. Si se pierde el alga se produce una pérdida de color en los márgenes exteriores del pólipo que da un efecto de blanqueamiento. Si este fenómeno continúa se produce la muerte del coral. El blanqueamiento aparece a concentraciones de filtros UV de entre 10-300μg/l, dependiendo del filtro y de la especie de coral23,27,28,30,40, a las 18-48horas de la exposición, llegando al blanqueamiento completo aproximadamente en 96 horas27,28,39. También hay evidencia de que algunos filtros UV promueven la propagación de infecciones virales latentes en las zooxantelas que las obligan a entrar en un ciclo lítico y luego a ser expulsadas del pólipo de coral11,23,26,27,31,37. Otros estudios han demostrado que los filtros UV pueden producir osificación del coral, alteraciones en el ADN y deformidades de las larvas de coral23, cambios metabólicos y en la función mitocondrial36,37, alteraciones del crecimiento39, en el microbioma39 y en la fotosíntesis39.
Los peces, tanto de agua dulce como marinos, también se pueden ver afectados por la bioacumulación y toxicidad de algunos filtros UV22,25,29,35,42–44. En los estudios incluidos filtros como el 4-MBC, EHMC, benzofenona 2 (BP-2), ácido 2-fenil-5-bencimidazol sulfónico (PBSA) produjeron distintas alteraciones en los peces, como por ejemplo mayor mortalidad, malformaciones, alteraciones en el comportamiento, en la sexualidad, enzimáticas o neurológicas.
Finalmente destacamos que hay evidencia sobre la bioacumulación también en animales terrestres, en concreto aves. Un estudio realizado en el Parque Nacional de Doñana analizó huevos de aves de distintas especies, detectando en ellos la presencia de distintos filtros UV15. Los autores sugieren que las madres se contaminaron al ingerir alimentos contaminados, por la poca capacidad de las EDAR para la depuración de filtros UV13–16, y los transfirieron a los huevos.
Efecto de los filtros ultravioleta en la cadena alimenticia y bioacumulación en humanosCuando se utilizan los productos con filtros UV parte de los múltiples componentes utilizados en su formulación pueden liberarse de su matriz al medio circundante, en especial al medio acuático. Esta liberación va a depender de las características de los componentes del producto, de las características del medio y de una serie de fenómenos fisicoquímicos de interacción entre ambos. Todo ello puede hacer que los componentes se mantengan inalterados en el medio o que cambie su especiación o incluso que se transformen a otros compuestos a mayor o menor velocidad45. Esto significa que algunos filtros no son biodegradables, o no en su totalidad, o que el proceso de degradación es lento en el tiempo, pudiéndose bioacumular y biopersistir en el medio.
Una vez en el medio los componentes originales o transformados pueden interactuar directa o indirectamente con el entorno y la vida acuática (o incluso terrestre)45. Muchos filtros UV, al ser lipolíticos, pueden atravesar membranas celulares fácilmente e inducir cambios fisiológicos en las células16. Así, e independientemente de otros efectos tóxicos, como hemos comentado previamente, se ha constatado que algunos filtros UV se acumulan en la grasa de muchas especies marinas y de agua dulce16, lo que las hace capaces (al menos teóricamente) de bioacumularse en la cadena alimentaria superior, llegando incluso al ser humano. Aunque actualmente la evidencia es limitada, ya se han publicado algunos estudios en los que se ha detectado BP-3 en muestras de orina en población de los EE. UU.46, y presencia de BP-3, 4-MBC, OMC, OC y otros filtros comúnmente utilizados en leche materna16. También se ha reportado una posible asociación entre los filtros UV y el leiomioma uterino47, y en la motilidad de varias líneas celulares del cáncer de mama y de pulmón48.
Otra de las vías mediante la cual los filtros UV podrían llegar a la cadena alimenticia es a través de los microplásticos. Los plásticos y sus residuos son uno de los principales problemas medioambientales de la actualidad. En su proceso de degradación se forman microplásticos secundarios, con un diámetro inferior a 5mm. Los efectos adversos que pueden ocasionar en la biota se deben a su propia composición química y a los productos químicos adsorbidos en su superficie, entre los que se encuentran filtros solares y pesticidas. Cuando los microorganismos marinos ingieren estos microplásticos absorben en su tubo digestivo los contaminantes adsorbidos a ellos, pudiendo pasar, al menos teóricamente, a los humanos a través de la cadena alimenticia. En un estudio realizado en las Islas Canarias se observó que los microplásticos obtenidos de playas turísticas presentaban mayor concentración de filtros UV con respecto a los microplásticos de playas no turísticas49,50. También se pudo demostrar mayor estrés oxidativo en las branquias de la especie Scrobicularia plana cuando se la expuso a microplásticos que contenían BP-351.
Limitaciones y el futuro de la investigación del impacto medioambiental de los filtros ultravioletaEl estudio del efecto de los filtros UV es extremadamente complejo. Existe una gran cantidad de filtros UV presentes en productos muy diferentes, así como medios y organismos (ecosistemas) con los que interaccionar, algunos sumamente complejos, pero también una gran variabilidad y falta de estandarización en cuanto a la metodología a emplear (diseño del estudio, técnicas, tipo de test de toxicidad, duraciones de la exposición, variables de estudio incluyendo las de resultado, definiciones/criterios, concentraciones, umbrales de toxicidad, etc.). Además, faltan datos sobre su efecto a largo plazo en el medioambiente.
DiscusiónLa revisión de la literatura realizada ha permitido evidenciar en primer lugar que los filtros UV se encuentran acumulados en diferentes medios, como el agua y los sedimentos, y también en distintos organismos. Esto es debido probablemente a distintos factores; uno de ellos es el uso masivo alcanzado en los últimos años de productos que los contienen. Se ha estimado que anualmente se producen 10.000 toneladas de filtros UV para el mercado global12. Algunos de estos filtros poseen unas características estructurales y fisicoquímicas que hacen que sean poco biodegradables, con su consiguiente capacidad de bioacumulación. Esta acumulación en aguas puede producirse de forma directa, por ejemplo con un bañista en una playa (de hecho las playas son las zonas donde mayores concentraciones de filtros UV se suelen encontrar) o de forma indirecta, por la poca capacidad de las EDAR para filtrarlos13–16.
Por otra parte, hemos mostrado la capacidad tóxica de algunos de estos filtros, sobre todo la BP-3 y el OC en múltiples organismos, muchas veces dosis dependiente, especialmente tras exposiciones in vitro22,26–44. También, aunque en menor medida, se ha objetivado esta toxicidad in vivo11,15,25. En este punto queremos poner de manifiesto que el estudio del impacto medioambiental es muy complicado (limitaciones metodológicas, ecosistemas muy complejos, fenómeno dinámico, etc.), lo que hace que estos resultados deban ser interpretados con cautela. Pero, aunque sobre el terreno la toxicidad encontrada no sea muy elevada, teniendo en cuenta que es muy probable que el uso de filtros siga aumentando, es posible que en un futuro podamos observar mayor daño al alcanzarse concentraciones más elevadas de los filtros UV.
En un estudio reciente se han encontrado concentraciones sanguíneas de diferentes filtros solares (BMDBM, BP-3, OC, HS, EHMC y salicilato de etilhexilo) superiores a 0,5ng/ml tras una única aplicación de fotoprotector solar; en el momento actual se desconoce su implicación clínica en cuanto a carcinogenia y/o efectos en la reproducción. Además, debido a que estos filtros presentan una vida media larga, habitualmente mayor de 48horas, su aplicación repetida condiciona que se puedan detectar en sangre hasta 17 días después de su última aplicación52,53. En este mismo sentido, aunque los filtros UV o sus derivados potencialmente podrían llegar a los humanos a través de la cadena alimentaria, hasta la fecha no se ha confirmado efecto tóxico en las personas.
Contra esta situación existe una corriente y posibles actuaciones que buscan desarrollar filtros UV con fotoprotección adecuada, fundamental para prevenir el cáncer de piel y el envejecimiento cutáneo, y respetuosos con el medioambiente.
Una de las primeras acciones sería la regulatoria, prohibiendo los compuestos que demuestren ser tóxicos para el medioambiente. En este sentido, algunos de los filtros UV más dañinos como el EHMC y la BP-3 ya están prohibidos en algunos lugares, como por ejemplo en Palaos o Hawái, debido al potencial deterioro que están causando en los corales, uno de sus principales atractivos turísticos16.
Por otro lado, si bien es cierto que en nuestro entorno solo se pueden utilizar los filtros UV enumerados en el Reglamento (CE) 1223/2009 del Parlamento Europeo y del Consejo54, que además se deben utilizar conforme a las indicaciones que se dan para cada uno de los mismos, los productos para el cuidado personal (conocidos como PCP) pueden incluir filtros UV, pero no requieren de un estudio de riesgo medioambiental, a pesar de estar considerados como contaminantes emergentes.
Además, la falta de estandarización en cuanto a las concentraciones que pueden llegar a ser tóxicas para el medioambiente, o la falta de definición sobre qué es un producto biodegradable o qué es proteger el medioambiente o ser respetuosos con los océanos hace que en los envases nos encontremos información muchas veces insuficiente, confusa o incluso incorrecta.
Urge implantar cambios, tanto en las fórmulas de los productos, buscando el menor impacto medioambiental, pero siempre garantizando la fotoprotección, como en los métodos de tratamiento del agua de las EDAR. Es prioritario que las marcas comerciales de PCP con filtros UV sean conscientes de los efectos negativos potenciales que pueden producir estos filtros en el medioambiente. Así pues, la investigación y la industria deben incrementar sus esfuerzos para identificar nuevas moléculas de filtros UV, o mezclas o concentraciones concretas de las mismas, que proporcionen la fotoprotección necesaria y tengan un bajo impacto ambiental.
Las sociedades científicas, con la Asociación Española de Dermatología y Venereología a la cabeza, deben continuar su labor de concienciación sobre la importancia de la fotoprotección. Las estrategias adecuadas de fotoprotección no dependen de un único factor, sino que son multifactoriales: buscar la sombra, usar ropa y bañadores fotoprotectores, aplicarse protectores solares en las áreas expuestas al sol, limitar los tiempos de exposición y ser muy cuidadosos con las superficies que hacen efecto espejo. Subrayar que los resultados anteriormente expuestos no contradicen estas estrategias de fotoprotección.
Los filtros solares han evolucionado amoldándose mejor a las necesidades individuales de las personas, teniendo en cuenta su edad, el tipo de piel, la presencia o riesgo de enfermedades, así como a las diferentes actividades que realizan estas personas20. Es de esperar que ahora evolucionen conteniendo fórmulas respetuosas con el medioambiente. Para ello será necesario un mayor nivel de evidencia, de estandarización de procedimientos y de regulación.
Conflicto de interesesLoa autores declaran no tener ningún conflicto de intereses.
AgradecimientosA Marta Barluenga Badiola, Científico titular del Museo Nacional de Ciencias Naturales, CSIC, por su lectura crítica y revisión del trabajo.