Se han reportado diversos tipos de reacción adversa cutánea durante la terapia de anticuerpos anti (PD)-1 de muerte celular programada. Describimos aquí casos raros de liquen plano (LP) que se desarrolló durante la terapia de nivolumab para el cáncer de pulmón de células no pequeñas (CPCNP) avanzado. Ambos casos comprometieron los miembros inferiores, correspondiendo uno de ellos a LP ampollar.
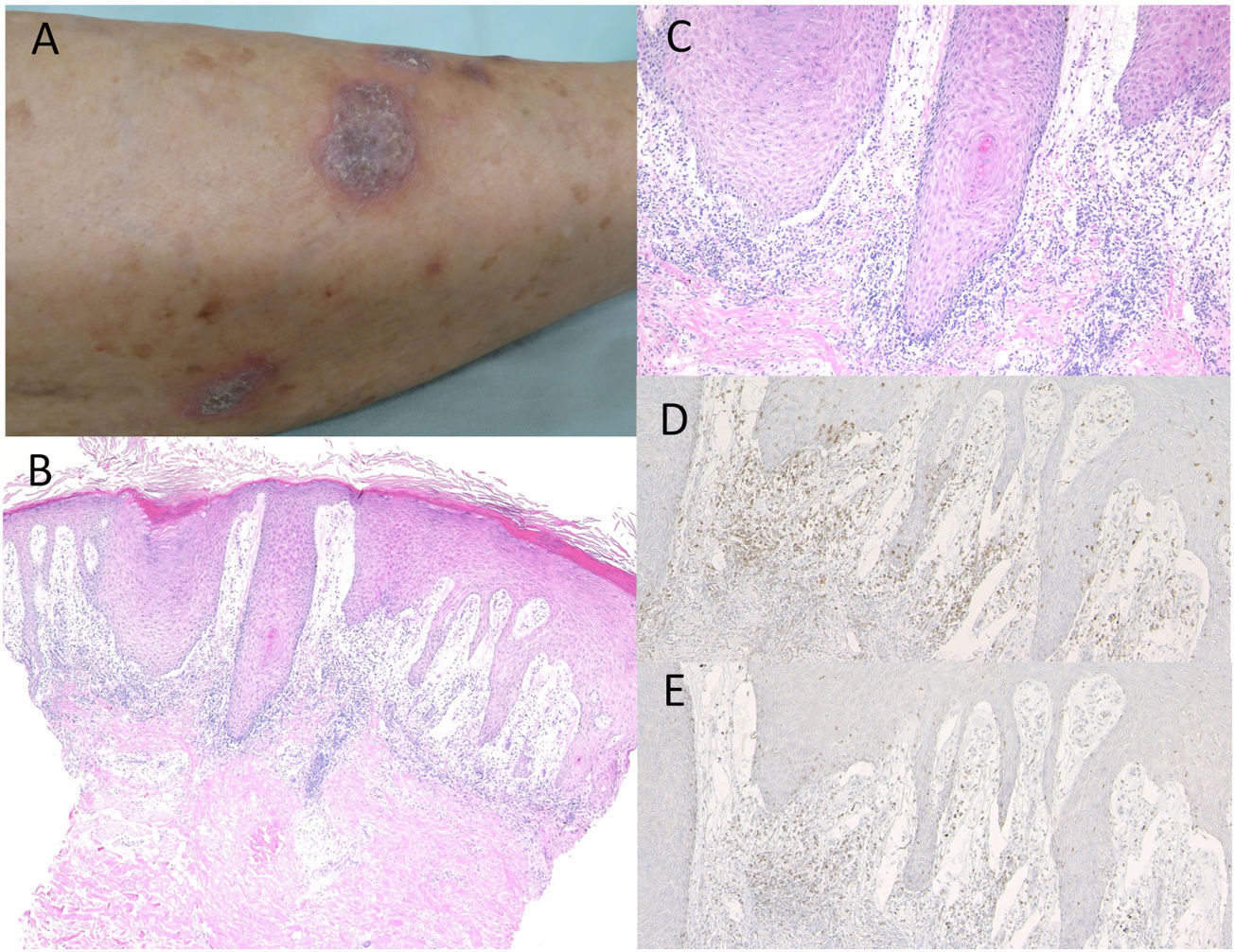
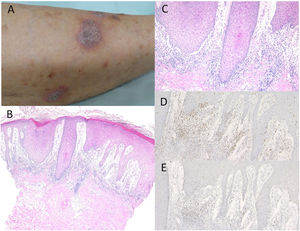
Caso 1. Una mujer de 74 años fue derivada al Departamento de Dermatología del Hospital General Kosei de Shirakawa, reportando erupción cutánea en los miembros inferiores. No tomaba medicación alguna. Había sido tratada con nivolumab (3mg/kg) cada dos semanas, debido a CPCNP. Tras la tercera infusión, comenzaron a aparecer erupciones pruriginosas en las piernas. La exploración física reveló múltiples placas queratósicas violáceas, bien definidas, ligeramente cubiertas de escamas en la parte inferior de ambas piernas (fig. 1A). El examen histológico reveló hiperqueratosis focal con paraqueratosis, pérdida focal de la capa granular, hiperproliferación epidérmica irregular y leve degeneración de la licuefacción de las capas epidérmicas basales, con edema subepidérmico prominente (fig. 1B,C). Se observó infiltrado de células mononucleares, principalmente compuesto de células T CD4− y CD8+ en la dermis superior (fig. 1D,E). La inmunofluorescencia directa fue negativa para inmunoglobulinas o depósitos de C3 en la membrana basal epidérmica. Por tanto, fue tratada con corticosteroides tópicos, sin discontinuación de nivolumab, aunque con efectos insuficientes.
A)Placas queratósicas violáceas diseminadas en la parte baja de la pierna. B)Las características histológicas revelaron proliferación epidérmica irregular con edema subepidérmico e infiltrados celulares en la dermis superior. Tinción hematoxilina-eosina (HE), ×100. C)Ampliación máxima que muestra degeneración de la licuefacción de las capas epidérmicas basales. HE, ×200. Las células infiltrantes fueron inmunorreactivas para CD4, ×200 (D) y CD8, ×200 (E). gr1.
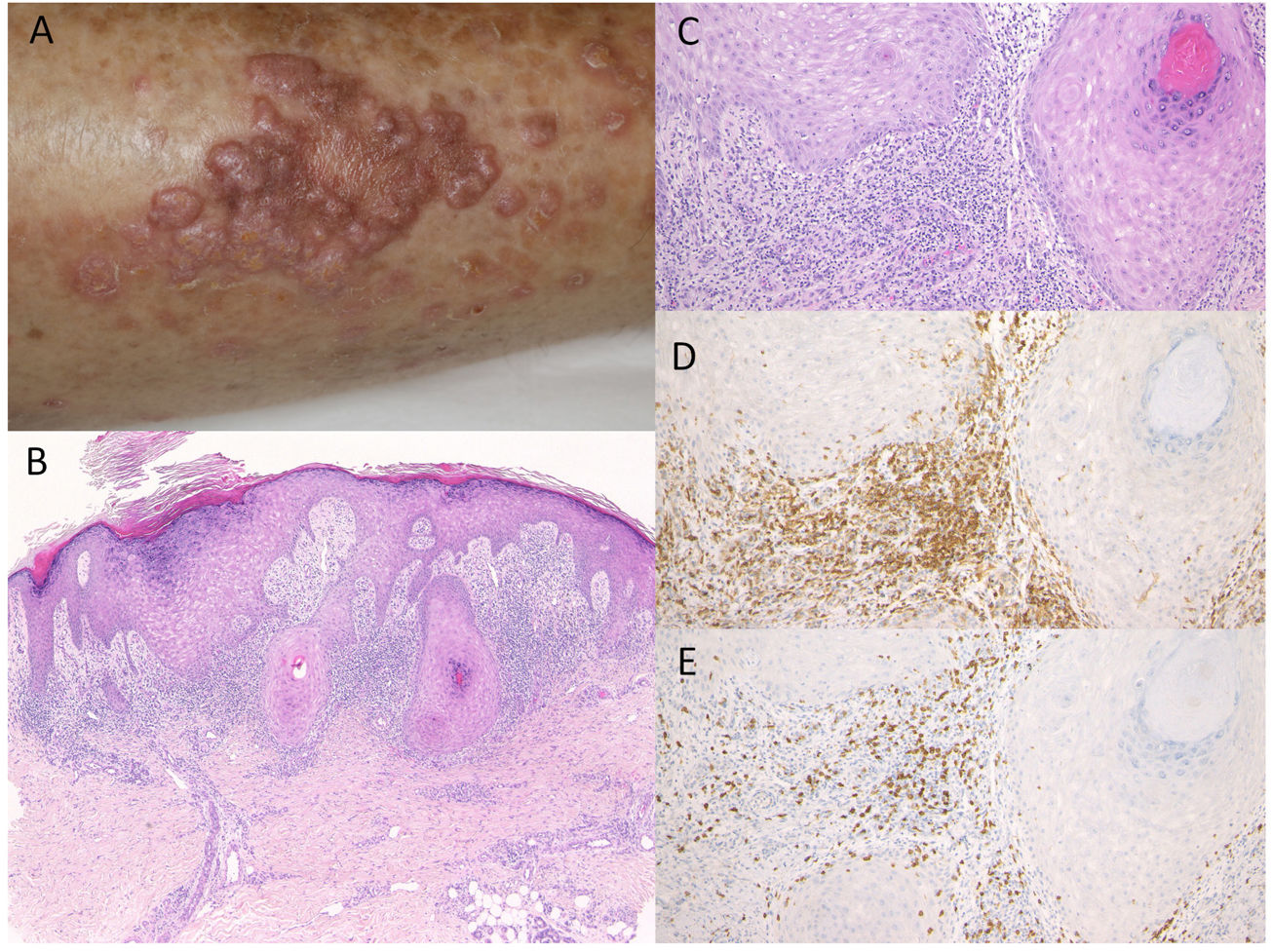
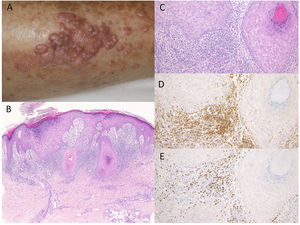
Caso 2. Un varón de 81 años fue tratado con administración de pembrolizumab (3mg/kg) cada tres semanas, debido a CPCNP. Tras la novena infusión, fue derivado al Departamento de Dermatología del Hospital Universitario Médico de Fukushima, reportando erupción cutánea pruriginosa en la parte inferior de los muslos. Tras la duodécima infusión comenzaron a aparecer eritema y múltiples placas de color rojo oscuro, bien definidas, cubiertas de escamas (fig. 2A). El examen histológico reveló hiperqueratosis focal con ortoqueratosis, hiperplasia de la capa granular, hiperproliferación epidérmica irregular y leve degeneración de la licuefacción de las capas basales, y edema de la dermis papilar (fig. 2B,C). Se observó un infiltrado de tipo banda de células inflamatorias, principalmente compuesto de célulasT CD4− y CD8+, en la dermis superior (fig. 2D,E). Fue tratado con corticosteroides tópicos y antihistamínicos orales, sin discontinuación de pembrolizumab, con efectos satisfactorios.
A)Múltiples placas eritematosas de color rojo oscuro, bien definidas, con escamas en la parte baja de los muslos. B,C)Características histológicas que muestran hiperqueratosis focal con ortoqueratosis, hiperplasia de la capa granular, hiperproliferación epidérmica irregular, leve degeneración de la licuefacción de las capas basales y edema de la dermis papilar. HE: (B) ×100, (C) ×200. Las células infiltrantes fueron inmunorreactivas para CD4, ×200 (D) y CD8, ×200 (E). gr2.
Hasta la fecha se han reportado casos de exacerbación de psoriasis preexistente o inducción de novo de psoriasis/erupciones psoriasiformes durante la terapia de nivolumab. Sin embargo, la inducción de LP es rara. Existen diversos informes sobre LP o dermatitis liquenoide1-6. En un estudio unicéntrico de cohorte se observaron reacciones liquenoides en el 17 al 82% de los pacientes con melanoma metastásico que recibieron terapia anti-PD-11. Histopatológicamente, el grado de dermatitis de interfase y cambios epidérmicos son variables. El LP ampollar se observa a menudo en los miembros inferiores. Histopatológicamente, la biopsia de la lesión ampollosa se caracteriza por una ampolla subepidérmica acompañada de cambios clásicos del LP. La formación de ampollas puede deberse a la amplia licuefacción y vacuolización de la capa basal. En el caso1, las placas queratósicas violáceas aparecieron en las piernas tras el inicio de la administración de nivolumab. El examen histopatológico reveló hiperproliferación epidérmica irregular, con edema subepidérmico marcado. Wakade et al.5 reportaron tres casos de reacciones de tipo LP ampollar inducidas por el inhibidor de PD-1 tras 2-22 ciclos de administración. Dos de los pacientes tenían CPCNP, y el tercero de ellos tenía melanoma. Biolo et al.6 reportaron recientemente un caso inusual de LP ampollar lineal que comprometió unilateralmente el miembro inferior, con tratamiento de nivolumab.
Se ha sugerido que la patogenia de LP es debida al daño epidérmico causado por las célulasT CD8+ citotóxicas autorreactivas, mediado por interferón-γ (IFN-γ). En los modelos murinos de LP, la expresión prominente de PD-L1 en los queratinocitos es sugestiva de jugar un papel protector frente a las célulasT CD8+ citotóxicas7. Además, los estudios in vitro reflejaron que la administración de anticuerpos anti-PD-1 indujo un incremento de la producción de IFN-γ de las células mononucleares de sangre periférica de los pacientes con LP oral8. Komori et al.9 reportaron recientemente un caso que desarrolló LP focalmente en una zona irradiada, sugiriendo fenómeno de Koebner. Ellos conjeturaron una relación cercana entre la terapia anti-PD-1 más radioterapia, y el desarrollo de LP. Otro informe reciente reflejó un incremento de la expresión de ARNm de granzimaB e IFN-γ tras el tratamiento de nivolumab10. La inhibición de PD-1 puede inducir daño de la capa basal epidérmica con edema prominente, causando LP ampollar, mediado por IFN-γ y otras moléculas.
Conflicto de interesesLos autores no tienen conflicto de intereses directamente relevantes para el contenido de este artículo.