La hidradenitis supurativa es una enfermedad inflamatoria crónica de la piel caracterizada por nódulos dolorosos, abscesos y tractos fistulosos que pueden dar lugar a complicaciones cicatriciales irreversibles. Dentro de las opciones terapéuticas se incluyen el tratamiento con antibióticos, las terapias biológicas y los procedimientos quirúrgicos. El tratamiento actual de la hidradenitis supurativa promueve una intervención quirúrgica temprana junto con el uso de la terapia médica, con lo que se busca favorecer la curación y minimizar las cicatrices y complicaciones en una enfermedad que se caracteriza por una ventana de oportunidad terapéutica. Las técnicas quirúrgicas van desde la incisión y el drenaje hasta la escisión amplia, con tasas de recurrencia variables en base a principalmente la extensión de los procedimientos. Las técnicas de reconstrucción varían principalmente en función de la extensión del defecto y de la zona afectada. En todos los casos, una buena planificación y delimitación preoperatoria con pruebas de imagen, preferiblemente intra o perioperatoria facilita la extirpación completa del tejido implicado, preservando la integridad y función de la piel sana y minimizando las recidivas.
Hidradenitis suppurativa is a chronic inflammatory skin condition characterized by painful nodules, abscesses, and sinus tracts that may lead to irreversible scarring complications. Therapeutic options include antibiotics, biologic therapies, and surgical procedures. Current management of hidradenitis suppurativa favors early surgical intervention along with medical therapy to promote healing and minimize scars and complications in a disease characterized by a therapeutic window of opportunity. Surgical techniques range from incision and drainage to wide excision, with varying recurrence rates mainly based on the extent of procedures. Reconstruction techniques would vary primarily based on the extent of the defect and the area involved. In all cases, a good preoperative planning and delimitation with imaging modalities, preferably intra- or perioperative facilitates complete removal of involved tissue, preserving the integrity and function of healthy skin and minimizing recurrences.
La hidradenitis supurativa (HS) es una afección cutánea inflamatoria crónica caracterizada por la presencia de nódulos, abscesos y tractos sinusales que provocan cicatrices irreversibles desfigurantes en las regiones de los pliegues cutáneos1. La HS causa dolor y molestias graves, lo que conlleva un deterioro significativo de la calidad de vida, las interacciones sociales y el funcionamiento laboral de los pacientes2. Aunque la patogenia exacta de la HS no se conoce por completo, en general se considera una enfermedad de queratinización autoinflamatoria que surge en los epitelios de los folículos pilosos de la región infundibular, lo que conduce a la oclusión de los folículos pilosos y a una inflamación secundaria3.
Existen múltiples opciones de tratamiento para la HS, entre las que se incluyen antibióticos, agentes antiinflamatorios, fármacos biológicos inmunomoduladores, procedimientos quirúrgicos, junto con medidas coadyuvantes como el tratamiento del dolor, el abandono del tabaco o la pérdida de peso4. La heterogeneidad clínica de la HS5, sus diferentes formas y tasas de progresión6, y el amplio abanico de posibilidades terapéuticas médicas o quirúrgicas7 convierten la elección del tratamiento óptimo en un reto clínico. Esta revisión narrativa pretende resumir las opciones de tratamiento quirúrgico para el manejo de la HS.
¿Cuál es el momento óptimo para una intervención quirúrgica?Los pacientes con HS se enfrentan a 2 problemas principales: problemas relacionados con la inflamación, como nódulos inflamados y abscesos, que suelen tratarse con procedimientos médicos o no quirúrgicos; y complicaciones secundarias, como tractos fistulosos y cicatrices irreversibles, que a menudo requieren una intervención quirúrgica7. Tradicionalmente, el tratamiento quirúrgico se ha reservado para lesiones localizadas recurrentes, lesiones inflamatorias resistentes al tratamiento médico o secuelas estructurales relacionadas con la enfermedad7.
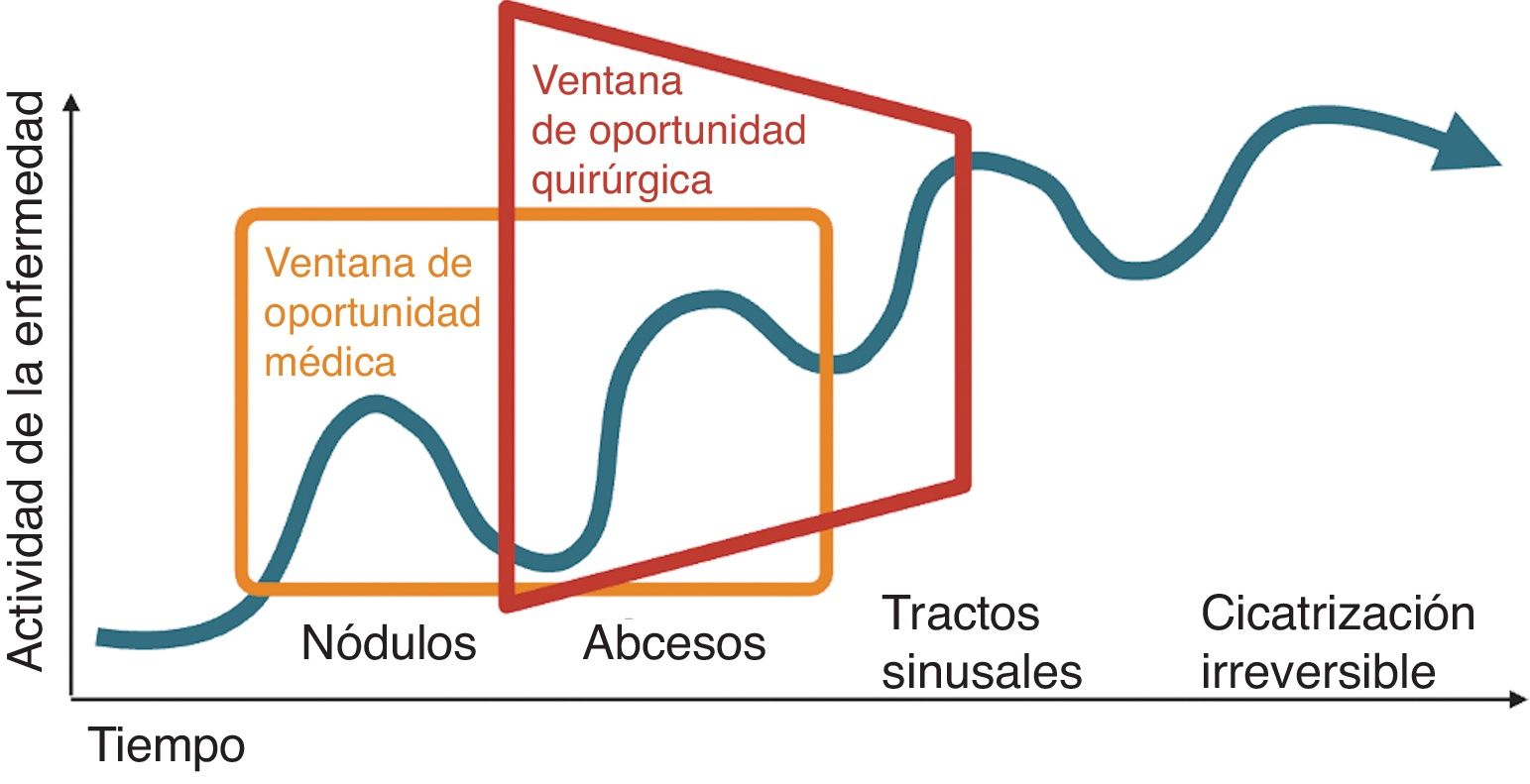
En los últimos años, se ha sugerido que el tratamiento médico precoz mejora las respuestas y reduce las complicaciones cicatriciales, lo que ha dado lugar al concepto de ventana de oportunidad en el tratamiento de la HS7. Manzano et al. realizaron un estudio multicéntrico retrospectivo en práctica clínica real que incluía datos de 389 pacientes y observaron que un tiempo más prolongado desde el inicio de la HS hasta el inicio del adalimumab era un factor de riesgo significativo de no respuesta al adalimumab en el análisis univariante (p=0,0016)8. Se han notificado mejores resultados con adalimumab+cirugía frente a la cirugía sola9,10. El adalimumab reduce las zonas inflamadas, disminuyendo la superficie que requiere extirpación quirúrgica. El tratamiento médico previo a la cirugía facilita una diferenciación más clara entre el tejido afectado y el sano durante la cirugía, al tiempo que prepara la herida para una cicatrización óptima11. Sin embargo, el tratamiento sistémico por sí solo puede no inducir la remisión completa de la inflamación en los tractos sinusales10, y la remisión completa es esencial para evitar que la inflamación cutánea residual induzca nuevas lesiones inflamadas12. Por lo tanto, la combinación de tratamiento médico+cirugía podría representar el mejor estándar terapéutico. El concepto de ventana de oportunidad se aplicaría no sólo a la terapia médica, sino también a la cirugía (fig. 1). La cirugía precoz de las lesiones fibróticas tempranas inflamadas sintomáticas —junto con la terapia médica— podría reducir el área quirúrgica, prevenir las recaídas y detener la progresión de la enfermedad en fases tempranas, evitando así la morbilidad y las complicaciones cicatriciales.
Estudio preoperatorio por imagenEl objetivo quirúrgico de la cirugía de la HS es extirpar todo el tejido inflamado para evitar nuevas recidivas12. Se han estudiado modalidades de obtención de imágenes preoperatorias como la resonancia magnética, la termografía por infrarrojos, la tomografía de coherencia óptica o la microscopia confocal de reflectancia13. Actualmente, entre ellas, la ecografía Doppler en color se considera crucial para evaluar a los pacientes con HS14,15. Esta modalidad de obtención de imágenes no invasiva y ampliamente disponible proporciona una visualización de alta resolución de las lesiones milimétricas subclínicas localizadas en la dermis y el tejido subcutáneo13.
En un estudio multicéntrico en el que participaron 143 pacientes con HS, Martorell et al. demostraron que la ecografía de alta frecuencia (HFUS), utilizando una sonda lineal con una imagen de alta frecuencia de 18MHz, mejoraba significativamente (p<0,01) la clasificación clínica de la enfermedad, modificando su enfoque terapéutico16. La delimitación del margen quirúrgico mediante ecografía aumentó significativamente la superficie extirpada en >3,5cm2 (p=0,004) y redujo la tasa de recidiva del 30% al 10% (p=0,10) frente a la delimitación clínica17. La ecografía preoperatoria ayuda a preservar las estructuras vasculonerviosas vecinas y preserva el tejido sano, lo que facilita la extirpación quirúrgica. También ayuda a otros abordajes quirúrgicos, como la extirpación de tractos sinusales, al identificar túneles adicionales y garantizar su extirpación completa18.
Se han definido algunos signos ecográficos para predecir la falta de respuesta al adalimumab, lo que permite una planificación preoperatoria más adecuada y oportuna. Estos signos incluyen la presencia de fibrosis del túnel de la pared19,20, vascularización20, y pseudoepitelización de las paredes del túnel, descrito como el signo del ferrocarril21. Recientemente, la elastografía cuantitativa por onda de cizallamiento, una nueva modalidad de imagen no invasiva que mide la elasticidad o rigidez tisular de los tejidos, ha mostrado resultados prometedores en la evaluación de la fibrosis de la HS22. Sin embargo, aún no se ha definido su función exacta en el contexto preoperatorio.
Anestesia localLa mayoría de las intervenciones quirúrgicas de la HS pueden realizarse con anestesia local, siendo la anestesia local tumescente (ALT) la más utilizada. La anestesia local tumescente consiste en la inyección subdérmica de grandes volúmenes (normalmente>100mL) de anestésicos locales muy diluidos, a menudo lidocaína tamponada con bicarbonato sódico23,24. Las ventajas de esta técnica incluyen la reducción de la hemorragia intra- y postoperatoria —también reducida por el uso rutinario de epinefrina junto con el agente anestésico—, la inflamación postoperatoria, el dolor o el riesgo de infección25,26, pero su uso en la cirugía de la HS no se ha comunicado ampliamente.
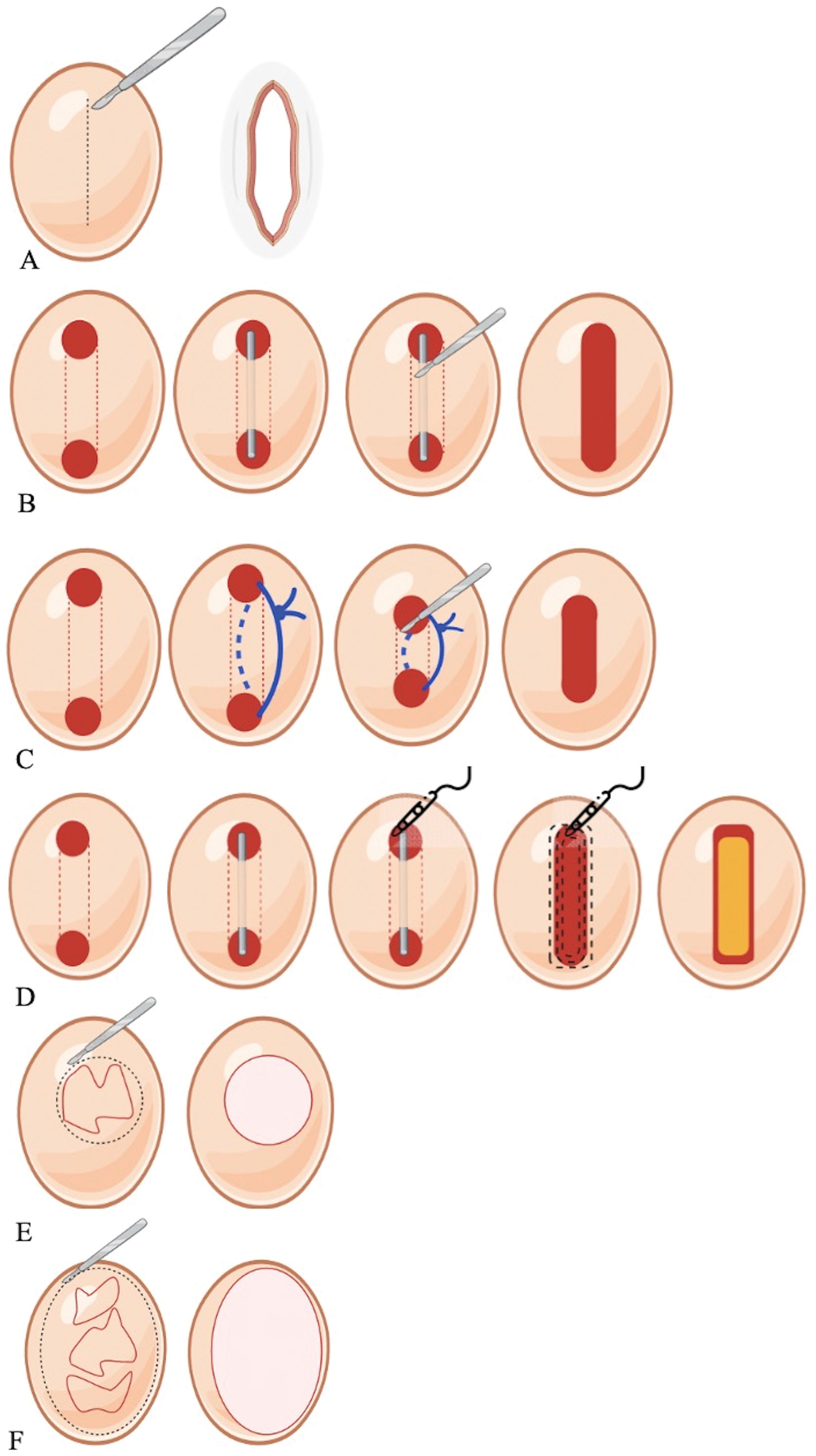
¿Qué tipo de cirugía debe seleccionarse para cada paciente?La cirugía de la HS consta de 2 partes principales: incisión y extirpación del tejido afectado (fig. 2) y cierre o reconstrucción del defecto quirúrgico. La elección de la técnica quirúrgica depende de factores como la extensión y la gravedad de la lesión o la zona anatómica afectada27,28, así como de las preferencias de los pacientes. Las tasas de recurrencia varían para cada técnica, siendo generalmente más altas cuando no se reseca todo el tejido afectado con un margen radical, oscilando entre el 26% en las escisiones parciales y el 5% en las escisiones regionales (p<0,01)29,30. Dado que pocos ensayos controlados aleatorizados han comparado diferentes técnicas, la calidad de la evidencia es baja31,32, lo que hace que la elección del tratamiento sea un reto importante.
- 1.
Incisión quirúrgica y drenaje
Este tratamiento se reserva para las lesiones agudas en forma de abscesos dolorosos fluctuantes. Suele tener un efecto temporal, con tasas de recurrencia cercanas al 100%, y en general debe evitarse a menos que se requiera un tratamiento sintomático del dolor28. Algunos autores prefieren el desbridamiento, con el que se consigue un alivio sintomático similar con menos recurrencias28.
- 2.
Destechamiento (deroofing)
El deroofing consiste en extirpar el «techo» de un nódulo, absceso o tracto sinusal33. Estas estructuras, incluidos los túneles epitelizados, contienen tejido inflamatorio activo, y su extirpación mediante esta cirugía limitada reduce la carga inflamatoria al tiempo que preserva el tejido sano adyacente, dejando una cicatriz cosméticamente aceptable33. Los candidatos ideales para este tratamiento son los pacientes con enfermedad limitada en estadio Hurley I o II localizada en la zona axilar o inguinal18. Las lesiones localizadas en la zona perianal o perineal deben investigarse previamente para descartar la presencia de fístulas colorrectales o urogenitales18.
Las lesiones se identifican clínicamente mediante visualización y palpación, y se delimitan preferiblemente con HFUS. Bajo anestesia local, una sonda roma insertada en las aberturas sinusales guía la extirpación del «techo» de la lesión con un bisturí, tijeras o un asa electroquirúrgica, dejando el suelo de la lesión expuesto a la cicatrización por segunda intención33. En pacientes con estadios I o II de Hurley, la tasa libre de recidiva del deroofing es del 83% tras una mediana de seguimiento de 34 meses, con una mediana de satisfacción de 8 en una escala de 0-1033. La ecografía puede identificar colecciones inflamatorias hipoecoicas o túneles epitelizados ocultos para un tratamiento adecuado18. El láser de CO2 se utiliza para cavidades profundas, grandes, interconectadas o recidivantes11. Para abscesos o túneles pequeños, puede utilizarse una técnica de mini-deroofing mediante una biopsia en sacabocados, un procedimiento que puede ser realizado en consulta34. Los setones (lazos de silicona no absorbentes) introducidos a través de las aberturas de un tracto sinusal y asegurados con nudos quirúrgicos pueden reducir la inflamación y el drenaje del tracto sinusal, facilitar la epitelización e inducir la migración gradual del tracto sinusal hacia la superficie de la piel, lo que da lugar a un deroofing espontáneo y a la resolución de las fístulas, o conduce a fístulas menos profundas más accesibles a la intervención quirúrgica35. En una serie retrospectiva de 34 casos de tractos sinusales (27 pacientes con HS en estadio Hurley II y Hurley III), la colocación de setones se asoció a una reducción significativa (p<0,001) del dolor y la profundidad del tracto sinusal36. En 16 casos no fue necesario ningún tratamiento adicional tras la extracción de los setones, 3 setones se extruyeron espontáneamente, 12 requirieron deroofing y 3 requirieron la escisión de las fístulas. En el seguimiento de 16 semanas, sólo se detectaron 2 recidivas (6%) (ambas tras la escisión radical)36. Por lo tanto, los setones son prometedores en el tratamiento quirúrgico de la HS, pero se necesitan más estudios para confirmar su perfil de seguridad y eficacia.
- 3.
Escisión con preservación del tejido cutáneo y exfoliación electroquirúrgica (STEEP)
Desarrollado para el tratamiento de lesiones de HS en los estadios II-III de Hurley, el STEEP extirpa todo el tejido afectado preservando la mayor cantidad posible de tejido sano para evitar contracturas, lo que es especialmente importante en los pliegues cutáneos, y facilita el cierre de la herida, que es más difícil cuando se ha realizado una extirpación regional37. Realizado bajo anestesia general, el STEEP comienza localizando los nódulos inflamatorios y la fibrosis mediante palpación o, preferiblemente, mediante la obtención de imágenes perioperatorias. Se sondean los tractos sinusales, se evalúa su extensión y el techo sinusal se somete a una incisión electroquirúrgica con una punta de asa de alambre, como en la técnica de deroofing. El tejido lesional y la fibrosis se extirpan mediante transecciones electroquirúrgicas tangenciales sucesivas, preservando en la medida de lo posible el suelo sinusal epitelizado y la grasa subcutánea. En esta técnica, se intenta preservar el suelo de los túneles no inflamados, mientras que los túneles inflamados se someten a un procedimiento de curetaje completo. Los márgenes de la herida se comprueban meticulosamente en busca de tractos sinusales residuales y se inyectan con acetónido de triamcinolona y bupivacaína para evitar la formación de tejido de granulación excesivo. Las heridas resultantes se dejan abiertas para que cicatricen por segunda intención37. Esta técnica incluye la extirpación completa del tejido fibrótico, lo que teóricamente conduce a una baja tasa de recidiva, aunque los informes indican una tasa de recidiva de hasta el 50% en el primer año38. No obstante, las pruebas existentes son limitadas, y consisten principalmente en series de casos que carecen de datos de seguimiento a largo plazo28. Por lo tanto, la STEEP debe reservarse para las lesiones limitadas solitarias o recidivantes32.
- 4.
Escisión lesional
La escisión lesional, también denominada escisión limitada, implica la extirpación restringida al tejido afectado. La escisión lesional suele consistir en la extirpación de cada lesión individual por separado, asegurando al mismo tiempo unos márgenes adecuados27,39. Principalmente reservada para lesiones solitarias, o un pequeño número de lesiones confinadas en áreas limitadas32, esta técnica se realizó inicialmente bajo anestesia local en pacientes en estadio Hurley I o II con lesiones recurrentes normalmente menores que el tamaño de la palma de una mano, logrando unos márgenes claros y permitiendo el cierre primario40. En una serie de 92 extirpaciones lesionales, Van Rappard et al. informaron de una tasa de recidiva del 23% tras una media de 10 meses, y una media de seguimiento sin recidiva de 27 meses40. Aunque las complicaciones fueron leves —incluidas hemorragias e infecciones—, se notificaron 20 casos (22%) de dehiscencia de sutura40.
- 5.
Escisión regional
La escisión regional —antes denominada escisión amplia— consiste en extirpar todas las lesiones dentro de la zona afectada en un único bloque, incluidos los nódulos, los túneles no inflamados, el tejido cicatricial y el tejido sano adyacente39,41. Aunque los márgenes de escisión pueden variar, se ha sugerido un margen de hasta 1cm en el tejido subcutáneo o que se extienda hasta la fascia41. Dado que estos procedimientos quirúrgicos pueden requerir resecciones amplias que afecten a los tejidos adyacentes, estos procedimientos suelen requerir la colaboración con otros especialistas, como urólogos, cirujanos generales o cirujanos plásticos. Las tasas de recurrencia tras la escisión regional van del 5% al 18%29,41, las más bajas entre los procedimientos quirúrgicos. Por este motivo, tradicionalmente se ha considerado el tratamiento quirúrgico de elección para la HS, especialmente en los casos graves27,37. Actualmente se recomienda la escisión regional para la HS Hurley III con el fin de prevenir nuevas recidivas32.
Opciones de reconstrucción tras la escisión regionalAunque la escisión regional es una técnica óptima para tratar la HS, las grandes áreas de herida resultantes pueden provocar contracturas y tiempos de cicatrización prolongados. Existen varios métodos para tratar el defecto, cada uno de ellos con diferentes tasas de recurrencia y complicaciones, que requieren un conocimiento adecuado para una selección apropiada42,43.
- 1.
Sutura primaria
El cierre primario puede considerarse para escisiones menores rodeadas de piel laxa, especialmente en lesiones de pequeño tamaño y casos de HS de grado bajo27,44. Aunque puede ser la técnica de cierre preferida por los pacientes27, se asocia con las tasas más altas de recidiva entre las técnicas de cierre (70%)45. Se recomienda el cierre holgado de la herida, ya que permite el drenaje del exudado y reduce el riesgo de seroma e infección44. También puede producirse dehiscencia de la herida, cicatrización y contracturas, por lo que no es aconsejable el cierre bajo tensión24.
- 2.
Cicatrización por segunda intención
Consiste en permitir el cierre de la herida mediante el proceso natural de granulación, retracción y epitelización44. Es el método de elección para técnicas como el deroofing o el STEEP33,37, con un tiempo medio de cierre de la herida variable según la zona de la herida desde 14 hasta 53 días33,38. Además, también es útil para escisiones regionales de hasta 140cm2, sobre todo en la zona anogenital, troncular o axilar24, con tasas de recidiva cercanas al 12%46. En estos casos, se asocia a cicatrices cosméticas de menor tamaño que el defecto inicial, sin cicatrización adicional de las zonas donantes, y evitando pérdidas significativas de movilidad11,24,44. Sin embargo, la cicatrización por segunda intención requiere tiempos de cicatrización prolongados y la necesidad de un cuidado meticuloso de la herida y de cambios de apósito44. También existe el riesgo de contractura de la herida, especialmente con escisiones de mayor tamaño44.
- 3.
Injertos de piel de grosor parcial (STSG)
Los STSG, recogidos de muslos o nalgas y expandidos en una proporción de 3:1 con múltiples incisiones, se utilizan ampliamente para heridas grandes, con un riesgo mínimo de complicaciones. Tradicionalmente, los injertos se aplicaban sobre el tejido de granulación tras un acondicionamiento prolongado de la herida24,44. Sin embargo, los injertos tienen buenas propiedades hemostáticas y pueden realizarse en un único acto quirúrgico inmediatamente después de la escisión, especialmente si se utilizan dispositivos de presión negativa para promover el tejido de granulación47. El STSG proporciona resultados aceptables, sobre todo en zonas como las axilas y las nalgas, donde la contracción del injerto o los cambios de color no causan problemas funcionales o estéticos importantes24,44. Se han descrito buenos resultados con un abordaje en 2 fases, aplicando primero un injerto de dermis artificial y después un injerto de piel normal48. Este abordaje es especialmente útil en casos en los que deben realizarse escisiones amplias y profundas, evitando las deformidades por depresión y la falta de flexibilidad del tejido44,48.
- 4.
Colgajos cutáneos
La reconstrucción de defectos con colgajos ofrece una calidad superior de cierre cutáneo y puede evitar contracturas y cicatrices graves frente a otras técnicas reconstructivas. Sin embargo, los colgajos plantean dificultades, como unos procedimientos de extracción más complejos e invasivos y un mayor riesgo de complicaciones, como necrosis tisular o hemorragia44. Dado que pueden producirse recidivas locales si la piel movilizada se ve afectada por la HS, los procedimientos con colgajos sólo pueden llevarse a cabo cuando pueden garantizarse unos márgenes limpios44. Los procedimientos con colgajos son esenciales para cubrir estructuras anatómicas vitales, como los haces neurovasculares expuestos. Aunque se han descrito varias técnicas de colgajo en función de la localización anatómica49, hasta la fecha no se ha reconocido ninguna técnica de referencia50.
ConclusionesEl tratamiento quirúrgico precoz de la HS, junto con la terapia médica, puede representar el estándar de elección para la HS. Dada la mayor tasa de recidiva asociada a dejar remanentes de tejido lesional, las extirpaciones deroofing, STEEP o parciales pueden considerarse procedimientos de elección para los estadios Hurley I-II, mientras que las extirpaciones regionales son preferibles para la enfermedad Hurley II-III más grave. Las técnicas de reconstrucción pueden variar, dependiendo principalmente de la extensión del defecto y de la zona afectada. En todos los casos, una buena planificación preoperatoria y la delimitación con pruebas de imagen —preferiblemente intra- o perioperatorias— facilitan la extirpación completa del tejido afectado, preservan las estructuras sanas, reducen las recidivas y nos permiten beneficiarnos de la ventana de oportunidad quirúrgica.
Conflicto de interesesLM no ha declarado ningún conflicto de intereses. EV ha percibido honorarios por consultoría/ponencia y/o ha participado en ensayos clínicos patrocinados por Abbvie, Almirall, Amgen, Bayer, Biofrontera, Boehringer Ingelheim, Celgene, Galderma, Gebro, Isdin, Janssen, Leo-Pharma, Lilly, Merck-Serono, MSD, Novartis, Pfizer, Roche, Sandoz, Sanofi, UCB. L. Puig ha recibido honorarios por consultoría/ponencia y/o ha participado en ensayos clínicos patrocinados por Abbvie, Almirall, Amgen, Biogen, Boehringer Ingelheim, Bristol Myers Squibb, Fresenius-Kabi, Horizon (DSMB), J&J Innovative Medicine, Leo-Pharma, Lilly, Novartis, Pfizer, STADA, Sun-Pharma, Takeda y UCB.