La urticaria crónica (UC) es una enfermedad debilitante cuyo tratamiento es principalmente sintomático. El estudio UCREX tuvo como objetivo identificar el perfil de los pacientes con UC, el manejo de la enfermedad y la calidad de vida (CdV) en la práctica clínica diaria en España.
MétodosEstudio observacional, prospectivo, multicéntrico de 12 meses, que incluyó pacientes con UC de novo o establecida que acudieron a la consulta de dermatología/alergología de 39 hospitales españoles. Las variables principales fueron: el Urticaria Activity Score (UAS) y el UAS por siete días (UAS7). Las variables secundarias fueron: el cuestionario de CdV de urticaria crónica (CU-Q2oL), el EuroQol-5 Dimensiones (EQ-5D), la escala Medical Outcomes Study Sleep (MOS-Sleep) y la escala hospitalaria de ansiedad y depresión (HADS).
ResultadosSe incluyeron 361 pacientes, de los cuales 176 (48,8%) formaron parte del análisis del objetivo principal. La edad media (DE) fue de 46,6 (14,2) años y el 71,8% eran del sexo femenino. El año anterior al periodo de inclusión de los pacientes, la mayoría de ellos (57,1%) se habían tratado con antihistamínicos H1 no sedantes (AHNS-H1). En la basal, se registró una media (DE) de 3,6 (6,8) de visitas a atención primaria. La media (DE) del UAS7 en la basal fue de 14,3 (11,0) y del CU-Q2oL 24,1 (17,0), observándose una tendencia en la mejoría en 8,6 (9,7) y 13,9 (15,0), respectivamente, a los 12 meses. El MOS-Sleep y el EQ-5D se mantuvieron estables durante el estudio, excepto por el dolor/malestar y la ansiedad/depresión que pasaron de 58,7 y 49,6% a 29,6 y 26,9%, respectivamente. En situación basal, el HADS mostró una ansiedad media (DE) de 8,7 (4,5) y una depresión de 5,1 (4,4), disminuyendo respectivamente a 7,0 (4,3) y 4,7 (4,3) a los 12 meses.
ConclusionesAunque la mayoría de los pacientes son tratados con AHNS-H1, la actividad de la enfermedad sigue siendo importante, afectando negativamente a su CdV, su actividad laboral y repercutiendo negativamente en el uso de recursos sanitarios. Un manejo adecuado de la enfermedad podría ser la base para alcanzar el control de los síntomas, la mejora de la CdV y la optimización de los recursos sanitarios necesarios.
Chronic Urticaria (CU) is a debilitating disease whose treatment is mainly symptomatic. UCREX study aimed to identify CU patients’ profile, disease management and quality-of-life (QoL) in daily clinical practice in Spain.
MethodsObservational, 12-months prospective, multicenter study, included de novo or established CU patients attending to dermatology/allergy consultations in 39 Spanish hospitals. Main variables: Urticaria Activity Score (UAS), UAS over 7 days (UAS7). Secondary variables: CU-QoL Questionnaire (CU-Q2oL), EuroQol-5 dimensions (EQ-5D), Medical Outcomes Study Sleep (MOS-Sleep) scale, Hospital Anxiety and Depression Scale (HADS).
Results361 patients included. Of them, 176 (48.8%) considered for the main objective analysis. Mean age (SD) of 46.6 (14.2) years and 71.8% women. The year prior to inclusion, most patients (57.1%) were treated with non-sedating H1-antihistamines (NS-H1AH). At baseline, mean (SD) 3.6 (6.8) visits were registered to primary care. Mean (SD) UAS7 at baseline was 14.3 (11.0) and CU-Q2oL 24.1 (17.0) which tended to improve by 8.6 (9.7) and 13.9 (15.0), respectively, at 12-months. MOS-Sleep and EQ-5D remained steady during the study, except pain/discomfort and anxiety/depression which went from 58.7% and 49.6% to 29.6% and 26.9%, respectively. At baseline, HADS showed a mean (SD) anxiety of 8.7 (4.5) and depression 5.1 (4.4), decreasing to 7.0 (4.3) and 4.7 (4.3), respectively, at 12-months.
ConclusionsAlthough most CU patients are treated with NS-H1AH, disease activity is still important, negatively affecting patients’ QoL, work activity and healthcare resources use. An appropriate disease management could be the basis for symptoms control, QoL improvement and resources optimization.
La urticaria crónica (UC) es una enfermedad cutánea caracterizada por la presencia de habones, con eritema, inflamación, prurito y, en algunos casos, de ardor y dolor, durante al menos seis semanas, acompañados o no de angioedema1–3. Se estima que entre el 8-20% de la población es susceptible de experimentar al menos un episodio de urticaria a lo largo de su vida1,2. Basado en el estudio de Gaig et al., la prevalencia de la UC en España es del 0,6%, siendo dos veces más prevalente entre las mujeres que en los hombres. La edad promedio de aparición de la UC es alrededor de los 40 años3,4. La UC se puede clasificar en urticaria crónica espontánea (UCE) donde los síntomas persisten por más de seis semanas sin un desencadenante específico conocido y la urticaria crónica inducible (CINDU), inducida por desencadenantes específicos3.
Varios estudios indican que la UC afecta negativamente a la calidad de vida (CdV) de los pacientes, así como a la actividad laboral1,2,5, teniendo un impacto considerable en los costos directos e indirectos relacionados con la salud6. La UC no tiene cura y, por lo tanto, el manejo apropiado de los síntomas de la enfermedad será crucial. Las pautas actuales recomiendan antihistamínicos H1 no sedantes (AHNS-H1) en dosis autorizadas como primera línea de tratamiento para la UC3. En el caso de que los pacientes no respondan, se podría incrementar la dosis de AHNS-H1 hasta en cuatro veces. Si se necesitara una tercera línea, la opción recomendada es agregar omalizumab al tratamiento, seguida de ciclosporina A como cuarta línea de tratamiento, cuando el paciente no responde a omalizumab. Se puede considerar el uso de corticosteroides sistémicos por periodos cortos en caso de exacerbaciones severas1,3,6,7.
Si bien las guías indican una pauta para el manejo de los pacientes con UC, la experiencia clínica en su manejo será la piedra angular para una correcta individualización del tratamiento, lo que permitirá que los resultados obtenidos sean más efectivos8. En este sentido, el estudio UCREX fue diseñado para comprender el perfil de los pacientes con UC, el manejo clínico, el impacto de la UC en la CdV de los pacientes y el uso de los recursos sanitarios (URS) en la práctica clínica diaria en España.
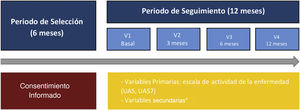
Materiales y métodosDiseño del estudioUCREX es un estudio observacional, multicéntrico y prospectivo (12 meses) realizado en España entre el 31 de mayo de 2013 y el 31 de enero de 2015. Participaron 39 hospitales y 42 investigadores (21 dermatólogos y 21 alergólogos). Los pacientes incluidos tenían ≥ 18 años, con el diagnóstico de novo o previo de UCE o CINDU y quienes se encontraban bajo seguimiento en los servicios de alergología o dermatología. Se excluyeron aquellos pacientes con urticaria aguda, vasculitis urticariana u otro tipo de urticaria física no asociada a la UC, angioedema en ausencia de habones o prurito relacionado con enfermedades cutáneas o que participaban en cualquier otro estudio.
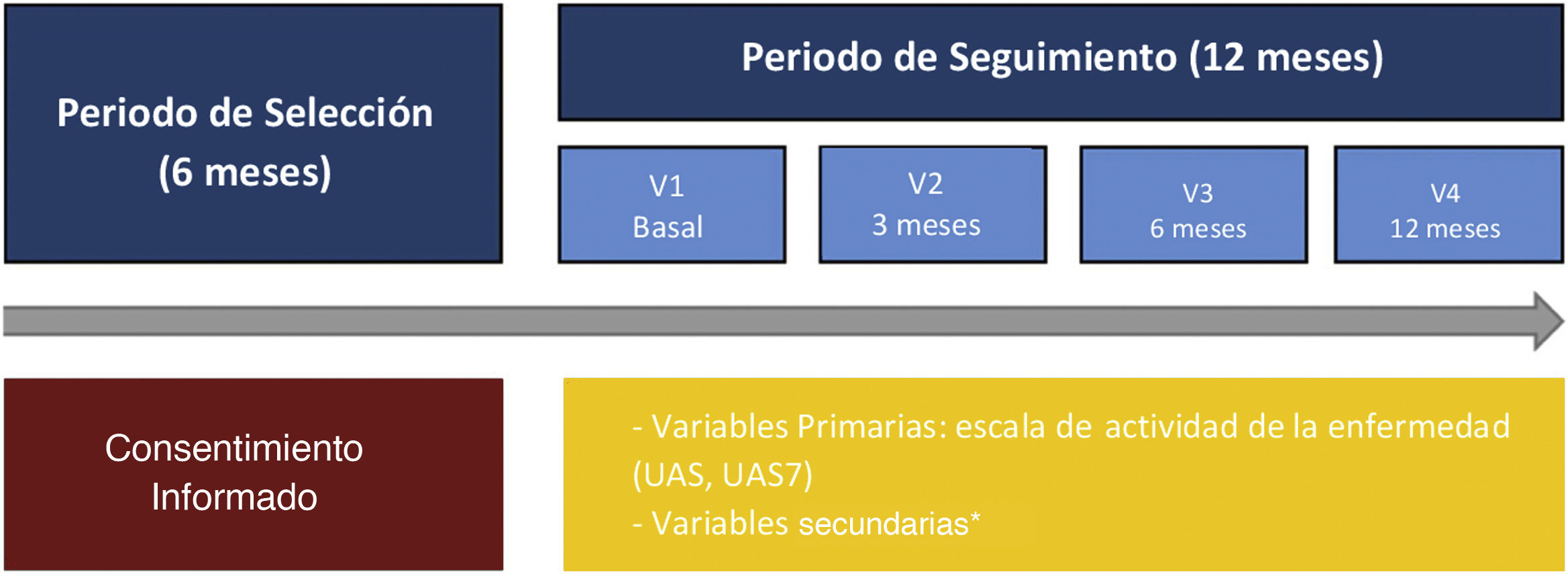
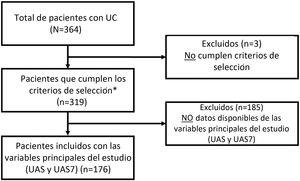
El estudio se estructuró en cuatro visitas (visita basal, a los 3, 6 y a los 12 meses). Los datos basales del estudio se registraron utilizando un cuaderno de recogida de datos electrónico ad hoc (eCRF). Los resultados informados por los pacientes (PROs) fueron registrados usando cuestionarios físicos, los cuales posteriormente se transcribieron en la base de datos del estudio. Los datos relacionados con la práctica clínica diaria se extrajeron de las historias clínicas y se completaron los siguientes cuestionarios: el Urticaria Activity Score (UAS) y el UAS durante siete días (UAS7) para evaluar los signos y síntomas clave de la urticaria, el cuestionario de CdV de urticaria crónica (CU-Q2oL), el EuroQol-5 dimensiones (EQ-5D), la escala de de Medical Outcomes Study Sleep (MOS-Sleep) y la escala de Ansiedad y Depresión Hospitalaria (HADS) (fig. 1)9.
Diseño del estudio desde el periodo de selección hasta el seguimiento.
*HADS, HRQoL (CU-Q2oL, EQ-5D), MOS-Sleep, datos sociodemográficos y antropométricos, características clínicas de urticaria, comorbilidades asociadas, recursos directos usados debidos a la UC, circuito de derivación, días de ausentismo laboral, tiempo desde el inicio de los síntomas hasta el diagnóstico de la UC.
CU-Q2oL: Cuestionario de la Calidad de vida asociada a la Urticaria Crónica; EQ-5D: EuroQol-5 dimensiones; HADS: Escala de Ansiedad y depresión hospitalaria; HRQoL: Calidad de vida relacionada con la Salud; MOS-Sleep: Medical Outcomes Study Sleep scale; UAS: Urticaria Activity Score; UAS7: Urticaria Activity Score durante siete días; UC: urticaria crónica; V: visita.
Las variables principales del estudio fueron el UAS y el UAS7. Las variables secundarias incluyeron: datos sociodemográficos y clínicos, comorbilidades asociadas, manejo de la enfermedad, patrones terapéuticos, recursos sanitarios directos y PROs. Se utilizaron los cuestionarios CU-Q2oL y EQ-5D para evaluar los síntomas y el impacto de la UC en la CdV10–12. Para evaluar el impacto de la enfermedad en la calidad del sueño se utilizó la escala de MOS-Sleep13,14. El cuestionario HADS se utilizó para medir los niveles de ansiedad y la depresión hospitalaria15,16.
Para la recogida de los recursos asistenciales directos asociados a la UC se analizó el número de ingresos hospitalarios, las visitas a atención primaria (AP), urgencias, alergología y dermatología, las pruebas diagnósticas realizadas antes y durante el estudio y los tratamientos prescritos.
Métodos estadísticosLa estimación del tamaño de la muestra se basó en la prevalencia del 0,6% de la UC en España4 con una precisión del 5,5%, estimando una proporción máxima de incertidumbre y mayor variabilidad del 50% y un intervalo de confianza del 95%, considerando un 5% de pérdidas. Un total de 335 pacientes fue el número de pacientes estimado para recoger un tamaño de muestra que fuese representativo para el estudio.
Se realizó un análisis estadístico de los pacientes disponibles y análisis descriptivos de todas las variables por separado, utilizando tablas de frecuencia absolutas y relativas para variables cualitativas y cuantitativas discretas, y mediante promedio, desviación estándar (DE), valores extremos y cuartiles, para variables cuantitativas continuas. Para todas las comparaciones se consideró un nivel de significación estadística del 0,05. Se utilizó el paquete estadístico Statistical Analysis System (SAS) versión 9.2 o posterior para Windows.
Consideraciones éticasEl estudio se ha realizado siguiendo los principios éticos de la Declaración de Helsinki y las directrices especificadas en la Orden SAS/3470/2009 de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). El protocolo, consentimiento informado y demás información de los pacientes fueron aprobados por el Comité Ético de Investigación Clínica (CEIC) de referencia del Hospital del Mar (IMIM de Barcelona), así como por todos los CEIC y comunidades autónomas de los hospitales participantes, según fuera necesario. Todos los pacientes firmaron un consentimiento informado por escrito antes de ser incluidos en el estudio.
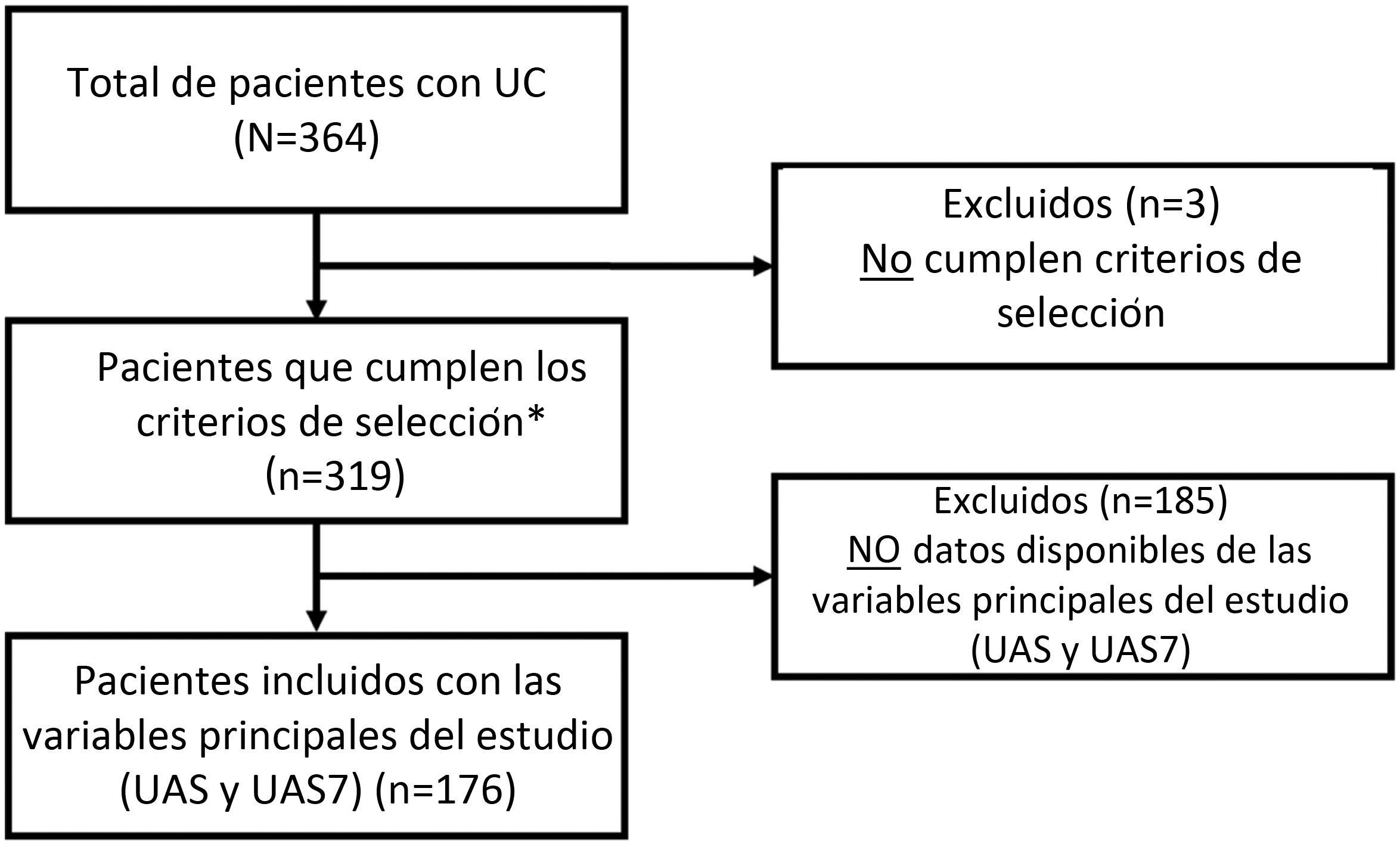
ResultadosInicialmente se incluyeron un total de 364 pacientes con el diagnóstico de UC. La muestra basal estaba constituida por 361 pacientes que cumplían todos los criterios de selección. Para el análisis del objetivo principal, se evaluaron 176 pacientes: utilizando aquellos en los que se contaban con los datos necesarios para valorar la variable principal (UAS / UAS7) y que habían recibido un tratamiento específico para la UC en la visita de 12 meses (fig. 2).
Diagrama de flujo de la selección de la población de estudio.
*Pacientes incluidos para las variables secundarias (pacientes disponibles): HADS (n = 361), HRQoL (CU-Q2oL: n = 361, EQ-5D; n = 361), MOS-Sleep (n = 361), datos sociodemográficos y antropométricos (n = 361), características clínicas de urticaria (n = 361), comorbilidades asociadas (n = 236), recursos directos utilizados debido a la UC (n = 361), circuito previo de derivación (n = 351), días de ausentismo laboral (n = 195 durante el año previo al periodo de inclusión del estudio), tiempo desde el inicio de los síntomas hasta el diagnóstico de UC (n = 361).UC: urticaria crónica; CU-Q2oL: Cuestionario de la Calidad de vida asociada a la Urticaria Crónica; EQ-5D: EuroQol-5 dimensiones; HADS: Escala de Ansiedad y depresión hospitalaria; HRQoL: Calidad de vida relacionada con la Salud; MOS-Sleep: Medical Outcomes Study Sleep scale; UAS: Urticaria Activity Score; UAS7: Urticaria Activity Score durante siete días.
Las características sociodemográficas y clínicas basales de la población de estudio se recogen en la tabla 1. Los pacientes incluidos en el estudio tenían una edad media (DE) de 46,6 años (14,2), eran principalmente del sexo femenino (71,8%) y 152 (42,1%) pacientes habían presentado angioedema en alguno de los episodios/brotes de urticaria. La mayoría de los pacientes (n = 345; 95,6%) fueron diagnosticados de UCE, asociada a CINDU en el 38,6% de los casos. Solo 16 pacientes (4,4%) fueron diagnosticados con CINDU (no asociada a UCE). De los 361 de los pacientes incluidos en el estudio, 199 estaban trabajando activamente (55,1%) (tabla 1). Dentro de estos pacientes activos, 195 (98,0%) presentaron ausentismo laboral en el año previo al periodo de inclusión del estudio y 147 (73,9%) durante los 12 meses del estudio, con una media (DE) de 2,7 (17,5) y 4,8 (37,4) días, respectivamente.
Características sociodemográficas y clínicas basales de la población de estudio (pacientes que cumplen todos los criterios de selección)
| Población(n = 361) | |
|---|---|
| Datos sociodemográficos | |
| Sexo (femenino), n (%) | 259 (71,8) |
| Edad (años), media (DE) | 46,6 (14,2) |
| Peso (kg), media (DE)* | 72,2 (13,9) |
| Altura (cm), media (DE)¥ | 165,3 (8,7) |
| Grupo étnico, n (%) | |
| Caucásico | 345 (95,6) |
| Africano | 1 (0,3) |
| América del sur | 9 (2,5) |
| Asiático | 0 (0,0) |
| Árabe | 4 (1,1) |
| Otros | 1 (0,3) |
| No disponible | 1 (0,3) |
| Situación laboral, n (%) | |
| Activo a tiempo completo | 167 (46,3) |
| Activo a tiempo parcial | 32 (8,9) |
| Desempleado | 36 (10,0) |
| Pensionista | 47 (13,0) |
| Estudiante | 15 (4,2) |
| Ama de casa | 52 (14,4) |
| No disponible | 12 (3,3) |
| Datos clínicos | |
| Diagnóstico de UCE, n (%) | 345 (95,6) |
| UCE asociada a CINDU, n (%) | 133 (38,6) |
| CINDU, n (%) | 16 (4,4) |
| Tiempo desde el inicio de los síntomas (meses), media (DE) | 65,1 (81,2) |
| Tiempo desde el diagnóstico de urticaria (meses), media (DE) | 39,5 (57,6) |
| Brotes en el año anterior a la inclusión, media (DE) | 14,9 (50,7) |
| Pacientes con angioedema en cualquier episodio/brote de urticaria, n (%) | |
| Si | 152 (42,1) |
| No | 208 (57,6) |
| No disponible | 1 (0,3) |
| Exacerbaciones en el año anterior a la inclusión, media (DE) | 7,2 (27,2) |
| Comorbilidades, n (%) | 236 (65,4) |
| Antecedentes de atopia | 92 (25,5) |
| Hipotiroidismo | 45 (12,5) |
| Exacerbación de UC por AINES | 37 (10,3) |
| Otras patologías autoinmunes asociadas | 32 (8,9) |
| Urticaria aguda inducida por AINES | 18 (5,0) |
| Infecciones previas o concomitantes | 14 (3,9) |
| Otro tipo de enfermedades tiroideas | 13 (3,6) |
| Anafilaxia | 7 (1,9) |
| Hipertiroidismo | 7 (1,9) |
| Hábitos, como el uso de canabis | 0 (0,0) |
| Otras comorbilidades | 131 (36,3) |
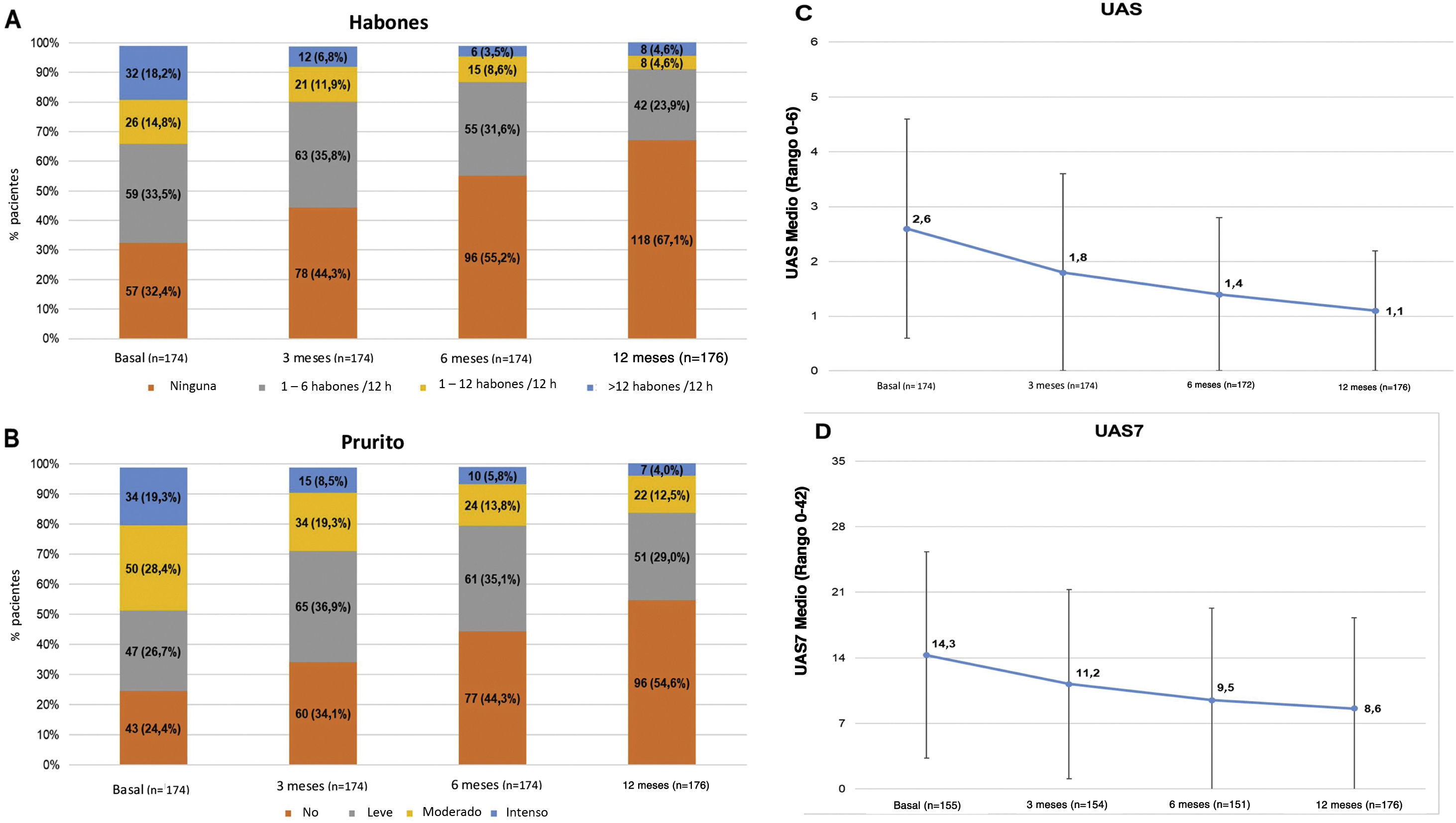
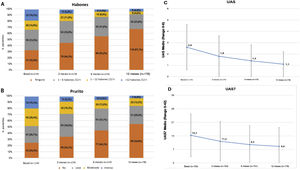
En el presente estudio, el 75,6% de los pacientes con UC presentaban síntomas (UAS7 > 0) en la visita de los 12 meses a pesar de haber recibido el tratamiento recomendado por las guías de práctica clínica. Entre los pacientes que respondieron a los cuestionarios (n = 176), la incidencia de habones y/o prurito tendió a reducirse según la escala UAS entre la visita basal y la visita a los 12 meses (117 [66,5%] y 131 [74,4%] pacientes con habones y prurito, respectivamente, al inicio del estudio frente a 58 [33,0%] y 80 [45,5%] pacientes en la visita a los 12 meses, respectivamente). Las puntuaciones medias (DE) UAS y UAS7 también tendieron a disminuir a lo largo del estudio (2,6 [2,0] y 14,3 [11,0], presentando 1,1 [1,5] al inicio frente a 8,6 [9,7] a los 12 meses, respectivamente). Aunque las reducciones de la puntuación UAS y UAS7 se relacionaron con la mejoría de los síntomas, la gravedad de la enfermedad en estos pacientes en la visita a los 12 meses se clasificó como moderada para 22 pacientes (12,5%) y como intensa para siete pacientes (4,0%) (fig. 3).
Descripción de la actividad de la UCE estratificada por habones, prurito, UAS y puntuaciones medias de UAS7 por visita.
Valores medios de Habones (A), prurito (B), UAS (C) y UAS7 (D) durante la visita.
Población evaluada (n = 176).
Prurito leve: prurito presente pero no irritante o desagradable; prurito moderado: picor desagradable, pero sin interferir con las actividades de la vida diaria del paciente o con el sueño del paciente; prurito intenso: picor grave, lo suficientemente molesto para interferir con las actividades de la vida diaria del paciente y con el sueño del paciente.
h: horas; UAS: Urticaria Activity Score; UAS7: Urticaria Activity Score durante siete días; UCE: urticaria crónica espontánea.
Para estudiar el manejo de los pacientes con UC se tuvo en cuenta el siguiente periodo de tiempo: del año anterior a la inclusión hasta la visita de los 12 meses. Durante el año anterior a la inclusión, los servicios de urgencias tuvieron una media (DE) de 1,6 (2,8) de consultas por UC (n = 355), tendiendo a reducirse a 0,3 (1,3) durante los 12 meses del estudio (n = 268). Apenas fue necesario el ingreso hospitalario de los pacientes en el año anterior a su inclusión en el estudio (n = 357; media [DE] de 0,0 [0,1]) y durante los 12 meses del estudio (n = 268; media [DE] de 0,0 [0,2]). Los centros de AP fueron el destino de referencia prioritario en el manejo de la UC durante el año previo a la inclusión en el estudio (n = 340), con una media (DE) de 3,6 (6,8) visitas (alergología vs. dermatología [n = 358 en ambos casos], con 2,4 [4,3] y 2,6 [4,2] visitas, respectivamente). Los pacientes con UC fueron identificados inicialmente en los centros de AP (294 pacientes, 81,9%) y posteriormente derivados para la confirmación del diagnóstico y el seguimiento, siendo mayor la derivación a los servicios de dermatología (155 pacientes, 42,9%) que a los servicios de alergología (139 pacientes, 38,5%). Después de ser derivados a los especialistas, los pacientes con UC tuvieron una media (DE) de 1,7 (3,3) visitas de seguimiento a los servicios de alergología y 1,4 (2,8) a los servicios de dermatología al año.
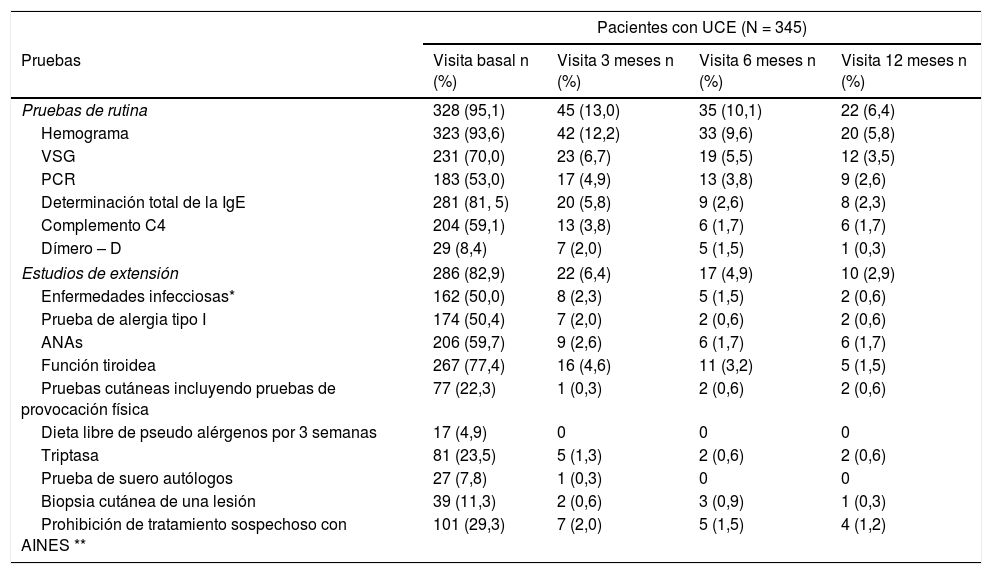
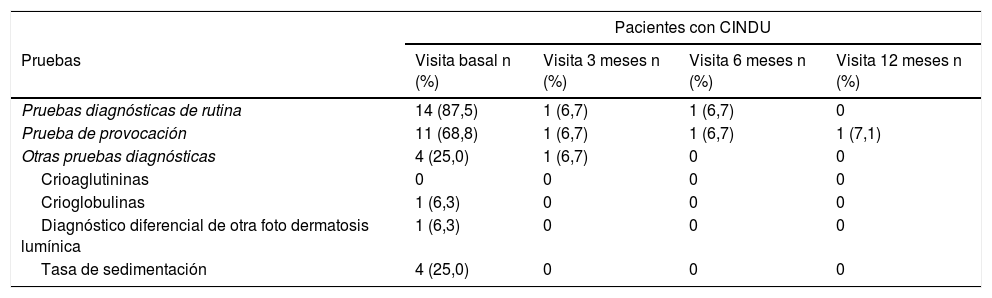
Se realizaron pruebas diagnósticas en 328 (95,1%) de los pacientes con UCE, siendo el hemograma la prueba más utilizada (323 pacientes, 93,6%). También se realizaron otras pruebas complementarias en 286 pacientes (82,9%) (tabla 2). En cuanto a los pacientes con CINDU (n = 16), 14 pacientes (87,5%) fueron sometidos a pruebas diagnósticas en el momento de la inclusión, siendo las pruebas de provocación las más frecuentes (11 pacientes, 68,8%) (tabla 3).
Pruebas diagnósticas realizadas a pacientes con UCE durante todo el estudio UCREX
| Pacientes con UCE (N = 345) | ||||
|---|---|---|---|---|
| Pruebas | Visita basal n (%) | Visita 3 meses n (%) | Visita 6 meses n (%) | Visita 12 meses n (%) |
| Pruebas de rutina | 328 (95,1) | 45 (13,0) | 35 (10,1) | 22 (6,4) |
| Hemograma | 323 (93,6) | 42 (12,2) | 33 (9,6) | 20 (5,8) |
| VSG | 231 (70,0) | 23 (6,7) | 19 (5,5) | 12 (3,5) |
| PCR | 183 (53,0) | 17 (4,9) | 13 (3,8) | 9 (2,6) |
| Determinación total de la IgE | 281 (81, 5) | 20 (5,8) | 9 (2,6) | 8 (2,3) |
| Complemento C4 | 204 (59,1) | 13 (3,8) | 6 (1,7) | 6 (1,7) |
| Dímero – D | 29 (8,4) | 7 (2,0) | 5 (1,5) | 1 (0,3) |
| Estudios de extensión | 286 (82,9) | 22 (6,4) | 17 (4,9) | 10 (2,9) |
| Enfermedades infecciosas* | 162 (50,0) | 8 (2,3) | 5 (1,5) | 2 (0,6) |
| Prueba de alergia tipo I | 174 (50,4) | 7 (2,0) | 2 (0,6) | 2 (0,6) |
| ANAs | 206 (59,7) | 9 (2,6) | 6 (1,7) | 6 (1,7) |
| Función tiroidea | 267 (77,4) | 16 (4,6) | 11 (3,2) | 5 (1,5) |
| Pruebas cutáneas incluyendo pruebas de provocación física | 77 (22,3) | 1 (0,3) | 2 (0,6) | 2 (0,6) |
| Dieta libre de pseudo alérgenos por 3 semanas | 17 (4,9) | 0 | 0 | 0 |
| Triptasa | 81 (23,5) | 5 (1,3) | 2 (0,6) | 2 (0,6) |
| Prueba de suero autólogos | 27 (7,8) | 1 (0,3) | 0 | 0 |
| Biopsia cutánea de una lesión | 39 (11,3) | 2 (0,6) | 3 (0,9) | 1 (0,3) |
| Prohibición de tratamiento sospechoso con AINES ** | 101 (29,3) | 7 (2,0) | 5 (1,5) | 4 (1,2) |
Población evaluable (n = 345).* Enfermedad infecciosa: Helicobacter pylori, Anisakis y otros. ** Indicación médica.
AINE: antiinflamatorio no esteroideo; ANA: anticuerpos antinucleares; IgE: inmunoglobulina E; PCR: proteína C reactiva; UCE: urticaria crónica espontánea; VSG: velocidad de sedimentación glomerular.
Pruebas diagnósticas realizadas a pacientes con CINDU durante todo el estudio UCREX
| Pacientes con CINDU | ||||
|---|---|---|---|---|
| Pruebas | Visita basal n (%) | Visita 3 meses n (%) | Visita 6 meses n (%) | Visita 12 meses n (%) |
| Pruebas diagnósticas de rutina | 14 (87,5) | 1 (6,7) | 1 (6,7) | 0 |
| Prueba de provocación | 11 (68,8) | 1 (6,7) | 1 (6,7) | 1 (7,1) |
| Otras pruebas diagnósticas | 4 (25,0) | 1 (6,7) | 0 | 0 |
| Crioaglutininas | 0 | 0 | 0 | 0 |
| Crioglobulinas | 1 (6,3) | 0 | 0 | 0 |
| Diagnóstico diferencial de otra foto dermatosis lumínica | 1 (6,3) | 0 | 0 | 0 |
| Tasa de sedimentación | 4 (25,0) | 0 | 0 | 0 |
Población evaluable (n = 16 en la visita basal, n = 15 a los 3 meses, n = 15 a la visita de los 6 meses, n = 14 a los 12 meses). El número de pruebas realizadas en pacientes con diagnóstico de CINDU se calculó en la población evaluable.
CINDU: urticaria inducible crónica.
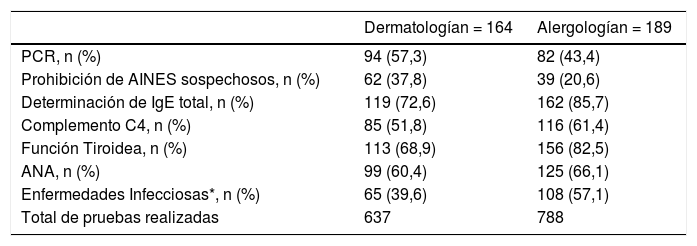
En cuanto a las pruebas de rutina solicitadas, se detectó una tendencia específica dependiente del tipo de especialidad, según fuese solicitada por dermatología o por alergología (n = 164 y n = 189 pacientes, respectivamente). En la visita basal, los servicios de alergología realizaron más pruebas diagnósticas (n = 788, 55,3%) que los de dermatología (n = 637, 44,7%) (tabla 4). Entre los pacientes con CINDU, se realizaron pruebas de rutina y pruebas de provocación en 26 (15,9%) y 28 (17,1%) pacientes en los servicios de dermatología, y a 47 (24,9%) y 26 (13,8%) pacientes en los servicios de alergología en la visita basal, respectivamente.
Pruebas diagnósticas realizadas a pacientes con UCE al inicio del estudio en los servicios de dermatología y alergología
| Dermatologían = 164 | Alergologían = 189 | |
|---|---|---|
| PCR, n (%) | 94 (57,3) | 82 (43,4) |
| Prohibición de AINES sospechosos, n (%) | 62 (37,8) | 39 (20,6) |
| Determinación de IgE total, n (%) | 119 (72,6) | 162 (85,7) |
| Complemento C4, n (%) | 85 (51,8) | 116 (61,4) |
| Función Tiroidea, n (%) | 113 (68,9) | 156 (82,5) |
| ANA, n (%) | 99 (60,4) | 125 (66,1) |
| Enfermedades Infecciosas*, n (%) | 65 (39,6) | 108 (57,1) |
| Total de pruebas realizadas | 637 | 788 |
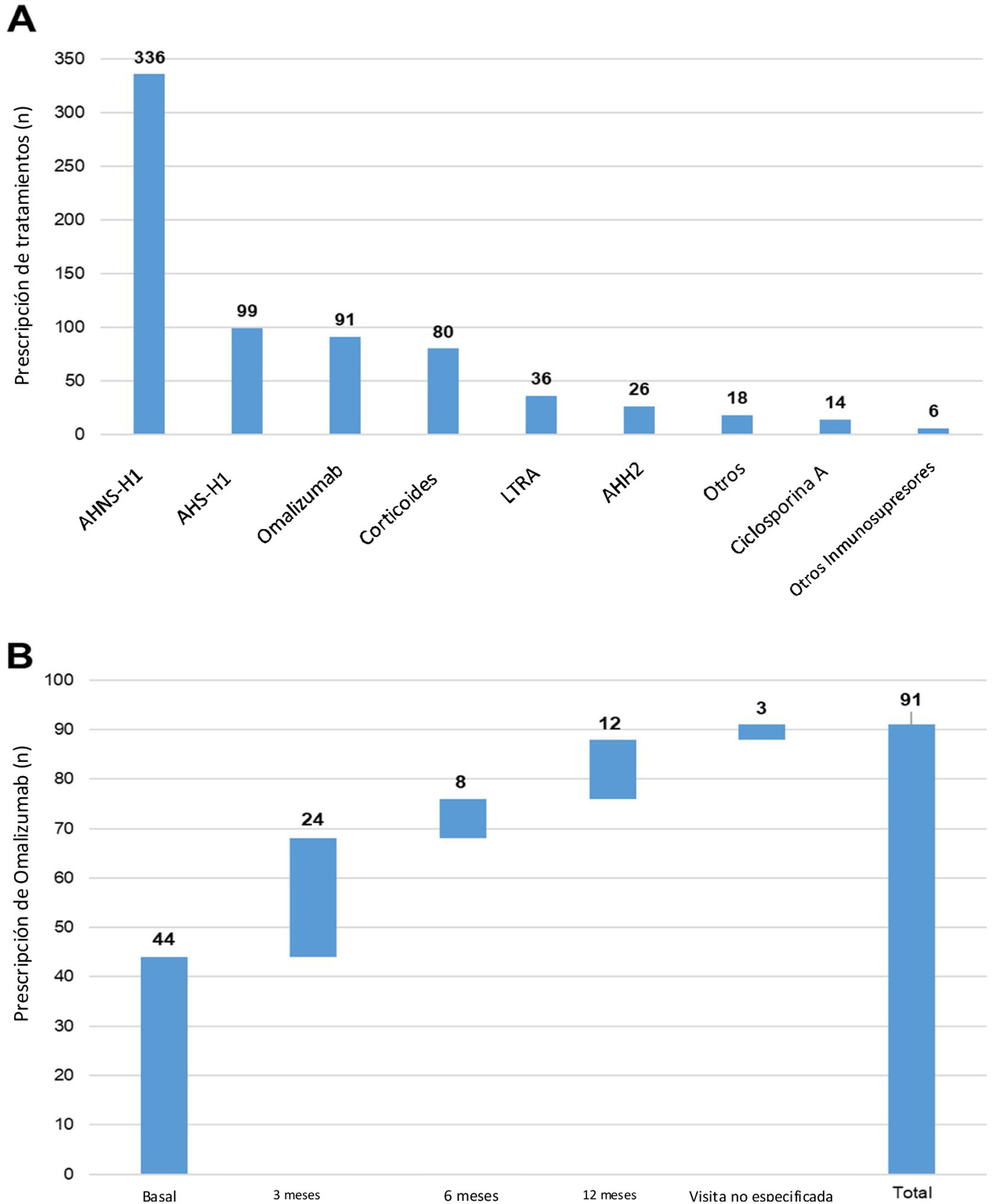
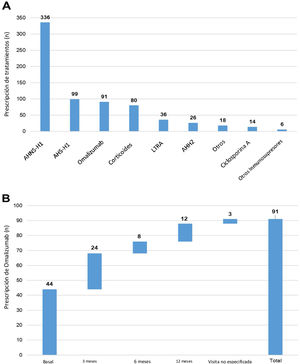
Durante el estudio UCREX realizado en España durante un año (336 pacientes, 47,6%), los AHNS-H1 fueron el tratamiento prescrito con mayor frecuencia entre los pacientes con UC (n = 706), seguidos de los antihistamínicos H1 sedantes (AHS-H1) (99 pacientes, 14,0%), omalizumab (91 pacientes, 12,9%) y corticoides (80 pacientes, 11,3%) (fig. 4). La prescripción de omalizumab estuvo presente a lo largo del estudio UCREX durante un año. La tendencia de prescribir omalizumab se observó mayoritariamente al inicio del estudio (44 prescripciones al inicio del estudio), aunque también ocurrió en visitas posteriores (24, 8 y 12 prescripciones en visitas de 3, 6 y 12 meses, respectivamente) (fig. 4).
Tratamientos prescritos a pacientes con UC en España durante el estudio UCREX y prescripción de omalizumab durante el estudio.
Tratamientos prescritos a pacientes con UC (A), prescripción de omalizumab (B).
Población evaluable (n = 361). Un paciente puede haber recibido tratamientos de diferentes familias. Los tratamientos pueden ser concomitantes y/o secuenciales.
AHH2: antihistamínicos H2; LTRA: antagonistas del receptor de leucotrienos; AINES: antiinflamatorios no esteroideos; AHNS-H1: antihistamínicos no-sedantes - H1; AHS-H1: antihistamínicos sedantes H1.
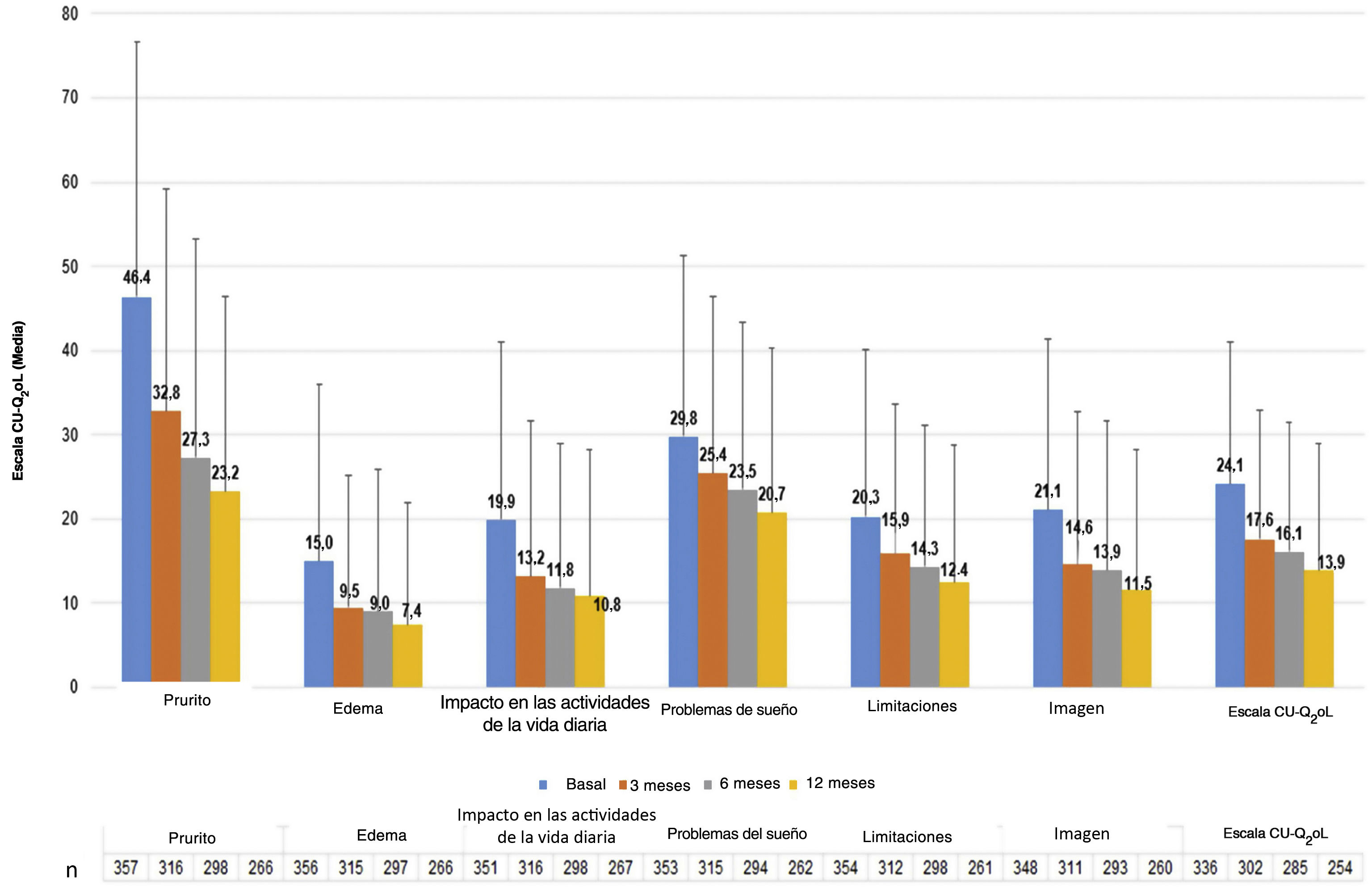
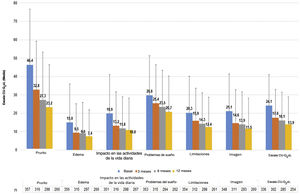
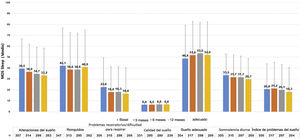
Los pacientes con UC presentaron una puntuación media (DE) de CU-Q2oL de 24,1 (17,0) en la visita basal (n = 336) y de 13,9 (15,0) en la visita de 12 meses (n = 254), siendo el prurito el principal síntoma con impacto negativo (46,4 (30,3) y 23,2 (23,2), respectivamente) (fig. 5). Según el cuestionario EQ-5D, en la visita basal (n = 357) 212 pacientes (58,7%) refirieron dolor/malestar, 179 pacientes (49,6%) ansiedad/depresión, 90 pacientes (24,9%) presentaron un impacto en las actividades de la vida diaria y 61 pacientes (16,9%) refirieron problemas de movilidad. Estos porcentajes se mantuvieron estables, excepto para el dolor/malestar y la ansiedad/depresión, que tendieron a disminuir en la visita de los 12 meses (n = 266: 107 [29,6%] y 97 [26,9%] pacientes, respectivamente). La puntuación media de la EVA (DE) fue de 68,4 (20,4) en la visita basal (n = 355), y tendió a aumentar a 73,6 (19,6) en la visita a los 12 meses (n = 266). La puntuación del índice se mantuvo estable durante el estudio (0,8 [0,2]) (n = 357 al inicio del estudio y n = 266 en la visita de 12 meses) (Apéndice A1).
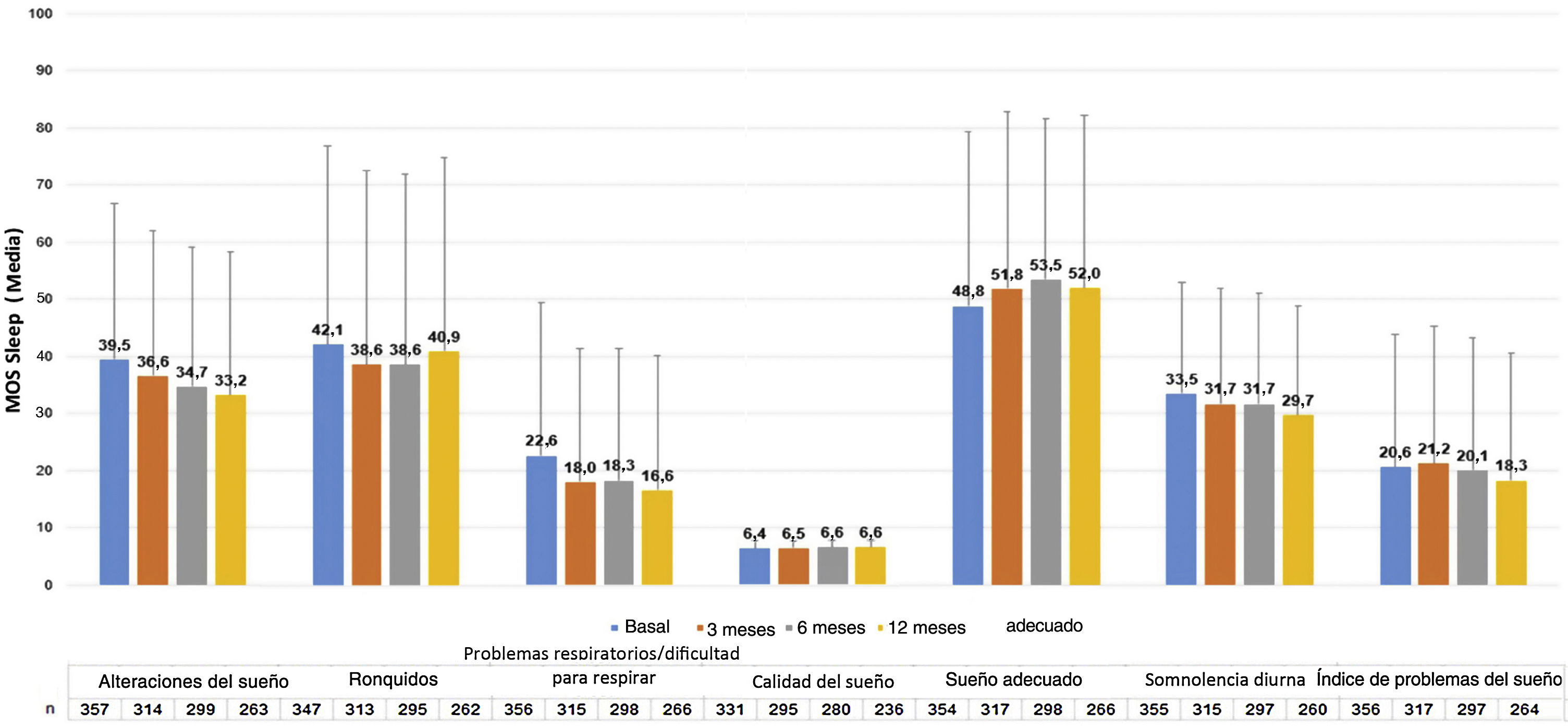
La escala MOS-Sleep estableció que la UC tuvo un impacto negativo en la calidad del sueño, y esta tendencia apenas mejoró con el tratamiento. Los pacientes durmieron una media (DE) de 6,4 (1,4) horas por noche en la visita basal (n = 331) y 6,6 (1,2) en la visita a los 12 meses (n = 236). La tendencia de las puntuaciones medias para las diferentes dimensiones apenas mejoró a lo largo del estudio (fig. 6).
Los niveles de ansiedad y depresión según la escala HADS se mantuvieron estables durante el año del estudio UCREX. El valor medio de ansiedad (DE) pasó de 8,7 (4,5) en la visita basal (n = 349) a 7,0 (4,3) en la visita de los 12 meses (n = 262), mientras que el valor medio (DE) de depresión pasó de 5,1 (4,4) (n = 345) a 4,7 (4,3) (n = 261), respectivamente.
DiscusiónEl estudio UCREX fue diseñado para identificar el porcentaje de pacientes con UC que permanecieron sintomáticos a pesar del tratamiento estándar establecido según la práctica clínica diaria en España. Los resultados del estudio sugieren que, aunque existe una tendencia positiva en el control de los síntomas a lo largo del tratamiento, al final del estudio se evidenció que una elevada proporción de los pacientes no estaban controlados de manera adecuada. Existen varias escalas validadas para la población española enfocadas al seguimiento de los síntomas de la UC. En este estudio utilizamos la escala UAS/UAS7, la herramienta validada y recomendada en las Guías Europeas EAACI/GA(2)LEN/EDF/WAO, para evaluar la actividad de la enfermedad1–3,5,17,18.
La mayoría de los pacientes con UC fueron tratados de acuerdo con las pautas estándar en el momento del inicio del estudio, disminuyendo la proporción de pacientes con habones y/o prurito en un 33,5% y un 28,9%, respectivamente, en la visita de los 12 meses. Sin embargo, el 75,6% de los pacientes con UC presentaban síntomas en la visita de los 12 meses, mostrando una actividad moderada de la enfermedad. Según estudios previos realizados en la práctica clínica diaria, menos del 50% de los pacientes con UCE responden al tratamiento con dosis autorizadas de AHNS-H13, posiblemente debido a un retraso considerable entre el diagnóstico y la derivación al especialista, una falta de adherencia a las guías clínicas de la urticaria5 o por falta de eficacia de los antihistamínicos H1. Adicionalmente, el control subóptimo de los síntomas de la UC podría explicarse por la falta de adherencia terapéutica, como se demostró con los AHS-H1, que podría atribuirse a sus efectos anticolinérgicos y sedantes6.
Una limitación del presente estudio es la falta de datos relativos a la adherencia, la interrupción y los cambios de tratamiento en los pacientes no respondedores, lo que podría haber explicado la elevada tasa de pacientes no controlados. Nuestros resultados muestran que la UC sigue activa, según la puntuación UAS7, a pesar del uso de los tratamientos recomendados, lo que podría apuntar hacia la falta de efectividad de las terapias disponibles.
De acuerdo a las recomendaciones de las guías clínicas, se utilizaron los cuestionarios CU-Q2oL y el EQ-5D para evaluar la CdV relacionada con la salud (CVRS) de los pacientes incluidos en el estudio UCREX1,3,5,19. De acuerdo con estudios previos, nuestros resultados muestran que la UC afecta negativamente la CdV del paciente, aunque hay una tendencia positiva en la mejora de la CdV a lo largo del estudio5,20–23. El dolor y el malestar se observaron desde el inicio, objetivándose valores de EVA por encima de 60, lo que indica un dolor moderado a severo24. Con respecto a la calidad del sueño, los resultados del cuestionario MOS-Sleep revelaron un impacto negativo al inicio del estudio, datos consistentes con estudios previos19.
De acuerdo con las guías utilizadas al momento del estudio, durante los 12 meses del estudio UCREX, los tratamientos prescritos con mayor frecuencia fueron los AHNS-H1 (47,6% de los pacientes). Omalizumab, fue aprobado para su uso en UCE durante el período de inclusión de pacientes y se prescribió principalmente al comienzo del estudio. Los resultados de un ensayo clínico de fase III que analizó omalizumab en la UCE mostró que un número tres veces mayor de los pacientes que recibieron omalizumab lograron un buen control de la enfermedad en comparación con placebo, mejorando la CdV del paciente25,26. En este sentido, las guías clínicas europeas actualizadas de urticaria3 recomiendan el tratamiento con omalizumab en pacientes que permanezcan sintomáticos después de recibir hasta cuatro veces la dosis de AHNS-H1 de una a cuatro semanas.
La falta de control de la sintomatología de la UC a pesar del tratamiento estándar basado en AHNS-H13,5 conlleva un impacto negativo en la vida diaria del paciente, baja CdV y ausentismo laboral. La incapacidad para controlar la actividad de la UC impacta negativamente en la URS, incluyendo la AP, atención especializada y/o consultas al servicio de emergencias1,5. Esto apunta hacia la necesidad de un mejor manejo de los pacientes y optimización del uso de los recursos asociados a la enfermedad, así como mejores tratamientos que permitan un adecuado control de los síntomas de la UC. El desarrollo de nuevas terapias biológicas como omalizumab es una estrategia prometedora para abordar los síntomas de la UCE y mejorar la CdV de los pacientes.
ConclusionesLa UC es una enfermedad crónica de larga duración que afecta principalmente a la población activa (mujeres y hombres), y que genera un impacto negativo en su CdV, trabajo y URS. Los datos recogidos del estudio UCREX demostraron que, en España durante el periodo del estudio, el 75,6% de los pacientes aún presentaban una UC con actividad moderada a pesar de estar recibiendo algún tratamiento utilizado normalmente en la práctica clínica habitual. Un manejo apropiado por parte de los médicos será básico para disminuir la carga de la enfermedad y mejorar así los síntomas y la CdV en los pacientes.
FinanciaciónLa financiación para el estudio UCREX ha sido proporcionada por Novartis Farmacéutica, España.
Conflicto de interesesJoan Bartra, Moises Labrador-Horrillo, Javier Miquel-Miquel, Juan Francisco Ortiz y Antonio Valero han colaborado con Novartis y otras industrias farmacéuticas. Pau Terradas y Marian Vidal son empleados de Novartis.
Marta Ferrer Puga es miembro del Consejo Asesor Científico y ponente de Novartis y FAES Farma, ha sido miembro del Consejo Asesor Científico de Genentech, ha recibido becas de investigación de Novartis y ha recibido honorarios de ponente en Menarini.
Juan Francisco Silvestre ha realizado consultorías y ha dictado conferencias en eventos educativos para Sanofi-Genzyme, Regeneron, AbbVie y Novartis. Ha sido investigador principal en ensayos clínicos patrocinados por AbbVie, Amgen, Eli-Lilly, Leo Pharma, Novartis y Pfizer.
Anna Giménez-Arnau es Asesor Médico de Uriach Pharma, Genentech, Novartis, FAES, GSK, Sanofi. Becas de Investigación apoyadas por Uriach Pharma, Novartis, Becas del Instituto Carlos III FEDER. Actividades educativas para Uriach Pharma, Novartis, Genentech, Menarini, LEO-PHARMA, GSK, MSD, Almirall, Sanofi.
Joaquin Sastre se ha desempeñado como consultor de Thermofisher, MSD, Novartis, Sanofi, Leti, Roche, ALK, FAES FARMA, Mundipharma y GSK. Ha recibido honorarios por conferencias de Novartis, GSK, Stallergenes, LETI y FAES FARMA; además de haber recibido subvenciones para investigación de Thermofisher, ALK y Sanofi.
Ignacio Jáuregui ha actuado como miembro remunerado de los consejos asesores de Novartis España, Sanofi-Genzyme y AbbVie, ha sido consultor de FAES Farma, ha recibido becas de formación de Leti Pharma y Menarini, y ha sido pagado por las tasas de conferencias Novartis, Sanofi-Genzyme, MSD, Roxall Laboratories y FAES Farma.
Agradecemos a todos los centros e investigadores que han colaborado en el estudio UCREX (Anexo A2). Además, agradecemos a IQVIA, Carmen Barrull, Mireia Sumalla y Sukanya Ghildiyal por brindar la asistencia editorial médica con este manuscrito.
Por favor, cite este artículo como: Ferrer Puga M, Silvestre Salvador JF, Bartra Tomas J, Giménez-Arnau A, Labrador-Horrillo M, Miquel-Miquel J, et al. Daily Clinical Practice in the Management of Chronic Urticaria in Spain: Results of the UCREX Study. Actas Dermosifiliogr. 2022;113:4–14.