Los inhibidores de Janus quinasa (JAK) actúan bloqueando la acción de ciertas citoquinas inflamatorias involucradas en varias enfermedades inflamatorias. Cuatro moléculas han sido aprobadas para empleo en dermatología: upadacitinib, baricitinib, abrocitinib y ruxolitinib tópico. Se han reportado usos fuera de indicación para diferentes patologías dermatológicas. Se realizó una revisión narrativa de la literatura sobre la seguridad a largo plazo de los inhibidores de JAK aprobados y su utilización fuera de indicación en enfermedades dermatológicas, mediante búsquedas bibliográficas en PubMed y Google Scholar desde enero del 2000 hasta enero del 2023, incluyendo las palabras clave: «Janus kinase inhibitors», «JAK inhibitors», «off-label», «dermatology», «safety», «adverse events», «ruxolitinib», «upadacitinib», «abrocitinib» y «baricitinib». Se encontraron un total de 37 trastornos cutáneos con estudios que respaldan el uso de estos fármacos. Los ensayos preliminares indican que los inhibidores de JAK tienen un perfil de seguridad generalmente favorable y pueden considerarse una opción en muchas enfermedades dermatológicas.
JAK inhibitors target specific inflammatory cytokines involved in various inflammatory diseases. Four molecules have been approved for dermatological use: upadacitinib, baricitinib, abrocitinib and topical ruxolitinib. Off-label prescriptions for other dermatological conditions have been reported. We conducted a narrative review of the literature to assess the long-term safety profile of currently approved JAK inhibitors in dermatology, and their off-label use in skin disorders. We performed literature searches with PubMed and Google Scholar from January 2000 to January 2023, using the keywords “Janus kinase inhibitors”, “JAK inhibitors”,“off-label”, “dermatology”, “safety”, “adverse events”, “ruxolitinib”, “upadacitinib”,“abrocitinib” and “baricitinib”. Our search yielded a total of 37 dermatological disorders with studies supporting the use of these JAK inhibitors. Preliminary studies indicate that JAK inhibitors generally have a favorable safety profile and can be considered as an option in many dermatological disorders.
En los últimos años, el campo de la dermatología ha experimentado avances significativos con el desarrollo de múltiples fármacos biológicos y pequeñas moléculas que actúan selectivamente sobre moléculas específicas del sistema inmunitario. Una vía de señalización especialmente notable, implicada tanto en la inmunidad innata como en la adaptativa, es la vía Janus quinasa/transductor de señal y activador de la transcripción (JAK-STAT). Esta última implica tirosina quinasas intracelulares denominadas Janus quinasas (JAK), que se componen de cuatro isoformas: JAK1, JAK2, JAK3 y TYK2. Los inhibidores de JAK actúan suprimiendo de forma reversible la fosforilación de las JAK mediante la ocupación del sitio catalítico de unión al ATP1. Aunque los inhibidores de JAK más selectivos pueden evitar los efectos adversos asociados a las isoformas JAK no bloqueadas, las implicaciones de esta selectividad para la seguridad a largo plazo siguen sin estar claras2.
El upadacitinib y el abrocitinib orales (inhibidores selectivos de JAK 1), así como el baricitinib oral y el ruxolitinib tópico (inhibidores de JAK1/2) han sido aprobados por la Administración de Alimentos y Medicamentos de EE. UU. (FDA) y/o la Agencia Europea de Medicamentos (EMA) para varias indicaciones dermatológicas (tabla 1). En este estudio, pretendemos revisar el perfil de seguridad a largo plazo de estos inhibidores de JAK en dermatología y describir su uso fuera de ficha técnica en diversos trastornos cutáneos.
Mecanismo de acción e indicaciones aprobadas para los inhibidores de JAK 1 en Dermatología
| Droga | Mecanismo de acción | Indicaciones aprobadas por la FDA en Dermatología | Indicaciones aprobadas por la EMA en Dermatología |
|---|---|---|---|
| Abrocitinib (oral) | Inhibidor selectivo JAK 1 | Dermatitis atópica moderada a severa | Dermatitis atópica moderada a severa |
| Baricitinib (oral) | Inhibidor JAK 1 y JAK 2 | Alopecia areata | Alopecia areataDermatitis atópica moderada a severa |
| Upadacitinib (oral) | Inhibidor reversible JAK con mayor potencia inhibitoria para JAK1 que JAK2, JAK3, o TYK2 | Dermatitis atópica moderada a severa | Dermatitis atópica moderada a severa |
| Ruxolitinib (tópico) | Inhibidor JAK 1 y JAK 2 | Dermatitis atópica leve a moderadaVitíligo no segmentario | – |
EMA: European Medicines Agency; FDA: Food and Drugs Administration; JAK: Janus quinasa; TYK2: tirosina quinasa 2.
Se realizó una revisión narrativa de la literatura. Se efectuaron búsquedas bibliográficas en PubMed y Google Scholar desde enero de 2000 hasta enero de 2023 utilizando las palabras clave «Janus kinase inhibitors», «JAK inhibitors», «off-label», «dermatology», «safety», «adverse events», «ruxolitinib», «upadacitinib», «abrocitinib» y «baricitinib». También se incluyeron las enfermedades inflamatorias cutáneas en la estrategia de búsqueda: «granuloma annulare», «histiocytosis», «sarcoidosis», «morphea», «livedoid vasculopathy», «Sweet syndrome», «VEXAS syndrome», «hypereosinophilic syndrome», «Kimura disease», «acrodermatitis continua of Hallopeau», «erythema multiforme», «DRESS syndrome», «Steven Johnson syndrome», «toxic epidermal necrolysis», «autoinflammatory diseases», «panniculitis», «cutaneous vasculitis», «cutaneous lupus», «lichen planus», «graft versushost disease», «Still disease», «necrobiosis lipoidica» y «chronic nodular prurigo». La estrategia de búsqueda incluyó ensayos clínicos, metaanálisis, estudios observacionales, series y reportes de casos, y se restringió a artículos en inglés y español.
ResultadosPerfil de seguridad a largo plazoLos inhibidores de JAK suelen asociarse a diversos acontecimientos adversos. Entre ellos, se incluyen citopenias, infecciones urinarias y del tracto respiratorio superior, reactivación del virus del herpes, náuseas, diarrea, cefalea, alteración de las pruebas de función hepática, hipercolesterolemia y aumento de la creatinfosfoquinasa (CPK)3. Los acontecimientos adversos más graves y poco frecuentes incluyen los eventos tromboembólicos, la reactivación del virus de la hepatitis B (VHB), la tuberculosis diseminada, la perforación gastrointestinal (en particular el tofacitinib4) y a los cánceres sólidos3. Entre las reacciones adversas dermatológicas poco comunes están el cáncer de piel no melanoma, el molusco contagioso diseminado y las reacciones cutáneas adversas5.
El primero de septiembre de 2021, la FDA revisó los resultados del ensayo de seguridad poscomercialización que comparaba el tofacitinib con los inhibidores del factor de necrosis tumoral alfa (TNF-α) en la artritis reumatoide. En el estudio participaron pacientes de ≥ 50 años tratados simultáneamente con metotrexato y con factores de riesgo cardiovascular preexistentes. Se concluyó que el tofacitinib planteaba un mayor riesgo de eventos cardiovasculares mayores (MACE), acontecimientos tromboembólicos, neoplasias malignas y la muerte. Basándose en estos resultados, la FDA emitió una advertencia (Boxed Warning), que también se extendió a otros inhibidores de JAK que no habían sido evaluados en ensayos clínicos similares6. Sin embargo, un estudio que analizó un amplio conjunto de datos en 126.815 informes de eventos adversos asociados al uso de inhibidores de JAK no logró identificar ningún aumento estadísticamente significativo de acontecimientos cardiovasculares graves4. Además, dos metaanálisis que investigaron los inhibidores de JAK en enfermedades inflamatorias y dermatitis atópica informaron de una incidencia similar de tromboembolismo venoso en comparación con los controles7,8.
Los datos procedentes de ensayos controlados aleatorizados (ECA) sugieren que ciertos eventos adversos pueden actuar de forma dependiente de la dosis, debido al bloqueo de otras isoformas de JAK más allá de las diana9.
AbrocitinibEn un estudio en el que se evaluaron las tasas de incidencia a largo plazo de los eventos adversos graves de una cohorte del estudio de análisis integrado de seguridad para abrocitinib con 2.856 pacientes y 1.614 persona-años (pa), el abrocitinib a dosis de 100 mg y 200 mg mostró 0,6 y 0,4 cánceres de piel no melanoma/100 pa; 0,6 y 0,2 eventos MACE/100 pa, y 0,0 y 0,4 acontecimientos tromboembólicos venosos (TEV)/100 pa, respectivamente. Se produjeron otras neoplasias malignas (excluido el cáncer de piel no melanoma) a una tasa de 0,2/100 pa6,10. Los eventos adversos relacionados con la dosis incluyeron principalmente náuseas, cefalea, acné y trombocitopenia. Las tasas de incidencia fueron de 2,65/100 pa y 2,33/100 pa para las infecciones graves, 2,04/100 pa y 4,34/100 pa para el herpes zóster y 8,73/100 pa y 11,83/100 pa para el herpes simple en los grupos de 100 y 200 mg, respectivamente. Se notificaron tres muertes, atribuidas a carcinoma gástrico, muerte súbita y COVID-1910.
En adolescentes con dermatitis atópica, la seguridad del abrocitinib oral se ha evaluado en un ECA de fase 3 controlado con placebo, demostrando una menor incidencia de acontecimientos adversos graves en comparación con el grupo placebo11. Un metanálisis en dermatitis atópica mostró que el abrocitinib a 100 mg estaba relacionado con más efectos adversos graves que el dupilumab (odds ratio [OR] 2,6)12. Un análisis de los recuentos plaquetarios a partir de datos obtenidos en cinco ensayos clínicos de abrocitinib informó de un mayor riesgo de trombocitopenia en las primeras cuatro semanas de tratamiento en pacientes con recuentos plaquetarios basales bajos13.
BaricitinibLa incidencia de los eventos adversos graves asociados al baricitinib está en consonancia con el riesgo inherente que plantea la población de la enfermedad específica que se está tratando. Las enfermedades reumatológicas suelen asociarse a una mayor prevalencia de MACE, TEV, neoplasias malignas, infecciones graves y herpes zóster. Por el contrario, los casos de herpes simples son más frecuentes entre los pacientes con dermatitis atópica14.
En un análisis de seguridad combinado de 8 ECA de baricitinib en 2.531 sujetos con dermatitis atópica, la tasa global de acontecimientos adversos emergentes del tratamiento (EAET) fue mayor en los pacientes tratados con baricitinib que en los que se manejaron con placebo. La tasa de incidencia ajustada de infecciones graves fue de 3,0/100 pa y de 1,5/100 pa para baricitinib a 4 mg y 2 mg diarios, respectivamente. Se notificaron dos casos de MACE en personas que recibieron baricitinib 2 mg y se observaron dos casos de TEV en los que obtuvieron la dosis de 4 mg. Hubo una muerte en el grupo de baricitinib a 4 mg, debida a hemorragia gastrointestinal. Los acontecimientos adversos comunes relacionados con alteraciones en la analítica fueron el aumento de la CPK, la hiperlipidemia y alteraciones hematológicas, hepáticas y renales leves15. El análisis de seguridad ampliado de baricitinib a 2 mg mostró resultados similares16.
Entre los 1.303 pacientes con alopecia areata (AA) incluidos en un análisis integrado de seguridad, los EAET más frecuentes fueron la infección de las vías respiratorias superiores, la nasofaringitis, la cefalea, el acné y la elevación de la CPK. El análisis identificó 34 casos de herpes zóster, tres neoplasias malignas (excluido el cáncer de piel no melanoma), una infección oportunista, un infarto de miocardio, una embolia pulmonar y una perforación gastrointestinal17.
En cuanto a la psoriasis, el baricitinib se sometió a un ensayo clínico de fase 2 b (n = 271), con informes de seguridad comparables18.
UpadacitinibSe realizó un metaanálisis de 2 ECA para evaluar las tasas de incidencia a largo plazo de acontecimientos adversos en pacientes con dermatitis atópica. Los resultados indicaron que el upadacitinib en dosis de 15 mg y 30 mg presentaba tasas de neoplasias inferiores y similares, respectivamente, en comparación con la tasa de incidencia general de todas las neoplasias en la población de EE. UU. El upadacitinib también mostró tasas bajas de cáncer de piel no melanoma (0,4 eventos/100 años), MACE (0,0-0,1 eventos/100 años) y TEV (0,1 eventos/100 años)6. En ambos ECA, la incidencia de eventos adversos graves fue similar entre los grupos. Los EAET observados con mayor frecuencia incluyeron el acné, una infección de las vías respiratorias superiores, la elevación de los niveles de CPK y la dermatitis atópica19. Otros ECA realizados en pacientes con dermatitis atópica informaron de un perfil de seguridad igualmente favorable20. Un estudio reveló tasas ligeramente superiores de infecciones graves (1,1 vs. 0,6%), eccema herpético (0,3 vs. 0%), herpes zóster (2,0 vs. 0,9%) y alteraciones analíticas en sujetos que recibieron upadacitinib en comparación con los que obtuvieron dupilumab20. Los ensayos controlados con placebo arrojaron resultados similares, aunque el aumento del riesgo de herpes zóster e infecciones graves no fue constante en todos los estudios21,22. Un metaanálisis realizado en pacientes con artritis psoriásica mostró que una dosis diaria de upadacitinib de 30 mg se asociaba a un riesgo relativo de acontecimientos adversos de 1,20 en comparación con el placebo, mientras que una dosis diaria de 15 mg no alcanzó significación estadística23. Aunque otro metaanálisis sobre el perfil de seguridad del upadacitinib demostró tasas similares de eventos adversos emergentes con el tratamiento (EAET) en pacientes con dermatitis atópica y en aquellos con afecciones reumatológicas, los EAET graves, el herpes zóster y las elevaciones de la creatinfosfoquinasa fueron menos frecuentes en personas con dermatitis atópica. Sin embargo, se observaron tasas más elevadas de acné en aquellos con dermatitis atópica. El mismo estudio concluyó que el upadacitinib se vinculaba a un mayor riesgo de herpes zóster, cáncer de piel no melanoma y elevación de la CPK en comparación con el metotrexato y el adalimumab24.
Ruxolitinib tópicoEn general, el ruxolitinib tópico se tolera bien y sus efectos adversos se limitan principalmente a reacciones cutáneas locales (dolor en el lugar de aplicación, eritema, exfoliación, foliculitis, prurito)25,26. No se ha notificado toxicidad sistémica. Curiosamente, en un estudio doble ciego de ruxolitinib 0,5 o 1,0% de crema diaria o 1,5% de crema dos veces al día en la psoriasis, no se observó inhibición de transductor de señal y activador de la transcripción 3 (STAT3) fosforilada en las células sanguíneas, y se detectaron bajas concentraciones plasmáticas del fármaco en estado estacionario27. Un estudio en dermatitis atópica estimó que la exposición sistémica correspondía aproximadamente a 4-5% de la dosis aplicada28. En dos ECA de fase 3 en dermatitis atópica (n = 1.251), se notificó una menor tasa de reacciones en el lugar de aplicación en comparación con el vehículo29.
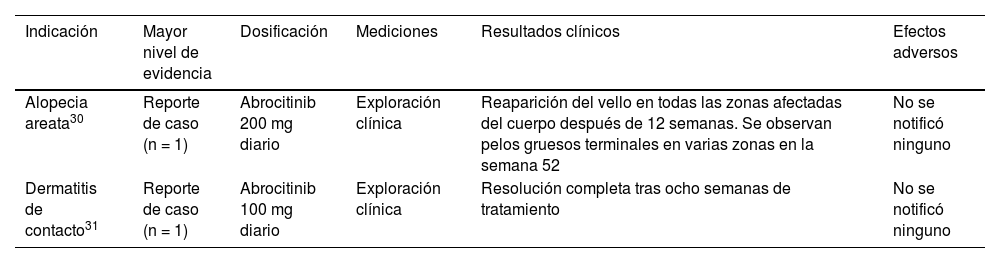
Uso fuera de la ficha técnica de los inhibidores de JAK en trastornos cutáneosAbrocitinib (tabla 2)Alopecia areataUna adolescente con dermatitis atópica y AA universalis recibió abrocitinib 200 mg/día, tras lo cual el cabello le volvió a crecer al cabo de 12 semanas. Se observaron pelos terminales en varias zonas en la semana 5230 (tabla 2).
Uso fuera de ficha técnica de abrocitinib en Dermatología
| Indicación | Mayor nivel de evidencia | Dosificación | Mediciones | Resultados clínicos | Efectos adversos |
|---|---|---|---|---|---|
| Alopecia areata30 | Reporte de caso (n = 1) | Abrocitinib 200 mg diario | Exploración clínica | Reaparición del vello en todas las zonas afectadas del cuerpo después de 12 semanas. Se observan pelos gruesos terminales en varias zonas en la semana 52 | No se notificó ninguno |
| Dermatitis de contacto31 | Reporte de caso (n = 1) | Abrocitinib 100 mg diario | Exploración clínica | Resolución completa tras ocho semanas de tratamiento | No se notificó ninguno |
Un paciente adulto tratado con abrocitinib 100 mg/día para una dermatitis de contacto alérgica ocupacional transmitida por el aire alcanzó la resolución completa después de ocho semanas31.
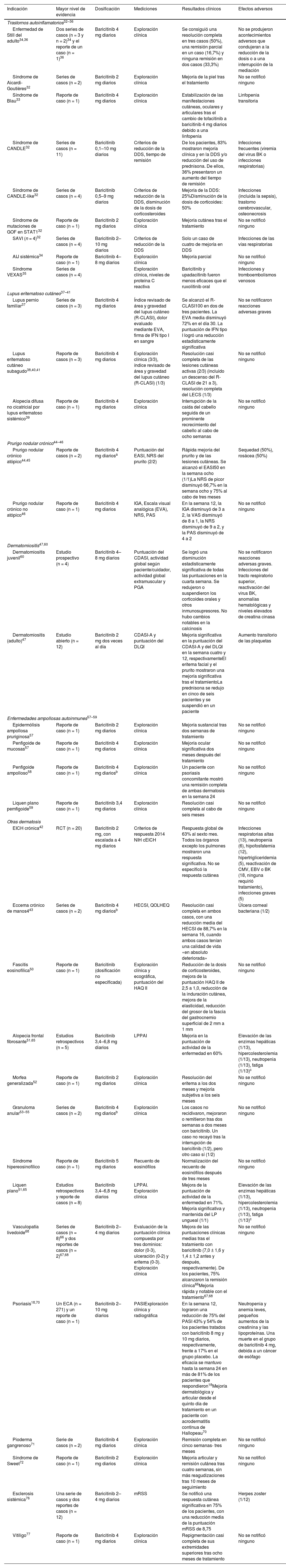
Baricitinib (tabla 3)Trastornos autoinflamatorios con manifestaciones cutáneasEl baricitinib oral se ha probado en determinados trastornos autoinflamatorios. Se observó mejoría clínica en series y/o reportes de pacientes con síndrome de dermatosis neutrofílica atípica crónica con lipodistrofia y elevación de la temperatura (CANDLE)32, síndrome de «CANDLE-like»32, Aicardi-Goutières32, vasculopatía asociada a la proteína STING de inicio en la infancia (SAVI)32, mutaciones de ganancia de función (GOF) en STAT132, síndrome de Blau refractario33 y artritis idiopática juvenil sistémica34. En el síndrome de vacuolas, enzima E-1, ligado a x, autoinflamatorio, somático (VEXAS), un estudio multicéntrico retrospectivo mostró que el baricitinib y el upadacitinib conducían a peores resultados que el ruxolitinib oral35. Dos series de casos (n = 3 y n = 2) de enfermedad de Still del adulto presentaron resolución completa (40%) o parcial (20%)34 con el baricitinib 4 mg/día, y se comunicó un caso de remisión clínica tras asociar baricitinib a anakinra y corticoides36 (tabla 3).
Uso en Dermatología del baricitinib fuera de ficha técnica
| Indicación | Mayor nivel de evidencia | Dosificación | Mediciones | Resultados clínicos | Efectos adversos |
|---|---|---|---|---|---|
| Trastornos autoinflamatorios32–36 | |||||
| Enfermedad de Still del adulto34,36 | Dos series de casos (n = 3 y n = 2)34 y el reporte de un caso (n = 1)36 | Baricitinib 4 mg diarios | Exploración clínica | Se consiguió una resolución completa en tres casos (50%), una remisión parcial en un caso (16,7%) y ninguna remisión en dos casos (33,3%) | No se produjeron acontecimientos adversos que condujeran a la reducción de la dosis o a una interrupción de la mediación |
| Síndrome de Aicardi-Goutières32 | Series de casos (n = 2) | Baricitinib 2 mg diarios | Exploración clínica | Mejoría de la piel tras el tratamiento | No se notificó ninguno |
| Síndrome de Blau33 | Reporte de caso (n = 1) | Baricitinib 4 mg diarios | Exploración clínica | Estabilización de las manifestaciones cutáneas, oculares y articulares tras el cambio de tofacitinib a baricitinib 4 mg diarios debido a una linfopenia | Linfopenia transitoria |
| Síndrome de CANDLE32 | Series de casos (n = 11) | Baricitinib 0,1–10 mg diarios | Criterios de reducción de la DDS, tiempo de remisión | De los pacientes, 83% mostraron mejoría clínica y en la DDS y/o reducción del uso de prednisona. De ellos, 36% presentaron un aumento del tiempo de remisión | Infecciones frecuentes (viremia del virus BK o infecciones respiratorias) |
| Síndrome de CANDLE-like32 | Series de casos (n = 4) | Baricitinib 0,5–9 mg diarios | Criterios de reducción de la DDS, disminución de la dosis de corticosteroides | Mejoría de la DDS: 25%Disminución de la dosis de corticoides: 50% | Infecciones (incluida la sepsis), trastorno cerebrovascular, osteonecrosis |
| Síndrome de mutaciones de GOF en STAT132 | Reporte de caso (n = 1) | Baricitinib 2 mg diarios | Exploración clínica | Mejoría cutánea tras el tratamiento | No se notificó ninguno |
| SAVI (n = 4)32 | Series de casos (n = 4) | Baricitinib 2–10 mg diarios | Criterios de reducción de la DDS | Solo un caso de cuatro de mejoría en DDS | Infecciones de las vías respiratorias |
| AIJ sistémica34 | Reporte de caso (n = 1) | Baricitinib 4–8 mg diarios | Exploración clínica | Mejoría parcial | No se notificó ninguno |
| Síndrome VEXAS35 | Series de casos (n = 4) | Exploración clínica, niveles de proteína C reactiva | Baricitinib y upadacitinib fueron menos eficaces que el ruxolitinib oral | Infecciones y tromboembolismos venosos | |
| Lupus eritematoso cutáneo37–41 | |||||
| Lupus pernio familiar37 | Series de casos (n = 3) | Baricitinib 4 mg diarios | Índice revisado de área y gravedad del lupus cutáneo (R-CLASI), dolor evaluado mediante EVA, firma de IFN tipo I en sangre | Se alcanzó el R-CLASI100 en dos de tres pacientes. La EVA media disminuyó 72% en el día 30. La puntuación de IFN tipo I logró una reducción estadísticamente significativa | No se notificaron reacciones adversas graves |
| Lupus eritematoso cutáneo subagudo38,40,41 | Reporte de casos (n = 3) | Baricitinib 4 mg diarios | Exploración clínica (3/3), índice revisado de área y gravedad del lupus cutáneo (R-CLASI) (1/3) | Resolución casi completa de las lesiones cutáneas activas (2/3) (incluido un descenso del R-CLASI de 21 a 3), resolución completa del LECS (1/3) | No se notificó ninguno |
| Alopecia difusa no cicatricial por lupus eritematoso sistémico39 | Reporte de caso (n = 1) | Baricitinib 4 mg diarios | Exploración clínica | Interrupción de la caída del cabello seguida de un prominente recrecimiento del cabello al cabo de ocho semanas | No se notificó ninguno |
| Prurigo nodular crónico44–46 | |||||
| Prurigo nodular crónico atópico44,45 | Reporte de casos (n = 2) | Baricitinib 4 mg diariosa | Puntuación del EASI, NRS del prurito (2/2) | Rápida mejoría del prurito y de las lesiones cutáneas. Se alcanzó el EASI50 en la semana ocho (1/1)La NRS de picor disminuyó 66,7% en la semana ocho y 75% al cabo de tres meses | Sequedad (50%), rosácea (50%) |
| Prurigo nodular crónico no atópico46 | Reporte de caso (n = 1) | Baricitinib 4 mg diarios | IGA, Escala visual analógica (EVA), NRS, PAS | En la semana 12, la IGA disminuyó de 3 a 2, la VAS disminuyó de 8 a 1, la NRS disminuyó de 9 a 2, y la PAS disminuyó de 4 a 2 | No se notificó ninguno |
| Dermatomiositis47,60 | |||||
| Dermatomiositis juvenil60 | Estudio prospectivo (n = 4) | Baricitinib 4–8 mg diarios | Puntuación del CDASI, actividad global según paciente/cuidador, actividad global extramuscular y PGA | Se logró una disminución estadísticamente significativa de todas las puntuaciones en la cuarta semana. Se redujeron o suspendieron los corticoides orales y otros inmunosupresores. No hubo cambios notables en la calcinosis | No se notificaron reacciones adversas graves. Infecciones del tracto respiratorio superior, reactivación del virus BK, anomalías hematológicas y niveles elevados de creatina cinasa |
| Dermatomiositis (adulto)47 | Estudio abierto (n = 12) | Baricitinib 2 mg dos veces al día | CDASI-A y puntuación del DLQI | Mejoría significativa en la puntuación del CDASI-A y del DLQI en la semana cuatro y 12, respectivamenteEl eritema facial y el prurito mostraron una mejoría significativa tras el tratamientoLa prednisona se redujo en cinco de seis pacientes y se suspendió en un paciente | Aumento transitorio de las plaquetas |
| Enfermedades ampollosas autoinmunes57–59 | |||||
| Epidermólisis ampollosa pruriginosa57 | Reporte de caso (n = 1) | Baricitinib 2 mg diarios | Exploración clínica | Mejoría sustancial tras dos semanas de tratamiento | No se notificó ninguno |
| Penfigoide de mucosas57 | Reporte de caso (n = 1) | Baricitinib 4 mg diarios | Exploración clínica | Mejoría ocular significativa dos meses después del tratamiento | No se notificó ninguno |
| Penfigoide ampolloso58 | Reporte de caso (n = 1) | Baricitinib 4 mg diariosb | Exploración clínica | Un paciente con psoriasis concomitante mostró una remisión completa de ambas dermatosis en la semana 24 | No se notificó ninguno |
| Liquen plano pemfigoide59 | Reporte de caso (n = 1) | Baricitinib 3,4 mg diarios | Exploración clínica | Resolución casi completa al cabo de seis meses | No se notificó ninguno |
| Otras dermatosis | |||||
| EICH crónica42 | RCT (n = 20) | Baricitinib 2 mg, con escalada a 4 mg diarios | Criterios de respuesta 2014 NIH cEICH | Respuesta global de 63% al sexto mes. Todos los órganos excepto los pulmones mostraron una respuesta significativa. No se especificó la respuesta cutánea | Infecciones respiratorias altas (13), neutropenia (6), hipofosfatemia (12), hipertrigliceridemia (5), reactivación de CMV, EBV o BK (18, ninguna requirió tratamiento), infecciones graves (5) |
| Eccema crónico de manos443 | Series de casos (n = 2) | Baricitinib 4 mg diariosb | HECSI, QOLHEQ | Resolución casi completa en ambos casos, con una reducción media del HECSI de 88,7% en la semana 16, cuando ambos casos tenían una calidad de vida «en absoluto deteriorada» | Úlcera corneal bacteriana (1/2) |
| Fascitis eosinofílica50 | Reporte de caso (n = 1) | Baricitinib (dosificación no especificada) | Exploración clínica y ecográfica, puntuación del HAQ II | Reducción de la dosis de corticosteroides, mejora de la puntuación HAQ II de 2,5 a 1,0, reducción de la induración cutánea, mejora de la elasticidad, reducción del grosor de la fascia del gastrocnemio superficial de 2 mm a 1 mm | No se notificó ninguno |
| Alopecia frontal fibrosante51,65 | Estudios retrospectivos (n = 5) | Baricitinib 3,4–6,8 mg diarios | LPPAI | Mejoría en la puntuación de actividad de la enfermedad en 60% | Elevación de las enzimas hepáticas (1/13), hipercolesterolemia (1/13), neutropenia (1/13), fatiga (1/13)c |
| Morfea generalizada52 | Reporte de caso (n = 1) | Baricitinib 2 mg diarios | Exploración clínica | Resolución del eritema a los dos meses y mejoría subjetiva a los seis meses | No se notificó ninguno |
| Granuloma anular53–55 | Series de casos (n = 2) | Baricitinib 4 mg diariosb | Exploración clínica | Los casos no recidivaron, mejoraron o remitieron tras dos semanas a dos meses con baricitinib. Un caso no recayó tras la interrupción de baricitinib (1/2), pero otro caso sí (1/2) | No se notificó ninguno |
| Síndrome hipereosinofílico | Reporte de caso (n = 1) | Baricitinib 5 mg diarios | Recuento de eosinófilos | Normalización del recuento de eosinófilos después de tres meses | No se notificó ninguno |
| Liquen plano51,65 | Estudios retrospectivos y reporte de casos (n = 8) | Baricitinib 3,4–6,8 mg diarios | LPPAI. Exploración clínica | Mejora de la puntuación de actividad de la enfermedad en 71%. Mejoría significativa y mantenida del LP ungueal (1/1) | Elevación de las enzimas hepáticas (1/13), hipercolesterolemia (1/13), neutropenia (1/13), fatiga (1/13)c |
| Vasculopatía livedoide68 | Series de casos (n = 8)66 y dos reportes de casos (n = 2)67,68 | Baricitinib 2–4 mg diarios | Evaluación de la puntuación clínica compuesta por tres dominios: dolor (0-3), ulceración (0-2) y eritema (0-3). Exploración clínica | Mejora de las puntuaciones clínicas medias tras el tratamiento con baricitinib (7,0 ± 1,6 y 1,4 ± 1,2 antes y después, respectivamente). De los pacientes, 75% alcanzaron la remisión clínica66Mejoría rápida y notable con el tratamiento67,68 | No se notificó ninguno |
| Psoriasis18,70 | Un ECA (n = 271) y un reporte de caso (n = 1) | Baricitinib 2–10 mg diarios | PASIExploración clínica y radiográfica | En la semana 12, lograron una reducción de 75% del PASI 43% y 54% de los pacientes tratados con baricitinib 8 mg y 10 mg diarios, respectivamente, frente a 17% en el grupo placebo. La eficacia se mantuvo hasta la semana 24 en más de 81% de los pacientes que respondieron18Mejoría dermatológica y articular desde el quinto día de tratamiento en un paciente con acrodermatitis continua de Hallopeau70 | Neutropenia y anemia leves, pequeños aumentos de la creatinina y las lipoproteínas. Una muerte en el grupo de baricitinib 4 mg, debida a un cáncer de esófago |
| Pioderma gangrenoso71 | Serie de casos (n = 2) | Baricitinib 4 mg diarios | Exploración clínica | Remisión completa en cinco semanas- tres meses | No se notificó ninguno |
| Síndrome de Sweet72 | Reporte de caso (n = 1) | Baricitinib 2 mg diarios | Exploración clínica | Mejoría articular y remisión cutánea tras cuatro semanas, sin más reagudizaciones tras 10 meses de seguimiento | No se notificó ninguno |
| Esclerosis sistémica76 | Una serie de casos y dos reportes de casos (n = 12) | Baricitinib 2–4 mg diarios | mRSS | Se notificó una respuesta cutánea significativa en 75% de los pacientes, con una reducción media de la puntuación mRSS de 8,75 | Herpes zoster (1/12) |
| Vitiligo77 | Reporte de caso (n = 1) | Baricitinib 4 mg diarios | Exploración clínica | Repigmentación casi completa de sus extremidades superiores tras ocho meses de tratamiento | No se notificó ninguno |
AIJ: artritis idiopática juvenil; CDASI-A: índice de actividad del área y gravedad de la enfermedad de dermatomiositis cutánea; CDASI: índice de área y gravedad de la enfermedad cutánea; DDS: puntuación diaria; DLQI: índice de calidad de vida dermatológica; EASI: índice de área y gravedad del eccema; EVA: escala visual analógica; ECA: ensayo controlado aleatorizado; EICH: enfermedad de injerto contra huésped; HAQ II: cuestionario de evaluación de la salud II; HECSI: índice de gravedad del eccema de manos; IGA: escala de evaluación global del investigador; JAK: Janus quinasa; LP: liquen plano; LPPAI: índice de actividad del liquen plano pilaris; mRSS: puntuación cutánea de Rodnan modificada; NRS: escala de clasificación numérica; PAS: puntuación de actividad del prurigo; PASI: puntuación del índice de área y gravedad de la psoriasis; PGA: actividad global del médico; QOLHE: cuestionario de calidad de vida en el eccema de manos; SAVI: vasculopatía asociada a STING de inicio en la infancia; LECS: lupus eritematoso cutáneo subagudo; RCT: ensayo clínico aleatorizado.
Encontramos una serie de casos y cuatro reportes de casos con baricitinib 4 mg/día. En pacientes con lupus pernio familiar se observó una mejoría de las lesiones lúpicas cutáneas al cabo de tres meses37. En los reportes de casos se consiguió una desaparición completa con estabilización concomitante de la alopecia frontal fibrosante38, una mejoría de la alopecia asociada al lupus eritematoso sistémico39 y una resolución casi completa de las lesiones de lupus eritematoso cutáneo subagudo40,41.
Enfermedad crónica de injerto contra huésped (EICHc)Un ECA de fase 1/2 de baricitinib en la enfermedad crónica de injerto contra huésped (EICHc) (n = 20), que incluyó 19 casos de EICHc esclerótica, demostró una respuesta global en el sexto mes de 63%, con 88% de respuestas duraderas42.
Eccema crónico de las manosUna serie de casos (n = 2) con baricitinib 4 mg/día reveló una resolución casi completa tras 16 semanas43.
Prurigo nodular crónicoBaricitinib 4 mg/día produjo una rápida mejoría del prurito y de las lesiones de prurigo en dos reportes de casos de pacientes con predisposición atópica44,45, y en uno con prurigo nodular crónico no atópico46.
Dermatomiositis (forma adulta)Un estudio abierto (n = 12) demostró que baricitinib 2 mg/12 h disminuía la actividad de la enfermedad y mejoraba la puntuación del Índice de Calidad de Vida en Dermatología (DLQI)47. Una serie de casos (n = 3)48 y el reporte de un caso49 de baricitinib 4 mg/día también documentaron resultados prometedores.
Fascitis eosinofílicaEn un varón adulto con fascitis eosinofílica refractaria, el baricitinib redujo la induración cutánea y el uso de corticoides, y mejoró la elasticidad cutánea50.
Alopecia frontal fibrosanteEn un estudio retrospectivo (n = 5), el baricitinib mejoró a 60% de los pacientes con alopecia fibrosante frontal51.
Morfea generalizadaUn varón con morfea generalizada refractaria fue tratado con baricitinib 2 mg/día, con mejoría al cabo de seis meses52.
Granuloma anularTodos los pacientes de una serie de casos (n = 2) y dos informes de casos experimentaron mejoría o remisión tras dos a ocho semanas de tratamiento con baricitinib 3-4 mg/día53–55.
Síndrome hipereosinofílicoUna mujer de 39 años con síndrome hipereosinofílico que presentaba vasculitis eosinofílica en los dedos normalizó el recuento de eosinófilos tras tres meses de baricitinib56.
Enfermedades ampollosas inmunesLos reportes de casos han documentado el uso de baricitinib en el tratamiento de diversos trastornos, como en la epidermólisis bullosa pruriginosa, en el penfigoide de la mucosa ocular, el penfigoide ampolloso y en el liquen plano (LP) penfigoide. Los resultados comunicados varían desde una mejoría significativa hasta la resolución completa57–59.
Dermatomiositis juvenilEl baricitinib (4-8 mg/día) redujo significativamente la actividad de la enfermedad en la dermatomiositis juvenil (DMJ) refractaria (n = 4) a partir de la cuarta semana en un estudio prospectivo60. Ensayos retrospectivos (n = 15 y n = 3) informaron de una mejoría cutánea en todos los pacientes con DMJ, incluida la estabilización de la calcinosis, la regresión parcial y la remisión completa61,62. Los reportes de casos demostraron una mejoría de los síntomas cutáneos y musculares63, así como reducciones de la calcinosis64.
Liquen planoEn un estudio retrospectivo (n = 7), el uso de baricitinib demostró mejoría en 71% de los pacientes con LP pilaris51. Una mujer con LP ungueal grave65 experimentó una mejoría significativa y sostenida con el baricitinib.
Vasculopatía livedoideUna serie de casos (n = 8) de baricitinib 2 mg/día para la vasculopatía livedoide refractaria halló una mejoría estadísticamente significativa de la actividad de la enfermedad. Se alcanzó la remisión clínica en seis casos66. Dos reportes de casos mostraron una mejoría rápida67 y notable con el baricitinib 4 mg/día68.
PsoriasisEn un ECA de fase 2 b de 12 semanas de duración (n = 271), se logró una reducción de 75% en el índice de área y gravedad de la psoriasis (PASI) en 43-54% de los pacientes tratados con baricitinib18. Un metaanálisis mostró una menor eficacia de este fármaco en comparación con el tofacitinib69. Una mujer de 28 años con acrodermatitis continua de Hallopeau presentó una remisión rápida y mantenida de los síntomas cutáneos y articulares con baricitinib 2 mg/día70.
Pioderma gangrenosoEl baricitinib 4 mg/día condujo a una respuesta completa en una serie de casos (n = 2) de pioderma gangrenoso refractario en la parte inferior de la pierna y el cuero cabelludo71.
Síndrome de SweetUna mujer de 59 años con síndrome de Sweet asociado a artritis reumatoide refractaria mejoró sus síntomas articulares y cutáneos tras cuatro semanas con baricitinib72.
Esclerosis sistémicaUna serie de casos (n = 10)73 y dos reportes de casos investigaron el uso de baricitinib en la esclerosis sistémica74,75. Se observó una respuesta cutánea significativa en nueve pacientes76.
VitíligoUn hombre de 67 años con vitíligo en ambas manos y antebrazos recibió baricitinib 4 mg/día para la artritis reumatoide, mostrando repigmentación al cabo de ocho meses77.
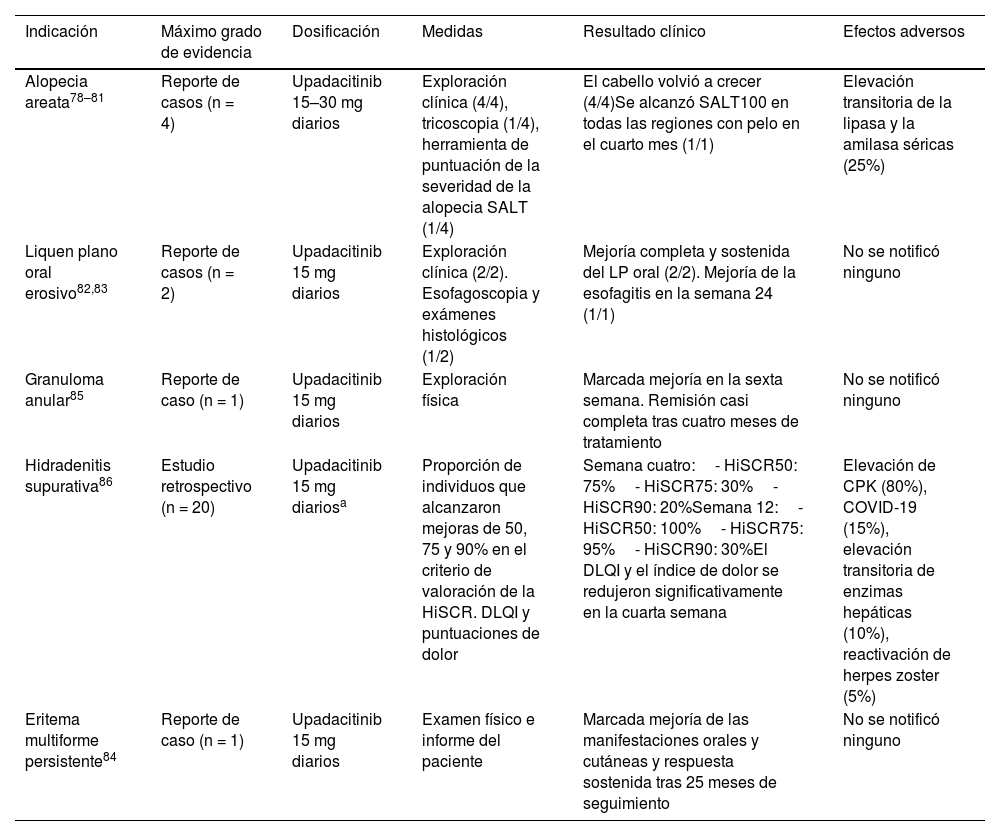
Upadacitinib (tabla 4)Alopecia areataCuatro informes de casos (n = 4) demostraron que el cabello volvía a crecer con upadacitinib 15-30 mg/día. En tres casos, este régimen también mejoró una dermatitis atópica grave concurrente78–81 (tabla 4).
Uso fuera de ficha técnica del upadacitinib en Dermatología
| Indicación | Máximo grado de evidencia | Dosificación | Medidas | Resultado clínico | Efectos adversos |
|---|---|---|---|---|---|
| Alopecia areata78–81 | Reporte de casos (n = 4) | Upadacitinib 15–30 mg diarios | Exploración clínica (4/4), tricoscopia (1/4), herramienta de puntuación de la severidad de la alopecia SALT (1/4) | El cabello volvió a crecer (4/4)Se alcanzó SALT100 en todas las regiones con pelo en el cuarto mes (1/1) | Elevación transitoria de la lipasa y la amilasa séricas (25%) |
| Liquen plano oral erosivo82,83 | Reporte de casos (n = 2) | Upadacitinib 15 mg diarios | Exploración clínica (2/2). Esofagoscopia y exámenes histológicos (1/2) | Mejoría completa y sostenida del LP oral (2/2). Mejoría de la esofagitis en la semana 24 (1/1) | No se notificó ninguno |
| Granuloma anular85 | Reporte de caso (n = 1) | Upadacitinib 15 mg diarios | Exploración física | Marcada mejoría en la sexta semana. Remisión casi completa tras cuatro meses de tratamiento | No se notificó ninguno |
| Hidradenitis supurativa86 | Estudio retrospectivo (n = 20) | Upadacitinib 15 mg diariosa | Proporción de individuos que alcanzaron mejoras de 50, 75 y 90% en el criterio de valoración de la HiSCR. DLQI y puntuaciones de dolor | Semana cuatro:- HiSCR50: 75%- HiSCR75: 30%- HiSCR90: 20%Semana 12:- HiSCR50: 100%- HiSCR75: 95%- HiSCR90: 30%El DLQI y el índice de dolor se redujeron significativamente en la cuarta semana | Elevación de CPK (80%), COVID-19 (15%), elevación transitoria de enzimas hepáticas (10%), reactivación de herpes zoster (5%) |
| Eritema multiforme persistente84 | Reporte de caso (n = 1) | Upadacitinib 15 mg diarios | Examen físico e informe del paciente | Marcada mejoría de las manifestaciones orales y cutáneas y respuesta sostenida tras 25 meses de seguimiento | No se notificó ninguno |
CPK: creatinfosfoquinasa; DLQI: índice de calidad de vida dermatológica; HiSCR: respuesta clínica de la hidradenitis supurativa; LP: liquen plano; SALT: herramienta de puntuación de la severidad de la alopecia.
Una mujer de 45 años con LP erosivo oral y artritis psoriásica82, y otra de 59 años con LP erosivo oral y esofágico refractario83 recibieron upadacitinib 15 mg diarios. En ambos casos se observó una mejoría drástica y sostenida de las lesiones orales.
Eritema multiformeUna mujer de 30 años con eritema multiforme persistente mostró una mejoría significativa con upadacitinib 15 mg/día84.
Granuloma anularUna mujer de 60 años con granuloma anular refractario en placas presentó una remisión casi completa con upadacitinib 15 mg/día85.
Hidradenitis supurativaUn estudio retrospectivo (n = 20) de hidradenitis supurativa de moderada a grave tratada con upadacitinib mostró una mejoría significativa de la respuesta clínica de la hidradenitis supurativa (HiSCR), el DLQI y las puntuaciones de dolor a partir de la cuarta semana de tratamiento86.
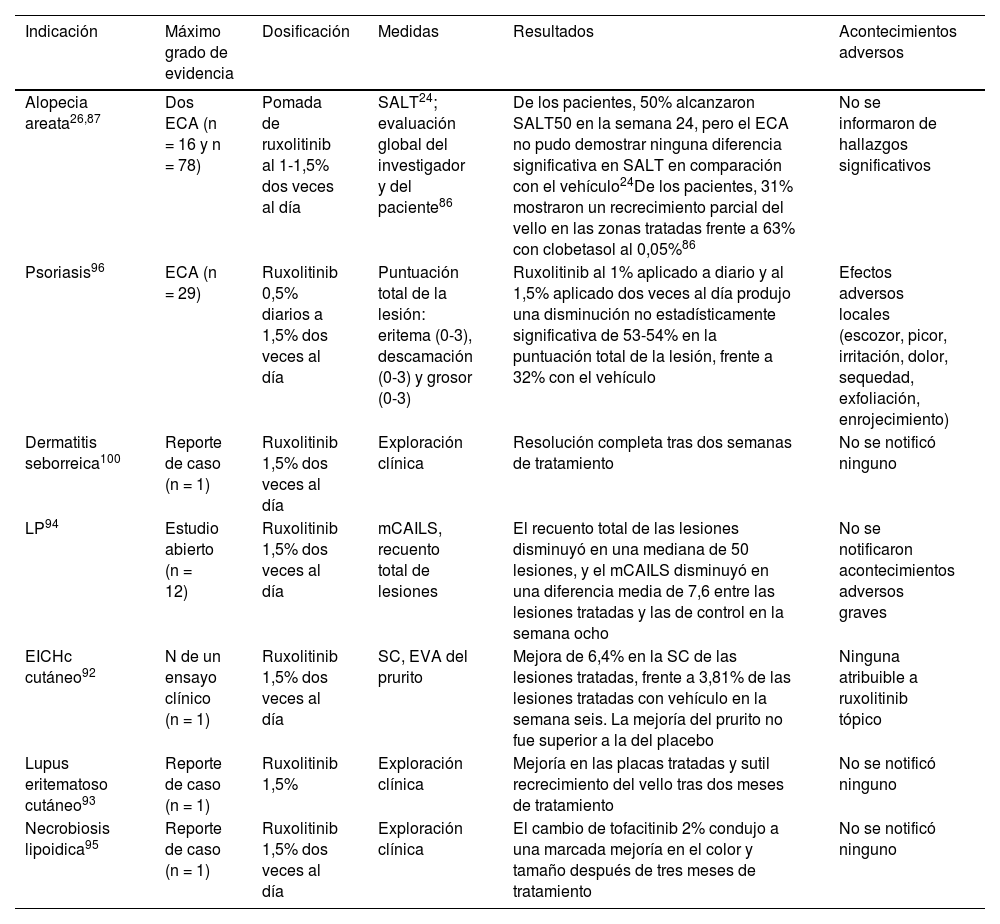
Ruxolitinib tópico (tabla 5)Alopecia areataEn un ECA de fase 1 (n = 16) en el que se comparó pomada de ruxolitinib al 1% con clobetasol 0,05% en individuos con AA universalis, 31% mostró un recrecimiento parcial del cabello en las zonas tratadas con ruxolitinib87. Un estudio piloto abierto seguido de un ECA, en el que participaron pacientes con 25-99% de pérdida de cabello al inicio del estudio, informó de que 50% logró una reducción > 50% en la Severity of Alopecia Tool (SALT50) en la semana 24 con crema de ruxolitinib al 1,5%. Sin embargo, el ECA no pudo demostrar una eficacia superior en comparación con el vehículo26 (tabla 5).
Uso fuera de ficha técnica del ruxolitinib tópico en dermatología
| Indicación | Máximo grado de evidencia | Dosificación | Medidas | Resultados | Acontecimientos adversos |
|---|---|---|---|---|---|
| Alopecia areata26,87 | Dos ECA (n = 16 y n = 78) | Pomada de ruxolitinib al 1-1,5% dos veces al día | SALT24; evaluación global del investigador y del paciente86 | De los pacientes, 50% alcanzaron SALT50 en la semana 24, pero el ECA no pudo demostrar ninguna diferencia significativa en SALT en comparación con el vehículo24De los pacientes, 31% mostraron un recrecimiento parcial del vello en las zonas tratadas frente a 63% con clobetasol al 0,05%86 | No se informaron de hallazgos significativos |
| Psoriasis96 | ECA (n = 29) | Ruxolitinib 0,5% diarios a 1,5% dos veces al día | Puntuación total de la lesión: eritema (0-3), descamación (0-3) y grosor (0-3) | Ruxolitinib al 1% aplicado a diario y al 1,5% aplicado dos veces al día produjo una disminución no estadísticamente significativa de 53-54% en la puntuación total de la lesión, frente a 32% con el vehículo | Efectos adversos locales (escozor, picor, irritación, dolor, sequedad, exfoliación, enrojecimiento) |
| Dermatitis seborreica100 | Reporte de caso (n = 1) | Ruxolitinib 1,5% dos veces al día | Exploración clínica | Resolución completa tras dos semanas de tratamiento | No se notificó ninguno |
| LP94 | Estudio abierto (n = 12) | Ruxolitinib 1,5% dos veces al día | mCAILS, recuento total de lesiones | El recuento total de las lesiones disminuyó en una mediana de 50 lesiones, y el mCAILS disminuyó en una diferencia media de 7,6 entre las lesiones tratadas y las de control en la semana ocho | No se notificaron acontecimientos adversos graves |
| EICHc cutáneo92 | N de un ensayo clínico (n = 1) | Ruxolitinib 1,5% dos veces al día | SC, EVA del prurito | Mejora de 6,4% en la SC de las lesiones tratadas, frente a 3,81% de las lesiones tratadas con vehículo en la semana seis. La mejoría del prurito no fue superior a la del placebo | Ninguna atribuible a ruxolitinib tópico |
| Lupus eritematoso cutáneo93 | Reporte de caso (n = 1) | Ruxolitinib 1,5% | Exploración clínica | Mejoría en las placas tratadas y sutil recrecimiento del vello tras dos meses de tratamiento | No se notificó ninguno |
| Necrobiosis lipoidica95 | Reporte de caso (n = 1) | Ruxolitinib 1,5% dos veces al día | Exploración clínica | El cambio de tofacitinib 2% condujo a una marcada mejoría en el color y tamaño después de tres meses de tratamiento | No se notificó ninguno |
ECA: ensayo controlado aleatorizado; EICHc: enfermedad crónica del injerto contra el huésped; LP: liquen plano; mCAILS: puntuación de la evaluación compuesta modificada del índice de gravedad de las lesiones; SALT: herramienta de puntuación de la severidad de la alopecia; SC: superficie corporal; EVA: escala visual analógica.
En una serie de casos pediátricos (n = 2), el ruxolitinib tópico al 1-2% dos veces al día hizo que volviera a crecer más de 75% del vello de las pestañas superiores en un paciente y en el otro no volvieron a salir las cejas88. Dos informes de casos mostraron un crecimiento parcial del vello con ruxolitinib tópico89,90. Otro caso no mostró eficacia con ruxolitinib al 0,6% dos veces al día91.
Enfermedad crónica cutánea de injerto contra huéspedUn varón de 51 años mostró una mejora de 6,4% en la superficie corporal total en las lesiones tratadas con ruxolitinib tópico al 1,5% en la sexta semana92.
Lupus eritematoso cutáneoUna mujer con lupus eritematoso discoide refractario presentó mejoría y le volvió a crecer pelo tras dos meses de crema de ruxolitinib al 1,5%93.
Liquen planoUn estudio prospectivo de fase 2 abierto con ruxolitinib al 1,5% dos veces al día en LP cutáneo (n = 12) mostró una reducción estadísticamente significativa del número de lesiones y su gravedad al cabo de ocho semanas94.
Necrobiosis lipoideaUna mujer con necrobiosis lipoídica refractaria observó una notable mejoría tras cambiar de crema de tofacitinib al 2% a ruxolitinib al 1,5% dos veces al día95.
PsoriasisEn un ECA de fase 2 (n = 29) se observó que el ruxolitinib al 1 y al 1,5% reducía las placas en 53 y 54%96. En un ensayo abierto de fase IIb se halló una mejora media del PASI de 40% tras tres meses de tratamiento con crema de ruxolitinib al 1%97. Otro ensayo abierto en el que se comparó la crema de ruxolitinib al 1% y 1,5% aplicada una o dos veces al día durante cuatro semanas mostró una reducción media de la puntuación del eritema (42-55%), la descamación (46-78%) y el grosor (50-65%) en todos los grupos98. Un estudio abierto de fase 2 (n = 25) de ruxolitinib al 1,5% dos veces al día reveló una mejora estadísticamente significativa en el día 2899.
Dermatitis seborreicaUn hombre de 74 años con rosácea concomitante mostró una resolución completa de la dermatitis seborreica y una mejoría parcial de la rosácea después de dos semanas con ruxolitinib al 1,5% dos veces al día100.
DiscusiónLa inclusión de una advertencia (Boxed Warning) para los inhibidores de JAK ha suscitado preocupación entre los dermatólogos en relación con la seguridad de estos medicamentos. Sin embargo, no debe sobrestimarse la magnitud de estas preocupaciones. Los efectos secundarios a largo plazo que motivaron la advertencia se observaron en pacientes ≥ 50 años con artritis reumatoide, en tratamiento concomitante con metotrexato y con factores de riesgo cardiovascular preexistentes9. En las indicaciones dermatológicas, las poblaciones de pacientes suelen diferir en gran medida según el contexto clínico en el que se realizó este estudio, lo que puede influir en el perfil de seguridad. Además, un ensayo que comparaba la incidencia de efectos adversos entre las terapias sistémicas tradicionales (metotrexato, ciclosporina y corticoesteroides sistémicos) y los inhibidores de JAK (upadacitinib y abrocitinib) halló tasas similares o superiores de malignidad, MACE y TEV con los abordajes tradicionales6. Esto sugiere que los inhibidores de JAK podrían ofrecer una alternativa más segura en términos de efectos secundarios a largo plazo. Para mitigar el riesgo de efectos graves, un grupo de trabajo multidisciplinar publicó en 2021 unas recomendaciones consensuadas para el tratamiento de los pacientes manejados con inhibidores de JAK101. En 2022, la EMA respaldó las medidas recomendadas por el Comité de Evaluación de Riesgos en Farmacovigilancia elaboradas con el mismo fin102 (tabla 6). Antes de iniciar el tratamiento con inhibidores de JAK, debe realizarse una anamnesis completa, centrándose en factores como antecedentes de MACE y TEV, trombosis familiar y neoplasias malignas previas. Debe efectuarse un examen físico completo y análisis de sangre, incluyendo un hemograma, pruebas de función hepática y renal, lipidograma, CPK y cribado serológico de virus de la inmunodeficiencia humana (VIH), VHB, virus de la hepatitis C (VHC) y virus de la varicela zoster (VVZ). También debe llevarse a cabo un cribado de la tuberculosis. Dado el elevado riesgo de herpes zóster, debe ofrecerse a todos los pacientes la vacunación en función de su estado serológico. Shingrix, una vacuna adyuvada recombinante contra el herpes zóster, ha mostrado resultados prometedores en los datos iniciales de sujetos con artritis reumatoide, con tan solo 0,7% de desarrollo de herpes zóster. Sin embargo, se necesitan más estudios para confirmar su eficacia en prevención103. El seguimiento y la monitorización estrechos son vitales durante todo el tratamiento con inhibidores de JAK. Los pacientes deben ser seguidos por profesionales expertos en estos medicamentos, y deben realizarse análisis de sangre periódicos para controlar los posibles efectos adversos. Las revisiones dermatológicas son especialmente importantes en los sujetos de alto riesgo para detectar signos precoces de cáncer de piel.
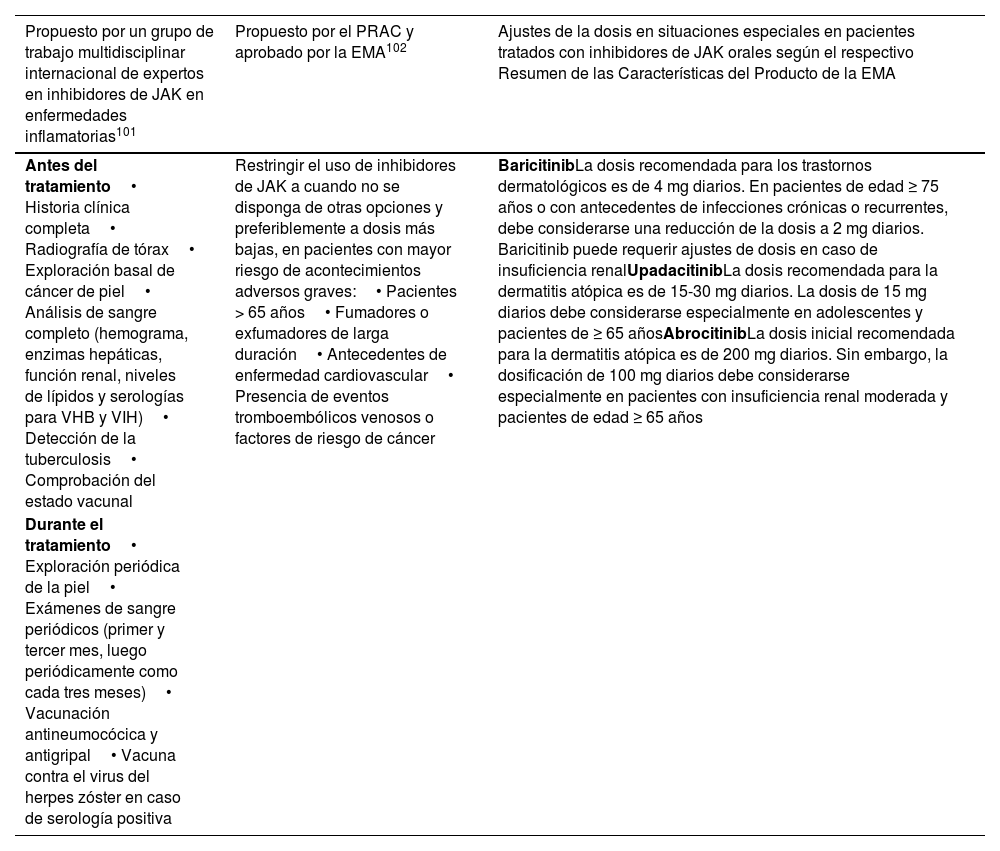
Resumen de recomendaciones de pretratamiento y seguimiento del tratamiento en pacientes que reciben inhibidores de JAK
| Propuesto por un grupo de trabajo multidisciplinar internacional de expertos en inhibidores de JAK en enfermedades inflamatorias101 | Propuesto por el PRAC y aprobado por la EMA102 | Ajustes de la dosis en situaciones especiales en pacientes tratados con inhibidores de JAK orales según el respectivo Resumen de las Características del Producto de la EMA |
|---|---|---|
| Antes del tratamiento• Historia clínica completa• Radiografía de tórax• Exploración basal de cáncer de piel• Análisis de sangre completo (hemograma, enzimas hepáticas, función renal, niveles de lípidos y serologías para VHB y VIH)• Detección de la tuberculosis• Comprobación del estado vacunal | Restringir el uso de inhibidores de JAK a cuando no se disponga de otras opciones y preferiblemente a dosis más bajas, en pacientes con mayor riesgo de acontecimientos adversos graves:• Pacientes > 65 años• Fumadores o exfumadores de larga duración• Antecedentes de enfermedad cardiovascular• Presencia de eventos tromboembólicos venosos o factores de riesgo de cáncer | BaricitinibLa dosis recomendada para los trastornos dermatológicos es de 4 mg diarios. En pacientes de edad ≥ 75 años o con antecedentes de infecciones crónicas o recurrentes, debe considerarse una reducción de la dosis a 2 mg diarios. Baricitinib puede requerir ajustes de dosis en caso de insuficiencia renalUpadacitinibLa dosis recomendada para la dermatitis atópica es de 15-30 mg diarios. La dosis de 15 mg diarios debe considerarse especialmente en adolescentes y pacientes de ≥ 65 añosAbrocitinibLa dosis inicial recomendada para la dermatitis atópica es de 200 mg diarios. Sin embargo, la dosificación de 100 mg diarios debe considerarse especialmente en pacientes con insuficiencia renal moderada y pacientes de edad ≥ 65 años |
| Durante el tratamiento• Exploración periódica de la piel• Exámenes de sangre periódicos (primer y tercer mes, luego periódicamente como cada tres meses)• Vacunación antineumocócica y antigripal• Vacuna contra el virus del herpes zóster en caso de serología positiva |
EMA: Agencia Europea de Medicamentos; JAK: quinasa Janus; PRAC: Comité de Evaluación de Riesgos en Farmacovigilancia.
Dado que los estudios clínicos tienden a infrarrepresentar a los pacientes pediátricos o mayores de 65 años, a los individuos con comorbilidades o en riesgo de malignidad o de eventos tromboembólicos y cardiovasculares, es necesario que los ensayos clínicos incluyan a estas poblaciones para evaluar de forma exhaustiva la seguridad de los inhibidores de JAK. Se necesitan más investigaciones para determinar si los riesgos pueden mitigarse mediante una cuidadosa selección de las dosis.
Nuestra revisión incluye datos preliminares sobre la eficacia de los inhibidores de JAK en varias entidades dermatológicas (tabla 7). Sobre la base de los prometedores hallazgos examinados, es razonable considerar a los inhibidores de JAK como una opción terapéutica potencial para enfermedades como la vasculopatía livedoide, la EICHc, las enfermedades autoinflamatorias, el lupus eritematoso cutáneo, la dermatomiositis y la esclerosis sistémica. Estas enfermedades suelen ser refractarias a los tratamientos convencionales o dependen en gran medida de los corticoesteroides, por lo que urge encontrar terapias alternativas.
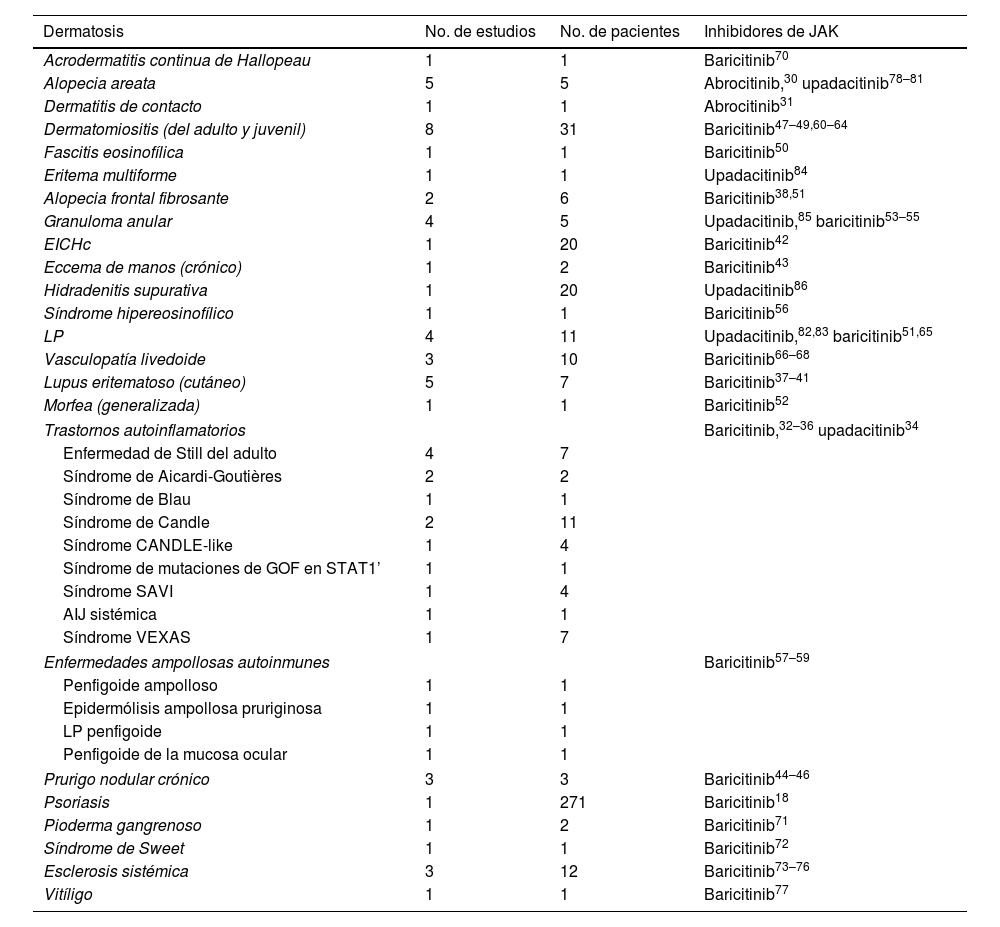
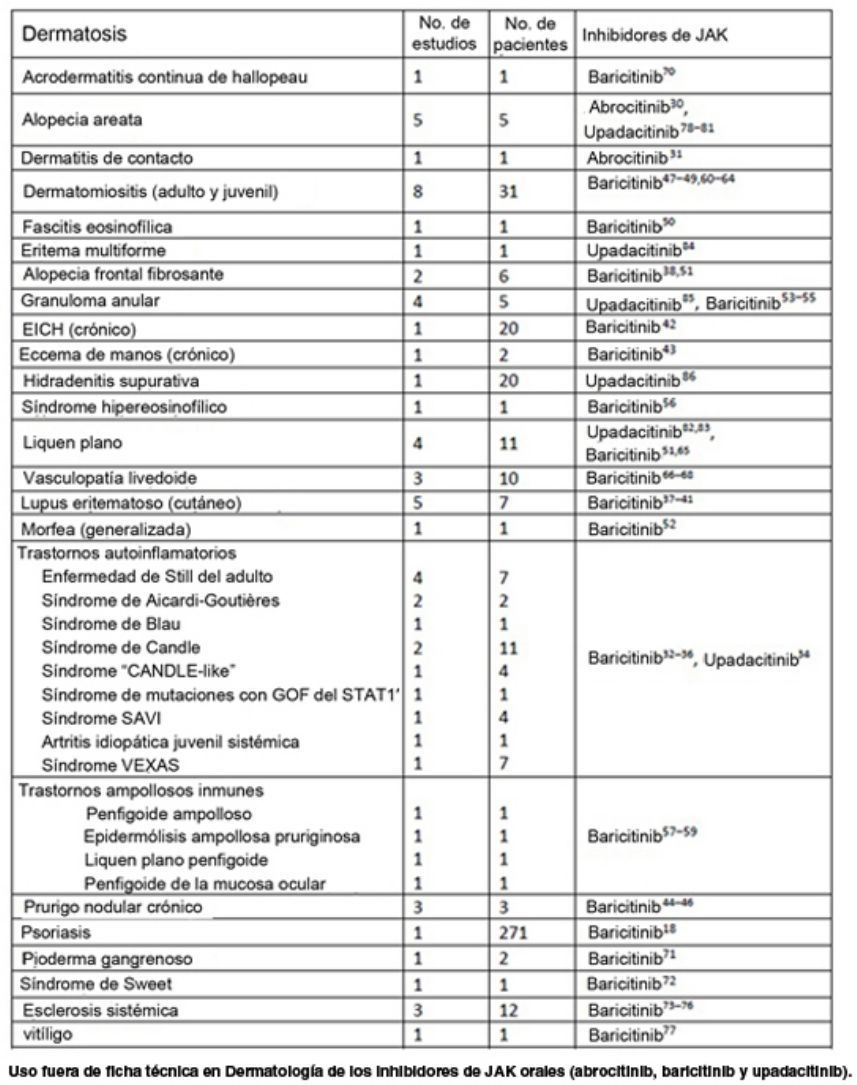
Uso fuera de ficha técnica en Dermatología de los inhibidores de JAK orales (abrocitinib, baricitinib y upadacitinib)
| Dermatosis | No. de estudios | No. de pacientes | Inhibidores de JAK |
|---|---|---|---|
| Acrodermatitis continua de Hallopeau | 1 | 1 | Baricitinib70 |
| Alopecia areata | 5 | 5 | Abrocitinib,30 upadacitinib78–81 |
| Dermatitis de contacto | 1 | 1 | Abrocitinib31 |
| Dermatomiositis (del adulto y juvenil) | 8 | 31 | Baricitinib47–49,60–64 |
| Fascitis eosinofílica | 1 | 1 | Baricitinib50 |
| Eritema multiforme | 1 | 1 | Upadacitinib84 |
| Alopecia frontal fibrosante | 2 | 6 | Baricitinib38,51 |
| Granuloma anular | 4 | 5 | Upadacitinib,85 baricitinib53–55 |
| EICHc | 1 | 20 | Baricitinib42 |
| Eccema de manos (crónico) | 1 | 2 | Baricitinib43 |
| Hidradenitis supurativa | 1 | 20 | Upadacitinib86 |
| Síndrome hipereosinofílico | 1 | 1 | Baricitinib56 |
| LP | 4 | 11 | Upadacitinib,82,83 baricitinib51,65 |
| Vasculopatía livedoide | 3 | 10 | Baricitinib66–68 |
| Lupus eritematoso (cutáneo) | 5 | 7 | Baricitinib37–41 |
| Morfea (generalizada) | 1 | 1 | Baricitinib52 |
| Trastornos autoinflamatorios | Baricitinib,32–36 upadacitinib34 | ||
| Enfermedad de Still del adulto | 4 | 7 | |
| Síndrome de Aicardi-Goutières | 2 | 2 | |
| Síndrome de Blau | 1 | 1 | |
| Síndrome de Candle | 2 | 11 | |
| Síndrome CANDLE-like | 1 | 4 | |
| Síndrome de mutaciones de GOF en STAT1’ | 1 | 1 | |
| Síndrome SAVI | 1 | 4 | |
| AIJ sistémica | 1 | 1 | |
| Síndrome VEXAS | 1 | 7 | |
| Enfermedades ampollosas autoinmunes | Baricitinib57–59 | ||
| Penfigoide ampolloso | 1 | 1 | |
| Epidermólisis ampollosa pruriginosa | 1 | 1 | |
| LP penfigoide | 1 | 1 | |
| Penfigoide de la mucosa ocular | 1 | 1 | |
| Prurigo nodular crónico | 3 | 3 | Baricitinib44–46 |
| Psoriasis | 1 | 271 | Baricitinib18 |
| Pioderma gangrenoso | 1 | 2 | Baricitinib71 |
| Síndrome de Sweet | 1 | 1 | Baricitinib72 |
| Esclerosis sistémica | 3 | 12 | Baricitinib73–76 |
| Vitíligo | 1 | 1 | Baricitinib77 |
AIJ: artitis idiopática juvenil; JAK: Janus quinasa; EICHc: enfermedad crónica del injerto contra el huésped; LP: liquen plano; SAVI: vasculopatía asociada a STING de inicio en la infancia.
La accesibilidad de los inhibidores de JAK como medicamentos fuera de ficha técnica plantea preocupaciones. Un estudio de cohorte prospectivo en clínicas dermatológicas alemanas reveló tasas de aprobación más bajas de inhibidores de JAK en comparación con los biológicos (OR 0,16)104. Además, considerando su alto coste, un análisis de coste-beneficio es esencial, especialmente para afecciones que no amenazan la vida.
Nuestro estudio tiene varias limitaciones. Es una revisión narrativa y no sistemática. Los tamaños de muestra eran en su mayoría pequeños, faltaban estudios prospectivos en muchas indicaciones fuera de ficha técnica y hubo periodos de seguimiento cortos con metodologías heterogéneas, lo que limitó la generalización de los hallazgos. Muchos informes de casos y series que evaluaron la eficacia de los inhibidores de JAK enfrentaron desafíos al atribuir resultados positivos únicamente a estos medicamentos, ya que numerosos casos involucraron tratamientos concomitantes que podrían haber influido en los hallazgos.
ConclusiónLos inhibidores de JAK suponen un importante paso hacia la medicina de precisión. Su seguridad depende en gran medida de las características del paciente, la enfermedad que se está tratando, la vía de administración, el inhibidor específico de JAK y la dosis. En comparación con las terapias inmunosupresoras tradicionales, en general, estos fármacos demuestran mejores perfiles de seguridad. Estos agentes son prometedores como tratamientos para diversas dermatosis inflamatorias que tienen un gran impacto en la calidad de vida.
FinanciaciónNinguna.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.