La hidroxicloroquina es un antimalárico con acción inmunomoduladora, antiinflamatoria, antibacteriana y antiviral. Posee un buen perfil de seguridad y puede ser utilizada en niños, en mujeres embarazadas o durante la lactancia, y no produce inmunosupresión. La retinopatía es uno de sus efectos adversos más temidos y requiere controles regulares. La hidroxicloroquina es un fármaco esencial en dermatología, utilizado ampliamente con buenas tasas de respuesta clínica tanto como un tratamiento de primera línea en el lupus eritematoso, como en múltiples dermatosis autoinmunes/inflamatorias como liquen plano, erupción polimorfa lumínica, porfiria cutánea tarda, granuloma anular y sarcoidosis, entre otras. Durante el año 2020 fue prescrita a gran escala como profilaxis y tratamiento de la infección producida por el coronavirus SARS-CoV-2 (COVID-19). El aumento de la utilización de hidroxicloroquina produjo serias dificultades para su obtención e incluso desabastecimiento. En metaanálisis recientes se ha concluido que la hidroxicloroquina no es efectiva para el tratamiento de esta patología y se desaconseja su prescripción.
Hydroxychloroquine is an antimalarial drug with immunomodulatory, anti-inflammatory, antibacterial, and antiviral properties. It has a good safety profile, can be used in children and in pregnant and breastfeeding women, and does not suppress the immune system. Regular screening for retinopathy, one of the drug's most feared adverse effects, is necessary. Hydroxychloroquine is a widely used, essential drug in dermatology. Clinical response rates are good in lupus erythematous, where it is a first-line therapy, as well in numerous autoimmune/inflammatory diseases, including lichen planus, polymorphic light eruption, porphyria cutanea tarda, granuloma annulare, and sarcoidosis. In 2020, it was widely prescribed both to prevent and to treat COVID-19 caused by SARS-CoV-2. Its increased use led to serious supply shortages and in some cases stocks were entirely depleted. Recent meta-analyses have concluded that hydroxychloroquine is ineffective against COVID-19 and have advised against its use.
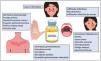
La hidroxicloroquina es un antimalárico derivado de la cloroquina, de bajo coste y con un perfil bueno de seguridad1. Presenta una acción inmunomoduladora, antiinflamatoria y fotoprotectora, aunque puede actuar como fotosensibilizante. En dermatología está indicada como tratamiento de primera línea en el lupus eritematoso y es ampliamente utilizada fuera de indicación en múltiples dermatosis autoinmunes/inflamatorias (fig. 1)1-3. Posee propiedades antibacterianas, antifúngicas y antivirales, motivo por el cual fue prescrita fuera de ficha técnica para la profilaxis y el tratamiento de la infección producida por el coronavirus SARS-CoV-2 (COVID-19)4,5. El aumento de la utilización de la hidroxicloroquina en este contexto produjo dificultades para la obtención del fármaco e incluso un desabastecimiento temporal. A continuación se revisa el uso de la hidroxicloroquina en dermatología, su mecanismo de acción y toxicidades, y la amenaza que la COVID-19 ha significado para el abastecimiento del fármaco.
Farmacocinética y mecanismo de acción de la hidroxicloroquinaLa hidroxicloroquina presenta una biodisponibilidad oral alta, un 45% es eliminada por vía renal3 y es metabolizada por el citocromo P450, aunque sus niveles plasmáticos no se ven afectados por inductores o inhibidores de estas enzimas2 (tabla 1).
Farmacocinética de la hidroxicloroquina
| Rápidamente absorbida en el tubo gastrointestinal |
| Alta biodisponibilidad oral (75-100%) |
| Larga vida mediaa |
| Sus niveles cutáneos son 100 a 200 veces mayores que los plasmáticos |
| Excretada por vía renal en el 45% y por vía gastrointestinal en el 20% |
| La alcalinización de la orina aumenta su excreción |
| Metabolizada por el citocromo P450 |
| Sus niveles plasmáticos no se ven afectados por fármacos inductores o inhibidores del citocromo P450 |
Su mecanismo de acción es complejo. Su acción inmunomoduladora deriva de la inhibición de la presentación de antígenos a través del complejo mayor de histocompatibilidad, la estabilización de membranas lisosomales, una disminución de la citotoxicidad mediada por células y la inhibición de múltiples receptores Toll-like intracelulares3. Su efecto antiinflamatorio es secundario a la inhibición de la fosfolipasa A2 y C y de diversas citoquinas (interleucina1, 2 y 6, factor de necrosis tumoralα e interferónα yγ)2, y su efecto fotoprotector es secundario a sus propiedades antioxidantes y estabilizadoras del ADN, y a la reducción de los niveles de interleucinas tras la irradiación ultravioleta (tabla 2)3. Además, disminuye la supervivencia viral, bacteriana y fúngica en los lisosomas y endosomas3.
Mecanismo de acción de la hidroxicloroquina
| Acción inmunomoduladora | Inhibe la presentación de antígenos a través del complejo mayor de histocompatibilidadEstabilización de membranas lisosomalesDisminuye la citotoxicidad mediada por célulasInhibe múltiples receptores Toll-like intracelulares |
| Acción antiinflamatoria | Inhibe la interleucina 1, 2 y 6, el factor de necrosis tumoral α y el interferón α y γReducción de la fosfolipasa A2 y C, y de la síntesis de prostaglandinas |
| Acción fotoprotectora | Presenta propiedades antioxidantes y protege del daño de los radicales libres inducidos por la radiación UVAbsorbe la radiación UVSe une al ADN, estabilizándoloRegula la transcripción del ARNReduce los niveles de interleucinas tras la irradiación UVReduce la presentación antigénica en la piel irradiada |
| Acción antibacteriana y antiviral | Alcaliniza los fagosomas y organelos intracelulares, reduciendo el crecimiento y la supervivencia de bacterias intracelulares y virusPotencia la acción intracelular de los antibióticosInhibe la modificación post-translacional de proteínas víricasInhibe la producción de ácido siálico |
| Acción antitrombótica | Inhibe la adhesión y la agregación plaquetariaAumenta la vasodilatación mediada por el endotelioInhibe la formación de anticuerpos antifosfolípidos |
| Acción hipolipemiante | Incrementa la cantidad de receptores de LDLIncrementa la excreción de lípidos |
| Acción hipoglicemiante | Aumenta la secreción de insulinaIncrementa la sensibilidad a la insulina |
Su uso está aprobado por la Food and Drug Administration (FDA) y la European Medicines Agency (EMA) para el tratamiento del lupus eritematoso.
Efectos adversos y toxicidadesLa hidroxicloroquina tiene un buen perfil de seguridad. Su suspensión por efectos adversos es poco frecuente. Una de las toxicidades más temidas es la retiniana, observada en el 7,5% de los pacientes, aunque es extremadamente rara durante los primeros 5años de tratamiento. Las dosis mayores de 5mg/kg de peso real/día y una duración superior a los 10años de tratamiento se asocian a un aumento de la tasa de retinopatía (tabla 3)6. Los efectos adversos gastrointestinales son relativamente frecuentes e incluyen anorexia, pirosis, diarrea y distención abdominal3. Los efectos adversos cutáneos más frecuentes son: erupción cutánea, hiperpigmentación y prurito, y puede provocar fotosensibilidad. Otras toxicidades infrecuentes incluyen las cardiacas, musculares y hematológicas7 (tabla 4).
Factores de riesgo para la retinopatía por hidroxicloroquina
| Dosis >5mg /kg (peso real)/díaa |
| Duración del tratamiento >5 años |
| Dosis acumulada >1.000 gb |
| Insuficiencia renalc |
| Patología retiniana o macular previa |
| Uso concomitante de tamoxifeno |
Efectos adversos potenciales de la hidroxicloroquina
| Gastrointestinales | Anorexia, pirosis, diarrea y distención abdominal |
| Oculares | Alteración de la acomodación visual (reversible) |
| Retinopatía (irreversible)a | |
| Opacidades corneales y edema corneal (reversibles) | |
| Cutáneos | Erupción cutánea, hiperpigmentación (reversible) y pruritoOtras infrecuentes son: eritema multiforme, síndrome DRESS, síndrome de Stevens-Johnson, NET, PEAGb, fotosensibilidad |
| Cardiacos | Alteraciones de la conducciónArritmias ventricularesCardiomiopatía restrictiva y obstructivaInsuficiencia cardiaca congestiva |
| Musculares | Miopatía proximal |
| Hematológicos | Agranulocitosis, leucopenia y anemia |
| Hepáticos | Hepatotoxicidad |
| Neuropsiquiátricos | Pesadillas, irritabilidad, alteraciones del ánimo |
Se recomienda una evaluación oftalmológica basal y anual después de 5años de terapia. Una revisión reciente no describió hemólisis con hidroxicloroquina en los pacientes con una deficiencia de la enzima glucosa-6-fosfato deshidrogenasa, por lo que no se recomienda su medición rutinaria7. En la tabla 5 se resumen las principales recomendaciones.
Hidroxicloroquina en la práctica clínica: dosis, monitorización y precauciones
| Dosis | Dosis más frecuentemente utilizada: 400 mg/día (≤ 5 mg/ kg [peso real]/día)En pacientes con fracaso terapéutico se pueden medir los niveles plasmáticos, intentando alcanzar niveles > 750 ng/mla |
| Monitorización | Oftalmológica:Revisión basal durante el primer año de tratamiento, y anual después del quinto añobPruebas de laboratorio:Hemograma y perfil bioquímico incluyendo función renal y pruebas hepáticas antes del inicio del tratamientoc |
| Precauciones | Recomendar suspensión del tabaco (disminuye la efectividad de los antimaláricos)Realizar controles analíticos estrictos en pacientes con insuficiencia renalPara disminuir las dosis acumuladas (y riesgo de retinopatía), se podría intentar suspender luego de 6 a 12 meses de uso en LEC, o en períodos de menor riesgo (invierno) |
LEC: lupus eritematoso cutáneo.
Se sugiere medir niveles plasmáticos cada 3 meses, con aumentos de dosis de 200mg, hasta alcanzar los valores deseados. Luego se puede reducir la dosis a 400mg/día, manteniendo buenas respuestas en la mayoría de los casos.
La revisión debería incluir una campimetría y tomografía de coherencia óptica. Puede ser realizada a intervalos menores de tiempo en pacientes de alto riesgo (tabla 3). El cribado oftalmológico no previene el daño, solo permite detectar la retinopatía en forma temprana y evitar su progresión. Ante la sospecha de retinopatía se debe suspender el medicamento
Los antimaláricos son fármacos de primera línea en el tratamiento del lupus eritematoso sistémico (LES). Reducen la sintomatología articular y cutánea, la actividad de la enfermedad, el daño a los órganos diana y las complicaciones cardiovasculares, y aumentan la supervivencia8.
En cuanto al lupus eritematoso cutáneo (LEC), una revisión sistemática reciente que incluyó 10 estudios y 852 pacientes mostró una efectividad del 50 al 97% (aproximadamente el 50% en los 2 ensayos clínicos aleatorizados [ECA] incluidos)9 (tabla 6). El grado de eficacia varía según el subtipo de LEC, siendo mayor para LEC agudo en comparación con LEC subagudo y LEC crónico10. En el lupus túmido, un estudio retrospectivo (n=36) mostró un 61% de respuestas satisfactorias con hidroxicloroquina9. La hidroxicloroquina también parece efectiva en la paniculitis lúpica2. El tiempo hasta la respuesta clínica es otro factor que dependería del subtipo de LEC, por lo que se recomienda evaluar la efectividad de la hidroxicloroquina a las 4 semanas en el LEC agudo, a las 5 semanas en el LEC subagudo y a las 8 semanas en el LEC crónico10.
Principales estudios clínicos sobre el uso de hidroxicloroquina en lupus eritematoso cutáneoa
| Autor, año | Tipo de estudio | Objetivo | Número de individuos | Resultados principales |
|---|---|---|---|---|
| Ruzicka et al., 1992 | ECA | Comparación entre HCQ y acitretino | 58 pacientes con LCCD y LECSA (28 tratados con HCQ) | Buena respuesta en el 50% de los casos. Resultados similares entre ambos fármacosMejor perfil de seguridad con HCQ |
| Chang et al., 2011 | Estudio prospectivo de cohorte | Evaluar la efectividad de los antimaláricos | 128 pacientes con LEC | Mejoría significativa en el 55% de los pacientes a los 2 meses. En los no respondedores la adición de quinacrina permitió alcanzar buenas respuestas en el 67% |
| Wahie et al., 2011 | Estudio retrospectivo multicéntrico | Evaluar la efectividad de HCQ e influencia de polimorfismo genético en la respuesta clínica | 200 pacientes con LCCD | 60% fueron respondedoresEl 4% de los pacientes suspendieron el medicamento por efectos adversosNo hubo diferencias en sus perfiles genéticos de metabolización |
| Frances et al., 2012 | Estudio prospectivo multicéntrico | Estudiar la relación entre la concentración sanguínea de HCQ y la eficacia clínica | 300 pacientes con LCC o LECSA | 38% de remisión completa, 29% de remisión parcial, 33% de no respondedoresA mayores concentraciones plasmáticas de HCQ, mejores respuestas |
| Alniemiet al., 2017 | Estudio retrospectivo | Evaluar características clínicas, enfermedades asociadas y resultados terapéuticos | 90 pacientes con LECSA (46 pacientes tratados con HCQ) | El 74% de los pacientes tratados con HCQ alcanzaron una respuesta completa |
| Yokohama et al., 2017 | ECA | Valorar eficacia y tolerabilidad de HCQ | 103 pacientes con LEC | Porcentaje superior de mejoría o marcada mejoría clínica con HCQ que con placebo (51,4% vs 8,7%) (p=0,0002) |
| Ototake et al., 2019 | Estudio retrospectivo | Estudiar la eficacia de HCQ en diversos subtipos de LEC | 35 pacientes con LEC | 87% de respuestas favorables (LECA > LCSA > LCC). Respuestas más rápidas en LECA y más lentas en LLC |
ECA: ensayo clínico aleatorizado; HCQ: hidroxicloroquina; LCC: lupus cutáneo crónico; LCCD: lupus cutáneo crónico discoide; LECA: lupus eritematoso cutáneo agudo; LECSA: lupus eritematoso cutáneo subagudo.
Para el LEC refractario al tratamiento con hidroxicloroquina existen diversas alternativas, y una de ellas es determinar los niveles plasmáticos de hidroxicloroquina. En el LES los niveles terapéuticos están entre 500 y 1.000ng/ml, y aún no se han determinado los rangos óptimos para el LEC. Los valores inferiores a 200ng/ml se asocian a una falta de adherencia terapéutica. En los casos refractarios se puede aumentar la dosis hasta alcanzar concentraciones superiores a 750ng/ml, lo que puede asociarse a una mejoría clínica significativa1. Otra alternativa es cambiar a cloroquina, con la que se puede alcanzar una mejoría cutánea en un porcentaje significativo de los pacientes, aunque con un perfil de seguridad peor. Otra opción es agregar quinacrina 100mg/día al tratamiento con hidroxicloroquina2,3. En España no está comercializada y debe obtenerse como medicación extranjera.
DermatomiositisEl tratamiento de las manifestaciones cutáneas de la dermatomiositis puede ser más difícil que el de las musculares. En un estudio retrospectivo multicéntrico que incluyó 115 individuos (93 con formas amiopáticas y 22 con hipomiopáticas) los antimaláricos fueron el tratamiento sistémico más frecuentemente indicado (76%), y solo el 11% logró un control de la afectación cutánea. La mayoría requirió inmunosupresores o inmunoglobulinas11. Se observaron resultados similares en un estudio de cohorte con 41 individuos con dermatomiositis amiopática12. En un estudio reciente se encontró un aumento significativo de las células mieloides dendríticas productoras de interferón β en la piel de los pacientes con una dermatomiositis que no habían respondido al tratamiento con hidroxicloroquina. El incremento en este subtipo celular podría explicar la respuesta disminuida a los antimaláricos13.
Algunos estudios han descrito que los individuos con dermatomiositis pueden presentar una mayor tasa de efectos adversos cutáneos con hidroxicloroquina (alrededor del 10%) que los pacientes con LES14, aunque esto no ha sido confirmado por otros autores.
MorfeaUn reciente estudio retrospectivo (n=84) mostró una tasa de respuesta completa superior al 40% y alrededor de un 50% de respuestas parciales. La mediana de tiempo hasta la respuesta clínica máxima fue de 12meses. Los pacientes con una morfea en placas respondieron mejor que aquellos con formas generalizadas, lineares o profundas15. En otro estudio retrospectivo que incluyó 16 pacientes con fascitis eosinofílica, el 25% de los tratados con hidroxicloroquina en monoterapia alcanzaron una respuesta completa y el 50%, parcial. La hidroxicloroquina fue una buena alternativa, aunque no superior a los corticoides orales16.
Vasculitis urticarialEn un estudio retrospectivo multicéntrico que incluyó 57 individuos con vasculitis urticarial hipocomplementémica, el uso de hidroxicloroquina fue un tratamiento efectivo como primera línea terapéutica, con tasas de respuesta similares a las de los corticoides sistémicos, con una respuesta global (respuesta completa +respuestas parciales) en más del 50% de los pacientes, aunque con una menor eficacia en los casos recurrentes o refractarios a otros fármacos17. Una reciente revisión sistemática sobre la vasculitis urticarial concluyó que la hidroxicloroquina (400mg/día) es un fármaco potencialmente efectivo en esta patología y útil como ahorrador de corticoides18.
Liquen planoUn estudio retrospectivo (n=61) en pacientes con liquen plano cutáneo (54%) o cutáneo-mucoso (25%), o mucoso exclusivo (21%), mostró tasas de resolución clínica del 61% con hidroxicloroquina 400mg/día en una media de 80días19. También se han descrito buenas respuestas en casos aislados de liquen plano actínico20.
En una serie de 21 individuos con liquen plano oral erosivo tratados con hidroxicloroquina 400mg/día durante 2 a 4meses se observó una respuesta completa en el 24% y una mejoría al menos moderada en el 57%21. Un ensayo clínico abierto previo (n=10) había mostrado resultados similares22. En un estudio prospectivo (n=8) todos los pacientes presentaron una mejoría clínica significativa con antimaláricos (7 con cloroquina 3,5-6mg/kg/día y uno con hidroxicloroquina 400mg/día) tras una media de 2,4meses23. En cuanto al liquen plano erosivo vulvar, un estudio retrospectivo (n=15) mostró una tasa de respuesta clínica del 60% con una dosis de hidroxicloroquina de 200 a 800mg/día (la mayoría con 400mg/día), con una mediana de tiempo hasta la respuesta de 5meses24.
Liquen plano pilarisUn estudio retrospectivo en 23 individuos con liquen plano pilaris (n=40) mostró un 61% de respuestas completas con hidroxicloroquina25. Otro estudio retrospectivo describió una reducción de actividad de la enfermedad en el 83% de los casos tras 12meses de tratamiento26. Sin embargo, el metotrexato fue superior a la hidroxicloroquina en reducir la actividad de la enfermedad en un ECA (n=29)27.
Alopecia frontal fibrosanteEn la alopecia frontal fibrosante (AFF), una reciente revisión de la literatura describió una estabilización de la enfermedad en el 71% de los casos (41/58), y recomiendan su uso como terapia de segunda línea tras la terapia combinada con corticoides intralesionales, tacrolimus y minoxidil tópicos28. Un estudio retrospectivo que incluyó 36 pacientes con AFF tratados con diversos fármacos, 16 de ellos con hidroxicloroquina, mostró una tasa de respuesta del 73% con el antimalárico, aunque la mayoría fueron respuestas parciales (64%)29. Se describieron resultados similares en otro estudio retrospectivo que incluyó 11 individuos con AFF26. En un amplio estudio retrospectivo multicéntrico se observó una estabilización de la patología con la hidroxicloroquina en el 59% (32/54) de los casos y una mejoría clínica en el 15% (8/54)30.
Alopecia areataUn estudio retrospectivo en 9 niños con alopecia areata refractaria (7 con alopecia areata grave) mostró un recrecimiento capilar superior al 50% en 5 de ellos (2 pacientes alcanzaron una respuesta prácticamente completa después de un año de terapia)31. Sin embargo, en una serie de 8 pacientes adultos no se observaron respuestas favorables2.
Urticaria crónica espontáneaUn ECA que incluyó 48 pacientes con urticaria crónica espontánea con respuesta insatisfactoria a antihistamínicos-H1 comparó la combinación de placebo y dosis altas de antihistamínicos-H1 (4 comprimidos/día) vs la combinación de hidroxicloroquina y altas dosis de antihistamínicos-H1. El 28% del grupo que asociaba la hidroxicloroquina alcanzó una remisión completa vs el 0% en el grupo control (p=0,01)32.
Dermatosis granulomatosasGranuloma anularEn un estudio retrospectivo que incluyó 18 pacientes, la mayoría con granuloma anular generalizado, el 55% mejoró con hidroxicloroquina33. Se observaron resultados similares en una serie prospectiva de casos (n=9)34. También se han descrito respuestas favorables en el granuloma anular elastolítico de células gigantes2.
Necrobiosis lipoidicaEn una serie de 8 pacientes tratados con antimaláricos (6 con cloroquina y 2 con hidroxicloroquina), 4 presentaron una respuesta prácticamente completa y 3 una estabilización clínica35. En casos clínicos aislados también se han observado buenas respuestas en las formas ulcerativas36.
Sarcoidosis cutáneaEn un ensayo clínico abierto (n=17) el 71% de los casos alcanzó una respuesta clínica completa y el 33% una respuesta parcial37. En una serie de 3 casos todos presentaron una resolución de las lesiones38. También hay casos descritos de sarcoidosis cutánea ulcerativa con una remisión completa con prednisona oral e hidroxicloroquina39.
Dermatosis fotoinducidas/fotoagravadasPorfiria cutánea tardaEn un ECA (n=48), dosis bajas de hidroxicloroquina (100mg 2veces por semana) fueron tan efectivas y seguras como las flebotomías en pacientes con porfiria cutánea tarda (PCT). La mediana de tiempo hasta la remisión clínica fue de 6,1meses40. Se observaron resultados similares en otro ECA previo (n=40) en pacientes alcohólicos con PCT41.
Erupción polimorfa lumínicaUn ECA que incluyó 117 pacientes con una erupción polimorfa lumínica mostró que la hidroxicloroquina (400mg/día durante un mes y luego 200mg/día por otro mes) es superior a la cloroquina en el control de quemaduras solares, prurito, descamación y eritema. El 69% presentó una respuesta clínica buena o excelente, y el 44%, una respuesta clínica completa42. Un ECA previo (n=13) había mostrado respuestas clínicas moderadas con una disminución significativa del eritema al ser utilizada durante el verano (400mg/día durante un mes y luego 200mg/día por 2meses)43.
Prurigo actínicoLa hidroxicloroquina es una opción efectiva y segura en niños con prurigo actínico, con unas dosis de 3-5mg/kg (la dosis se puede disminuir a la mitad después de un par de meses)44.
RosáceaUn ECA con 66 pacientes con rosácea comparó la efectividad de hidroxicloroquina 400mg/día vs doxiciclina 100mg/día por 2meses, obteniéndose resultados muy similares en ambos grupos. Los autores concluyen que la hidroxicloroquina puede ser efectiva en esta patología y, por lo tanto, podría ser utilizada en el tratamiento de la rosácea en embarazadas, situación clínica en la que existen pocas alternativas terapéuticas45.
Otras patologías dermatológicasSe han descrito respuestas favorables al tratamiento con hidroxicloroquina en liquen escleroso, mucinosis eritematosa reticular, lipodermatoesclerosis, estomatitis ulcerativa crónica, dermatitis actínica crónica, urticaria solar2, síndrome de Schnitzler, escleromixedema, eritema anular eosinofílico, síndrome antifosfolípidos, enfermedad de Kikuchi-Fujimoto1, pseudolinfoma3, infiltración linfocítica de Jessner, pénfigo foliáceo, dermatitis granulomatosa intersticial, mucinosis folicular y eritema nudoso crónico46, entre otros (tabla 7).
Usos fuera de indicación de la hidroxicloroquina en dermatología, y tipo de estudio que la avala en cada patología
| Patología | Estudios que avalan su uso |
| Dermatomiositis | Estudios retrospectivos |
| Morfea | Estudios retrospectivos |
| Granuloma anular | Estudios retrospectivos |
| Necrobiosis lipoidica | Serie de casos |
| Sarcoidosis cutánea | Ensayo clínico abierto |
| Urticaria crónica espontánea | Ensayo clínico aleatorizado |
| Vasculitis urticarial | Estudios retrospectivos |
| Liquen plano | Estudios retrospectivos, ensayo clínico abierto |
| Alopecia areata | Estudio retrospectivo |
| Porfiria cutánea tarda | Ensayos clínicos aleatorizados |
| Erupción polimorfa lumínica | Ensayos clínicos aleatorizados |
| Rosácea | Ensayo clínico aleatorizado |
| Liquen escleroso | Pequeña serie de casos o casos aislados |
| Lipodermatoesclerosis | Pequeña serie de casos o casos aislados |
| Dermatitis actínica crónica | Pequeña serie de casos o casos aislados |
| Prurigo actínico | Pequeña serie de casos o casos aislados |
| Urticaria solar | Pequeña serie de casos o casos aislados |
| Síndrome de Schnitzler | Pequeña serie de casos o casos aislados |
| Escleromixedema | Pequeña serie de casos o casos aislados |
| Eritema anular eosinofílico | Pequeña serie de casos o casos aislados |
| Síndrome antifosfolípido | Estudios retrospectivos |
| Enfermedad de Kikuchi-Fujimoto | Pequeña serie de casos o casos aislados |
| Pseudolinfoma | Pequeña serie de casos o casos aislados |
| Eritema nudoso crónico | Pequeña serie de casos o casos aislados |
Como hemos visto, la hidroxicloroquina es un fármaco polivalente. Puede indicarse en múltiples dermatosis con buenas respuestas clínicas. Su acción inmunomoduladora, y no inmunosupresora, junto a su buen perfil de seguridad posibilita indicarla incluso en niños, en embarazadas y durante la lactancia1. Generalmente se requieren varios meses antes de alcanzar una respuesta clínica satisfactoria, lo que debe advertirse al paciente para evitar la suspensión del fármaco.
Hidroxicloroquina y COVID-19La hidroxicloroquina presenta una potente actividad antimicrobiana (antifúngica, antibacteriana y antiviral). Se ha descrito un efecto antiviral contra los virus influenzaA yB, hepatitisB yC, herpes simple, Chikungunya, Dengue, Zika y Ebola, entre otros.
La hidroxicloroquina fue considerada uno de los fármacos más prometedores para el tratamiento de la COVID-19. Su rol antivírico se basa en su potencial capacidad para inhibir la fusión del virus con la célula huésped, bloquear el transporte viral desde los endosomas a endolisosomas y reducir la tormenta inflamatoria en los pacientes graves3. Los antimaláricos interfieren con la glucosilación del receptor de la enzima convertidora de angiotensina, receptor utilizado por el SARS-CoV-2 para entrar en las células, disminuyendo la penetración viral. Así también, alcalinizan los endosomas y las vesículas endocíticas, alterando la endocitosis del virus. Además, reducen la liberación de citoquinas proinflamatorias al disminuir la presentación antigénica (especialmente la de autoantígenos) y la activación de los linfocitosT CD4+, y reducir la señalización intracelular de los receptores Toll-like47,48.
Pese a que no había evidencia consistente de que la hidroxicloroquina fuera efectiva en el tratamiento o la prevención de la COVID-19 y que la Sociedad Americana de Enfermedades Infecciosas solo la recomendara dentro de ECA, el antimalárico fue utilizado en diversos protocolos hospitalarios de tratamiento e incluso recomendada a la población general4. La FDA advirtió sobre los potenciales efectos cardiovasculares del medicamento, luego autorizó su uso en pacientes hospitalizados por COVID-19 (28 de marzo de 2020) y posteriormente retiró esta autorización (15 de junio de 2020)49. La alta demanda por el fármaco (se multiplicó por 80 solo en Estados Unidos) provocó dificultades para su administración y desabastecimiento4,5. Además, India, uno de los mayores productores de hidroxicloroquina genérica, prohibió temporalmente la exportación de este fármaco, lo que afectó a la cadena global de suministro4. En una encuesta internacional a miembros del Systemic Lupus International Collaborating Clinics (29% europeos), el 55% describió un desabastecimiento de hidroxicloroquina durante la pandemia entre pacientes con LES50. Otros autores comunicaron la existencia de ansiedad e incertidumbre entre los individuos con LES al no poder acceder al medicamento8,51. Además, se ha observado un impacto importante en los programas de control de la malaria5,52. No hemos encontrado artículos originales sobre el impacto del desabastecimiento en pacientes con patologías dermatológicas, aunque estimamos que habría sido importante de haberse mantenido en el tiempo.
En cuanto a la efectividad de la hidroxicloroquina en la COVID-19, un reciente metaanálisis que incluyó 14 estudios (n=12.455) no encontró diferencias significativas en la supervivencia, en la disminución de síntomas al décimo día, ni en la tasa de seroconversión, y describió una mayor tasa de efectos adversos cardiovasculares y gastrointestinales que en los grupos control49. Una revisión reciente de la base de datos Cochrane no encontró diferencias significativas en el riesgo de muerte por COVID-19 (o en la necesidad de ventilación mecánica) al utilizar hidroxicloroquina, y los autores recomiendan no realizar más ECA con este fármaco en esta patología53. Un ECA (n=2.314) recientemente publicado tampoco encontró un efecto positivo de la hidroxicloroquina como profilaxis de la COVID-1954.
La hidroxicloroquina es un fármaco esencial para el control de la malaria y para el tratamiento de pacientes con determinadas patologías reumatológicas y/o dermatológicas, y nos parece importante ser cautos en la recomendación de este fármaco fuera de indicación para otras patologías (incluida la COVID-19), con el fin de asegurar su suministro a pacientes que lo requieren.
ConclusionesLa hidroxicloroquina es indispensable en el arsenal terapéutico dermatológico. Está indicada en primera o segunda línea en múltiples dermatosis inflamatorias, granulomatosas, fotoinducidas o fotoagravadas. El tratamiento y la prevención de la COVID-19 con hidroxicloroquina ha dado resultados insatisfactorios y produjo dificultades en el abastecimiento del fármaco. Se requiere una mayor cautela al recomendar su uso a gran escala en patologías fuera de indicación, y así garantizar el acceso al fármaco para los pacientes que lo requieren.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.