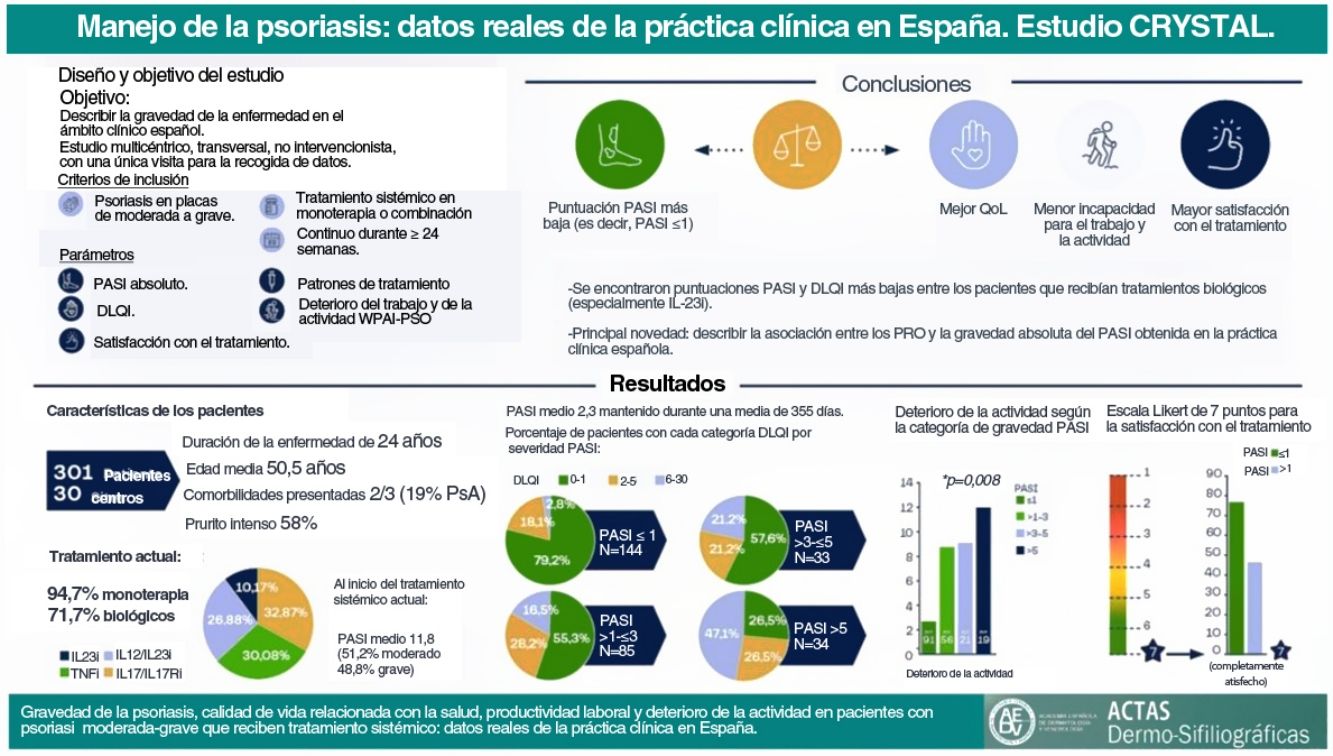
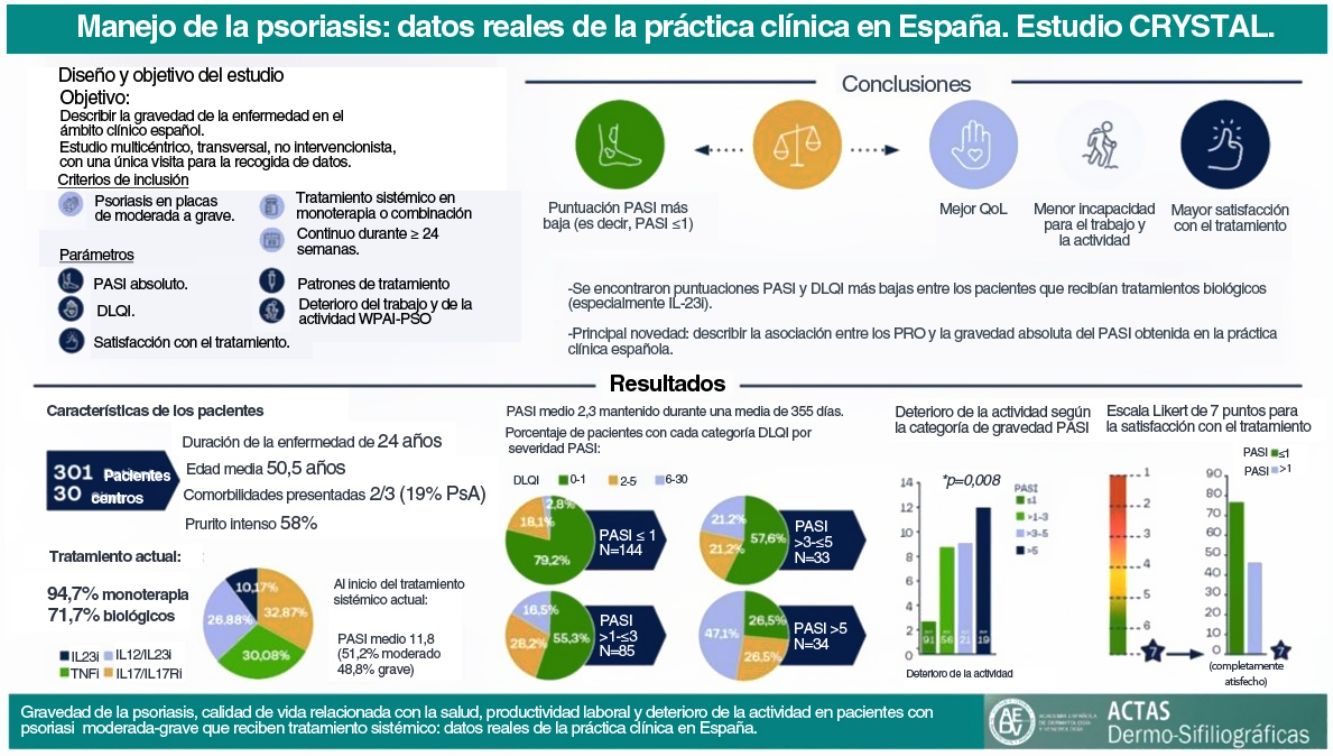
El tratamiento de la psoriasis debe centrarse más allá de las afectaciones cutáneas, y valorar la calidad de vida relacionada con la salud (CVRS), abordando así el concepto de discapacidad acumulada en el transcurso vital y tratando al paciente desde una perspectiva holística. El estudio CRYSTAL tuvo como objetivo caracterizar la psoriasis con datos de la práctica clínica española en pacientes con enfermedad moderada a grave que recibieron tratamiento sistémico continuado durante al menos 24 semanas mediante la puntuación absoluta del Índice de la Severidad del área de Psoriasis (PASI) (medida del estado de la enfermedad en un momento dado y no por comparación con una puntuación basal) y su correlación con la CVRS.
Material y métodosSe trata de un estudio no intervencionista, transversal, realizado en 30 centros de España, con 301 pacientes de edades comprendidas entre los 18 y los 75 años. Se recogieron datos relativos al tratamiento actual y al PASI absoluto y su relación con la CVRS mediante el Índice de Calidad de Vida en Dermatología (DLQI), con el deterioro de la actividad mediante el Cuestionario para el Deterioro de la Actividad y la Productividad Laboral (WPAI) y con la satisfacción con el tratamiento.
ResultadosLa edad media (DE) fue de 50,5 (12,5) años, con una duración de la enfermedad de 14 (14,1) años. La media (DE) del PASI absoluto notificado fue de 2,3 (3,5), con 28,7% de pacientes que presentaban un PASI de > 1 a ≤ 3 y 22,6% con un PASI > 3. Las puntuaciones más altas del PASI se asociaron a puntuaciones más altas del DLQI (p < 0,001) y del WPAI y a niveles más bajos de satisfacción con el tratamiento (p < 0,001).
ConclusionesEstos datos indican que alcanzar valores absolutos más bajos de PASI puede correlacionarse no solo con una mejor CVRS, sino también con una mejor productividad laboral y satisfacción con el tratamiento.
The treatment of psoriasis should not only focus on skin affectations but also weigh the parameters for health-related quality of life (HRQoL), thereby tackling the concept of cumulative life course impairment (CLCI) and treating the patient from a holistic perspective. The CRYSTAL study aimed to characterize psoriasis with real-word data from Spanish clinical practice in patients with moderate to severe disease who received continuous systemic treatment for at least 24 weeks by using the absolute Psoriasis Area and Severity Index (PASI) score and its correlation to HRQoL.
Material and methodsThis was a non-interventional, cross-sectional study conducted in 30 centers in Spain, with 301 patients between the ages of 18 and 75 years. The study collected data regarding current treatment and absolute PASI and their relationship to HRQoL using the Dermatology Life Quality Index (DLQI), to activity impairment using the Work Productivity and Activity Impairment (WPAI) questionnaire, and to treatment satisfaction.
ResultsThe mean (SD) age was 50.5 (12.5) years, with a duration of disease of 14 (14.1) years. The mean (SD) absolute PASI reported was 2.3 (3.5), with 28.7% of patients presenting with PASI from >1 to ≤3 and 22.6% with PASI>3. Higher PASI scores were associated with higher DLQI (p<0.001) and WPAI scores and lower levels of treatment satisfaction (p<0.001).
ConclusionsThese data indicate that achieving lower absolute PASI values may correlate not only with better HRQoL but also with better work productivity and treatment satisfaction.
La psoriasis es una enfermedad inflamatoria crónica cutánea con una prevalencia en España de aproximadamente el 2,69%.1 Tanto la enfermedad como las comorbilidades asociadas afectan a la calidad de vida relacionada con la salud (CVRS) de los pacientes y a sus actividades tanto laborales como no laborales.2 Los perjuicios de la CVRS en estos pacientes son comparables a los de otras enfermedades crónicas importantes,3 y la naturaleza crónica de la psoriasis tiene un efecto progresivo que conduce a un deterioro acumulativo del curso de la vida (conocido como CLCI), donde la carga del estigma, la comorbilidades físicas y psicológicas, las estrategias de adaptación y los factores externos interactúan e impiden que los pacientes alcancen su máximo potencial vital.4,5
La psoriasis moderada a grave se trata con tratamientos sistémicos, que incluyen terapias convencionales (metotrexato, ciclosporina, acitretino y ácido fumárico), fototerapia, agentes biológicos (inhibidores del factor de necrosis tumoral [TNFi], inhibidores de la interleucina (IL)-12/23 [IL-12/23i], inhibidores de los receptores de IL-17/IL-17 [IL-17i/IL-17Ri] e inhibidores de la IL-23 [IL-23i]) y una pequeña molécula oral que inhibe la fosfodiesterasa-4 (apremilast). El logro de dianas terapéuticas óptimas se ha incrementado con la aprobación de nuevas opciones de tratamiento.6
El Índice de Área y Gravedad de la Psoriasis (PASI) y el Índice de Calidad de Vida en Dermatología (DLQI) se utilizan para evaluar la eficacia y los cambios en la calidad de vida, respectivamente, de la terapia sistémica.7 El PASI puede medirse como una puntuación relativa o absoluta, y la puntuación absoluta se utiliza en ensayos clínicos de productos biológicos más nuevos8,9 y cada vez más en la práctica clínica. Según el consenso del Grupo Español de Psoriasis, un PASI≤3 absoluto se define como un objetivo terapéutico adecuado, y un PASI absoluto igual a cero como un objetivo terapéutico óptimo.8 La puntuación de PASI absoluto también se incluye en el algoritmo de decisión para el tratamiento de la psoriasis en las guías francesa e italiana.10,11
Existen correlaciones entre el PASI y el DLQI12 que dependen del tipo de tratamiento, la localización de las lesiones13 y el uso del PASI relativo frente al absoluto.8 La evaluación de la CVRS y la productividad laboral en función de la gravedad de la enfermedad y la amplia gama de tratamientos sistémicos sigue siendo una necesidad insatisfecha. Un registro nacional de pacientes con psoriasis en España (Biobadaderm14,15) recogió datos de seguridad y eficacia, pero no los datos sobre la CVRS, la productividad laboral o la satisfacción de los pacientes. El objetivo principal del presente estudio fue describir la gravedad de la psoriasis en pacientes con psoriasis moderada a grave que reciben tratamiento sistémico en el ámbito clínico español mediante puntuaciones PASI absolutas. Además, nos propusimos describir los patrones de tratamiento, la CVRS, el deterioro del trabajo y la actividad, y la satisfacción con el tratamiento en estos pacientes.
Materiales y métodosEl estudio CRYSTAL es un estudio multicéntrico, transversal y no intervencionista realizado entre mayo y diciembre del 2020 en 30 centros médicos de España. En una sola visita se recogieron el consentimiento informado y los datos de los pacientes, así como todos los tratamientos administrados de acuerdo con la práctica clínica habitual. El estudio fue aprobado por el CEIm del Hospital Universitario La Princesa y realizado de acuerdo con la Declaración de Helsinki, las directrices para las Buenas Prácticas de Farmacoepidemiología de la Sociedad Internacional de Farmacoepidemiología, y las directrices STROBE (Strengthening the Reporting of Observational Studies in Epidemiology).
Este estudio incluyó pacientes que dieron su consentimiento para participar, elegibles con edad entre 18 y 75 años; con diagnóstico confirmado de psoriasis crónica en placas de moderada a grave; que habían recibido algún tratamiento sistémico aprobado para la psoriasis, ya sea como monoterapia o terapia combinada, de forma continua durante al menos 24 semanas. Se les evaluó el PASI absoluto al inicio del tratamiento sistémico actual (incluida una ventana de 30 días antes hasta 7 días después); y se realizó una evaluación PASI absoluta en la visita del estudio. Los pacientes que estaban o habían recibido cualquier tratamiento mediante alguna intervención en investigación dentro de 1 mes o 5 vidas medias del agente no eran elegibles.
En la visita de estudio se recogieron las características sociodemográficas y antropométricas actuales; además del hábito tabáquico, la severidad de la enfermedad por PASI absoluto, las características clínicas, las comorbilidades, el tratamiento pautado para la psoriasis y los resultados informados por los pacientes (PRO) en términos de la CVRS (DLQI), el deterioro de la actividad (cuestionario de productividad laboral y deterioro de la actividad [WPAI]) y la satisfacción del paciente con el tratamiento. En la recogida retrospectiva de los datos se incluyeron las características de la enfermedad en el momento del diagnóstico de la psoriasis, la historia clínica clínicamente relevante, los tratamientos anteriores para la psoriasis y la información acerca del tratamiento actual, desde su inicio hasta la inclusión (es decir, fecha de inicio, dosis inicial e intensificaciones de la dosis). Se utilizaron, las versiones validadas de los cuestionarios DLQI16 y WPAI para la psoriasis (WPAI:PSO)17 en España. La satisfacción con el tratamiento se midió mediante una escala Likert de 7 puntos de un solo ítem, que osciló entre 1 (completamente insatisfecho) y 7 (completamente satisfecho).
Para el análisis estadístico, se determinó un tamaño muestral de 300 pacientes para proporcionar precisiones de estimación (definidas como el ancho del intervalo de confianza [IC] del 95% de la media) de ±0,11 para las puntuaciones PASI absolutas, basadas en estudios clínicos previos. Se detallaron los valores de las frecuencias y porcentajes para todas las variables categóricas. Se informaron medias y desviaciones estándar (DE) para todas las variables continuas. Las pruebas de Mann-Whitney, Kruskal-Wallis, Chi-cuadrado y la prueba exacta de Fisher fueron utilizadas para determinar las diferencias entre las variables del estudio, en función de su distribución. La prueba de Spearman se usó para analizar las correlaciones entre las variables. Un análisis de regresión lineal evaluó las asociaciones entre el PASI absoluto en la visita de estudio y las siguientes características: sexo; tratamientos previos para la psoriasis, número de ciclos de tratamiento previos, antecedentes familiares de psoriasis, tratamiento sistémico actual, edad, índice de masa corporal (IMC), historia clínica, PASI absoluto, duración de la psoriasis, antecedentes de artritis psoriásica, espondilitis, entesitis, dactilitis y prurito y áreas difíciles de tratar al inicio del tratamiento sistémico actual. Se construyó un modelo de regresión lineal múltiple utilizando características con p<0,20 en análisis bivariados. Los datos faltantes no se consideraron en los análisis. Los análisis estadísticos se realizaron con IBM SPSS Statistics, versión 22.0 (IBM Corp., Armonk, USA), con significancia establecida en el nivel p<0.05.
ResultadosTras una evaluación inicial de un total de 309 pacientes de manera consecutiva, 301 fueron incluidos en este estudio. Los ocho pacientes excluidos no eran elegibles porque no cumplían con todos los criterios de selección.
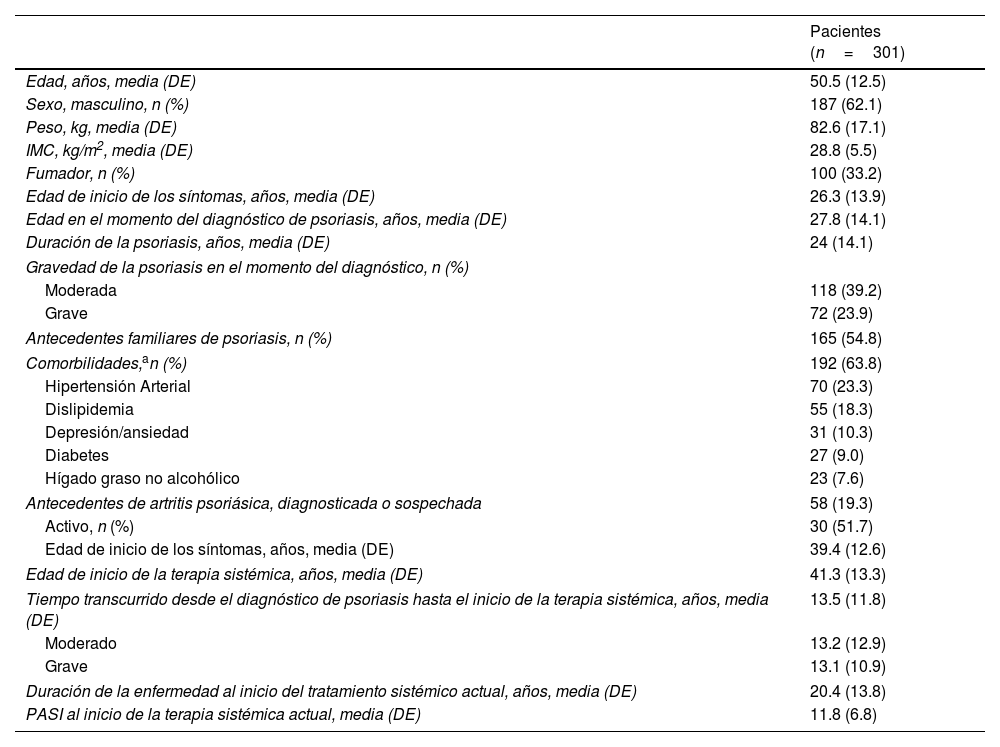
Las características demográficas y clínicas basales de los pacientes se presentan en la tabla 1. La edad media (DE) fue de 50,5 ± 12,5 años, y la mayoría de los pacientes fueron hombres (62,1%). Casi dos tercios de los pacientes (63,8%) tenían al menos una comorbilidad, y 58 (19,3%) pacientes tenían artritis psoriásica, que estaba activa en 30 de ellos. Los pacientes tuvieron una duración media (DE) de la enfermedad de 24 ± 14,1 años; tras 13,5 (11,8) años de recibir una terapia sistémica al inicio del tratamiento sistémico actual, los pacientes tenían un PASI absoluto medio de 11,8 (6,8), donde el 51,2% tenía psoriasis moderada y el 48,8% grave. El prurito severo fue reportado por el 57,8% de los pacientes al inicio del tratamiento y por el 27,9% al final del estudio (Apéndice B Tabla complementaria 1).
Datos demográficos basales y características clínicas
| Pacientes (n=301) | |
|---|---|
| Edad, años, media (DE) | 50.5 (12.5) |
| Sexo, masculino, n (%) | 187 (62.1) |
| Peso, kg, media (DE) | 82.6 (17.1) |
| IMC, kg/m2, media (DE) | 28.8 (5.5) |
| Fumador, n (%) | 100 (33.2) |
| Edad de inicio de los síntomas, años, media (DE) | 26.3 (13.9) |
| Edad en el momento del diagnóstico de psoriasis, años, media (DE) | 27.8 (14.1) |
| Duración de la psoriasis, años, media (DE) | 24 (14.1) |
| Gravedad de la psoriasis en el momento del diagnóstico, n (%) | |
| Moderada | 118 (39.2) |
| Grave | 72 (23.9) |
| Antecedentes familiares de psoriasis, n (%) | 165 (54.8) |
| Comorbilidades,an (%) | 192 (63.8) |
| Hipertensión Arterial | 70 (23.3) |
| Dislipidemia | 55 (18.3) |
| Depresión/ansiedad | 31 (10.3) |
| Diabetes | 27 (9.0) |
| Hígado graso no alcohólico | 23 (7.6) |
| Antecedentes de artritis psoriásica, diagnosticada o sospechada | 58 (19.3) |
| Activo, n (%) | 30 (51.7) |
| Edad de inicio de los síntomas, años, media (DE) | 39.4 (12.6) |
| Edad de inicio de la terapia sistémica, años, media (DE) | 41.3 (13.3) |
| Tiempo transcurrido desde el diagnóstico de psoriasis hasta el inicio de la terapia sistémica, años, media (DE) | 13.5 (11.8) |
| Moderado | 13.2 (12.9) |
| Grave | 13.1 (10.9) |
| Duración de la enfermedad al inicio del tratamiento sistémico actual, años, media (DE) | 20.4 (13.8) |
| PASI al inicio de la terapia sistémica actual, media (DE) | 11.8 (6.8) |
Se muestran las comorbilidades que afectan al ≥5% de los pacientes.
Abreviaturas: IMC, índice de masa corporal; PASI: Área de Psoriasis e Índice de Gravedad; DE: desviación estándar.
Al inicio del tratamiento sistémico actual, el 95,3% de los pacientes (n=287) habían recibido un tratamiento previo (65,4% tópico y 85,7% sistémico). La pauta fue en monoterapia en la mayoría de los casos (88,8%), y los tipos de tratamiento recibidos fueron convencionales (87,2%; de los cuales el 75,6% fue metotrexato), fototerapia (41,1%), biológicos (40,7%; de los cuales 73,3% fue TNFi), apremilast (2,3%) y ácido fumárico (2,3%).
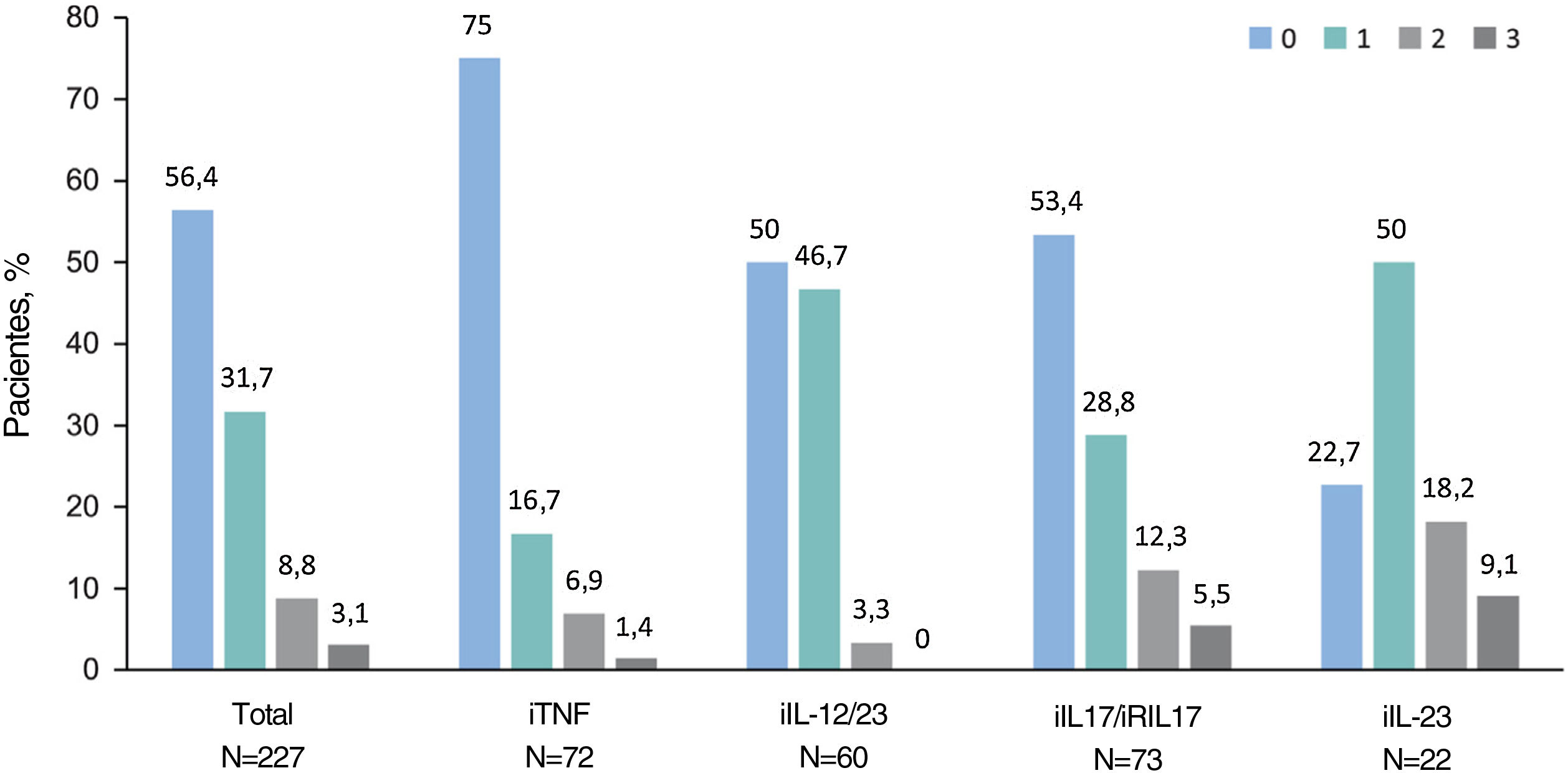
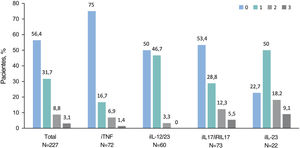
En la visita de estudio, el 94,7% (n=285) de los pacientes fueron tratados con monoterapia: el 71,7% (n=213) con un agente biológico (23,6% [n=71] con IL-17i/IL-17Ri, el 21,6% [n=65] con TNFi, el 19,3% [n=58] con IL-12/23i y el 7,3% [n=227,3%] con IL-23i), el 12,6% (n=38) con metotrexato, el 7,0% (n=21) con apremilast y el 3,3% (n=8) con otro agente. Otros pacientes (5,3% [n=16]) recibieron una combinación de tratamientos sistémicos. Entre los pacientes con tratamientos biológicos, el 56,4% (n=128) no había recibido un tratamiento biológico previo antes de su tratamiento actual, el 31,7% había recibido uno, el 8,8% había recibido dos y el 3,1% había recibido tres (fig. 1). El tratamiento biológico se intensificó (es decir, aumentó la dosis o disminuyó el tiempo entre dosis) en el 17,2% (n=39). Cuando se consideró cada tratamiento biológico, se observaron intensificaciones en los pacientes que recibieron IL-12/23i (31,7%), seguidos de TNFi (13,9%), IL-17i/IL-17Ri (13,7%) e IL-23i (4,5%).
Número de productos biológicos recibidos previamente de acuerdo al tratamiento biológico actual. Los pacientes se agrupan según el tratamiento biológico recibido en la visita del estudio. Las barras indican el porcentaje de pacientes tratados con agentes biológicos en la visita del estudio que previamente recibieron hasta 3 agentes biológicos (n=227). Abreviaturas: IL, interleuquina; IL-12/23i, inhibidores de IL-12/23; IL-17i, inhibidores de IL-17; IL-23i, inhibidores de IL-23; TNFi, inhibidores del factor de necrosis tumoral-α.
En la visita de estudio, el 50,8% (n=151) de los pacientes fueron tratados con terapia tópica concomitante, principalmente un corticoide (64,2%). Entre los pacientes tratados con productos biológicos, 62 (20,9%) recibieron tratamiento tópico concomitante y 151 (50,8%) no lo recibieron.
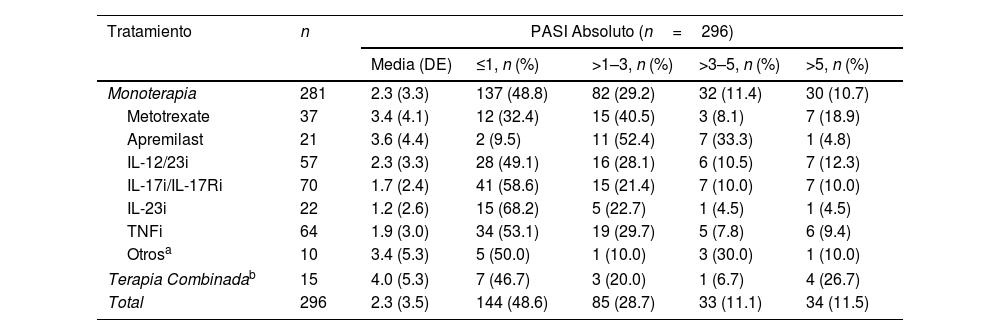
En la visita de estudio, la media (DE) del PASI absoluto fue de 2,3 (3,5) (n=296), mantenida durante un tiempo medio (DE) de 355 (648 días) (n=191). El 48,6% tenía PASI≤1, el 28,7% tenía PASI>1–3 y el 22,6% tenía PASI>3). Más de un tercio de los pacientes tenían un PASI>2 (35,1%). Los pacientes tratados con productos biológicos tuvieron la puntuación PASI más baja. El PASI≤1 fue alcanzado por el 68,2% de los pacientes con IL-23i, el 58,6% con IL-17i/IL-17Ri y el 53,1% con TNFi (tabla 2).
Gravedad del PASI por tratamiento sistémico
| Tratamiento | n | PASI Absoluto (n=296) | ||||
|---|---|---|---|---|---|---|
| Media (DE) | ≤1, n (%) | >1–3, n (%) | >3–5, n (%) | >5, n (%) | ||
| Monoterapia | 281 | 2.3 (3.3) | 137 (48.8) | 82 (29.2) | 32 (11.4) | 30 (10.7) |
| Metotrexate | 37 | 3.4 (4.1) | 12 (32.4) | 15 (40.5) | 3 (8.1) | 7 (18.9) |
| Apremilast | 21 | 3.6 (4.4) | 2 (9.5) | 11 (52.4) | 7 (33.3) | 1 (4.8) |
| IL-12/23i | 57 | 2.3 (3.3) | 28 (49.1) | 16 (28.1) | 6 (10.5) | 7 (12.3) |
| IL-17i/IL-17Ri | 70 | 1.7 (2.4) | 41 (58.6) | 15 (21.4) | 7 (10.0) | 7 (10.0) |
| IL-23i | 22 | 1.2 (2.6) | 15 (68.2) | 5 (22.7) | 1 (4.5) | 1 (4.5) |
| TNFi | 64 | 1.9 (3.0) | 34 (53.1) | 19 (29.7) | 5 (7.8) | 6 (9.4) |
| Otrosa | 10 | 3.4 (5.3) | 5 (50.0) | 1 (10.0) | 3 (30.0) | 1 (10.0) |
| Terapia Combinadab | 15 | 4.0 (5.3) | 7 (46.7) | 3 (20.0) | 1 (6.7) | 4 (26.7) |
| Total | 296 | 2.3 (3.5) | 144 (48.6) | 85 (28.7) | 33 (11.1) | 34 (11.5) |
Terapia combinada incluye acitretino+fototerapia; metotrexate+apremilast; metotrexate+IL-12/23i; metotrexate+IL-17i/IL-17Ri; metotrexate+TNFi; metotrexate+acitretino+apremilast; salazopirina+TNFi.
Abreviaturas: IL, interleuquina; inhibidores de IL-12/23i, IL-12/23; inhibidores del receptor IL-17i/IL-17Ri, IL-17/IL-17; inhibidores de IL-23i, IL-23; PASI, Área de Psoriasis e Índice de Gravedad; DE, desviación estándar; TNFi, inhibidores del factor de necrosis tumoral -α.
El modelo de regresión lineal múltiple reveló que el tratamiento sistémico convencional (estimación, 1,221 [IC 95%, 0,33–2,11; p=0,007]) y el apremilast (estimación, 1,883 [IC 95%, 0,46–3,31; p=0,010) se relacionaron con puntuaciones PASI más altas en la visita de estudio (Apéndice B Tabla complementaria 2).
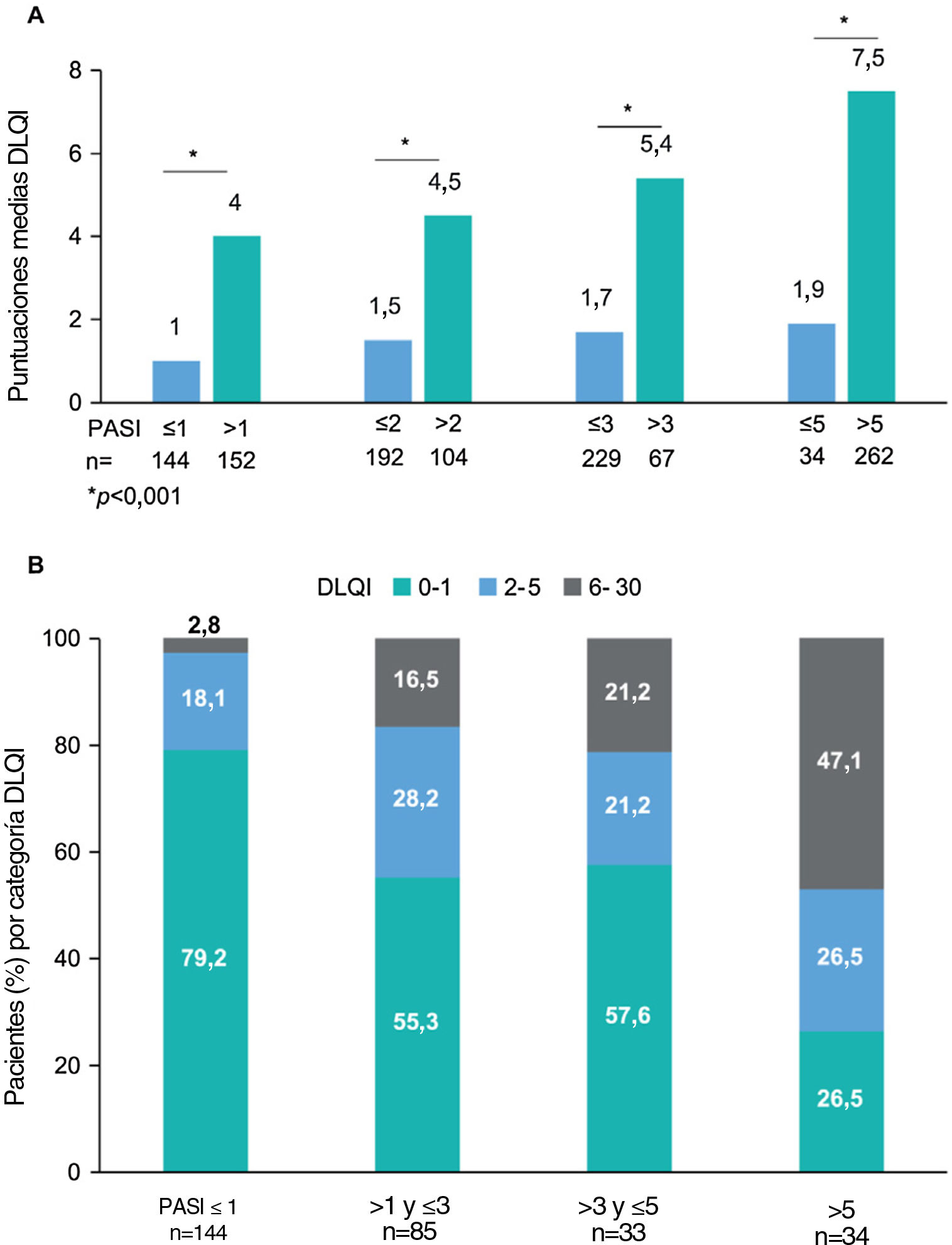
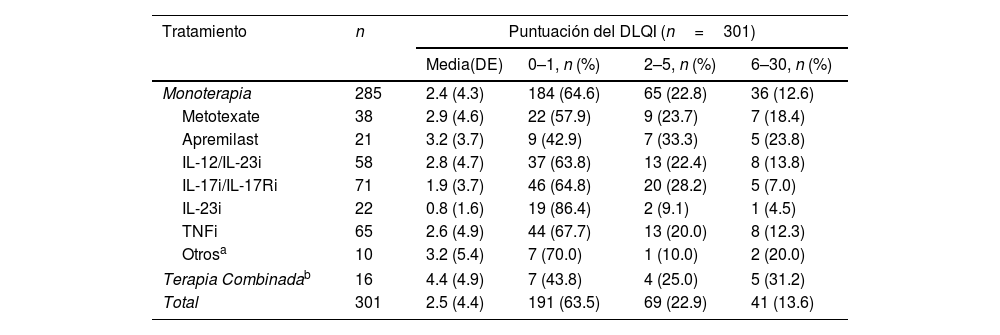
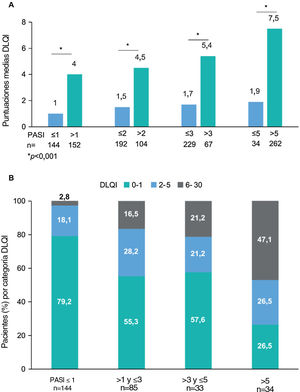
Se observaron alteraciones en la CVRS (puntuaciones DLQI≥2) en el 36,5% (n=110) de los pacientes. La puntuación media (DE) del DLQI en la visita de estudio fue de 2,5 (4,4). Las puntuaciones del DLQI aumentaron con puntuaciones PASI más altas (p<0,001) (fig. 2). Las puntuaciones del DLQI oscilaron entre 1,0 en pacientes con PASI≤1–7,5 en pacientes con PASI>5. Se observaron puntuaciones de DLQI entre 0 y 1 (sin efecto) en la mayoría de los pacientes con PASI≤1 (79,2%) y en solo el 26,5% de los pacientes con PASI>5. Entre los que recibieron productos biológicos, solo los pacientes que recibieron IL-23i tuvieron una puntuación media inferior a 1 (0,8) (tabla 3).
Puntuación del DLQI por gravedad del PASI. (A) Puntuaciones medias del DLQI por categoría de gravedad del PASI, *valor de p < 0,001 (prueba de Mann-Whitney) y (B) Porcentaje de pacientes con cada categoría de DLQI (0-1: sin efecto; 2-5: efecto pequeño; 6-30: efecto moderado/muy grande/extremadamente grande) por categoría de gravedad del PASI, con las variables comparadas mediante la prueba de hipótesis χ2 (Chi-cuadrado), con valor de p < 0,001 (N = 301).
Puntuación de DLQI según el tratamiento sistémico
| Tratamiento | n | Puntuación del DLQI (n=301) | |||
|---|---|---|---|---|---|
| Media(DE) | 0–1, n (%) | 2–5, n (%) | 6–30, n (%) | ||
| Monoterapia | 285 | 2.4 (4.3) | 184 (64.6) | 65 (22.8) | 36 (12.6) |
| Metotexate | 38 | 2.9 (4.6) | 22 (57.9) | 9 (23.7) | 7 (18.4) |
| Apremilast | 21 | 3.2 (3.7) | 9 (42.9) | 7 (33.3) | 5 (23.8) |
| IL-12/IL-23i | 58 | 2.8 (4.7) | 37 (63.8) | 13 (22.4) | 8 (13.8) |
| IL-17i/IL-17Ri | 71 | 1.9 (3.7) | 46 (64.8) | 20 (28.2) | 5 (7.0) |
| IL-23i | 22 | 0.8 (1.6) | 19 (86.4) | 2 (9.1) | 1 (4.5) |
| TNFi | 65 | 2.6 (4.9) | 44 (67.7) | 13 (20.0) | 8 (12.3) |
| Otrosa | 10 | 3.2 (5.4) | 7 (70.0) | 1 (10.0) | 2 (20.0) |
| Terapia Combinadab | 16 | 4.4 (4.9) | 7 (43.8) | 4 (25.0) | 5 (31.2) |
| Total | 301 | 2.5 (4.4) | 191 (63.5) | 69 (22.9) | 41 (13.6) |
La terapia combinada incluye el acitretino+fototerapia; metotrexate+apremilast; metotrexate+IL-12/23i; metotrexate+IL-17i/IL-17Ri; metotrexate+TNFi; metotrexate+acitretino+apremilast; salazopirina+TNFi.
Abreviaturas: DLQI, “Dermatology Life Quality Index”; IL, interleuquina; inhibidores de la IL-12/23i, IL-12/23; inhibidores de los receptores de la IL-17i/IL-17Ri, IL-17/IL-17; inhibidores de IL-23i, IL-23; DE, desviación estándar; TNFi, inhibidores del factor de necrosis tumoral -α.
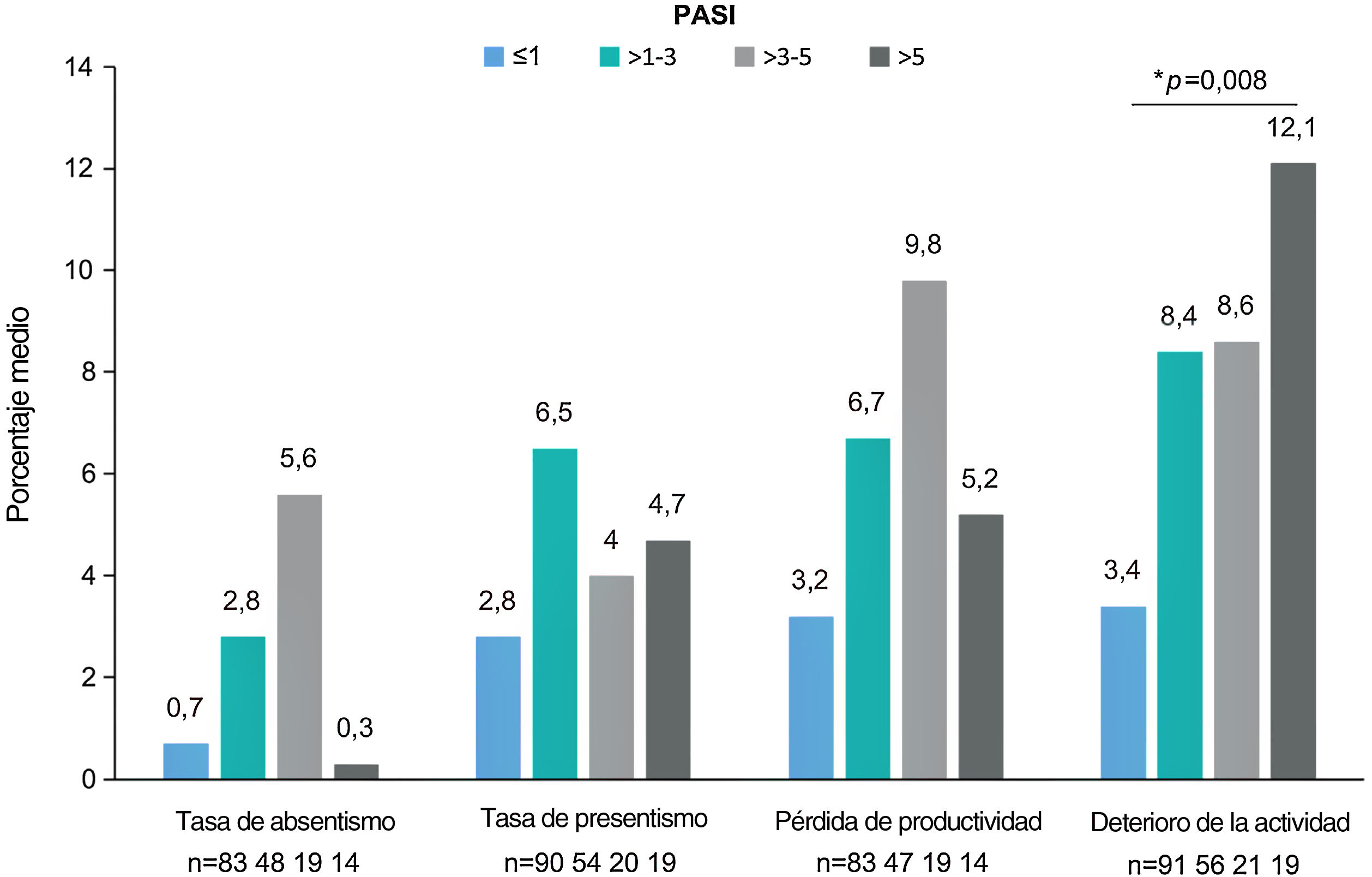
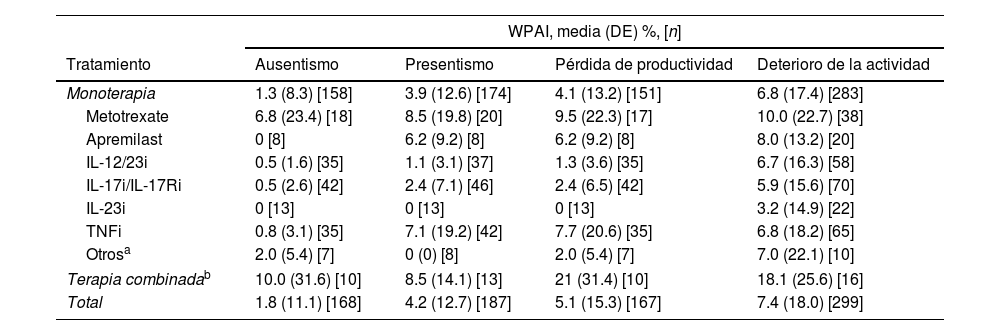
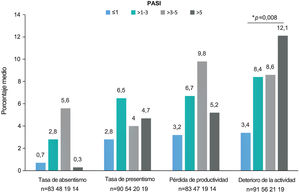
El cuestionario WPAI fue completado por 299 pacientes. Los pacientes con empleo (n=191, 63,9%) trabajaron una media (DE) de 34,8 ± 17h semanales y refirieron una tasa de absentismo del 1,8% (tiempo de trabajo perdido), una tasa de presentismo del 4,2% (reducción de la eficacia durante el trabajo), una pérdida de productividad del 5,1% (deterioro general del trabajo) y un deterioro del 7,4% en actividades no relacionadas con el trabajo (tabla 4). Se observaron diferencias estadísticamente significativas para el deterioro de la actividad (p=0,008), siendo los pacientes con PASI≤1 los que mostraron la menor tasa de deterioro de la actividad (fig. 3). Para el presentismo, los pacientes con PASI≤2 tuvieron tasas más bajas (2,9%) que los pacientes con PASI>2 (6,9%; p=0,034).
WPAI por tratamiento sistémico
| WPAI, media (DE) %, [n] | ||||
|---|---|---|---|---|
| Tratamiento | Ausentismo | Presentismo | Pérdida de productividad | Deterioro de la actividad |
| Monoterapia | 1.3 (8.3) [158] | 3.9 (12.6) [174] | 4.1 (13.2) [151] | 6.8 (17.4) [283] |
| Metotrexate | 6.8 (23.4) [18] | 8.5 (19.8) [20] | 9.5 (22.3) [17] | 10.0 (22.7) [38] |
| Apremilast | 0 [8] | 6.2 (9.2) [8] | 6.2 (9.2) [8] | 8.0 (13.2) [20] |
| IL-12/23i | 0.5 (1.6) [35] | 1.1 (3.1) [37] | 1.3 (3.6) [35] | 6.7 (16.3) [58] |
| IL-17i/IL-17Ri | 0.5 (2.6) [42] | 2.4 (7.1) [46] | 2.4 (6.5) [42] | 5.9 (15.6) [70] |
| IL-23i | 0 [13] | 0 [13] | 0 [13] | 3.2 (14.9) [22] |
| TNFi | 0.8 (3.1) [35] | 7.1 (19.2) [42] | 7.7 (20.6) [35] | 6.8 (18.2) [65] |
| Otrosa | 2.0 (5.4) [7] | 0 (0) [8] | 2.0 (5.4) [7] | 7.0 (22.1) [10] |
| Terapia combinadab | 10.0 (31.6) [10] | 8.5 (14.1) [13] | 21 (31.4) [10] | 18.1 (25.6) [16] |
| Total | 1.8 (11.1) [168] | 4.2 (12.7) [187] | 5.1 (15.3) [167] | 7.4 (18.0) [299] |
Terapia combinada incluye acitretino+fototerapia; metotrexate+apremilast; metotrexate+IL-12/23i; metotrexate+IL-17i/IL-17Ri; metotrexate+TNFi; metotrexate+acitretino+apremilast; salazopirina+TNFi.
Abreviaturas: IL, interleuquina; inhibidores de IL-12/23i, IL-12/23; IL-17i/IL-17Ri, inhibidores del receptor IL-17/IL-17; inhibidores de IL-23i, IL-23; DE, desviación estandar; TNFi, ihnibidores del factor de necrosis tumoral -α; WPAI, “Work Productivity and Activity Impairment”.
Dominios WPAI por gravedad del PASI. Porcentaje medio de absentismo (tiempo de trabajo perdido), presentismo (reducción de la eficacia en el trabajo durante el trabajo), pérdida de productividad (deterioro general del trabajo) y deterioro de la actividad diaria debido a la psoriasis (actividades no relacionadas con el trabajo) por categoría de gravedad PASI. *p=0,008 (prueba de Kruskal-Wallis). Abreviaturas: PASI, Área de Psoriasis e Índice de Severidad; TNFi: inhibidores del factor de necrosis tumoral-α; WPAI, Productividad del Trabajo y Deterioro de la Actividad (“Work Productivity and Activity Impairment”).
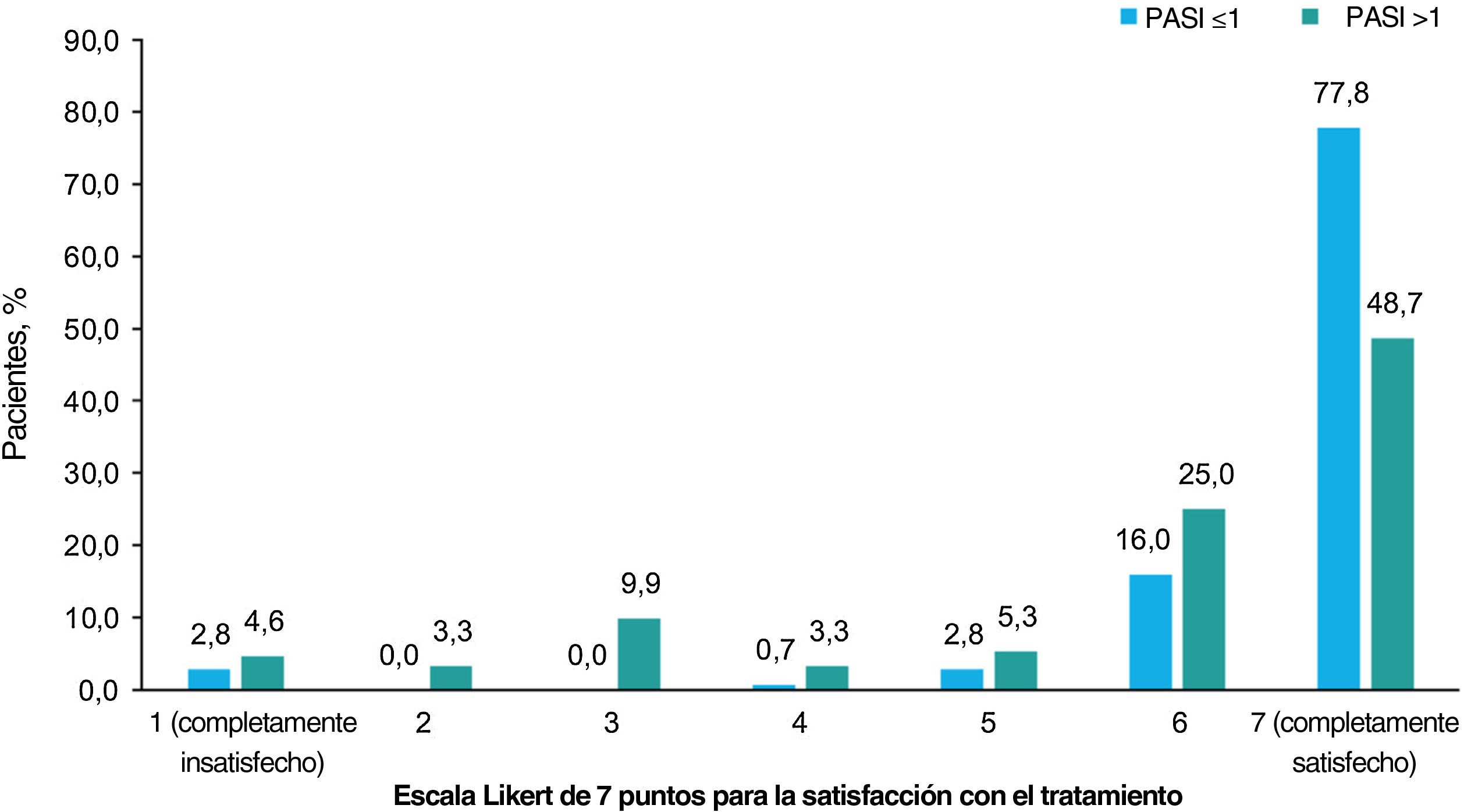
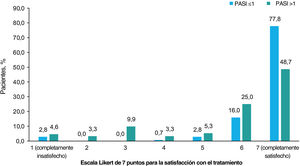
En general, la satisfacción con el tratamiento fue muy alta, con un 62,8% de los pacientes completamente satisfechos y un 20,6% casi siempre satisfechos. Según el tratamiento recibido, más de la mitad de los pacientes tratados con productos biológicos estaban completamente satisfechos (62,1% [n=36] tratados con IL-12/23i; 69,0% [n=49] con IL-17i/IL-17Ri; 75,4% [n=49] con TNFi; y 95,5% [n=21] con IL-23i), y menos de la mitad de los pacientes tratados con apremilast (33,3% [n=7]), metotrexato (44,7% [n=17]) y otros agentes (40% [n=4]) estaban completamente satisfechos. Se observó una mayor satisfacción con el tratamiento con un menor PASI (prueba de Chi-cuadrado, p<0,001; fig. 4).
Satisfacción con el tratamiento. Porcentaje de pacientes que dieron cada una de las 7 respuestas posibles a la pregunta “¿Cómo calificaría su nivel de satisfacción con el control general de su psoriasis con su tratamiento actual?” según la gravedad de PASI. Las opciones de la escala Likert fueron: 1 (completamente insatisfecho), 2 (casi siempre insatisfecho), 3 (algo insatisfecho), 4 (ni satisfecho ni insatisfecho), 5 (algo satisfecho), 6 (casi siempre satisfecho), 7 (completamente satisfecho). Los pacientes fueron divididos en 2 grupos por puntuación PASI (≤1 y >1). Las variables se compararon mediante la prueba de Chi-cuadrado de hipótesis, con p<0,001. Abreviatura: PASI, Área de Psoriasis e Índice de Severidad.
El estudio CRYSTAL, realizado en una cohorte de 301 pacientes españoles con psoriasis crónica en placas de moderada a grave que recibían un tratamiento sistémico continuo durante al menos 24 semanas, mostró una puntuación PASI absoluta media de 2,3 en el momento del estudio. El aumento de la gravedad de la enfermedad se asoció con un mayor efecto negativo sobre la CVRS y el deterioro de la actividad, medidos por DLQI y WPAI, respectivamente. La principal novedad del presente estudio fue describir la asociación entre las PRO y la severidad absoluta del PASI obtenida en la práctica clínica española.
Hace quince años en España, aproximadamente el 42% de los pacientes con psoriasis (de una muestra de 561) estaban siendo tratados con terapia sistémica (tradicional o biológica), y la puntuación media del PASI era de 9,6.18 La media del PASI en nuestro estudio es considerablemente inferior a la del estudio mencionado, a pesar de que todos los pacientes habían sido diagnosticados de psoriasis moderada a grave.
Esto puede sugerir que el manejo de la psoriasis en España ha mejorado, posiblemente debido a la mayor disponibilidad de productos biológicos, aunque, para el estudio anterior, no existía el requisito previo de recibir tratamiento sistémico durante al menos 24 semanas. En nuestro estudio, se encontraron puntuaciones PASI más bajas entre los pacientes que reciben biológicos que entre los que reciben tratamientos convencionales o apremilast. El PASI promedio más bajo se observó en los pacientes tratados con IL-23i, seguidos por los que recibieron IL-17i/IL-17Ri. Sin embargo, el 35% de los pacientes presentaban un PASI>2 absoluto. Estos datos indican que aún queda un largo camino por recorrer para alcanzar el objetivo terapéutico de PASI≤2 en todos los pacientes, tal y como se ha propuesto recientemente9.
Las comorbilidades más prevalentes (hipertensión arterial, dislipidemia, depresión/ansiedad y diabetes) se correspondían con las observadas previamente en España.19,20 Una comorbilidad prevalente fue la artritis psoriásica, diagnosticada o sospechada en casi el 20% de los pacientes aproximadamente 11 años tras el diagnóstico. Tanto la prevalencia como el tiempo transcurrido desde el diagnóstico de psoriasis hasta el inicio de los síntomas de la artritis psoriásica fueron consistentes con otros estudios.19–22 Los factores de riesgo cardiovascular y un IMC elevado se han asociado con alteraciones vasculares y mortalidad en pacientes con psoriasis.23 La presencia de estas comorbilidades y sus implicaciones para la salud general del paciente pone de manifiesto la importancia del cribado de factores de riesgo cardiovascular, artritis psoriásica y otras comorbilidades por parte de los dermatólogos y para el tratamiento del paciente en colaboración con otros especialistas.7,23
La mayoría de los pacientes fueron tratados con monoterapia, lo que coincide con el hecho de que en la psoriasis no existe una indicación aprobada para ninguna combinación de un medicamento biológico con una terapia sistémica convencional. Además, el 17,2% de los pacientes presentaron intensificaciones en su tratamiento biológico más allá del TNFi, lo que confirma que en la práctica clínica aún existen indicaciones de dosis fuera de ficha técnica de agentes biológicos24, y la mitad de los pacientes fueron tratados con terapia tópica concomitante. Teniendo en cuenta todas las terapias sistémicas, los pacientes tratados con IL-23i requirieron menos terapia tópica concomitante y menos intensificaciones del tratamiento, lo que podría traducirse en un ahorro de costes para el sistema sanitario, disminuyendo el elevado coste de tratar a los pacientes con enfermedad más grave mediante terapías biológicas25,26.
Se ha observado una correlación entre las puntuaciones del DLQI y el PASI, reflejando estudios previos27,28 e indicando que los valores PASI≥3 tienen un efecto negativo considerable en la calidad de vida del paciente, pero el PASI≤1 tiene aún un efecto positivo más pronunciado sobre la calidad de vida.
Un estudio en el año 2020 que evaluó la productividad laboral y las consecuencias económicas de la psoriasis en seis países29 demostró una pérdida anual de casi 4000 USD por paciente en España debido a los costes indirectos. Aunque nuestro estudio no evaluó la carga económica de la psoriasis, sí muestra que cuanto mayor es la puntuación PASI, mayor es el deterioro de la actividad y la consiguiente carga económica.
El nivel de satisfacción de los pacientes con psoriasis con el tratamiento recibido dicta su nivel de adherencia al mismo30 y ese nivel de satisfacción se correlaciona con las puntuaciones absolutas del PASI. Los pacientes con valores más altos de PASI están menos satisfechos con su tratamiento actual. Hasta donde sabemos, esta es la primera vez que se reporta este tipo de correlación en la psoriasis.
Estos resultados demuestran los beneficios de lograr objetivos terapéuticos más elevados para los pacientes en muchos aspectos de su vida diaria, como la calidad de vida percibida. El impacto de un control adecuado de la psoriasis en el concepto de deterioro acumulativo a lo largo de la vida amerita futuras investigaciones.
Este estudio tiene limitaciones. En primer lugar, incluye tanto grandes hospitales de referencia nacional como también aquellos regionales más pequeños, lo que implica un manejo heterogéneo de la enfermedad. Esto puede dificultar un muestreo más realista de los pacientes con psoriasis. En segundo lugar, aunque el tamaño de la muestra es adecuado, para algunos tipos de análisis existe una escasa representación, lo que puede impedir llegar a conclusiones sólidas. Por último, el estudio se llevó a cabo durante la pandemia de COVID-19 y, por lo tanto, el seguimiento de los pacientes se tuvo que hacer por vía telefónica.
ConclusionesEste estudio revela una mejora en el manejo de la psoriasis en el ámbito clínico español en los últimos años, con una puntuación media de PASI del 2,3. Los pacientes que recibieron productos biológicos tuvieron puntuaciones PASI y DLQI más bajas, especialmente los que recibieron IL-23i. Los pacientes con valores absolutos de PASI bajos versus altos presentan una mejor calidad de vida, mayor satisfacción con el tratamiento y menos deterioro de la actividad laboral. Por lo tanto, para el beneficio de los pacientes con psoriasis, el objetivo terapéutico debe ser alcanzar valores absolutos más bajos del PASI (incluido PASI≤1).
Conflicto de interesesEl apoyo financiero para el estudio fue proporcionado por AbbVie. AbbVie participó en el diseño y la realización del estudio, la interpretación de los datos, la revisión y la aprobación de la publicación. No se hicieron honorarios ni pagos por la autoría.
ED ha participado como miembro de la junta asesora y consultor; recibió becas, apoyo a la investigación y honorarios por dar conferencias; y/o participó en ensayos clínicos para AbbVie/Abbott, Almirall, Amgen, Celgene, Janssen-Cilag, Leo Pharma, Lilly, MSD/Schering-Plough, Novartis, Pfizer y UCB. DV ha participado en ensayos clínicos y/o ha recibido honorarios como consultor, investigador u orador para AbbVie, Janssen, Lilly, Novartis y UCB. AR ha participado en ensayos clínicos y/o ha recibido honorarios como consultor, investigador o ponente para AbbVie, Almirall, Amgen, Janssen, Leo Pharma, Lilly, Novartis y UCB. RR ha participado en consejos asesores, como ponente y/o en ensayos clínicos para AbbVie, Almirall, Boehringer Ingelheim, Celgene, Janssen, Leo Pharma, Lilly, MSD, Novartis, Pfizer, UCB. JM ha participado como ponente y como investigador en estudios clínicos con AbbVie, Janssen, Leo Pharma, Lilly y Novartis. MJO ha participado como consultor y/o ponente para AbbVie, Amgen, Leo Pharma y Novartis. CV ha participado como consultor y/o ponente para AbbVie, Janssen, Leo Pharma, Novartis. PI y NC son empleados de AbbVie y pueden ser propietarios de acciones de AbbVie. MTB, EZ y LM no tienen conflicto de intereses. AZ ha participado como consultor, ponente e investigador en ensayos clínicos con AbbVie, Almirall, Amgen, Biogen, Celgene, Janssen, Leo Pharma, Lilly, Novartis, Pfizer y Reig Jofré.
ReconocimientosLos autores agradecen a Laura Prieto del Val y Vanessa Chiganças de Evidenze Health España S.L. su apoyo en el diseño del estudio, el análisis de los datos y la redacción del manuscrito. Estos servicios fueron financiados por AbbVie.