El melanoma desmoplásico (MD) es un subtipo raro de melanoma que afecta a los pacientes mayores de 70 años, con daño solar intenso. El MD responde bien a la inmunoterapia, y se caracteriza por una elevada tasa de mutación1–3.
Estudiamos un total de 12 casos de MD, y analizamos las variables clínicas e histopatológicas. Se realizaron estudios mutacionales mediante secuenciación masiva de todos los tumores. Se amplificaron ADN y ARN mediante Oncomine Precision Panel – GX5 – Solid Tumour w2.6.0 DNA and Fusion Panel (Thermo Fisher Scientific), generando una librería e incluyendo amplicones para el estudio de mutaciones e INDELs en las regiones críticas de 45 genes, variaciones del número de copias en 14 genes, y fusiones en 18 genes. Se analizó la secuenciación en la plataforma del Sistema Genexus.
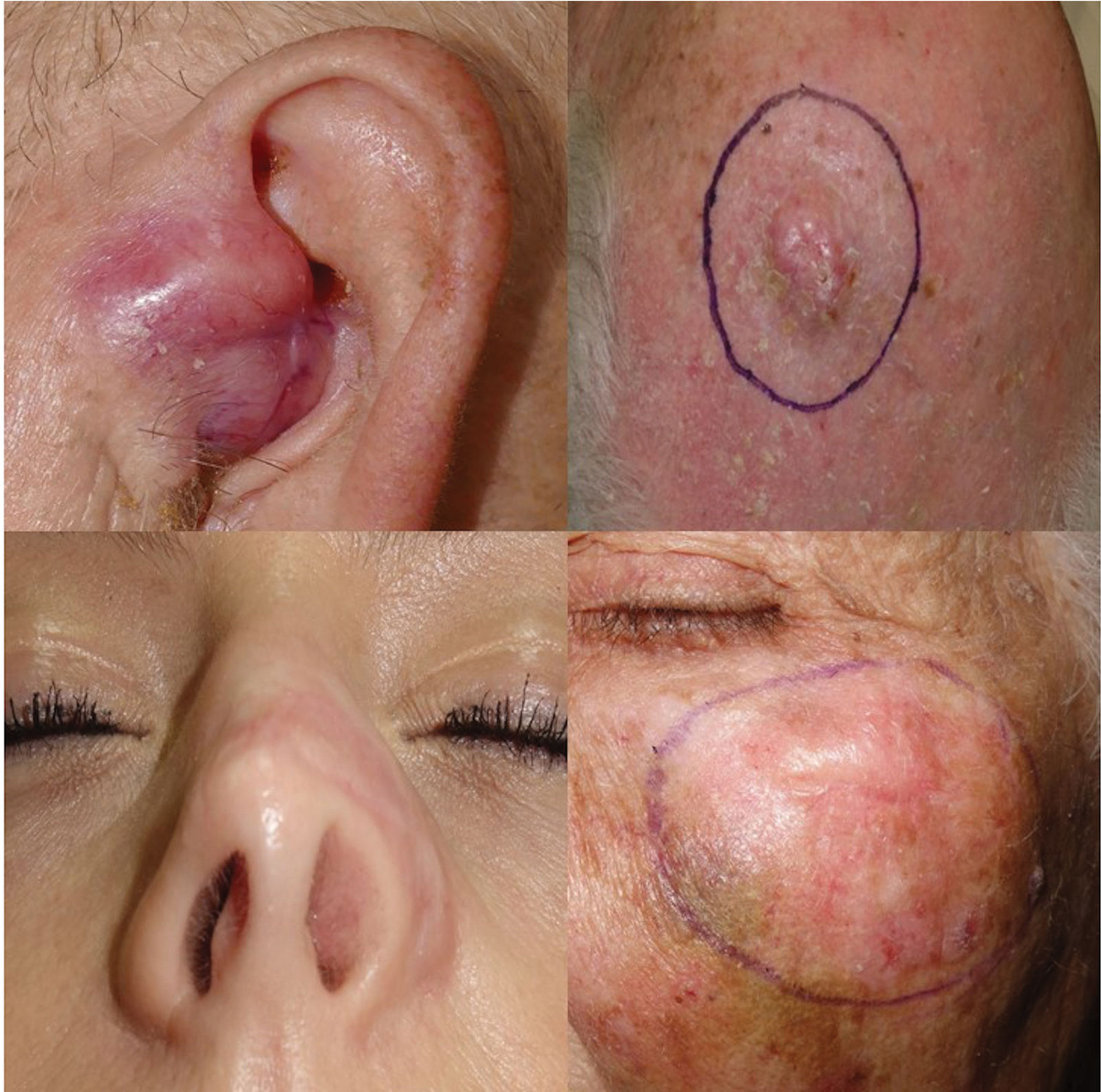
Se estudió un total de 12 pacientes (8♂:4♀) con una edad media de 70 años, y diagnosticados de MD. La presentación más común fueron los nódulos en el cuero cabelludo (5 casos, 41,6%), siendo otras presentaciones comunes los nódulos en mejillas, brazos, nariz y oreja (fig. 1). Histopatológicamente, se encontraron ocho casos puros y cuatro mixtos, siendo el espesor medio de Breslow de 7,3mm, sin diferencias significativas reportadas entre los casos puros y mixtos. Sólo el 25% de los casos (3 casos) fueron pigmentados, el 50% (6 casos) presentaron neurotropismo, y todos los casos presentaron agregados linfoides. La estadificación de los pacientes (tomografía computarizada) resultó negativa en todos los pacientes al realizarse el diagnóstico, exceptuando un paciente, el 16% (2 casos) reflejó ganglios centinelas positivos, siendo todos ellos de subtipo mixto, y el 25% (3 casos) reflejó recidivas locales. El 75% (6 casos) de todos los MD puros fueron de estadio IIB, y el 25% (2 casos), de estadio IV. El 50% (2 casos) de todos los MD mixtos fueron de estadio IIB, y el 50% restante (2 casos), de estadios III y IV. Se inició terapia sistémica con anti-PD-L1 y/o anti-CTLA4 en el 41% de los pacientes (5 pacientes), con respuesta excelente en todos ellos (tabla 1). Ningún paciente ha fallecido por melanoma hasta la fecha. Se encontraron veinticinco mutaciones en 13 genes diferentes – siendo 21 las mutaciones somáticas – y cuatro variaciones del número de copias con amplificaciones. El gen con mayor número de mutaciones fue TP53, que se encontró en el 50% (6 casos) de todos los MD. Las mutaciones de los genes EGFR, IDH1 RET fueron las siguientes más ampliamente encontradas en el 16% (2 casos) de todos los MD reportados. Se encontraron otras mutaciones en los genes ALK, MET, CTNNB1, CD274/PD-L1, FGFR 1 y 3. Sólo un caso de MD exhibió el gen BRAF mutado, mientras que no se encontró gen mutado en tres MD (tabla 2). No se encontraron diferencias en términos de espesor de Breslow ni en casos puros o mixtos de MD con mutaciones de TP53 frente a los casos restantes de MD.
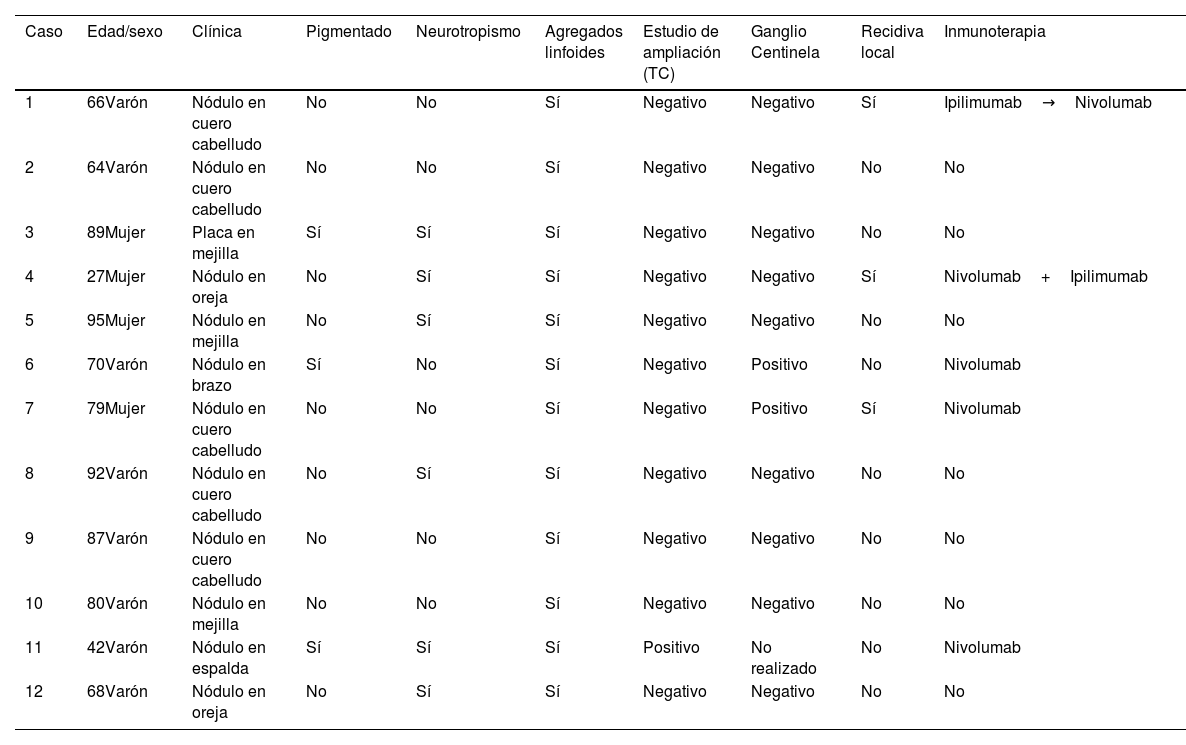
Características clínicas e histopatológicas de los pacientes diagnosticados de MD
| Caso | Edad/sexo | Clínica | Pigmentado | Neurotropismo | Agregados linfoides | Estudio de ampliación (TC) | Ganglio Centinela | Recidiva local | Inmunoterapia |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 66Varón | Nódulo en cuero cabelludo | No | No | Sí | Negativo | Negativo | Sí | Ipilimumab→Nivolumab |
| 2 | 64Varón | Nódulo en cuero cabelludo | No | No | Sí | Negativo | Negativo | No | No |
| 3 | 89Mujer | Placa en mejilla | Sí | Sí | Sí | Negativo | Negativo | No | No |
| 4 | 27Mujer | Nódulo en oreja | No | Sí | Sí | Negativo | Negativo | Sí | Nivolumab+Ipilimumab |
| 5 | 95Mujer | Nódulo en mejilla | No | Sí | Sí | Negativo | Negativo | No | No |
| 6 | 70Varón | Nódulo en brazo | Sí | No | Sí | Negativo | Positivo | No | Nivolumab |
| 7 | 79Mujer | Nódulo en cuero cabelludo | No | No | Sí | Negativo | Positivo | Sí | Nivolumab |
| 8 | 92Varón | Nódulo en cuero cabelludo | No | Sí | Sí | Negativo | Negativo | No | No |
| 9 | 87Varón | Nódulo en cuero cabelludo | No | No | Sí | Negativo | Negativo | No | No |
| 10 | 80Varón | Nódulo en mejilla | No | No | Sí | Negativo | Negativo | No | No |
| 11 | 42Varón | Nódulo en espalda | Sí | Sí | Sí | Positivo | No realizado | No | Nivolumab |
| 12 | 68Varón | Nódulo en oreja | No | Sí | Sí | Negativo | Negativo | No | No |
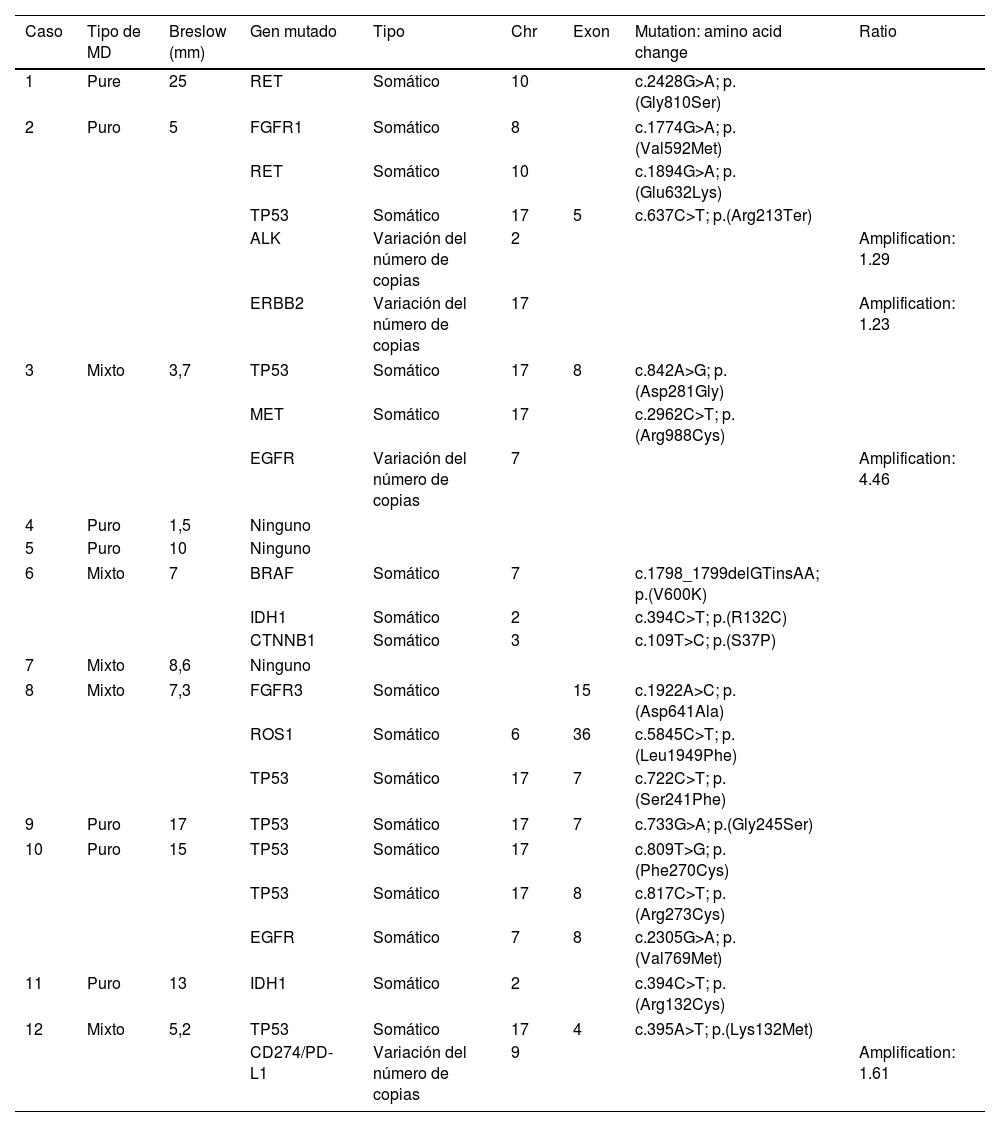
Subtipo, espesor de Breslow y mutaciones de los tumores MD
| Caso | Tipo de MD | Breslow (mm) | Gen mutado | Tipo | Chr | Exon | Mutation: amino acid change | Ratio |
|---|---|---|---|---|---|---|---|---|
| 1 | Pure | 25 | RET | Somático | 10 | c.2428G>A; p.(Gly810Ser) | ||
| 2 | Puro | 5 | FGFR1 | Somático | 8 | c.1774G>A; p.(Val592Met) | ||
| RET | Somático | 10 | c.1894G>A; p.(Glu632Lys) | |||||
| TP53 | Somático | 17 | 5 | c.637C>T; p.(Arg213Ter) | ||||
| ALK | Variación del número de copias | 2 | Amplification: 1.29 | |||||
| ERBB2 | Variación del número de copias | 17 | Amplification: 1.23 | |||||
| 3 | Mixto | 3,7 | TP53 | Somático | 17 | 8 | c.842A>G; p.(Asp281Gly) | |
| MET | Somático | 17 | c.2962C>T; p.(Arg988Cys) | |||||
| EGFR | Variación del número de copias | 7 | Amplification: 4.46 | |||||
| 4 | Puro | 1,5 | Ninguno | |||||
| 5 | Puro | 10 | Ninguno | |||||
| 6 | Mixto | 7 | BRAF | Somático | 7 | c.1798_1799delGTinsAA; p.(V600K) | ||
| IDH1 | Somático | 2 | c.394C>T; p.(R132C) | |||||
| CTNNB1 | Somático | 3 | c.109T>C; p.(S37P) | |||||
| 7 | Mixto | 8,6 | Ninguno | |||||
| 8 | Mixto | 7,3 | FGFR3 | Somático | 15 | c.1922A>C; p.(Asp641Ala) | ||
| ROS1 | Somático | 6 | 36 | c.5845C>T; p.(Leu1949Phe) | ||||
| TP53 | Somático | 17 | 7 | c.722C>T; p.(Ser241Phe) | ||||
| 9 | Puro | 17 | TP53 | Somático | 17 | 7 | c.733G>A; p.(Gly245Ser) | |
| 10 | Puro | 15 | TP53 | Somático | 17 | c.809T>G; p.(Phe270Cys) | ||
| TP53 | Somático | 17 | 8 | c.817C>T; p.(Arg273Cys) | ||||
| EGFR | Somático | 7 | 8 | c.2305G>A; p.(Val769Met) | ||||
| 11 | Puro | 13 | IDH1 | Somático | 2 | c.394C>T; p.(Arg132Cys) | ||
| 12 | Mixto | 5,2 | TP53 | Somático | 17 | 4 | c.395A>T; p.(Lys132Met) | |
| CD274/PD-L1 | Variación del número de copias | 9 | Amplification: 1.61 | |||||
RET: protooncogén RET; FGFR: receptor del factor de crecimiento fibroblástico; TP53: proteína tumoral 53; ALK: cinasa del linfoma anaplásico; ERBB2: oncogén eritroblástico B2; MET: protooncogén MET, receptor de tirosina cinasa; EGFR: receptor del factor de crecimiento epidérmico; BRAF: protooncogén B-Raf, serina/treonina cinasa; IDH1: isocitrato deshidrogenasa (NADP (+)) 1; CTNNB1: β-catenina 1; ROS1: protooncogén ROS 1, receptor de tirosina cinasa; CD274/PD-L1: ligando de muerte celular programada 1.
El diagnóstico de MD puede ser complicado, ya que se trata normalmente de lesiones no específicas. Las lesiones frecuentes son zonas fotoexpuestas con daño solar, que están fuertemente asociadas a la radiación UV. Los agregados linfoides y la invasión perineural son hallazgos histopatológicos comunes en MD4,5, siendo un subtipo de melanoma con una tasa de mutación elevada. En nuestro estudio, el gen con mayor tasa de mutación fue TP53, sin correlación con el espesor de Breslow ni el subtipo MD. La mutación de TP53 está asociada a daño solar acumulado. Se han obtenido resultados similares en otros estudios, donde la mutación más comúnmente encontrada en el MD fue TP53. Sin embargo, en otros estudios, la mutación más ampliamente identificada se produjo en el gen NF16. En nuestro panel de genes estudiados, no se incluyó el gen NF1, lo cual supone una limitación para nuestros resultados. Por contra, la mutación de BRAF es rara en este subtipo de melanoma7,8. Los MD tienen buena respuesta a la inmunoterapia (anti PD-L1/anti-CTLA4), siendo bueno su pronóstico9,10.
Conflicto de interesesLos autores declaran la ausencia de conflicto de intereses.