El melanoma maligno —uno de los tipos de cáncer de mayor incremento a nivel mundial— plantea retos significativos debido a los largos periodos de seguimiento necesarios para los pacientes1,2. La incidencia creciente del melanoma ejerce más presión aún a los sistemas de atención sanitaria de cualquier lugar3. Aunque la detección temprana de la recidiva del melanoma es beneficiosa, no existe aún consenso internacional sobre la vigilancia y las estrategias de seguimiento óptimas para los pacientes con melanoma. Además, dichas estrategias varían considerablemente en los diferentes países y centros médicos3–5.
Muchos facultativos europeos, siguiendo las guías de práctica clínica, tales como las publicadas por la Sociedad Europea de Oncología Médica, supervisan rutinariamente los niveles séricos de la proteína S100b en los pacientes con melanoma4,6,7. Los niveles de S100b elevados en el diagnóstico, o el incremento de dichos niveles durante el seguimiento se han asociado a un riesgo mayor de progresión de la enfermedad y peor pronóstico3,5,6. Sin embargo, el valor predictivo de S100b para la detección temprana de la metástasis local o distante es un tanto limitado4,7.
El objetivo de este estudio es establecer la utilidad de la determinación de S100b para detectar la recidiva del melanoma en la práctica clínica del mundo real.
Realizamos un estudio retrospectivo y observacional de cohorte en la Unidad del Melanoma del Hospital Universitario La Princesa (Madrid, España) un centro de referencia terciario para el melanoma. El estudio incluyó a todos los pacientes consecutivos adultos de melanoma supervisados de enero de 2015 a diciembre de 2020.
Los datos se extrajeron prospectivamente de una base de datos de melanoma y de historias clínicas electrónicas, incluyendo datos demográficos basales, características de la enfermedad, y niveles séricos de S100b durante el diagnóstico y el seguimiento. Todos los participantes firmaron el consentimiento informado. Además, el estudio cumplió los estándares éticos de la Declaración de Helsinki.
Se incluyó a los pacientes con melanoma cutáneo primario de estadios IA a IIID, según la categorización de la 8.ª edición de la clasificación de la American Joint Committee on Cancer (AJCC). Se realizó biopsia del ganglio linfático centinela (BGLC) siguiendo las guías de práctica clínica de National Comprehensive Cancer Network (NCNN) clinical practice guidelines.
Se midieron periódicamente las concentraciones séricas de S100b de acuerdo con el protocolo del hospital (Anexo 1), aunque la naturaleza retrospectiva del estudio permitió realizar variaciones en el momento de dichas medidas. El criterio de valoración primario fue la utilidad del incremento de los niveles séricos de S100b en el diagnóstico de las metástasis del melanoma categorizadas mediante diferentes métodos de detección, incluyendo la sospecha del médico, la concienciación del paciente, las técnicas de imagen y los cambios del nivel de S100b.
Análisis estadístico: IBM SPSS® Statistics versión 26, considerándose estadísticamente significativos los valores p<0,05.
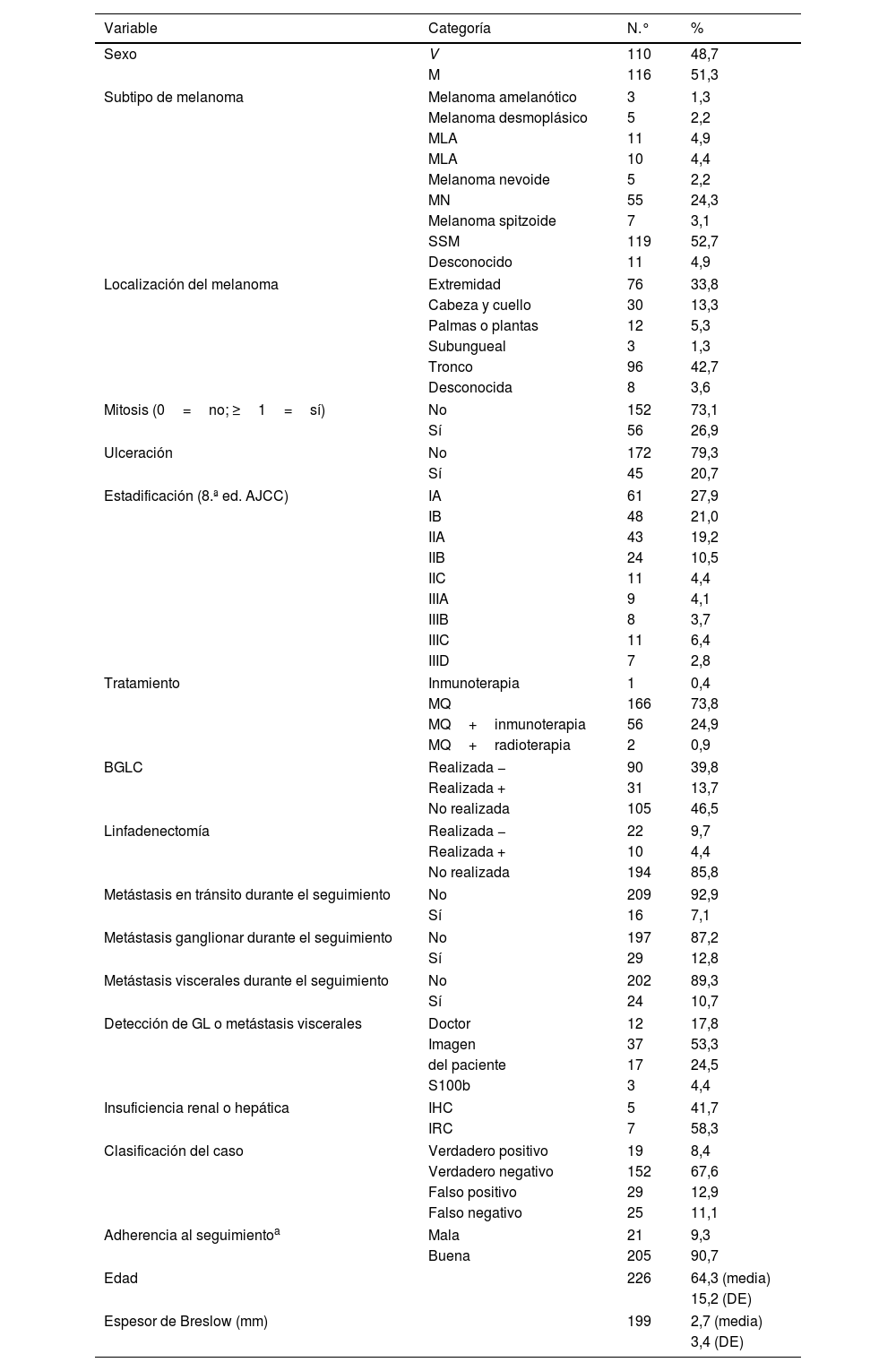
La cohorte se compuso de 226 pacientes con melanoma cutáneo invasivo (tabla 1). La edad media fue de 64,3 años (aproximadamente el 51,3% de los pacientes fueron mujeres). El subtipo más común fue el melanoma de extensión superficial, localizado principalmente en el tronco. El grosor de Breslow medio en el momento del diagnóstico fue de 2,7mm. La estadificación inicial se situó en el 48,9% (estadio I), 34,1% (estadio I) y el 17% (estadio III), muchos de ellos sometidos únicamente a tratamiento quirúrgico.
Características basales de la cohorte
| Variable | Categoría | N.° | % |
|---|---|---|---|
| Sexo | V | 110 | 48,7 |
| M | 116 | 51,3 | |
| Subtipo de melanoma | Melanoma amelanótico | 3 | 1,3 |
| Melanoma desmoplásico | 5 | 2,2 | |
| MLA | 11 | 4,9 | |
| MLA | 10 | 4,4 | |
| Melanoma nevoide | 5 | 2,2 | |
| MN | 55 | 24,3 | |
| Melanoma spitzoide | 7 | 3,1 | |
| SSM | 119 | 52,7 | |
| Desconocido | 11 | 4,9 | |
| Localización del melanoma | Extremidad | 76 | 33,8 |
| Cabeza y cuello | 30 | 13,3 | |
| Palmas o plantas | 12 | 5,3 | |
| Subungueal | 3 | 1,3 | |
| Tronco | 96 | 42,7 | |
| Desconocida | 8 | 3,6 | |
| Mitosis (0=no; ≥1=sí) | No | 152 | 73,1 |
| Sí | 56 | 26,9 | |
| Ulceración | No | 172 | 79,3 |
| Sí | 45 | 20,7 | |
| Estadificación (8.ª ed. AJCC) | IA | 61 | 27,9 |
| IB | 48 | 21,0 | |
| IIA | 43 | 19,2 | |
| IIB | 24 | 10,5 | |
| IIC | 11 | 4,4 | |
| IIIA | 9 | 4,1 | |
| IIIB | 8 | 3,7 | |
| IIIC | 11 | 6,4 | |
| IIID | 7 | 2,8 | |
| Tratamiento | Inmunoterapia | 1 | 0,4 |
| MQ | 166 | 73,8 | |
| MQ+inmunoterapia | 56 | 24,9 | |
| MQ+radioterapia | 2 | 0,9 | |
| BGLC | Realizada − | 90 | 39,8 |
| Realizada + | 31 | 13,7 | |
| No realizada | 105 | 46,5 | |
| Linfadenectomía | Realizada − | 22 | 9,7 |
| Realizada + | 10 | 4,4 | |
| No realizada | 194 | 85,8 | |
| Metástasis en tránsito durante el seguimiento | No | 209 | 92,9 |
| Sí | 16 | 7,1 | |
| Metástasis ganglionar durante el seguimiento | No | 197 | 87,2 |
| Sí | 29 | 12,8 | |
| Metástasis viscerales durante el seguimiento | No | 202 | 89,3 |
| Sí | 24 | 10,7 | |
| Detección de GL o metástasis viscerales | Doctor | 12 | 17,8 |
| Imagen | 37 | 53,3 | |
| del paciente | 17 | 24,5 | |
| S100b | 3 | 4,4 | |
| Insuficiencia renal o hepática | IHC | 5 | 41,7 |
| IRC | 7 | 58,3 | |
| Clasificación del caso | Verdadero positivo | 19 | 8,4 |
| Verdadero negativo | 152 | 67,6 | |
| Falso positivo | 29 | 12,9 | |
| Falso negativo | 25 | 11,1 | |
| Adherencia al seguimientoa | Mala | 21 | 9,3 |
| Buena | 205 | 90,7 | |
| Edad | 226 | 64,3 (media) | |
| 15,2 (DE) | |||
| Espesor de Breslow (mm) | 199 | 2,7 (media) | |
| 3,4 (DE) | |||
AJCC: American Joint Committee on Cancer; ALM: melanoma lentiginoso acral; BGLC: biopsia del ganglio linfático centinela; DE: desviación estándar; GL: ganglios linfáticos; IHC: insuficiencia hepática crónica; IRC: insuficiencia renal crónica; LMM: lentigo maligna melanoma; M: mujer; MN: melanoma nodular; MQ: margen quirúrgico; SSM: melanoma de extensión superficial; V: varón.
Durante el periodo de seguimiento, 69 pacientes desarrollaron metástasis. Los modos de detección incluyeron modalidades de imagen, exploración clínica, autoexamen del paciente y cambios en el nivel de S100b (tabla 2). La utilidad de S100b para impulsar realmente una investigación diagnóstica adicional fue limitada, corroborando a menudo los hallazgos de otros métodos en lugar de actuar como herramienta diagnóstica primaria (tabla 2).
Parámetros estadísticos de las capacidades predictivas de los valores séricos de S100b
| Recidiva | Se (%) | Sp (%) | VPP (%) | VPN (%) | LR+ | ||
|---|---|---|---|---|---|---|---|
| Sí | No | ||||||
| S100>0,15μg/l | |||||||
| Sí | 19 | 29 | 43 | 84 | 40 | 86 | 2,7 |
| No | 25 | 152 | |||||
LR: ratio de probabilidad; VPP: valor predictivo positivo; Se: sensibilidad; Sp: especificidad; VPN: valor predictivo negativo.
Se realizó el intervalo de puntuación de Wilson. Se creó una tabla de clasificación para las cuatro categorías posibles (verdadero positivo, verdadero negativo, falso positivo, falso negativo). La evaluación fue determinada por sensibilidad (Se), especificidad (Sp) y valores predictivos: negativo (VPN) y positivo (VPP) y sus intervalos de confianza del 95% (IC 95%) utilizando el intervalo de puntuación de Wilson. Además, calculamos el ratio de probabilidad para el valor positivo (LR+) definido como sensibilidad/(1-especificidad), que muestra el número de verdaderos positivos para cada falso positivo.
Las estadísticas descriptivas, intervalos de confianza y tabla de clasificación para las categorías diagnósticas (verdadero positivo, verdadero negativo, falso positivo, falso negativo) se muestran en la tabla 2. Se calcularon las tasas de sensibilidad y especificidad de S100b, junto con los valores predictivos (tabla 2). Se utilizó el ratio de probabilidad positiva para evaluar la eficiencia diagnóstica de la elevación de S100b (tabla 2). Se consideró la significación estadística para los valores p<0,05.
Las guías de práctica clínica nacionales e internacionales recomiendan la valoración rutinaria de S100b, especialmente para los pacientes de melanoma de alto riesgo4,6,8,9. Algunos estudios sugieren que los niveles basales altos o incrementados de S100b durante el seguimiento están asociados a un mayor riesgo de progresión de la enfermedad y un peor pronóstico, justificando una evaluación adicional2,3,10. En la práctica clínica, Podlipnk et al.3 encontraron que los cambios mensuales de S100b contribuyeron a diagnosticar recidiva y seguimiento intensivo de apoyo para los estadios del melanoma IIB, IIC y III. Ellos concluyeron que los incrementos mensuales de los valores de S100b dentro del rango normal mejoran la sensibilidad de la prueba y las tasas de especificidad3. Peric et al., reportaron el incremento sérico de S100b como el único signo de progresión de la enfermedad en el 20% de los pacientes10. En nuestra cohorte, el 4,4% de todos los diagnósticos de progresión se basaron exclusivamente en el incremento de S100b (debido probablemente a la inclusión de los melanomas de bajo riesgo).
Las tasas de sensibilidad y especificidad de nuestra cohorte (43 y 84%) son similares a los valores previamente reportados (del 29 al 43% y del 93 al 94%)2,10. La variabilidad de la efectividad de S100b puede atribuirse a la inclusión de los melanomas de estadio temprano, que tienen menor probabilidad de revelar cambios significativos de los niveles de S100b.
Las limitaciones del estudio incluyen el pequeño tamaño de la cohorte y los datos unicéntricos. Sus fortalezas son que el estudio destaca la necesidad de interpretar el incremento de S100b conjuntamente, en lugar de depender únicamente de un valor de corte absoluto o de una tasa de cambio aplicable a todas las cohortes (material suplementario).
La utilidad de S100b en el seguimiento de los pacientes con melanoma no metastásico es de valor individual limitado para la detección de metástasis. El uso suplementario de modalidades de imagen y examen médico puede añadir valor diagnóstico al manejo del paciente.
Conflicto de interesesLos autores declaran la ausencia de conflicto de intereses.