La dermatitis atópica (DA) es un trastorno cutáneo inflamatorio crónico y recidivante con un impacto enorme en la calidad de vida. Los brotes de DA son muy comunes durante el embarazo, presumiblemente a causa del cambio de respuesta de T helper 1 (Th1) a Th2 durante este periodo1. La evidencia sobre la eficacia y seguridad de las terapias sistémicas para DA durante el embarazo es muy limitada, y la ETFAD (European Task Force on Atopic Dermatitis) recomienda que deberán restringirse a corticosteroides, ciclosporina y azatioprina2. Dupilumab es un anticuerpo IgG4 que se une específicamente a la subunidad de la cadena compartida α de los receptores de interleucina-4 (IL-4) e interleucina-13 (IL-13), bloqueando por tanto la señalización de estas dos citocinas secretadas por los linfocitos Th23. Cabe esperar que este fármaco atraviese la placenta, de manera similar a otros anticuerpos IgG1. Reportamos un caso de DA que fue seguramente tratado con dupilumab durante el embarazo y la lactancia.
Describimos el caso de una mujer de 37 años que acudió a nuestro hospital con un brote de AD tres años antes del embarazo, habiéndose diagnosticado DA desde sus primeros meses de vida. Su enfermedad fue leve hasta los 30 años de edad. Los brotes anteriores fueron tratados con corticosteroides tópicos (TCS), corticosteroides sistémicos (SCS), ciclosporina y fototerapia. Su historial clínico era significativo en términos de rinoconjuntivitis alérgica y un episodio de eccema herpético dos años antes. En el momento en que comenzó el tratamiento con dupilumab, tenía lesiones de DA que afectaban al 22% de su área de superficie corporal (BSA), con una puntuación EASI (Eczema Area and Severity) de 19,1, SCORAD de 54,4, IGA (Investigator Global Assessment) de 4 y NRS prurítico de 7, lo cual repercutía considerablemente en su calidad de vida. La paciente inició tratamiento con dupilumab y experimentó una mejora significativa, logrando EASI90 y una reducción significativa del prurito (NRS prurítico=0) e IGA (IGA=1) tras 12 semanas de tratamiento. El único efecto adverso reportado fue artralgia leve. Transcurridos tres años de tratamiento, la paciente decidió concebir. Tras consultar con médicos Dermatólogos y Obstétricos, se decidió colectivamente continuar el tratamiento. No se produjeron complicaciones del embarazo, y la DA permaneció controlada a lo largo del periodo de gestación completo. Dio a luz a término a un bebé sano. La paciente continuó el tratamiento durante el periodo de lactancia de 8 meses, sin complicación alguna.
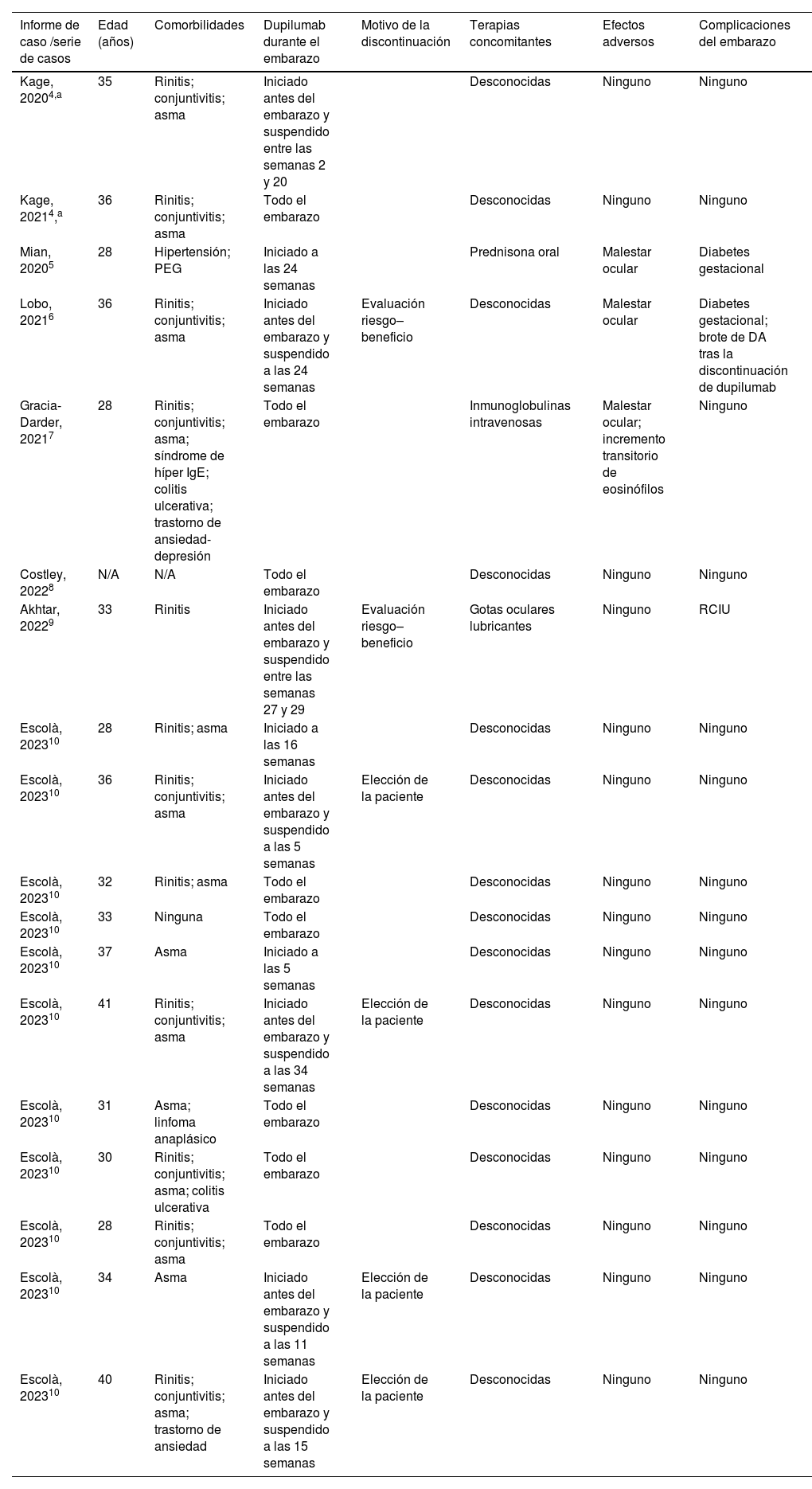
El manejo de la DA durante el embarazo y la lactancia puede suponer un reto. Los datos sobre la seguridad de las medicaciones sistémicas nuevas son muy limitados. La EMA (European Medicines Agency) consideró que la tasa de abortos espontáneos registrada durante los estudios de dupilumab no pareció exceder la tasa general3. Los datos sobre la seguridad del uso de dupilumab para el tratamiento de la DA durante el embarazo se limitan a informes y series de casos. Nosotros realizamos una revisión sistemática de dichos casos reportados en la literatura para resumir la evidencia existente en la tabla 14,10. La búsqueda en la base de datos de MEDLINE se realizó el 8 de junio de 2023, sin aplicación de filtros. En un total de dieciocho embarazos (una paciente tuvo dos embarazos), existe un caso reportado de restricción del crecimiento intrauterino (RCIU). En dicho caso, no existieron anomalías anatómicas ni histológicas en la placenta, y el bebé nació con un peso levemente bajo de 2.480g. Un embarazo se complicó por sospecha de feto pequeño para su edad gestacional antes de iniciar la paciente el tratamiento de dupilumab, pero el bebé tuvo un peso adecuado al nacer. Los efectos adversos reportados incluyen malestar ocular leve en el 17% de las pacientes, y un caso de incremento transitorio de eosinófilos. En cuanto a la lactancia, existen once casos publicados de mujeres que amamantaron a sus bebés con tiempos de seguimiento diferentes, pero no reportaron episodios adversos ni complicaciones4,10. De manera similar a otros agentes biológicos con alto peso molecular, la secreción de dupilumab en la leche materna es mínima, exceptuando los primeros tres días, cuando los amplios huecos entre las células alveolares de la mama permiten que las inmunoglobulinas atraviesen estas1.
Resumen de los casos reportados con uso de dupilumab para tratar la dermatitis atópica en el embarazo
| Informe de caso /serie de casos | Edad (años) | Comorbilidades | Dupilumab durante el embarazo | Motivo de la discontinuación | Terapias concomitantes | Efectos adversos | Complicaciones del embarazo |
|---|---|---|---|---|---|---|---|
| Kage, 20204,a | 35 | Rinitis; conjuntivitis; asma | Iniciado antes del embarazo y suspendido entre las semanas 2 y 20 | Desconocidas | Ninguno | Ninguno | |
| Kage, 20214,a | 36 | Rinitis; conjuntivitis; asma | Todo el embarazo | Desconocidas | Ninguno | Ninguno | |
| Mian, 20205 | 28 | Hipertensión; PEG | Iniciado a las 24 semanas | Prednisona oral | Malestar ocular | Diabetes gestacional | |
| Lobo, 20216 | 36 | Rinitis; conjuntivitis; asma | Iniciado antes del embarazo y suspendido a las 24 semanas | Evaluación riesgo–beneficio | Desconocidas | Malestar ocular | Diabetes gestacional; brote de DA tras la discontinuación de dupilumab |
| Gracia-Darder, 20217 | 28 | Rinitis; conjuntivitis; asma; síndrome de híper IgE; colitis ulcerativa; trastorno de ansiedad-depresión | Todo el embarazo | Inmunoglobulinas intravenosas | Malestar ocular; incremento transitorio de eosinófilos | Ninguno | |
| Costley, 20228 | N/A | N/A | Todo el embarazo | Desconocidas | Ninguno | Ninguno | |
| Akhtar, 20229 | 33 | Rinitis | Iniciado antes del embarazo y suspendido entre las semanas 27 y 29 | Evaluación riesgo–beneficio | Gotas oculares lubricantes | Ninguno | RCIU |
| Escolà, 202310 | 28 | Rinitis; asma | Iniciado a las 16 semanas | Desconocidas | Ninguno | Ninguno | |
| Escolà, 202310 | 36 | Rinitis; conjuntivitis; asma | Iniciado antes del embarazo y suspendido a las 5 semanas | Elección de la paciente | Desconocidas | Ninguno | Ninguno |
| Escolà, 202310 | 32 | Rinitis; asma | Todo el embarazo | Desconocidas | Ninguno | Ninguno | |
| Escolà, 202310 | 33 | Ninguna | Todo el embarazo | Desconocidas | Ninguno | Ninguno | |
| Escolà, 202310 | 37 | Asma | Iniciado a las 5 semanas | Desconocidas | Ninguno | Ninguno | |
| Escolà, 202310 | 41 | Rinitis; conjuntivitis; asma | Iniciado antes del embarazo y suspendido a las 34 semanas | Elección de la paciente | Desconocidas | Ninguno | Ninguno |
| Escolà, 202310 | 31 | Asma; linfoma anaplásico | Todo el embarazo | Desconocidas | Ninguno | Ninguno | |
| Escolà, 202310 | 30 | Rinitis; conjuntivitis; asma; colitis ulcerativa | Todo el embarazo | Desconocidas | Ninguno | Ninguno | |
| Escolà, 202310 | 28 | Rinitis; conjuntivitis; asma | Todo el embarazo | Desconocidas | Ninguno | Ninguno | |
| Escolà, 202310 | 34 | Asma | Iniciado antes del embarazo y suspendido a las 11 semanas | Elección de la paciente | Desconocidas | Ninguno | Ninguno |
| Escolà, 202310 | 40 | Rinitis; conjuntivitis; asma; trastorno de ansiedad | Iniciado antes del embarazo y suspendido a las 15 semanas | Elección de la paciente | Desconocidas | Ninguno | Ninguno |
Abreviaturas: DA: dermatitis atópica; RCIU: restricción del crecimiento intrauterino; PEG: feto pequeño para su edad gestacional.
En conclusión, nuestro caso se añade a los informes existentes sobre el uso exitoso y seguro de dupilumab durante el embarazo y la lactancia. Sin embargo, dada la falta de estudios de mayor tamaño, no es posible recomendar su uso como enfoque terapéutico estándar. Actualmente, existen dos estudios observacionales registrados en ClinicalTrials.gov (NCT03936335 y NCT04173442) que pueden ayudar a abordar esta brecha de la evidencia. Considerando que los datos actuales sugieren la seguridad de su uso, es razonable recomendarlo en los casos graves de DA durante el embarazo tras una evaluación riesgo-beneficio detenida y la garantía de que estas pacientes están debidamente vigiladas por Dermatólogos y Obstetras, de cara a la detección de efectos adversos potenciales o complicaciones.
Conflicto de interesesJosé Miguel Alvarenga y Ana Maria Lé no tienen conflicto de intereses. Tiago Torres ha recibido honorarios por asesoramiento y/o conferencias y/o ha participado en ensayos clínicos patrocinados por AbbVie, Amgen, Almirall, Arena Pharmaceuticals, Biocad, Biogen, Boehringer Ingelheim, Bristol Myers Squibb, Celgene, Fresenius-Kabi, Janssen, LEO Pharma, Eli Lilly, MSD, Mylan, Novartis, Pfizer, Samsung-Bioepis, Sanofi-Genzyme, Sandoz y UCB.