La aparición de enfermedades ampollosas autoinmunes (EAAI) puede estar influida por múltiples factores, incluyendo el uso de fármacos, infecciones virales o la administración de vacunas. Recientemente, se han documentado casos aislados potencialmente inducidos por la vacunación contra el SARS-CoV-21. En este artículo presentamos un caso inusual de penfigoide de membranas mucosas (PMM) desencadenado tras la vacunación contra SARS-CoV-2.
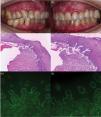
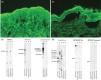
Se trata de una mujer de 75 años, sin antecedentes dermatológicos de interés, valorada en nuestro servicio por lesiones dolorosas en mucosa oral de unos 12 meses de evolución, sin afectación cutánea ni de otras mucosas. La paciente relacionaba la aparición de dichas lesiones con la administración de la segunda dosis de vacunación contra SARS-CoV-2 de Pfizer. Además, refería persistencia de las lesiones a pesar de tartamiento con corticoides tópcios. El examen físico reveló la presencia de placas erosivas y eritematosas en las encías superiores e inferiores (fig. 1a y b). En el estudio histopatológico, se observó un desprendimiento subepidérmico y células inflamatorias incluyendo eosinófilos (fig. 1c y d). La inmunofluorescencia directa (IFD) reflejó depósitos lineales de IgG y C3 a lo largo de la zona de la membrana basal (fig. 1e y f). Asimismo, utilizando el procedimiento salt-split (IIF-SS) se observaron depósitos lineales de IgG (1:40) en el lado epidérmico (fig. 2a y b). La prueba ELISA realizada en el suero de la paciente detectó un alto nivel de anticuerpos anti-BP-180 (116U/ml; normal<20U/ml). Mediante inmunoblot (IB), se encontró IgG contra los dominios C-terminal y LAD-1 de BP180 (fig. 2c y d). Nuestra paciente fue diagnosticada de PMM tipo anti-BP180, probablemente inducido por la vacuna contra el SARS-CoV-2. Se inició tratamiento con dapsona 50mg/12h y propionato de clobetasol tópico, con resolución completa de las lesiones transcurridos 4 meses desde el inicio del tratamiento.
(a y b) Placas erosivas y eritematosas con un diámetro de hasta 1cm, que afectaron las encías marginales, interdentales y adjuntas. (c y d) Imagen histológica representativa de la biopsia, que muestra una ampolla subepidérmica y múltiples células inflamatorias incluyendo eosinófilos (hematoxilina y eosina, ×100 [c] y ×200 [d]). (e, f) Prueba inmunofluorescencia directa que muestra (e) depósito lineal de IgG (×200) y (f) C3 a lo largo de la unión dermoepidérmica (×200).
(a y b) Imágenes de inmunofluorescencia indirecta. (a) El IgG de la paciente reacciona en la zona de la membrana basal, disolución 1:10 (×200). (b) El IgG de la paciente reacciona en el lado epidérmico de la sección, disolución 1:40 (×200). (c y d) Inmunoblot que muestra IgG vs. los dominios C-terminal y LAD-1 (HaCaT) de BP180. Los resultados fueron negativos para los extractos epidérmico (desmogleína 1 y 3) y dérmico, BP180 NC16a, y Laminina-332.
Hasta la fecha, han sido reportados diversos casos de trastornos autoinmunes, incluyendo EAAI, tras la vacuna contra el SARS-CoV-22. No obstante, solo el 6% de los pacientes con EAAI tras la vacunación contra el SARS-CoV-2 han desarrollado EAAI de novo, siendo las más frecuentemente reportadas el penfigoide ampolloso, el pénfigo vulgar y el pénfigo foliáceo tras la admistración de la 1a y/o 2a dosis1.
El desarrollo de EAAI con afectación de la mucosa oral tras la vacunación contra el SARS-CoV-2 ha sido reportado con poca frecuencia en la literatura y, habitualmente, en asociación con lesiones cutáneas. Se ha observado una ligera predominancia en mujeres (69%), con un tiempo medio de aparición de 9,4 días tras la vacunación. Además, según lo reportado hasta el momento, la vacuna BNT162b2 de BioNTech (Pfizer) tiende a desencadenar lesiones orales autoinmunes con mayor frecuencia3. Hasta la fecha, únicamente se han descrito dos casos de PMM posteriores a la vacunación contra el SARS-CoV-24,5 (tabla 1).
Casos reportados de penfigoide de mucosas tras la vacunación contra la COVID
| Autores | Sexo/edad (años) | Signos clínicos | Margen temporal | Histología | Autoanticuerpos | Tipo de vacuna | Tratamiento/resultado | Comorbilidades/tratamiento |
|---|---|---|---|---|---|---|---|---|
| Rungraungrayabku et al.4 | Mujer/74 | Eritema, erosiones, ampollas, mucosa gingival | 2 semanas tras la 1.a dosis de la vacuna | Ampolla subepitelialIFD: depósitos lineales de IgG y C3IIF: no reflejada | No reflejados | Vacuna BNT162b2 de BioNTech (Pfizer) | Doxiciclina, corticosteroides tópicosMejora | No relevante |
| Calabria et al.5 | Mujer/72 | Eritema, erosiones, ampollas, encías superior e inferior, ampliación bilateral al fórnix vestibular y la mucosa oral derecha mucosa | 9 días tras la 3.a dosis de la vacuna | Desprendimiento subepitelialIFD: depósitos lineales de IgG/IgA, depósitos granulares de C3 | ELISA: IgG vs. BP180 | Vacuna BNT162b2 de BioNTech (Pfizer) | Antibióticos, corticosteroides tópicos y sistémicosRespuesta completa | Cáncer de mamaInhibidor de aromatasaDenosumab |
| Nuestro caso | Mujer/75 | Eritema, encías superior e inferior | 7 días tras la 2.a dosis de la vacuna | Desprendimiento subepitelialIFD: depósitos lineales de IgG y C3IIF/salt split: IgG reaccionó con el lado epidérmico del split | ELISA: IgG vs. BP180IB: IgG BP180 dominios C-terminal y LAD-1 | Vacuna BNT162b2 de BioNTech (Pfizer) | Corticosteroides tópicos y sistémicosDapsonaMejora gradual | No relevante |
Estos casos aportan información de interés. En primer lugar, el PMM posterior a la vacunación ocurre principalmente en mujeres, al igual que el PMM de origen convencional. Además, las tres pacientes afectadas presentaron lesiones exclusivamente en la mucosa oral y, en dos de ellas, se detectaron autoanticuerpos IgG frente a BP180 mediante ELISA. Además, en nuestro caso se identificaron autoanticuerpos IgG dirigidos contra los dominios LAD-1 y C-terminal de BP180, evidenciados mediante IB.
Finalmente, los tres casos de PMM inducido por la vacuna contra el SARS-CoV-2 evolucionaron favorablemente tras el tratamiento, probablemente debido al carácter autolimitado del proceso inmunológico asociado a la vacunación. Todos estos hallazgos sugieren que la vacunación frente al SARS-CoV-2 podría actuar como desencadenante del PMM.
Hasta la fecha, no se ha establecido una clara relación causa-efecto entre la vacuna contra el SARS-CoV-2 y el desarrollo de enfermedades autoinmunes. No obstante, se han postulado varias hipótesis como explicación para la aparición o reactivación de EAAI tras la vacunación contra SARS-CoV-2. Estas teorías incluyen el mimetismo molecular entre el virus y proteínas humanas, o la activación indirecta de linfocitos2. Es importante señalar que las vacunas contra SARS-CoV-2 generan proteínas spike, las cuales pueden unirse a los receptores de la enzima convertidora de angiotensina 2 en los queratinocitos, lo que podría inducir también el reclutamiento de linfocitos CD4+. Además, los adyuvantes presentes en las vacunas podrían potenciar la respuesta inmunitaria.
No obstante, a pesar de estos hallazgos, un metaanálisis reciente sobre trastornos cutáneos autoinmunes tras la vacunación contra el SARS-CoV-2 indica que estas enfermedades no parecen asociar un mayor riesgo en comparación con otros factores desencadenantes6, lo cual respalda su recomendación en pacientes que requieren protección frente a la infección por SARS-CoV-2.
Conflicto de interesesLos autores declaran la ausencia de conflicto de intereses.


![(a y b) Placas erosivas y eritematosas con un diámetro de hasta 1cm, que afectaron las encías marginales, interdentales y adjuntas. (c y d) Imagen histológica representativa de la biopsia, que muestra una ampolla subepidérmica y múltiples células inflamatorias incluyendo eosinófilos (hematoxilina y eosina, ×100 [c] y ×200 [d]). (e, f) Prueba inmunofluorescencia directa que muestra (e) depósito lineal de IgG (×200) y (f) C3 a lo largo de la unión dermoepidérmica (×200). (a y b) Placas erosivas y eritematosas con un diámetro de hasta 1cm, que afectaron las encías marginales, interdentales y adjuntas. (c y d) Imagen histológica representativa de la biopsia, que muestra una ampolla subepidérmica y múltiples células inflamatorias incluyendo eosinófilos (hematoxilina y eosina, ×100 [c] y ×200 [d]). (e, f) Prueba inmunofluorescencia directa que muestra (e) depósito lineal de IgG (×200) y (f) C3 a lo largo de la unión dermoepidérmica (×200).](https://static.elsevier.es/multimedia/00017310/0000011600000009/v1_202510020504/S0001731025004855/v1_202510020504/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w9/t1/zx4Q/XH5Tma1a/6fSs=)




