El diagnóstico de la alopecia se ha basado tradicionalmente en la diferenciación entre formas cicatriciales y no cicatriciales, una distinción que no siempre es sencilla desde una perspectiva clínica o histopatológica. Aunque las características histopatológicas de los distintos tipos de alopecia están bien establecidas, publicaciones recientes han introducido nuevas variantes de alopecia no cicatricial y han identificado características histológicas que facilitan el diagnóstico. Algunos de estos hallazgos tienen implicaciones terapéuticas, mientras que otros proporcionan nuevas perspectivas patogénicas que mejoran nuestra comprensión de la alopecia. Este artículo destaca los avances recientes en la histopatología de la alopecia no cicatricial según lo informado en la literatura científica.
The diagnosis of alopecia has traditionally relied on distinguishing between scarring and non-scarring forms, a differentiation that is not always straightforward from either a clinical or histopathological perspective. While the histopathological features of various types of alopecia are well established, recent reports have introduced new variants of non-scarring alopecia and identified histological features to achieve diagnosis. Some of these findings have therapeutic implications, while others provide novel pathogenic insights that enhance our understanding of alopecia. This article highlights recent advancements in the histopathology of non-scarring alopecia as reported in the literature.
La clasificación de la alopecia en tipos cicatriciales y no cicatriciales es un concepto diagnóstico fundamental. Aunque esta distinción pueda parecer un tanto artificial, ha servido para orientar las estrategias de tratamiento y proporcionar información pronóstica más precisa a los pacientes. La biopsia del cuero cabelludo sigue siendo una herramienta valiosa para diagnosticar la alopecia, complementando el examen clínico y la tricoscopia.
Sin embargo, distinguir entre alopecia cicatricial y no cicatricial no siempre es sencillo, ni clínica ni histopatológicamente. En un estudio reciente sobre la alopecia crónica difusa en mujeres, los resultados de la biopsia revelaron alopecia cicatricial en el 32,5% de los casos, a pesar de que las presentaciones clínicas eran similares en los 32 pacientes estudiados1.
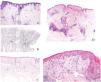
Desde el punto de vista histopatológico, la alopecia cicatricial se caracteriza principalmente por la fibrosis, a menudo perinfundibular, junto con la destrucción de las fibras elásticas, que puede requerir técnicas histoquímicas especiales para su detección (fig. 1A y B). Recientemente, Botega et al. describieron marcadores histológicos tempranos que diferencian la alopecia cicatricial de la no cicatricial antes de que se produzca la destrucción de las fibras elásticas2. La alopecia no cicatricial suele mostrar una mayor densidad folicular, con un mayor número de folículos no terminales y miniaturizados2 (fig. 1C). Por el contrario, la alopecia cicatricial se asocia a menudo con infiltrados inflamatorios dérmicos concentrados alrededor de la porción persistente del folículo, con frecuencia en un patrón liquenoide2. Otras características son la proliferación ductal de tipo siringoma, la seudohiperplasia del músculo erector del pelo y la reducción de la densidad de las glándulas sebáceas2. Los infiltrados inflamatorios son especialmente prominentes en la alopecia cicatricial asociada al lupus eritematoso discoide crónico (LEDC). Aunque el LEDC es el principal signo cicatricial de alopecia en el lupus, la mayoría de las manifestaciones de alopecia en el lupus no son cicatriciales.
A) Presencia de fibrosis perinfundibular concéntrica, fácilmente identificable con la tinción de hematoxilina y eosina, en un caso de alopecia cicatricial. B) Tinción histoquímica mediante la técnica de la orceína, que demuestra la destrucción de las fibras elásticas en las zonas perinfundibulares de un caso de alopecia cicatricial. C) Ejemplo de alopecia androgenética (no cicatricial), con marcada miniaturización folicular. D) Biopsia de una mancha alopécica en un paciente con lupus eritematoso. Presencia de un infiltrado inflamatorio perivascular superficial y profundo, junto con afectación perianexial, unión dermoepidérmica borrosa y atrofia epidérmica. E) Detalle del mismo caso de la figura LUPUS que muestra degeneración vacuolar de la capa basal de la epidermis con algunos queratinocitos apoptóticos.
Históricamente, la alopecia no cicatricial en el lupus eritematoso se consideraba un hallazgo inespecífico o casual. Sin embargo, estudios recientes han identificado una forma específica de alopecia no cicatricial asociada al lupus caracterizada por rasgos histopatológicos distintivos3. La alopecia no cicatricial difusa o en parches y el «pelo del lupus» pueden representar variaciones topográficas de una única entidad específica del lupus3.
Las características histopatológicas de la alopecia no cicatricial relacionada con el lupus incluyen atrofia epidérmica, infiltrados linfoplasmocitarios perivasculares y perianexiales (fig. 1D), cambios en la interfase de la membrana basal epidérmica o folicular (fig. 1E), depósitos dérmicos de mucina y depósitos inmunes (IgG, IgM, IgA, C3, C1q) a lo largo de la membrana basal epidérmica o folicular3.
Clínicamente, los pacientes con lupus que presentan una alopecia no cicatricial o el lupus capilar suelen estar asociados de manera intensa con la actividad del lupus eritematoso sistémico (LES). Estos pacientes suelen responder bien al tratamiento del LES y no evolucionan hacia una alopecia cicatricial3. Por el contrario, la paniculitis lúpica anular y lineal del cuero cabelludo presenta una asociación más débil con la actividad del LES, y las respuestas al tratamiento pueden variar.
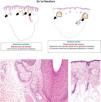
Marcadores histológicos emergentes en la alopecia no cicatricialLa glándula sebácea ha demostrado ser un marcador histológico útil para distinguir entre distintos tipos de alopecia. Por ejemplo, la alopecia psoriásica suele presentar un tamaño y un número reducidos de glándulas sebáceas, mientras que la alopecia areata, si bien muestra un recuento reducido, conserva un volumen normal de las glándulas sebáceas (fig. 2A). Sin embargo, estos cambios son difíciles de evaluar en biopsias pequeñas. En un estudio reciente se ha observado que las glándulas sebáceas de la alopecia psoriásica contienen predominantemente sebocitos inmaduros (fig. 2B), mientras que las de la alopecia areata están formadas principalmente por sebocitos maduros (fig. 2C)4. Aunque no es patognomónico, este hallazgo puede ayudar al diagnóstico.
A) Glándulas sebáceas en la alopecia psoriásica y la alopecia areata. En la alopecia psoriásica, las glándulas sebáceas muestran una reducción de tamaño y número, mientras que en la alopecia areata, el volumen medio de las glándulas sebáceas permanece inalterado con un volumen global reducido. B) Glándula sebácea en un ejemplo de alopecia psoriásica, con una mayor proporción de sebocitos inmaduros, caracterizados por un citoplasma más pequeño y basófilo y una menor vacuolización frente a los sebocitos maduros. C) Glándulas sebáceas en un ejemplo de alopecia areata. Las glándulas están compuestas predominantemente por sebocitos maduros con citoplasma pálido y vacuolado.
Otro marcador histológico importante son las células progenitoras. Las células madre del folículo piloso, localizadas en la protuberancia, generan células progenitoras CD34 positivas en la vaina radicular externa, contribuyendo así a la regeneración del folículo piloso durante la fase anágena (fig. 3A). En la alopecia androgenética, las células progenitoras CD34 positivas están ausentes (fig. 3B), mientras que son abundantes en la alopecia areata (fig. 3C)5-8.
A) Diagrama que ilustra la distribución de las células madre del folículo piloso (HFSC), localizadas principalmente en la protuberancia, así como de las células progenitoras, consideradas células germinales secundarias y progenie directa de las HFSC (localizadas a lo largo de la vaina radicular externa). Las células progenitoras son responsables de la formación de nuevos folículos pilosos en la fase anágena. Mientras que las células madre del folículo piloso son CD34−, las células progenitoras son CD34+. B) Tinción inmunohistoquímica para CD34 en un caso de alopecia androgenética, que muestra la ausencia de células progenitoras. C) Tinción inmunohistoquímica para CD34 en un caso de alopecia areata, que demuestra una fuerte expresión en la vaina radicular externa del folículo piloso.
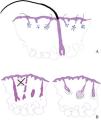
La alopecia areata refractaria con pelos aislados se ha reconocido como un subtipo distinto que clínicamente se asemeja a la alopecia frontal fibrosante9. Se presenta con una línea de implantación del cabello en retroceso, pelos aislados con el ostium borroso y folículos vacíos. El signo de «pelos sueltos» se refiere a los pelos terminales conservados en medio de un fondo de folículos miniaturizados (fig. 4A). Esta variante suele ser resistente a los tratamientos convencionales de la alopecia areata, con una respuesta limitada a los corticosteroides, la ciclosporina y el minoxidilo9,10.
A) Diagrama que muestra una explicación de los casos de alopecia areata de presentación clínica como alopecia areata refractaria con pelos únicos. En estos casos, se observa un pelo terminal aislado relativamente conservado en medio de una población de pelos miniaturizados afectados por la enfermedad. B) La variante granulomatosa de la alopecia areata no se define por la presencia de granulomas en ninguna localización de la biopsia. En cambio, los granulomas se localizan en el bulbo del folículo piloso.
La alopecia areata granulomatosa, descrita inicialmente en 2013, se ha establecido recientemente con mayor firmeza11. A diferencia de otras afecciones alopécicas con granulomas dérmicos, esta variante se define por granulomas que rodean los bulbos pilosos, el lugar característico de la inflamación en la alopecia areata (fig. 4B). Clínicamente, se presenta con alopecia en parches, eritema leve y una transición repentina de zonas normales a zonas dañadas del cuero cabelludo11-13.
Otros signos histopatológicos en algunas alopecias cicatriciales han llevado a la descripción de hallazgos tricoscópicos aparentemente patognomónicos. Este ha sido el caso del foliculotropismo de los linfocitos tumorales en la micosis fungoide, que se ha asociado a varios signos tricoscópicos interesantes descritos recientemente, como la presencia de numerosos pili torti, pelos en forma de 8 y tallos pilosos que se estrechan rápidamente en secciones largas14.
Hallazgos histopatológicos con implicaciones patogénicas y terapéuticasEstudios recientes sugieren que las vías patogénicas de la alopecia androgenética difieren entre hombres y mujeres15. Mientras que la pérdida de cabello de patrón masculino implica principalmente la miniaturización folicular, la alopecia de patrón femenino se caracteriza por una reducción del número de cabellos por unidad folicular. En la alopecia masculina avanzada, el mecanismo patogénico puede cambiar de la miniaturización folicular a la disminución de la densidad folicular.
Los mastocitos también se han implicado en la patogénesis de la alopecia areata16,17 (fig. 5). Las señales neuronales pueden estimular los mastocitos, desencadenando la actividad de los linfocitos citotóxicos CD8+, que impulsa la respuesta inflamatoria en la alopecia areata (fig. 5). Dirigirse a los mastocitos podría ofrecer nuevas vías terapéuticas.
En la alopecia areata pediátrica, el tratamiento es difícil debido a la falta de terapias aprobadas para niños. En un caso reciente se describe el tratamiento satisfactorio de una niña de 9 años con alopecia areata y vitíligo con upadacitinib y terapia UVB de banda estrecha18,19.
Otro aspecto terapéutico que considerar en las alopecias no cicatriciales se refiere a las formas alopécicas que pueden crecer debido a procedimientos estéticos20. Son ejemplos de alopecias no cicatriciales diversas formas de estas, y los mecanismos patogénicos implicados son variados. Por ejemplo, una inyección excesiva de relleno de ácido hialurónico puede causar alopecia inducida por presión.
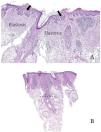
Alopecia tardía y exposición al solEn la alopecia avanzada, la exposición crónica al sol puede provocar queratosis actínicas en el cuero cabelludo, aumentando así el riesgo de carcinoma de células escamosas21. Aunque las queratosis actínicas suelen evitar las unidades pilosebáceas, observaciones recientes indican que puede producirse una afectación folicular (fig. 6A y B). Cuando está presente, debe documentarse la profundidad de la invasión folicular, ya que la extensión al tercio inferior del folículo se asocia con un riesgo del 100% de progresión a carcinoma escamoso invasivo22 (fig. 6B).
A) Ejemplo típico de queratosis actínica que afecta a la epidermis pero no al folículo piloso. Se observa una elastosis solar prominente en la dermis. B) Ejemplo de queratosis actínica que afecta al folículo piloso. En estos casos, es importante incluir en el informe la profundidad de la afectación folicular.
A pesar de la clasificación establecida desde hace tiempo de la alopecia en tipos cicatriciales y no cicatriciales, los recientes descubrimientos histopatológicos están impulsando revisiones de los criterios diagnósticos tradicionales. Siguen apareciendo nuevas variantes de alopecia con distintas implicaciones pronósticas y terapéuticas, lo que pone de manifiesto la naturaleza evolutiva de la enfermedad de la alopecia y su relevancia clínica.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.