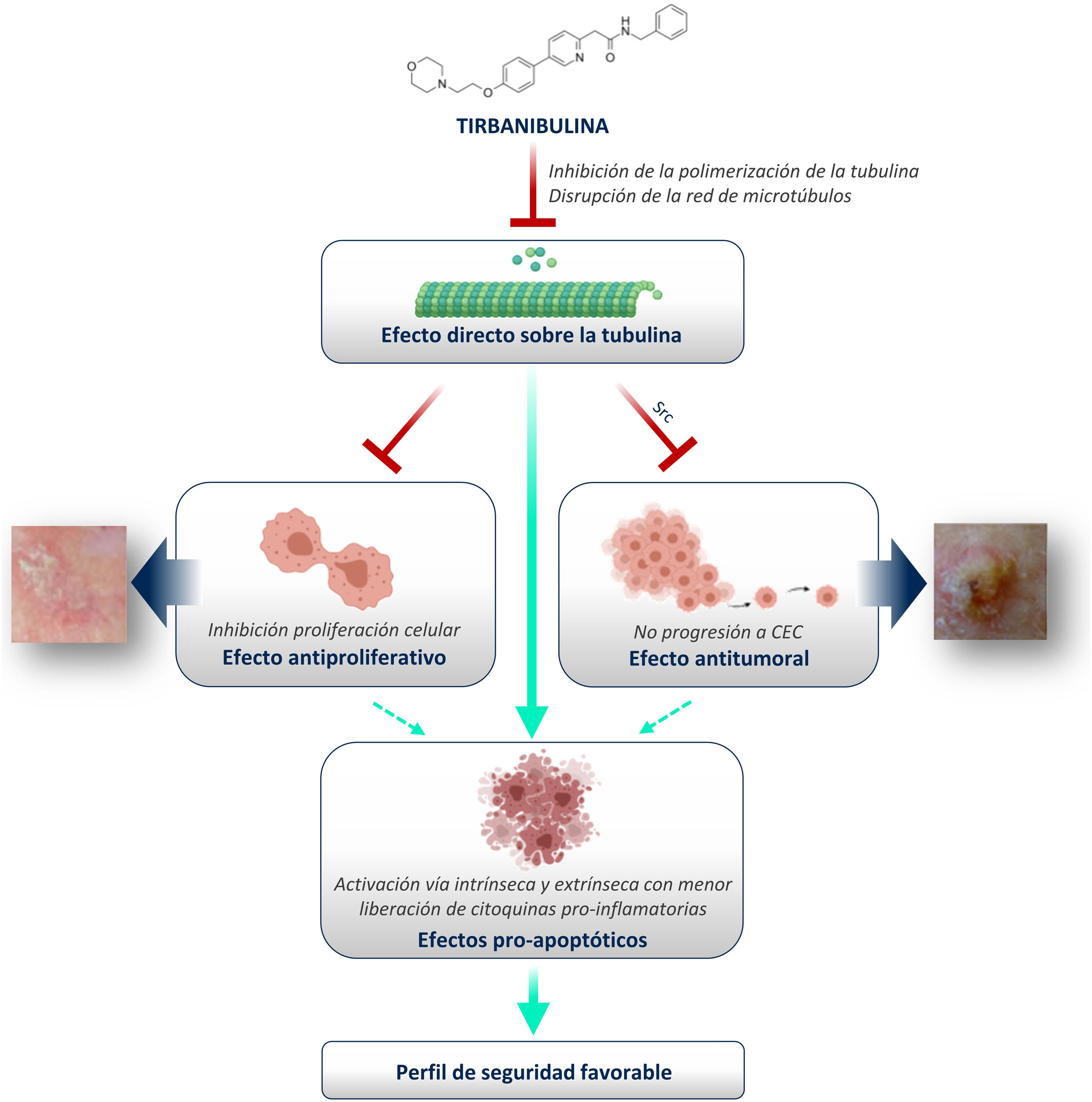
La queratosis actínica (QA) es una afección cutánea caracterizada por la proliferación de queratinocitos mutados que pueden convertirse en carcinoma escamoso cutáneo. Las terapias disponibles, aunque efectivas, están asociadas con una alta frecuencia de reacciones cutáneas locales graves. Tirbanibulina, uno de los tratamientos para la QA actualmente en desarrollo, es un nuevo fármaco sintético de origen químico con potentes efectos antiproliferativos y antitumorales in vitro e in vivo con eficacia probada en el tratamiento de la QA, demostrada recientemente en dos ensayos clínicos de faseIII. En la presente revisión se muestra el mecanismo de acción de tirbanibulina en base a la literatura relevante y los resultados de varios estudios preclínicos no publicados. Además, se plantea el escenario actual en cuanto a los tratamientos disponibles y cómo el mecanismo de acción novedoso de tirbanibulina encaja en el tratamiento de la QA.
Actinic keratosis (AK) is a skin condition characterized by the proliferation of mutated keratinocytes that can develop into squamous cell carcinoma. Available therapies, although effective, are associated with a high frequency of severe local skin reactions. Tirbanibulin, one of the treatments for AK currently in development, is a new synthetic chemical entity with anti-proliferative and anti-tumor effects, both in vitro and in vivo, with proved efficacy in the treatment of AK, which has been recently demonstrated in two phase III clinical trials. In the present review, the tirbanibulin mechanism of action, based on the relevant literature and the results of several unpublished preclinical studies, is shown. In addition, the current scenario regarding the available treatments and how the novel tirbanibulin mechanism of action fits into the treatment of AK is raised.
La queratosis actínica (QA) es una afección cutánea asociada con la exposición prolongada a la luz ultravioleta y caracterizada por la proliferación descontrolada de queratinocitos mutados que pueden convertirse en carcinoma escamoso cutáneo (CEC). Entre las alteraciones genéticas destacan las mutaciones del gen supresor tumoral p53, crucial para inducir la apoptosis en células dañadas1,2.
Tirbanibulina es un nuevo fármaco sintético de origen químico con potentes efectos antiproliferativos y antitumorales in vitro e in vivo3 que recientemente ha demostrado su eficacia en el tratamiento de la QA en dos ensayos clínicos de faseIII4.
A continuación se revisa el mecanismo de acción de tirbanibulina, destacando la literatura relevante y los resultados de los estudios preclínicos. Además, se muestra cómo este mecanismo de acción novedoso encaja en el tratamiento de la QA junto a los tratamientos disponibles actualmente.
Inhibición de la polimerización de la tubulinaMediante estudios de fotoafinidad y de unión competitiva in vitro con tubulina purificada y aglutinantes de tubulina (colchicina, vincristina, docetaxel), se identificaron las tubulinasα yβ como diana principal de tirbanibulina.
La tubulina es una proteína estructural que participa en la migración celular, el transporte de proteínas y la división celular. La importancia funcional de la unión de tirbanibulina a la tubulina radica en que inhibe la polimerización de la tubulina de manera reversible y dependiente de la concentración; la reversibilidad de la unión hace que los efectos celulares también sean reversibles, lo que explicaría la baja toxicidad de tirbanibulina5.
Disrupción de la red de microtúbulosMediante estudios de inmunofluorescencia se demostró que tirbanibulina produce la disrupción de la red de microtúbulos in vitro en células de cáncer de ovario (RMUS-S y RMUG-L), de mama (MDA-MB-231), de próstata (PC3), células mononucleares de sangre periférica (PBMC) y queratinocitos inmortalizados (CCD-1106 KERTr)3,5-7. También se observó que al eliminar tirbanibulina del cultivo celular, las estructuras filamentosas de tubulina se restablecían6.
In vivo, en diferentes tejidos tumorales de modelos murinos se objetivaron patrones de tinción similares a los obtenidos in vitro con células tumorales en comparación con los del grupo control7,8.
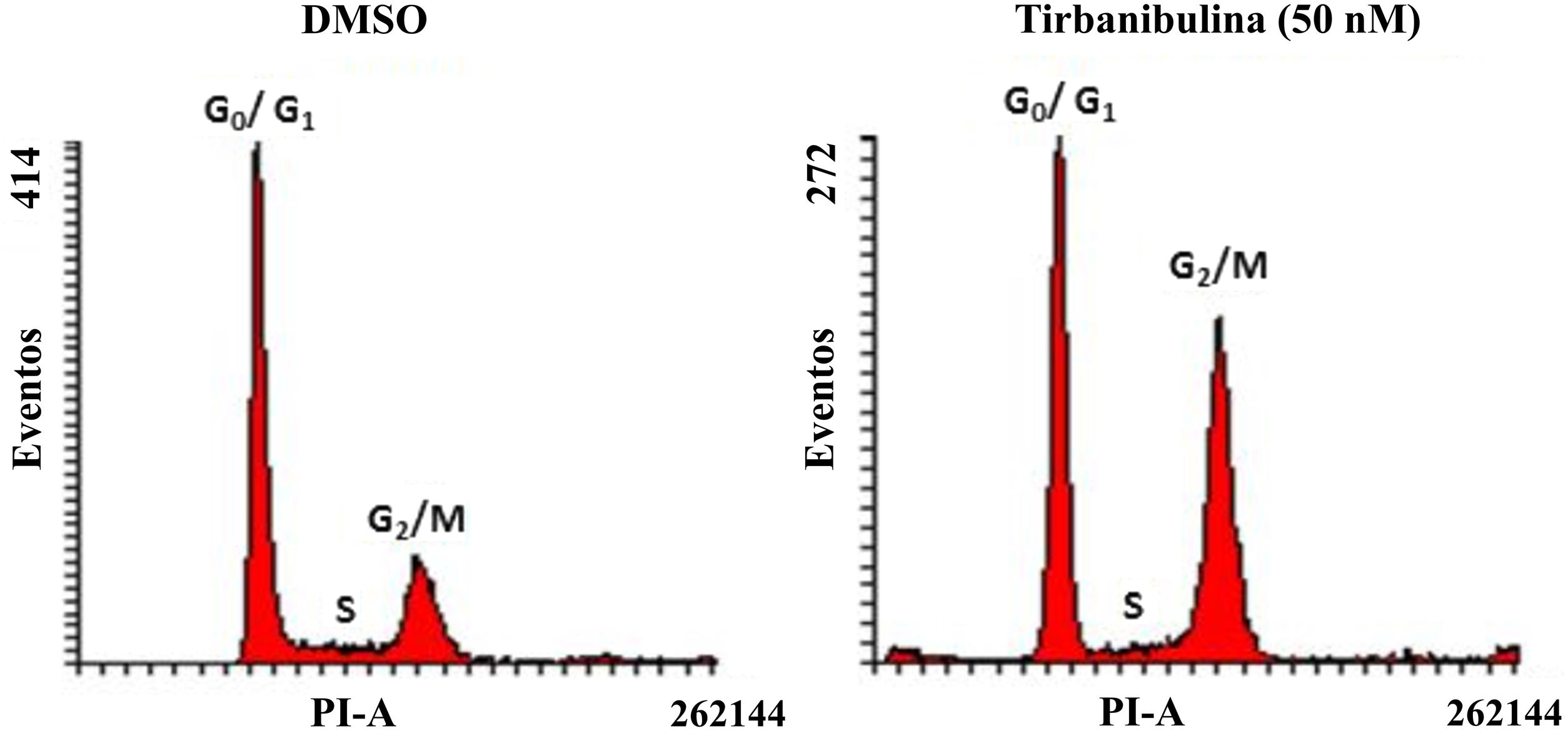
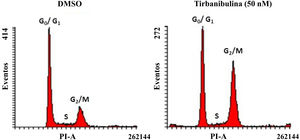
Detención del ciclo celularTras incubar células CCD-1106 KERTr con tirbanibulina y compararlas con la misma línea celular incubada con dimetilsulfóxido (DMSO) como control, el análisis del ciclo celular por citometría de flujo indicó que tirbanibulina conduce a la detención del ciclo celular en la interfase de crecimiento2 y mitosis (G2/M) (fig. 1). Resultados similares se obtuvieron en PBMC y líneas celulares de cáncer de mama, cuello uterino, próstata, hígado y pulmón3,5,9. Al final de la interfase del ciclo celular es cuando los microtúbulos llevan todo el material genético a cada polo para finalizar la división celular10. Es en este punto cuando ocurre el efecto principal de tirbanibulina deteniendo el ciclo celular.
Detención del ciclo celular en la fase de crecimiento 2/mitosis en la línea celular de queratinocitos inmortalizados (CCD-1106 KERTr).
Células CCD-1106 KERTr fueron incubadas con DMSO o tirbanibulina (50nM) durante 40h. Las células fueron permeabilizadas y teñidas con yoduro de propidio para analizarlas posteriormente mediante citometría de flujo.
DMSO: dimetilsulfóxido; G0/G1: fase de crecimiento 0/fase de crecimiento 1; G2/M: fase de crecimiento 2/mitosis; PI: yoduro de propidio.
Fuente: estudio ATNXUS-KX01-001.
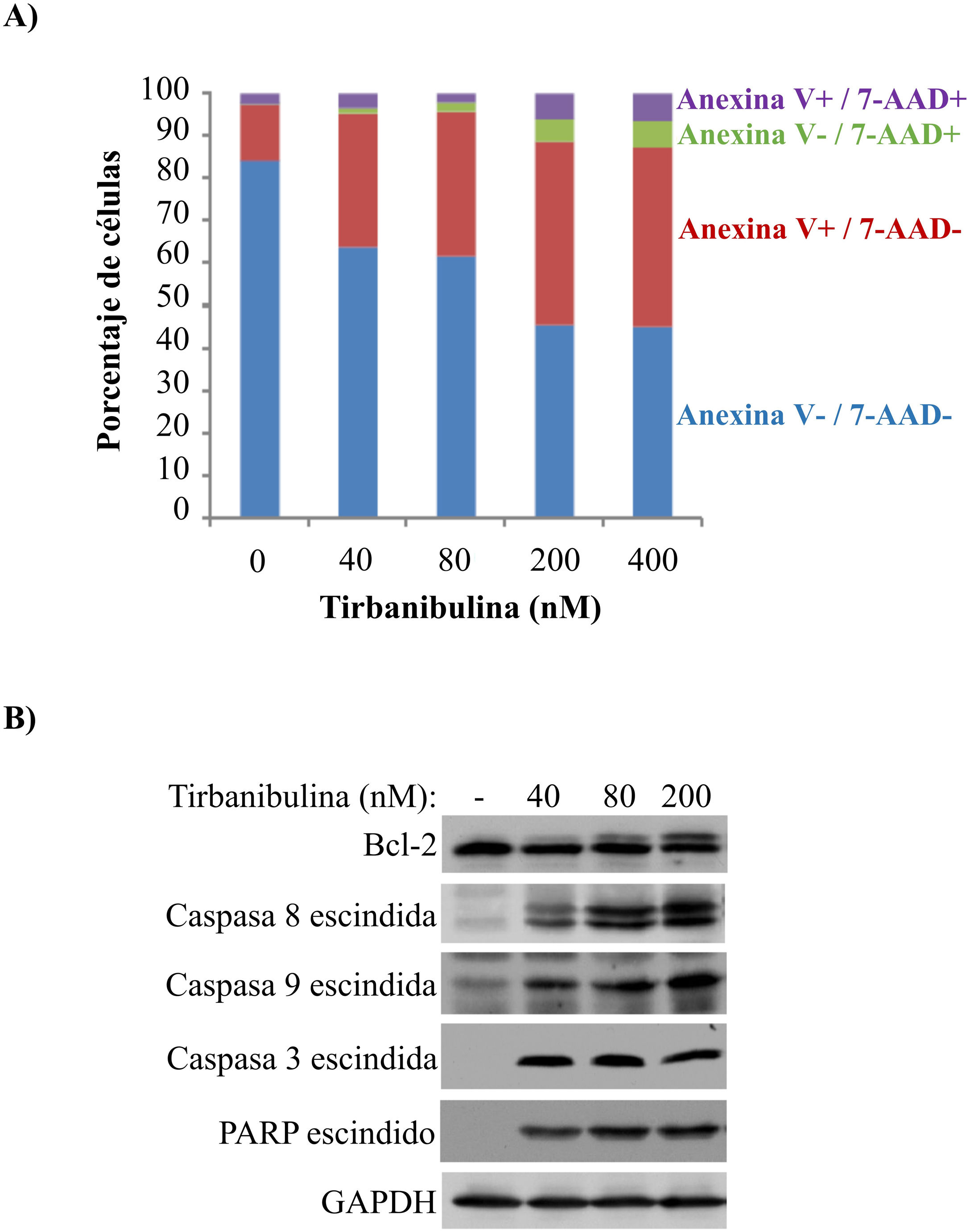
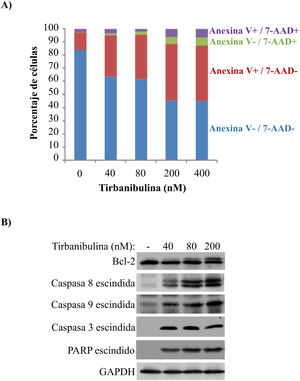
El tratamiento in vitro de la línea celular PC3-LN4 con tirbanibulina indujo la apoptosis temprana, como lo indica la tinción positiva de anexinaV; la tinción adicional con 7-aminoactinomicinaD representa células en apoptosis tardía o necrosis (fig. 2A).
Inducción de la apoptosis en células de cáncer de próstata (PC3-LN4).
A) Análisis mediante citometría de flujo de células PC3-LN4 teñidas con anexinaV y 7-AAD después de tratarlas con tirbanibulina en diferentes concentraciones durante 48h.
B) Análisis inmunoblot de células PC3-LN4 lisadas después de 24h de tratamiento con tirbanibulina.
7-AAD: 7-aminoactinomicina; GADPH: gliceraldehido-3-fosfatasa deshidrogenasa; PARP: inhibidor de la polimerasa poli (ADP-ribosa).
Fuente: estudio ATNXUS-KX01-001.
Además, mediante análisis inmunoblot se observó que el tratamiento con tirbanibulina condujo a la hiperfosforilación de Bcl-2, escisión de las caspasas 8 y 9, activación de la caspasa3 y posterior escisión del inhibidor de la polimerasa poli (ADP-ribosa) (fig. 2B). Esto mostraría que tirbanibulina activa la cascada intrínseca y extrínseca de señales de la apoptosis.
Estos efectos pro-apoptóticos también se observaron in vivo en modelos de xenoinjertos en ratón de diversos tumores3,7,8.
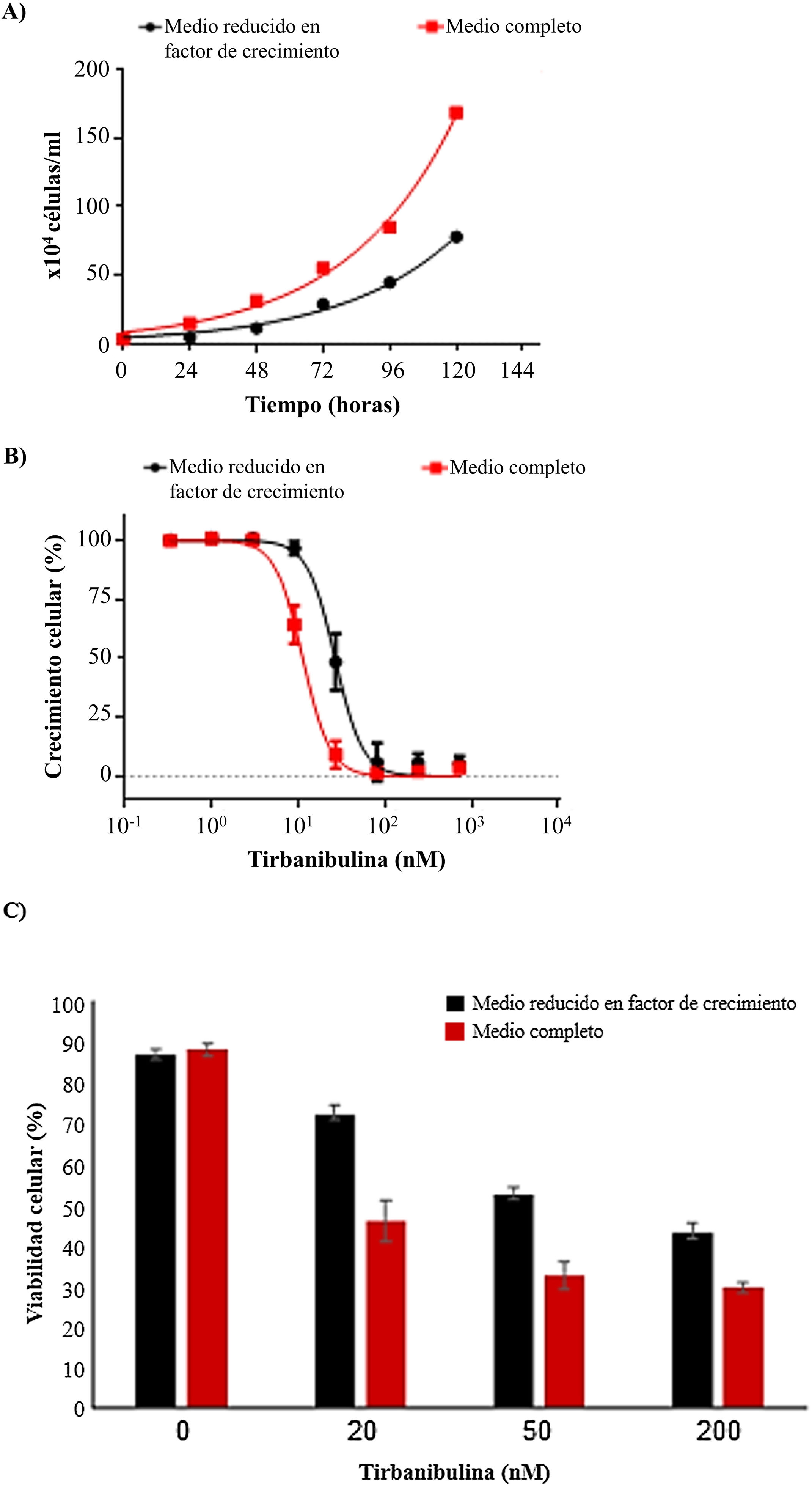
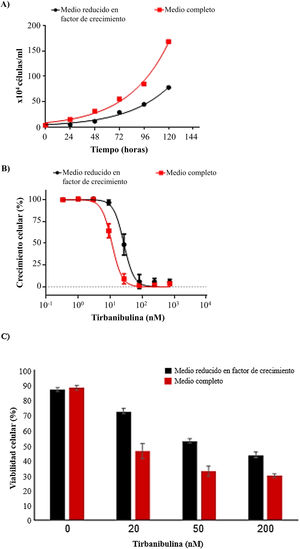
Inhibición del crecimiento celular y actividad antiproliferativaEn un experimento de crecimiento celular se estudió el efecto de tirbanibulina en cultivos celulares de queratinocitos (CCD-1106 KERTr) en un medio de cultivo completo y un medio reducido en factor de crecimiento (fig. 3A). Después de incubar ambos cultivos de queratinocitos con diversas concentraciones de tirbanibulina durante 72h (fig. 3B) se observó una mayor eficacia de tirbanibulina en la inhibición del crecimiento celular e inducción de la muerte celular en las células de crecimiento rápido (medio completo) en comparación con las células de crecimiento lento (medio reducido) (fig. 3C); la concentración de fármaco a la que se alcanzó el 50% de la inhibición del crecimiento celular (CI50) fue de 11nM frente a 27nM (p<0,0001, prueba t de Student).
Inducción de la inhibición del crecimiento celular y muerte celular en queratinocitos inmortalizados (CCD-1106 KERTr).
A) Se cultivaron queratinocitos inmortalizados CCD-1106 KERTr en medio completo o medio reducido en factor de crecimiento (5% del medio completo) y se contaron en varios tiempos de incubación. B) Las células CCD-1106 KERTr se trataron con diferentes concentraciones de tirbanibulina y se incubaron en medio de cultivo completo o medio reducido en factor de crecimiento durante 72h, después se realizó un análisis MTT; o C) Tinción con azul tripán; media±DE del porcentaje de viabilidad celular.
DE: desviación estándar; MTT: bromuro de 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolio.
Fuente: estudio ATNXUS-KX01-001.
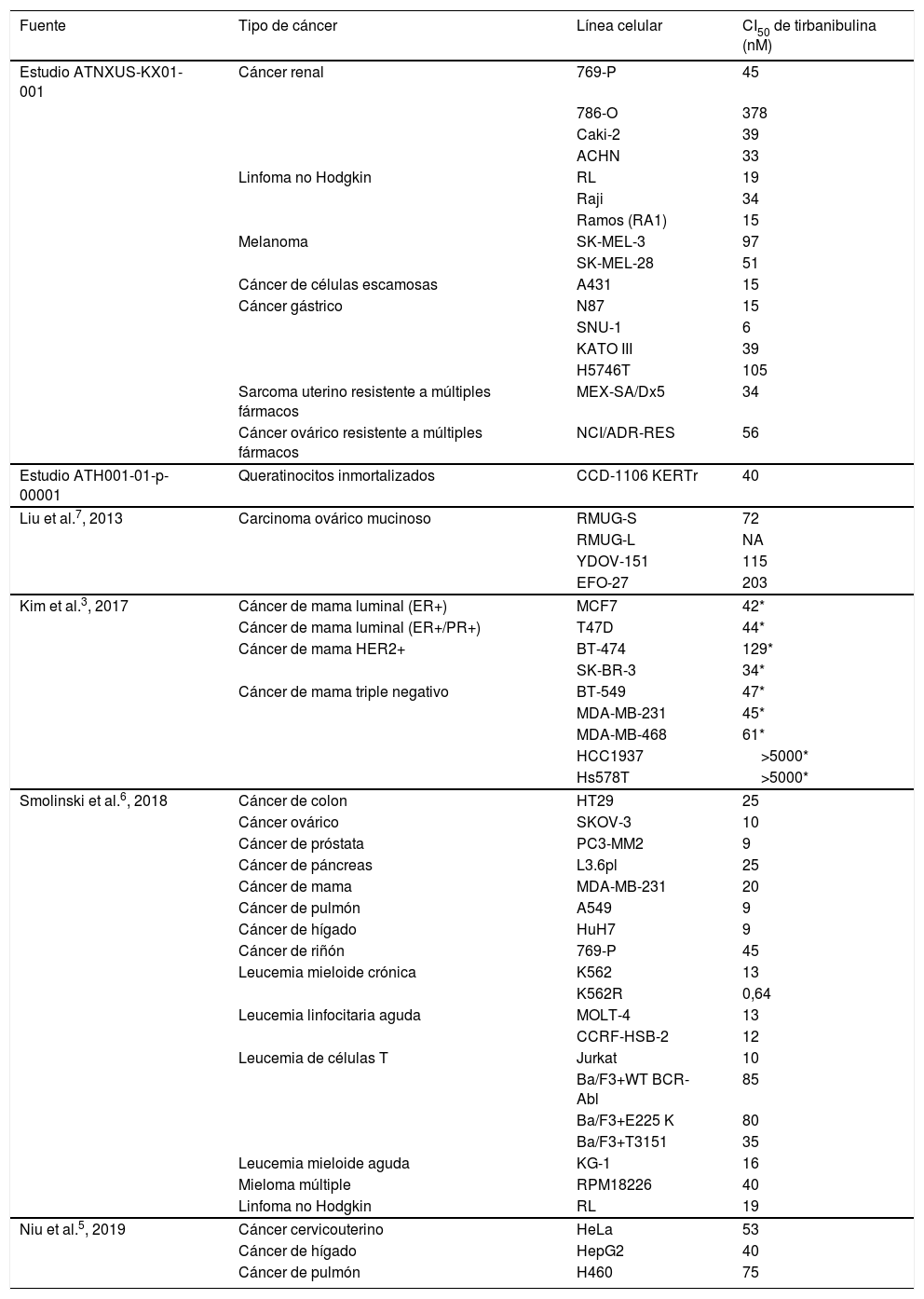
Mediante varios estudios se ha detectado una potente actividad antiproliferativa de tirbanibulina en varias líneas celulares cancerígenas que incluyen CEC, melanoma y células cancerosas resistentes a múltiples fármacos. La potencia antiproliferativa de tirbanibulina mediante la CI50 se muestra en la tabla 1.
Potencia de tirbanibulina en diferentes líneas celulares tumorales
| Fuente | Tipo de cáncer | Línea celular | CI50 de tirbanibulina (nM) |
|---|---|---|---|
| Estudio ATNXUS-KX01-001 | Cáncer renal | 769-P | 45 |
| 786-O | 378 | ||
| Caki-2 | 39 | ||
| ACHN | 33 | ||
| Linfoma no Hodgkin | RL | 19 | |
| Raji | 34 | ||
| Ramos (RA1) | 15 | ||
| Melanoma | SK-MEL-3 | 97 | |
| SK-MEL-28 | 51 | ||
| Cáncer de células escamosas | A431 | 15 | |
| Cáncer gástrico | N87 | 15 | |
| SNU-1 | 6 | ||
| KATO III | 39 | ||
| H5746T | 105 | ||
| Sarcoma uterino resistente a múltiples fármacos | MEX-SA/Dx5 | 34 | |
| Cáncer ovárico resistente a múltiples fármacos | NCI/ADR-RES | 56 | |
| Estudio ATH001-01-p-00001 | Queratinocitos inmortalizados | CCD-1106 KERTr | 40 |
| Liu et al.7, 2013 | Carcinoma ovárico mucinoso | RMUG-S | 72 |
| RMUG-L | NA | ||
| YDOV-151 | 115 | ||
| EFO-27 | 203 | ||
| Kim et al.3, 2017 | Cáncer de mama luminal (ER+) | MCF7 | 42* |
| Cáncer de mama luminal (ER+/PR+) | T47D | 44* | |
| Cáncer de mama HER2+ | BT-474 | 129* | |
| SK-BR-3 | 34* | ||
| Cáncer de mama triple negativo | BT-549 | 47* | |
| MDA-MB-231 | 45* | ||
| MDA-MB-468 | 61* | ||
| HCC1937 | >5000* | ||
| Hs578T | >5000* | ||
| Smolinski et al.6, 2018 | Cáncer de colon | HT29 | 25 |
| Cáncer ovárico | SKOV-3 | 10 | |
| Cáncer de próstata | PC3-MM2 | 9 | |
| Cáncer de páncreas | L3.6pl | 25 | |
| Cáncer de mama | MDA-MB-231 | 20 | |
| Cáncer de pulmón | A549 | 9 | |
| Cáncer de hígado | HuH7 | 9 | |
| Cáncer de riñón | 769-P | 45 | |
| Leucemia mieloide crónica | K562 | 13 | |
| K562R | 0,64 | ||
| Leucemia linfocitaria aguda | MOLT-4 | 13 | |
| CCRF-HSB-2 | 12 | ||
| Leucemia de células T | Jurkat | 10 | |
| Ba/F3+WT BCR-Abl | 85 | ||
| Ba/F3+E225 K | 80 | ||
| Ba/F3+T3151 | 35 | ||
| Leucemia mieloide aguda | KG-1 | 16 | |
| Mieloma múltiple | RPM18226 | 40 | |
| Linfoma no Hodgkin | RL | 19 | |
| Niu et al.5, 2019 | Cáncer cervicouterino | HeLa | 53 |
| Cáncer de hígado | HepG2 | 40 | |
| Cáncer de pulmón | H460 | 75 |
CI50: concentración inhibitoria 50 (concentración del fármaco que inhibe la proliferación celular en un 50%); ER: receptor de estrógeno; HER2: receptor del factor de crecimiento epidérmico humano tipo 2; PR: receptor de progesterona.
La actividad antiproliferativa de tirbanibulina observada in vitro se traduce en eficacia antitumoral in vivo. En modelos de xenoinjerto en ratón de cáncer de mama (células MDA-MB-231) y carcinoma ovárico mucinoso (células RMUG-S y RMUG-L), tirbanibulina retrasó eficazmente el crecimiento tumoral, se asoció con la disminución de la expresión del marcador de proliferación Ki67 y con un aumento de los niveles de células apoptóticas3,7.
Además, en un modelo murino de cáncer de próstata humano (células PC-3MM2GL), tirbanibulina mostró eficacia en la supresión del crecimiento tumoral tanto a nivel primario como a nivel metastásico. El peso medio del tumor se redujo significativamente en los grupos tratados con tirbanibulina (dosis de 5 y 10mg/kg) en comparación con el control (1,16 y 0,35 frente a 2,27g, respectivamente); el número de metástasis en los ganglios linfáticos disminuyó en los grupos tratados con tirbanibulina (5 y 10mg/kg) en comparación con el control (4/5 y 2/5 frente a 5/5, respectivamente). Otros estudios también mostraron inhibición del crecimiento tumoral dependiente de la dosis de tirbanibulina administrada en modelos de xenoinjertos en ratón de cáncer de mama (células MCF-7 y MDA-MB-231)8,9. Estos resultados estarían relacionados con la rotura de los microtúbulos, la desregulación de G2/M, la mitosis anormal y, en última instancia, la apoptosis.
Disrupción de la señalización SrcTanto en QA como en CEC se ha observado una mayor expresión de la tirosina quinasa Src y algunas evidencias sugieren que es necesaria una mayor señalización por parte de Src para la alteración de los hemidesmosomas, la migración de queratinocitos y la invasión del CEC11,12. Asimismo, se ha observado un aumento en la expresión de Src en tejidos metastásicos, varios tumores epiteliales, trastornos epidérmicos hiperproliferativos y lesiones premalignas, además de constatar que Src está involucrada en la angiogénesis y la estimulación del factor de crecimiento epitelial vascular8,9,13-15. Por lo tanto, la prevalencia del aumento de Src en neoplasias sugiere que esta proteína puede desempeñar un papel importante en la progresión de muchos tumores, mostrándola como una buena candidata a molécula diana de los posibles tratamientos16.
Además del efecto desencadenado por la inhibición de la polimerización de la tubulina, los estudios publicados han demostrado que la exposición a tirbanibulina de varias líneas de células cancerosas y xenoinjertos de tumores humanos en ratones da como resultado la rápida disminución de los niveles de Src fosforilado y/o sus sustratos, mostrando que tirbanibulina también interrumpe la señalización de Src3,8,9.
Aun así, Src no se identificó como un objetivo directo para la unión de tirbanibulina en un estudio diseñado para medir las interacciones de tirbanibulina con más de 450 quinasas humanas y variantes mutantes relevantes. Por otra parte, se ha demostrado que la red de microtúbulos regula la Src activa mediante el tráfico intracelular de Src17. Todos estos datos sugieren que tirbanibulina disminuye la actividad de Src a través de la interrupción indirecta de la señalización de Src, probablemente debido a la disrupción de la red de microtúbulos que perturba las vías de señalización celular, incluidas las que regulan el tráfico y la expresión de Src.
Necrosis, inflamación y toxicidadAlgunos fármacos utilizados en el tratamiento de la QA, como por ejemplo 5-fluorouracilo, inducen la producción de citoquinas proinflamatorias, como el factor de necrosis tumoral (TNF)-α y la interleucina (IL)-8, que pueden provocar reacciones cutáneas locales (LSRs) adversas18. Un estudio preclínico investigó cómo la incubación de los queratinocitos CCD-1106 KERTr con tirbanibulina durante 24h pudo influir en la liberación de citoquinas proinflamatorias. Los resultados mostraron que la incubación con tirbanibulina indujo solo un ligero aumento de IL-8 a la dosis más alta, en comparación con el aumento moderado de TNF-α e IL-8 provocado por 5-fluorouracilo. Además, tirbanibulina mostró un aumento significativo de IL-1α, un marcador de muerte celular, en comparación con el control DMSO y 5-fluorouracilo19. Estos datos sugieren que es menos probable que tirbanibulina induzca una fuerte respuesta de citoquinas proinflamatorias en comparación con 5-fluorouracilo, lo que posiblemente conduce a una reducción de la gravedad de las LSRs.
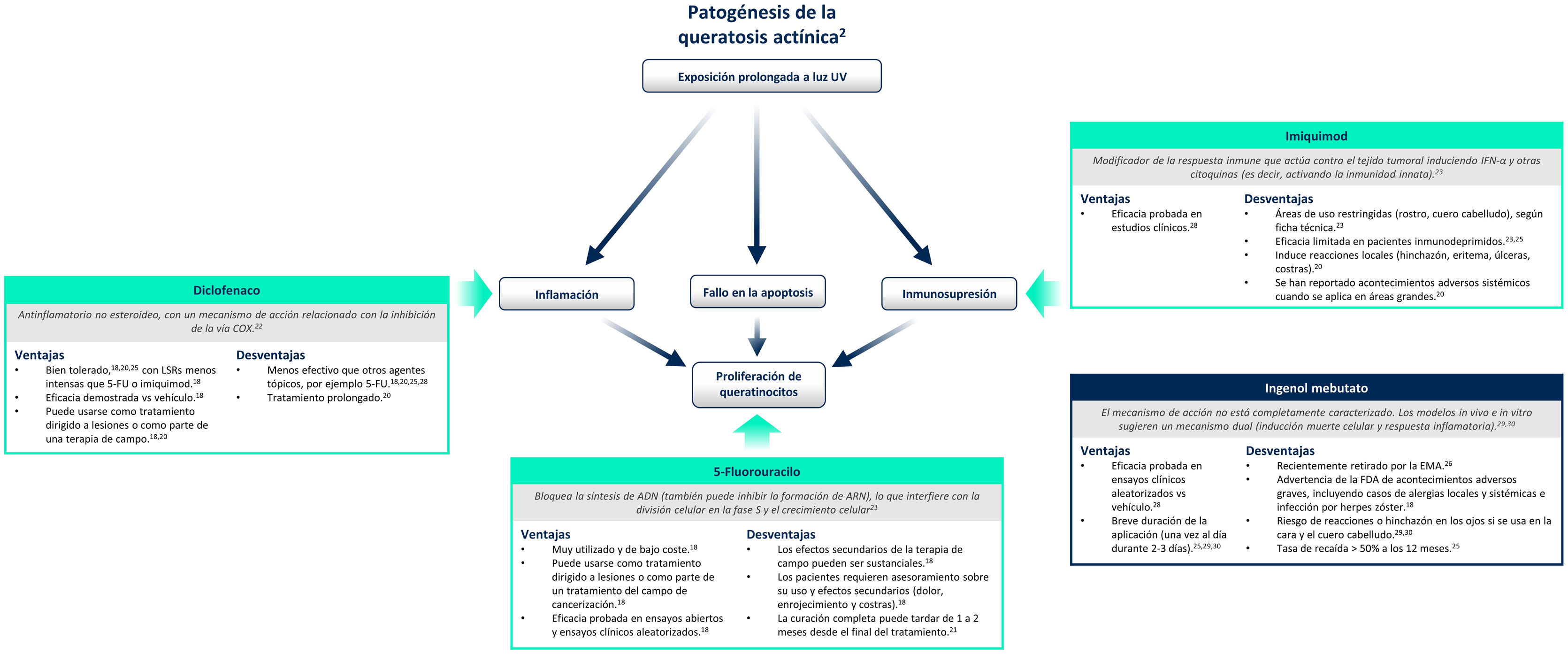
Tratamientos tópicos para la queratosis actínica disponibles actualmenteActualmente, los principales tratamientos tópicos disponibles son 5-fluorouracilo, diclofenaco e imiquimod. Recientemente ingenol mebutato ha sido retirado por la Agencia Europea de Medicamentos18,20.
La figura 4 resume el mecanismo de acción de cada tratamiento y sus ventajas/desventajas en el contexto de las implicaciones moleculares que supone una exposición prolongada a luz ultravioleta2. 5-fluorouracilo (0,5% 5-fluorouracilo/10% ácido salicílico) es un inhibidor de la síntesis de ADN/ARN que induce la apoptosis en células que se dividen rápidamente20; el tratamiento es aplicado por el propio paciente diariamente durante un período de hasta 12semanas21. Diclofenaco (3%) es un fármaco antiinflamatorio no esteroideo que inhibe la ciclooxigenasa-2, reduciendo la angiogénesis y la proliferación celular; debe aplicarse dos veces al día durante 60-90 días22. Imiquimod (5% o 3,75%) es un estimulador del sistema inmunológico innato que induce la producción de interferones y varias citoquinas con un efecto apoptótico directo sobre las células tumorales23,24; el tratamiento es aplicado por el paciente tres veces por semana durante 4semanas23,24. Ingenol mebutato es un compuesto biológico extraído de la planta Euphorbia peplus cuyo mecanismo de acción no está del todo caracterizado25. Parece tener un mecanismo de acción dual: uno es la inducción de la necrosis en las células displásicas y el otro, la estimulación de una respuesta inmune mediada por neutrófilos20. Sin embargo, tras una revisión de la seguridad del medicamento realizada por la Agencia Europea de Medicamentos, el uso de ingenol mebutato para el tratamiento de la QA no está autorizado en la Unión Europea desde 202026. En uno de los estudios de dicha revisión se observó una mayor incidencia de CEC en el área tratada con ingenol mebutato en comparación con imiquimod en un seguimiento de 3años (3,3% frente a 0,4%)26.
Tratamientos para la queratosis actínica en la actualidad.
ADN: ácido desoxirribonucleico; ARN: ácido ribonucleico; COX: ciclooxigenasa; EMA: Agencia Europea de Medicamentos; FDA: Food and Drug Administration, Administración de Alimentos y Medicamentos de Estados Unidos; FU: fluorouracilo; IFN-α: interferón alfa; LSRs: reacciones cutáneas locales; UV, ultravioleta28,29,30.
Algunas de estas terapias, aunque efectivas, a menudo se asocian con una alta frecuencia de LSRs graves (irritación de la piel, erosiones, ulceraciones, edema, costras, picor), cambios irreversibles (pigmentación de la piel, cicatrices) y con baja frecuencia acontecimientos adversos sistémicos18,20,25. Si además tenemos en cuenta que las terapias prolongadas pueden reducir el cumplimiento del tratamiento y afectar al éxito del mismo, se pone de manifiesto que existe la necesidad de encontrar terapias adecuadas con una duración de uso más corta, que se puedan utilizar en una amplia área cutánea y que tengan efectos secundarios locales leves en la piel27. Actualmente hay seis tratamientos para la QA en desarrollo en ensayos clínicos de faseII oIII, y uno de ellos es tirbanibulina20.
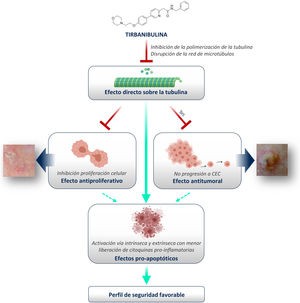
¿Cómo encaja el mecanismo de acción novedoso de tirbanibulina en el tratamiento de la queratosis actínica?Como se ha mostrado anteriormente, tirbanibulina supone un nuevo mecanismo de acción en el tratamiento de la QA, con potentes efectos antiproliferativos y antitumorales in vitro e in vivo, debido a su capacidad para inducir la detención del ciclo celular y la muerte celular apoptótica (fig. 5). Dado que la QA, como condición precancerosa de la piel, está formada por queratinocitos displásicos y con hiperproliferación celular, tirbanibulina representa un buen candidato terapéutico.
En los ensayos de faseIII, un total de 702 pacientes con QA en la cara o cuero cabelludo fueron asignados aleatoriamente a pomada de tirbanibulina 1% (n=353) o placebo (n=349). Tirbanibulina cumplió el criterio de valoración primario tras el aclaramiento completo de las lesiones tratadas a día 57 en ambos ensayos de faseIII. En el primer ensayo, el aclaramiento completo ocurrió en el 44% de los pacientes del grupo de tirbanibulina y en únicamente el 5% del grupo placebo (diferencia, 40 puntos de porcentaje; intervalo de confianza del 95% [IC95%], 32-47; p<0,001). En el segundo ensayo los porcentajes fueron del 54 y del 13% en los grupos de tirbanibulina y placebo, respectivamente (diferencia, 42 puntos de porcentaje; IC95%, 33-51; p<0,001)4.
Cabe destacar que el tratamiento con tirbanibulina se aplica una vez al día durante únicamente 5días consecutivos sobre un campo de tratamiento de 25cm2 en cara o cuero cabelludo. Esta simplificación de la pauta posológica, en contraste con la complejidad de las otras terapias disponibles para QA, facilita la compleción del tratamiento con tirbanibulina por parte del paciente.
Además, a diferencia de otras terapias tópicas y debido principalmente a una menor liberación de citoquinas, tirbanibulina no parece inducir una necrosis y/o inflamación tisular sustancial, lo cual se traduce clínicamente en una buena tolerabilidad y un perfil de seguridad favorable.
ConclusionesTirbanibulina es un nuevo fármaco sintético de origen químico que ha demostrado una potente actividad antiproliferativa y antitumoral. Estos efectos se pueden atribuir a la capacidad de tirbanibulina para unirse a la tubulina, inhibiendo su polimerización y promoviendo la disrupción de los microtúbulos en las células, así como a la alteración de manera indirecta de la señalización de la tirosina quinasa Src.
Por todo ello, y dado que la QA se asocia con hiperproliferación celular, tirbanibulina representa una buena candidata para el tratamiento de la QA. Asimismo, su sencillo régimen posológico permite una mejor adherencia terapéutica. Finalmente, tirbanibulina no induce una liberación pronunciada de citoquinas proinflamatorias en los queratinocitos in vitro, en contraste con otros tratamientos para la QA como 5-fluorouracilo, lo que se relaciona con una buena tolerabilidad y un perfil de seguridad favorable en la práctica clínica.
FinanciaciónAthenex Inc., Buffalo, NY, EE. UU., ha proporcionado financiación económica para la realización de la investigación. Almirall S.A., Barcelona, ha proporcionado financiación económica para la preparación del artículo.
Conflicto de interesesY. Gilaberte ha actuado como consultora para los laboratorios Almirall, Isdin, Roche Posay, Abbvie, Lilly, Sanofi y Pfizer, ha recibido becas para investigación de Galderma, Vichy, Sanofi y Almirall, y ha participado como ponente para Galderma, Roche Posay, Isdin, Avene, Cantabria Labs y Rilastil.
M.T. Fernández-Figueras ha recibido becas de Leo Pharma y Almirall, y ha participado como ponente para Almirall, Galderma, Leo Pharma, Novartis y Roche.
Los autores agradecen a Irene Mansilla, MSc, Eva Mateu, PhD, y Paula Casajust, MSc, de TFS S.L., su apoyo en la elaboración del manuscrito.