Roflumilast es un inhibidor de la fosfodiesterasa-4 aprobado de forma oral para la prevención de exacerbaciones en pacientes con enfermedad pulmonar obstructiva crónica y fenotipo de bronquitis crónica. En dermatología, el roflumilast tópico está aprobado por la Food and Drug Administration en psoriasis en placas y dermatitis seborreica leve/moderada. En cuanto a su uso fuera de indicación, hemos encontrado un ensayo clínico que avala la utilidad del roflumilast oral en psoriasis, así como pequeñas series de casos o casos clínicos aislados en hidradenitis supurativa, aftosis oral recurrente, eccema numular, liquen plano y enfermedad de Behçet. Su perfil de seguridad es favorable, similar al del apremilast, y su coste es considerablemente inferior a los de los fármacos de nueva generación, o incluso al de algunos inmunosupresores clásicos. Presentamos una revisión de roflumilast tópico y oral, en términos de farmacocinética y farmacodinámica, efectos adversos, usos dermatológicos aprobados y fuera de indicación. Roflumilast es un agente prometedor en dermatología.
Oral roflumilast is a phosphodiesterase-4 inhibitor approved for the prevention of exacerbations of chronic obstructive pulmonary disease and chronic bronchitis. In dermatology, topical roflumilast is authorized by the US Food and Drug Administration for the treatment of plaque psoriasis and mild to moderate seborrheic dermatitis. Several studies have described the off-label use of roflumilast in dermatology, including a randomized controlled trial showing its usefulness in the treatment of psoriasis; case reports and small series have also reported successful outcomes in hidradenitis suppurativa, recurrent oral aphthosis, nummular eczema, lichen planus, and Behçet disease. Roflumilast has a favorable safety profile, similar to that of apremilast, and it is considerably cheaper than new generation drugs and even some conventional immunosuppressants. We review the pharmacokinetics and pharmacodynamics of topical and oral roflumilast and discuss potential adverse effects and both approved and off-label uses in dermatology. Roflumilast is a promising agent to consider.
La llegada de los fármacos biológicos y moléculas pequeñas han revolucionado el manejo de múltiples dermatosis inflamatorias como la psoriasis, la dermatitis atópica, la hidradenitis supurativa y la alopecia areata, entre otras. Sin embargo, su alto coste supone una limitación significativa, especialmente cuando se requiere su uso fuera de indicación1.
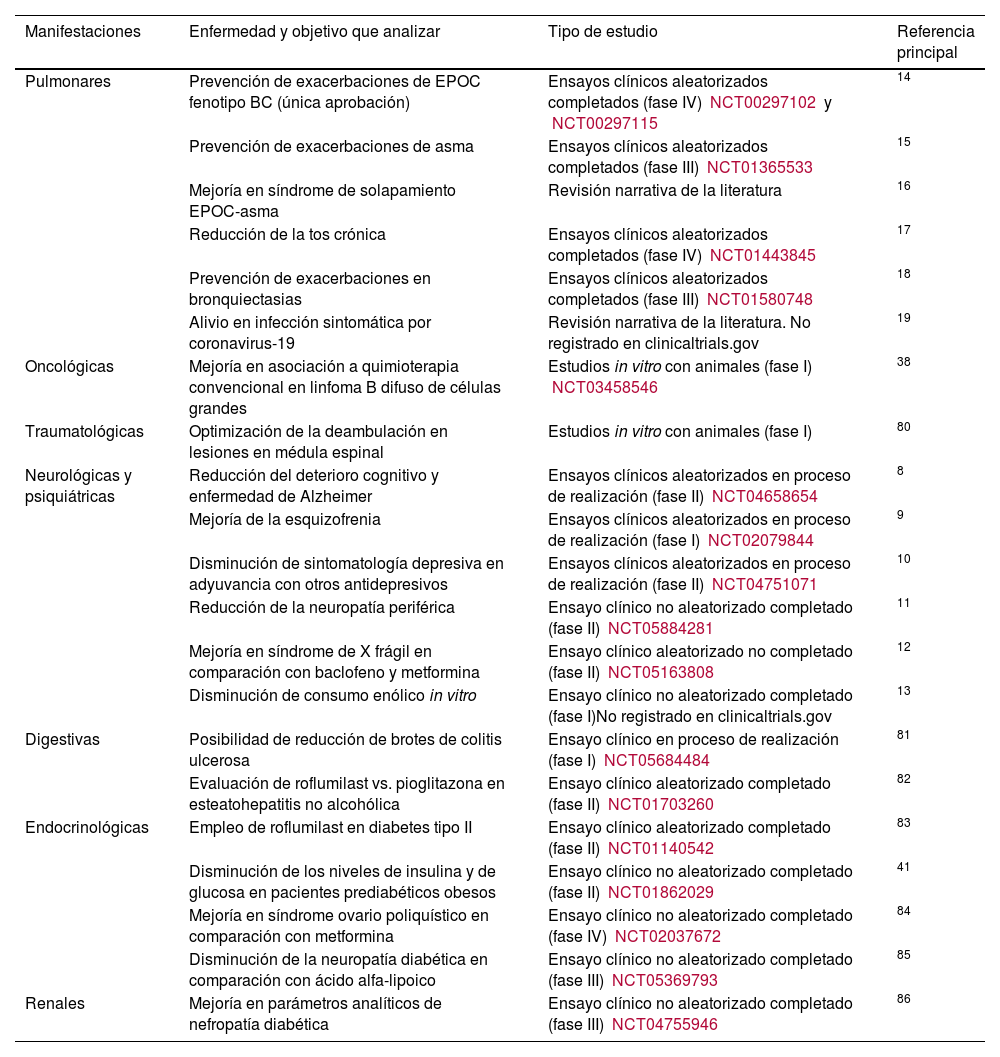
Apremilast, es un inhibidor oral de la enzima fosfodiesterasa-4 (PDE4), de efecto inmunomodulador y no inmunosupresor, aprobado por la Food and Drug Administration (FDA) en psoriasis2, artritis psoriásica y en el tratamiento de las úlceras orales de la enfermedad de Behcet3. Presenta un excelente perfil de seguridad, y se ha utilizado exitosamente fuera de indicación en múltiples dermatosis3. El crisaborol es un inhibidor tópico de PDE4 aprobado en dermatitis atópica4. Roflumilast es otro inhibidor de PDE4 (IPDE4). Su forma oral fue inicialmente aprobada por la Agencia Europea de Medicamentos (EMA) y por la FDA para reducir el riesgo de exacerbaciones de enfermedad pulmonar obstructiva crónica (EPOC) y fenotipo de bronquitis crónica5. El roflumilast tópico al 0,3% fue aprobado por la FDA en 2022 para el tratamiento de la psoriasis en placas en pacientes >12 años, constituyendo el primer inhibidor tópico de PDE4 aprobado en psoriasis en placas6. En abril de 2023, la FDA aprobó su uso tópico al 0,3% en dermatitis seborreica7. Debido a su excelente perfil de seguridad, facilidad posológica y a su bajo coste (el precio del roflumilast oral ronda los 35€ al mes en España), se ha utilizado este fármaco de forma oral en psoriasis en placas, aftosis oral recurrente, hidradenitis supurativa, eccema numular y liquen plano, entre otras dermatosis. Sus potenciales usos no solo se limitan al ámbito dermatológico, sino que se extienden al deterioro cognitivo, demencia, esquizofrenia y otras enfermedades neurológicas o psiquiátricas8–13, colitis ulcerosa, diabetes mellitus, obesidad y síndrome de ovario poliquístico, y al asma o en pacientes con bronquiectasias y fibrosis quística14–19 (tabla 1)8,38,80–86. En este artículo se revisa el mecanismo de acción, farmacocinética, perfil de seguridad a largo plazo y especialmente los usos fuera de indicación del roflumilast en dermatología. Así también, se discuten las enfermedades que potencialmente se podrían beneficiar de este fármaco, dado su mecanismo de acción análogo al de apremilast.
Usos del roflumilast en enfermedades no dermatológicas
| Manifestaciones | Enfermedad y objetivo que analizar | Tipo de estudio | Referencia principal |
|---|---|---|---|
| Pulmonares | Prevención de exacerbaciones de EPOC fenotipo BC (única aprobación) | Ensayos clínicos aleatorizados completados (fase IV) NCT00297102 y NCT00297115 | 14 |
| Prevención de exacerbaciones de asma | Ensayos clínicos aleatorizados completados (fase III) NCT01365533 | 15 | |
| Mejoría en síndrome de solapamiento EPOC-asma | Revisión narrativa de la literatura | 16 | |
| Reducción de la tos crónica | Ensayos clínicos aleatorizados completados (fase IV) NCT01443845 | 17 | |
| Prevención de exacerbaciones en bronquiectasias | Ensayos clínicos aleatorizados completados (fase III) NCT01580748 | 18 | |
| Alivio en infección sintomática por coronavirus-19 | Revisión narrativa de la literatura. No registrado en clinicaltrials.gov | 19 | |
| Oncológicas | Mejoría en asociación a quimioterapia convencional en linfoma B difuso de células grandes | Estudios in vitro con animales (fase I) NCT03458546 | 38 |
| Traumatológicas | Optimización de la deambulación en lesiones en médula espinal | Estudios in vitro con animales (fase I) | 80 |
| Neurológicas y psiquiátricas | Reducción del deterioro cognitivo y enfermedad de Alzheimer | Ensayos clínicos aleatorizados en proceso de realización (fase II) NCT04658654 | 8 |
| Mejoría de la esquizofrenia | Ensayos clínicos aleatorizados en proceso de realización (fase I) NCT02079844 | 9 | |
| Disminución de sintomatología depresiva en adyuvancia con otros antidepresivos | Ensayos clínicos aleatorizados en proceso de realización (fase II) NCT04751071 | 10 | |
| Reducción de la neuropatía periférica | Ensayo clínico no aleatorizado completado (fase II) NCT05884281 | 11 | |
| Mejoría en síndrome de X frágil en comparación con baclofeno y metformina | Ensayo clínico aleatorizado no completado (fase II) NCT05163808 | 12 | |
| Disminución de consumo enólico in vitro | Ensayo clínico no aleatorizado completado (fase I)No registrado en clinicaltrials.gov | 13 | |
| Digestivas | Posibilidad de reducción de brotes de colitis ulcerosa | Ensayo clínico en proceso de realización (fase I) NCT05684484 | 81 |
| Evaluación de roflumilast vs. pioglitazona en esteatohepatitis no alcohólica | Ensayo clínico aleatorizado completado (fase II) NCT01703260 | 82 | |
| Endocrinológicas | Empleo de roflumilast en diabetes tipo II | Ensayo clínico aleatorizado completado (fase II) NCT01140542 | 83 |
| Disminución de los niveles de insulina y de glucosa en pacientes prediabéticos obesos | Ensayo clínico no aleatorizado completado (fase II) NCT01862029 | 41 | |
| Mejoría en síndrome ovario poliquístico en comparación con metformina | Ensayo clínico no aleatorizado completado (fase IV) NCT02037672 | 84 | |
| Disminución de la neuropatía diabética en comparación con ácido alfa-lipoico | Ensayo clínico no aleatorizado completado (fase III) NCT05369793 | 85 | |
| Renales | Mejoría en parámetros analíticos de nefropatía diabética | Ensayo clínico no aleatorizado completado (fase III) NCT04755946 | 86 |
BC: bronquitis crónica; EPOC: enfermedad pulmonar obstructiva crónica.
Se realizó una revisión narrativa de la literatura. Durante mayo y junio de 2023 realizamos búsquedas en Medline y Google Scholar con los términos «roflumilast», «dermatología», «piel», «off-label», «seguridad», «apremilast», «fosfodiesterasa», «fosfodiesterasa 4», «psoriasis», «atopia», «dermatitis atópica», «eccema», «eccema de manos», «eccema numular», «úlceras», «úlceras orales», «estomatitis aftosa», «aftosis oral», «liquen plano», «dermatitis seborreica», «hidradenitis», «hidrosadenitis», «vitíligo», «alopecia areata», «sarcoidosis», «Behçet», «morfea». Se realizó esta búsqueda en castellano y en inglés. Los artículos se cribaron según su resumen y se seleccionaron según su relevancia tras la lectura de los estudios. Igualmente, se realizó una búsqueda con el término «roflumilast» en clinicaltrials.gov. Dos autores (MMP y DMC) realizaron la búsqueda y selección de los artículos.
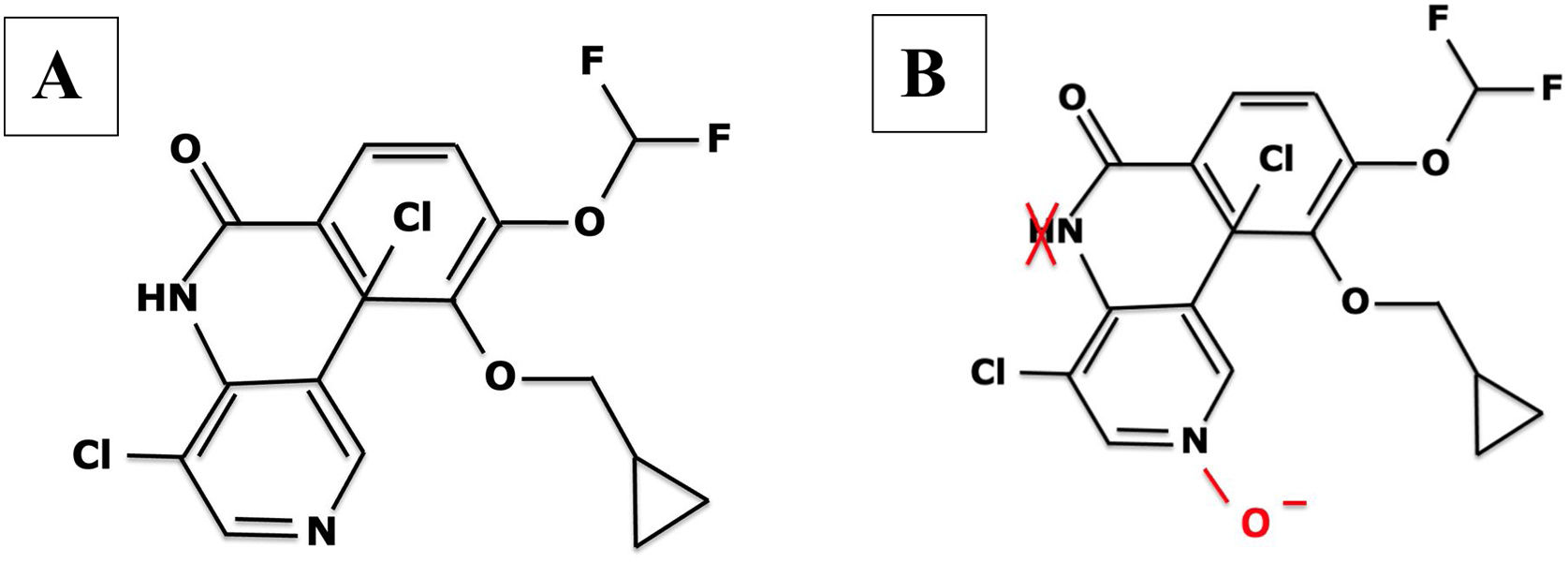
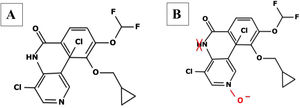
Farmacocinética y mecanismo de acción del roflumilastFarmacocinética (tabla 28,38,41,80–86)El roflumilast, al ser administrado por vía oral, se absorbe por completo en el tracto gastrointestinal y presenta una biodisponibilidad de aproximadamente el 80%, con una concentración plasmática máxima alcanzada a la hora después de su administración20 (tabla 2). En cuanto a su metabolismo, se realiza principalmente de forma hepática por los citocromos CYP1A2 y CYP3A4, los cuales transforman el compuesto inicial al metabolito activo roflumilast N-óxido (fig. 121), que representa >90% de la actividad inhibitoria total de roflumilast PDE422. Los metabolitos originales y activos de roflumilast se unen en gran medida a las proteínas plasmáticas (≥97%) y tienen un alto volumen de distribución, reflejando una penetración tisular significativa. No requiere ajuste posológico en la edad geriátrica o en insuficiencia renal. Los datos clínicos con roflumilast en pacientes con insuficiencia hepática leve de clase A según la escala Child-Pugh no son suficientes para recomendar un ajuste de dosis y por ello se debe utilizar con precaución en estos individuos, y está contraindicado en insuficiencia hepática moderada o severa23. El N-óxido de roflumilast tiene aproximadamente 10 veces más actividad que el fármaco original. La semivida plasmática de roflumilast y su metabolito activo es de 17 a 30h, respectivamente24. Su excreción es mayoritariamente renal. Su farmacocinética no se afecta por la ingesta de alimentos25, pero sí podría afectarse por fármacos inhibidores o inductores de CYP1A2 y CYP3A4, como eritromicina, fluconazol, claritromicina o rifampicina26. Se debe recomendar con anticoncepción en mujeres de edad fértil, evitando los anticonceptivos con gestodeno y etinilestradiol, por presentar un metabolismo compartido26.
Características del roflumilast
| Ítem | Roflumilast oral | Roflumilast tópico |
|---|---|---|
| Indicaciones aprobadas por la FDA | Prevención de exacerbaciones de EPOC fenotipo BC | Psoriasis en placasDermatitis seborreica |
| Farmacocinética | →Biodisponibilidad oral: 80% | →Posibilidad de absorción sistémica |
| →Vida media: entre 17 y 30h | →Vida media alrededor de 24h | |
| →Metabolismo: casi exclusivamente hepático. Conversión a metabolito activo N-óxido | →Metabolismo: casi exclusivamente hepático. Conversión a metabolito activo N-óxido | |
| →Excreción: 70% renal | →Excreción: cutánea y la porción absorbida sistémica, mayor parte renal | |
| Dosis | 250μg/día durante 28 días seguido de 500μg/día de mantenimiento | Aplicación de una capa fina en lesiones afectadas. Aprobado a concentración del 0,3% |
| Administración | Oral con o sin comida, con un poco de agua | Una aplicación (capa fina) al día. Evitar en región ocular, oral o intravaginal |
| Contraindicaciones | Hipersensibilidad al principio activo o alguno de sus excipientesa. Insuficiencia hepática moderada o grave (clase B o C según la escala Child-Pugh) | Hipersensibilidad al principio activo o alguno de sus excipientesa. Insuficiencia hepática moderada o grave (clase B o C según la escala Child-Pugh) |
| Interacciones farmacológicas | Principal metabolismo por citocromos CYP3A4 y CYP1A2. Puede requerir ajuste de dosis en pacientes con inductores o inhibidores de estos citocromos. El empleo de contracepción con gestodeno y etinilestradiol puede aumentar su toxicidadb | Principal metabolismo por citocromos CYP3A4 y CYP1A2. Puede requerir ajuste de dosis en pacientes con inductores o inhibidores de estos citocromos. El empleo de contracepción con gestodeno y etinilestradiol puede aumentar su toxicidadb |
| Ajuste en insuficiencia hepática | Precaución en insuficiencia hepática leve (clase A según la escala Child-Pugh) y contraindicado en insuficiencia hepática moderada o grave (clase B o C) | Precaución en insuficiencia hepática leve (clase A según la escala Child-Pugh) y contraindicado en insuficiencia hepática moderada o grave (clase B o C) |
| Ajuste en insuficiencia renal | No requiere de ajuste de dosis | No requiere de ajuste de dosis |
| Ajuste en edad avanzada | No requiere de ajuste de dosis | No requiere de ajuste de dosis |
| Embarazo | Los datos sobre el uso de roflumilast en mujeres embarazadas son limitados. Los estudios realizados en animales han mostrado toxicidad para la reproducción, por lo que no se recomienda su uso en embarazadas | Los datos sobre el uso de roflumilast en mujeres embarazadas son limitados. Los estudios realizados en animales han mostrado toxicidad para la reproducción, por lo que no se recomienda su uso en embarazadas |
| Anticoncepción | Las mujeres en edad fértil deben utilizar métodos anticonceptivos efectivos durante el tratamiento. Evitar gestodeno y etinilestradiolb | Podría considerarse si es preciso. Evitar gestodeno y etinilestradiolb |
| Lactancia | Los datos farmacocinéticos disponibles en animales muestran que roflumilast o sus metabolitos se excretan en la leche por lo que no se recomienda su uso en embarazadas | Posible. Evitar aplicación en región mamaria durante su aplicación |
| Pediátrica | Aprobado en ≥12 años. No hemos encontrado estudios que evalúen su eficacia en <12 años | Aprobado en ≥12 años. No estudios evalúen su eficacia en <12 años |
| Monitorización | Periódicas revisiones de cambios de peso y estado de ánimo (cada 3-6 meses). No especificación de realización de analítica durante el seguimiento por la FDA y la EMA. Recomendable analítica previa si se sospecha de insuficiencia hepática | Sin necesidad de monitorización |
BC: bronquitis crónica; EPOC: enfermedad pulmonar obstructiva crónica.
La farmacocinética de roflumilast tópico al 0,3% es similar a la del roflumilast oral, teniendo en cuenta la posibilidad de absorción sistémica. Tópicamente, presenta una biodisponibilidad de aproximadamente el 1,5%. Tras la aplicación de entre 3 a 6,5g diarios durante 15 días, presentó una exposición media de 72,7±53,1 y 628±648h ng/ml7,27.
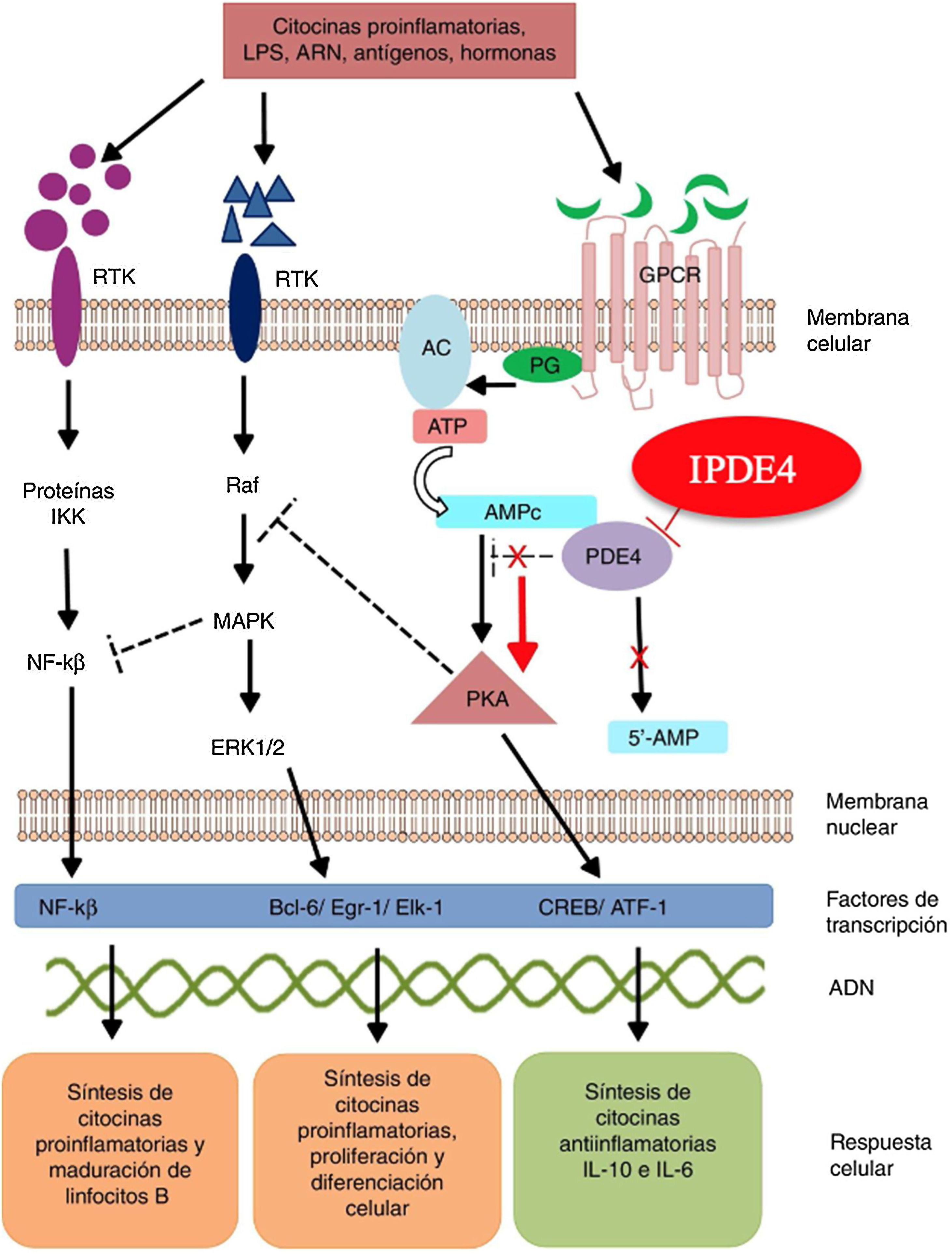
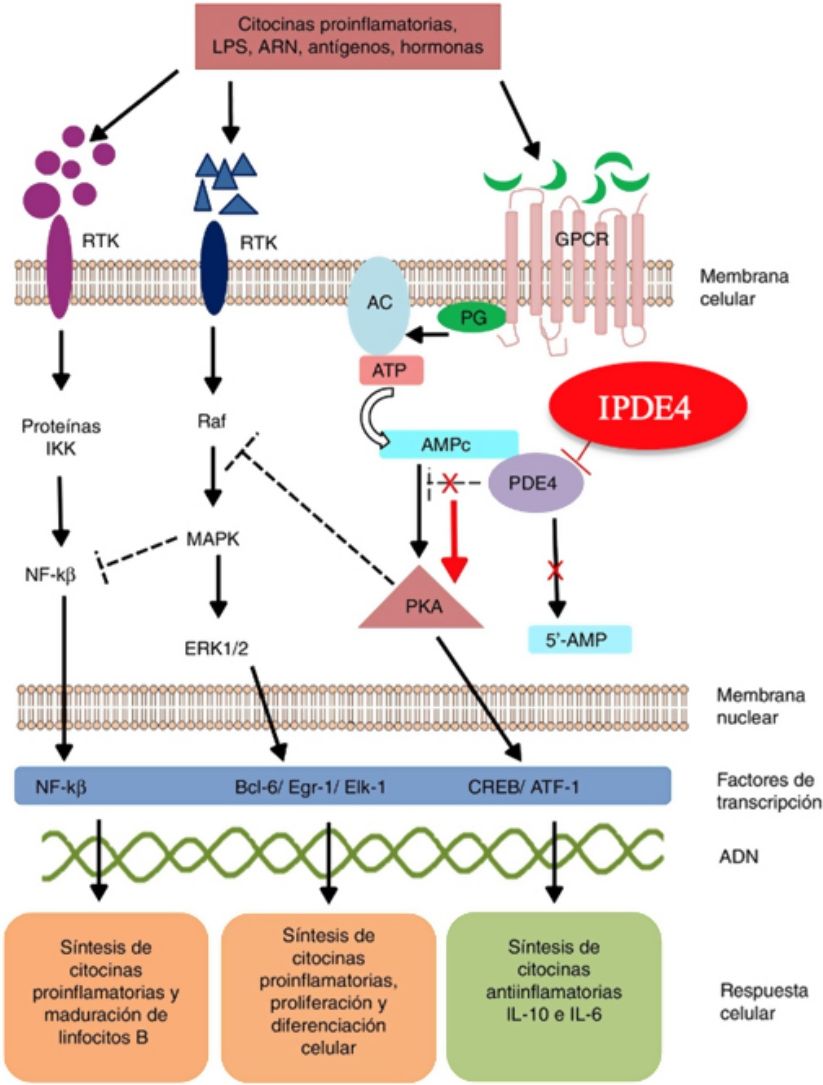
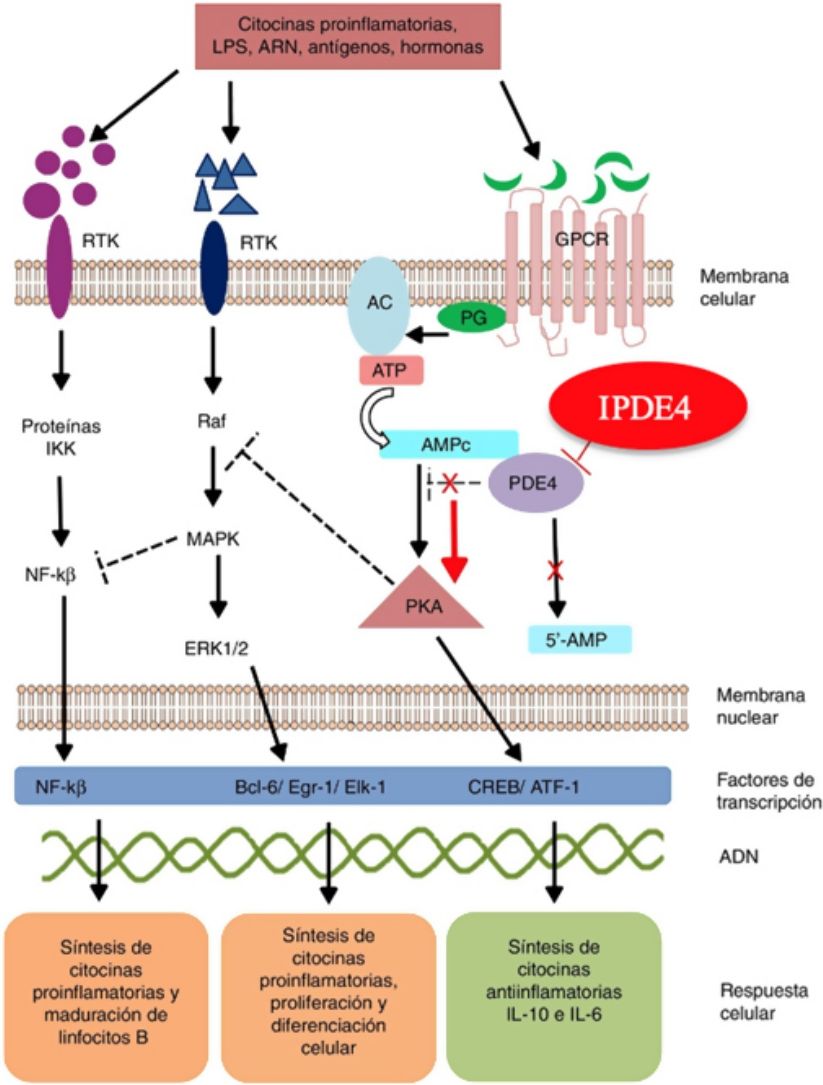
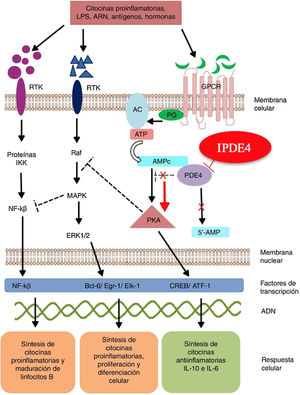
Mecanismo de acción y farmacodinámicaEl mecanismo de acción preciso de roflumilast no es bien conocido (fig. 234). El roflumilast y su metabolito activo, el roflumilast N-óxido, son IPDE4, una de las principales enzimas metabolizadoras del monofosfato de adenosina cíclica (AMPc), localizada tanto en el tejido pulmonar como en la piel, en el corazón, en los riñones, en el tracto gastrointestinal y en el sistema nervioso28. A nivel celular, PDE4 convierte el AMPc en monofosfato de adenosina (AMP), poniendo fin a la mensajería celular iniciada por el AMPc29. El roflumilast bloquea el efecto de PDE4, produciendo acumulación de AMPc en las células diana e incremento de señalización mediada por esta molécula. Esto da lugar a inhibición de la quimiotaxis, reducción de la infiltración inflamatoria, de la liberación de mediadores inflamatorios y citotóxicos, y de la inflamación en general30. En dermatología, PDE4 está presente en los queratinocitos epidérmicos, neutrófilos, células de Langerhans y linfocitos T31. Además, se han encontrado altos niveles de PDE4 en células mononucleares de sangre periférica de pacientes con psoriasis, así como alteraciones en la señalización del ATP32. La efectividad de roflumilast se fundamenta en la inhibición de múltiples vías inflamatorias, ejerciendo una acción tanto a nivel epidérmico en los queratinocitos y las células de Langerhans como a nivel dérmico en los neutrófilos, los linfocitos T y los macrófagos30,33. En dermatitis atópica, la hiperactivación de PDE4 induce una respuesta inflamatoria con polarización hacia la vía Th231,33. De forma específica, el AMPc presenta acciones inmunosupresoras y antiinflamatorias mediadas en gran parte por el factor nuclear-κß, clave para la acción de múltiples citoquinas, entre ellas el factor de necrosis tumoral alfa (TNF-α) o las interleucinas (IL) 1, 2, 8, 12, 18, 23, 27 o 3634,35. Las múltiples vías de señalización mediadas por PDE4 sugieren que su bloqueo puede ser útil en el manejo de múltiples dermatosis, como la hidradenitis supurativa, estomatitis aftosa recurrente o liquen plano3.
Mecanismo de acción de roflumilast. Los inhibidores de la fosfodiesterasa inducen una acumulación del AMPc intracelular al interferir con su degradación. El aumento de la concentración intracelular de AMPc da lugar a una inhibición de la quimiotaxis, a una menor infiltración inflamatoria, una disminución de la liberación de mediadores inflamatorios y citotóxicos, reduciendo así la inflamación.
AC: adenilato ciclasa; 5’-AMP: 5’-adenylic acid; ATF: activating transcription factor 1; ATP: adenosín trifosfato; Bcl-6: B-cell lymphoma protein 6; c-AMP: cyclic adenosine monophosphate; CREB: cAMP responsive element; Egr-1: early growth response protein 1; Elk-1: E-26-like protein 1; ERK: extracellular signal-regulated kinase; GPCR: G protein-coupled receptors; IKK: inhibitor of nuclear factor kappa-B kinase subunit beta; MAPK: mitogen-activated protein kinases; NFKB: nuclear factor KB; PDE4: phosphodiesterase type 4; PG: G protein; PKA: protein kinase A; Raf: rapidly accelerated fibrosarcoma protein kinases; RTK: receptor tyrosine kinases; IPDE-4: inhibitor of phosphodiesterase type 4.
En general, roflumilast es bien tolerado y presenta un excelente perfil de seguridad24 (tabla 3). En los ensayos clínicos (EC) con roflumilast en EPOC y bronquitis crónica, los efectos adversos (EA) más frecuentes fueron la diarrea (8-9%), la pérdida de peso (6-12%) y las náuseas (5%). Se reportó un 5-8% de casos de nasofaringitis y un 4% de infecciones del tracto respiratorio superior, aunque de forma similar al grupo placebo. Los EA se produjeron principalmente en las primeras semanas de tratamiento y la mayoría fueron autolimitados28. Un metaanálisis reportó una mayor tasa de EA en el grupo de roflumilast 500μg/día vs. placebo36. Un 15% suspendió el tratamiento por EA (vs. el 9% con placebo). Los motivos más frecuentes para retirar el fármaco fueron la diarrea y las náuseas28. Estos primeros análisis, reportaron además mayores tasas de pancreatitis aguda, síntomas psiquiátricos e incluso cáncer de próstata, pulmonar y colorrectal37. Sin embargo, estos primeros datos no pudieron ser comprobados posteriormente e incluso se ha propuesto su uso como adyuvante en el tratamiento de diversas neoplasias, como las pulmonares o el linfoma B difuso de células grandes38,39.
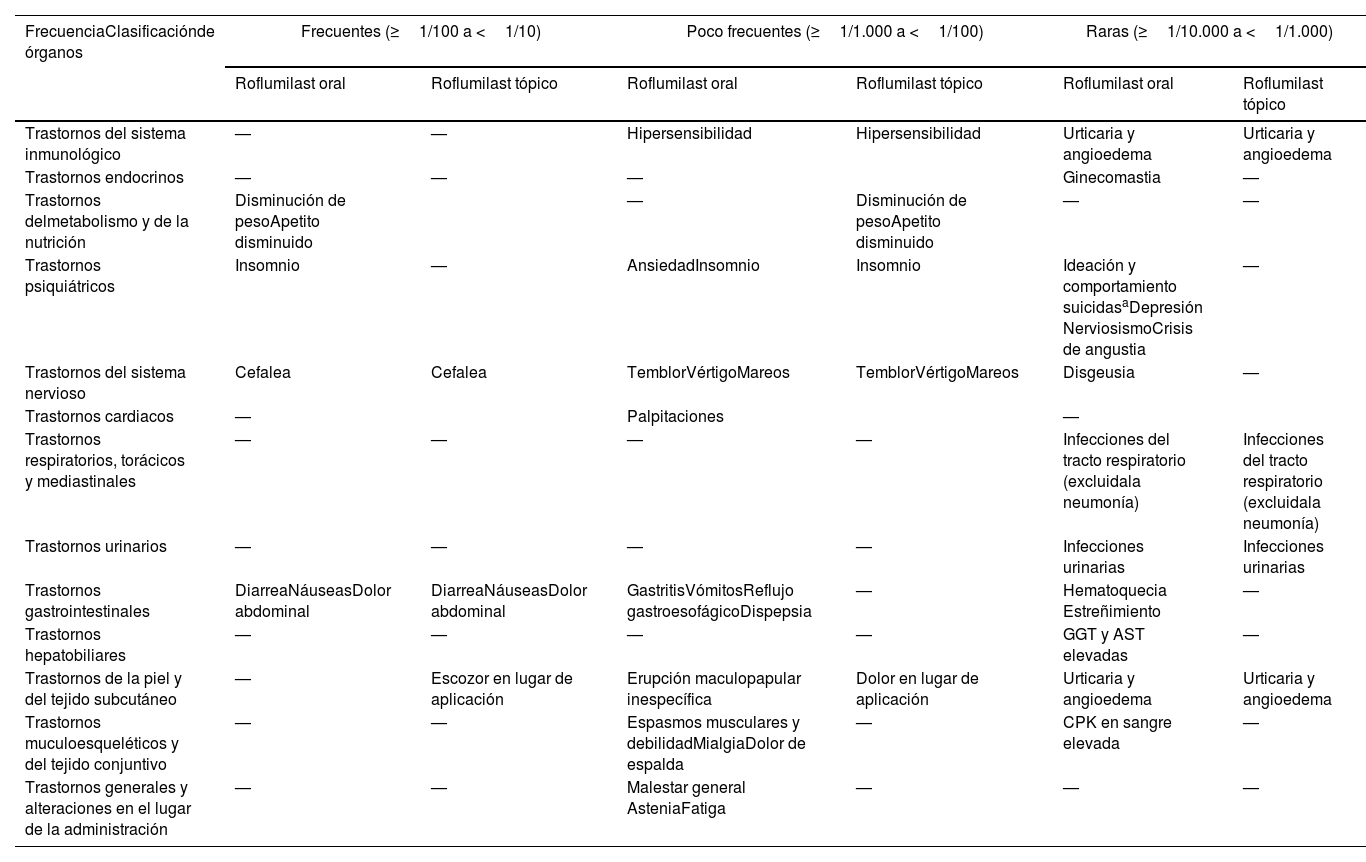
Efectos adversos descritos de roflumilast
| FrecuenciaClasificaciónde órganos | Frecuentes (≥1/100 a <1/10) | Poco frecuentes (≥1/1.000 a <1/100) | Raras (≥1/10.000 a <1/1.000) | |||
|---|---|---|---|---|---|---|
| Roflumilast oral | Roflumilast tópico | Roflumilast oral | Roflumilast tópico | Roflumilast oral | Roflumilast tópico | |
| Trastornos del sistema inmunológico | — | — | Hipersensibilidad | Hipersensibilidad | Urticaria y angioedema | Urticaria y angioedema |
| Trastornos endocrinos | — | — | — | Ginecomastia | — | |
| Trastornos delmetabolismo y de la nutrición | Disminución de pesoApetito disminuido | — | Disminución de pesoApetito disminuido | — | — | |
| Trastornos psiquiátricos | Insomnio | — | AnsiedadInsomnio | Insomnio | Ideación y comportamiento suicidasaDepresión NerviosismoCrisis de angustia | — |
| Trastornos del sistema nervioso | Cefalea | Cefalea | TemblorVértigoMareos | TemblorVértigoMareos | Disgeusia | — |
| Trastornos cardiacos | — | Palpitaciones | — | |||
| Trastornos respiratorios, torácicos y mediastinales | — | — | — | — | Infecciones del tracto respiratorio (excluidala neumonía) | Infecciones del tracto respiratorio (excluidala neumonía) |
| Trastornos urinarios | — | — | — | — | Infecciones urinarias | Infecciones urinarias |
| Trastornos gastrointestinales | DiarreaNáuseasDolor abdominal | DiarreaNáuseasDolor abdominal | GastritisVómitosReflujo gastroesofágicoDispepsia | — | Hematoquecia Estreñimiento | — |
| Trastornos hepatobiliares | — | — | — | — | GGT y AST elevadas | — |
| Trastornos de la piel y del tejido subcutáneo | — | Escozor en lugar de aplicación | Erupción maculopapular inespecífica | Dolor en lugar de aplicación | Urticaria y angioedema | Urticaria y angioedema |
| Trastornos muculoesqueléticos y del tejido conjuntivo | — | — | Espasmos musculares y debilidadMialgiaDolor de espalda | — | CPK en sangre elevada | — |
| Trastornos generales y alteraciones en el lugar de la administración | — | — | Malestar general AsteniaFatiga | — | — | — |
—: no descritas o reportes anecdóticos; AST: aspartato-aminotransferasa; CPK: creatina fosfoquinasa GGT: gamma-glutamiltransferasa.
En los ensayos clínicos y en la vigilancia tras la comercialización se notificaron casos infrecuentes de ideación y comportamiento suicida incluyendo suicidio37,43.
En relación con la pérdida de peso, su incidencia fue casi el doble (67,4 vs. 37,7%) en el grupo de roflumilast, y la pérdida de peso importante, definida como >10% sobre el peso basal, fue encontrada en el 7,1% del grupo de tratamiento vs. 1,9% en el grupo control37, y estuvo asociada a una mejoría del perfil metabólico glucídico y constituye un arma terapéutica potencial para la obesidad, la resistencia a la insulina y el síndrome metabólico40,41. Los síntomas psiquiátricos incluidos en los primeros estudios fueron la ansiedad, la depresión y el insomnio28. Sin embargo, estudios posteriores han evidenciado que este riesgo es mínimo e incluso podría constituir un fármaco prometedor para el tratamiento del deterioro cognitivo, la enfermedad de Alzheimer o la esquizofrenia8,10,42. Por último, se ha cuestionado la mayor incidencia de fibrilación auricular en pacientes con roflumilast oral. Este hecho se basa en su mayor incidencia en el grupo de roflumilast oral (n=24) vs. placebo (n=9) en ensayos pre-comercialización. Sin embargo, posteriormente no ha podido comprobarse en práctica clínica real. Además, los resultados de la monitorización del electrocardiograma Holter de 24h de 55 pacientes no demostraron diferencias entre los grupos en la frecuencia cardiaca ni en la aparición de arritmias43.
Los datos de seguridad a largo plazo con los IPDE4 y, específicamente con roflumilast, son igualmente favorables sin reportar nuevos EA ni EA acumulativos44,45. Tampoco se han descrito en enfermedades con más experiencia con este fármaco como es el EPOC46. Actualmente se encuentra en marcha un EC para evaluar la seguridad de roflumilast oral a largo plazo en la EPOC47.
Los datos de seguridad con roflumilast tópico son igualmente favorables, con EA graves excepcionales dada su mínima absorción (biodisponibilidad del 1-2%). Los más frecuentes son diarrea (3-4%) y cefalea (2-4%), seguidas de insomnio, náuseas, escozor o dolor en el sitio de aplicación7,27.
Indicaciones aprobadas en dermatologíaEl uso de roflumilast oral está aprobado por la FDA (no por la EMA) para el tratamiento tópico de la psoriasis en placas y de la dermatitis seborreica leve/moderada6,7,27. El primer reporte de roflumilast en psoriasis en placas data de 2017, cuando Michels et al.48 describieron un caso con psoriasis y EPOC concomitante, en el cual se observó mejoría de las lesiones cutáneas durante el tratamiento de la enfermedad pulmonar con roflumilast oral. En 2020, Papp et al.49 reportaron el primer ensayo clínico (EC) fase I/IIa donde se alcanzó una respuesta en psoriasis en placas con roflumilast tópico del 0,5 y 0,15% superior al placebo. Los EC DERMIS-1 y DERMIS-227 sentaron la aprobación de roflumilast tópico al 0,3% por parte de la FDA en el tratamiento de la psoriasis en placas, alcanzando el 42,4% de los casos el Investigator's Global Assessment Scale (IGA) objetivo (aclaramiento total o mejoría en IGA≥2 puntos sobre el basal) vs. el 6,1% en el grupo control (DERMIS-1); y el 37,5% el IGA objetivo vs. un 6,9% en el grupo control (DERMIS-2). El perfil de seguridad fue favorable en ambos estudios, siendo los EA más frecuentes las molestias gastrointestinales77. Recientemente se han publicado dos EC fase IIb50 y fase III6 donde se demuestra la eficacia de roflumilast tópico al 0,3% en el prurito y descanso nocturno, y en el cuero cabelludo, respectivamente (tabla 46,7,27,49,50,78,79,82).
Estudios del roflumilast tópico en psoriasis en placas y dermatitis seborreica
| Dermatosis | Año, autores | N | Tipo de estudio | Objetivos del estudio | Resultados |
|---|---|---|---|---|---|
| Psoriasis en placas | 2023, Kircik L et al.6 | 304 | Ensayo clínico aleatorizado fase IIb | Evaluar eficacia y seguridad de roflumilast tópico 0,3% vs. placebo en psoriasis en placas de cuerpo y cuero cabelludo durante 8 semanas | Un número significativamente mayor de pacientes tratados con roflumilast (59,1%) que pacientes tratados con vehículo (11,4%) lograron el IGA objetivo en cuero cabelludo en semana 8 (p<0,0001). También mejoría significativa en objetivos secundarios: IGA corporal, escala de picor en cuero cabelludo y PSSI del cuero cabelludo. |
| 2023, Thurston Jr et al.82 | Revisión con 495 pacientes | Estudio postensayo | Estudio postensayo de varios ensayos clínicos fase II donde se evaluaron las características farmacocinéticas de roflumilast tópico al 0,3% en psoriasis en placas | Biodisponibilidad sistémica del 1,5%. Concentración en piel entre 61 y 126 superior a la administración oral.Acción de roflumilast N-óxido 8 veces superior a roflumilast, pero este efecto no está demostrado de forma cutánea.Vida media de 4 días. | |
| 2022, Stein Gold L et al.50 | 331 | Ensayo clínico aleatorizado fase IIb | Evaluación el prurito en pacientes con psoriasis en placas tras tratamiento con roflumilast tópico al 0,3%, al 0,15% y placebo en psoriasis en placas a las 12 semanas | Roflumilast tópico al 0,3% demostró una mayor mejoría del prurito y en el descanso nocturno vs. roflumilast tópico al 0,15% y a placebo | |
| 2022, Pixley J et al.78 | Revisión con 2.064 pacientes | Revisión sistemática | Incluyó varios ensayos clínicos fase III sobre la efectividad de roflumilast tópico en psoriasis en placas | Roflumilast tópico al 0,3% constituye un tratamiento eficaz y seguro para la psoriasis en placas e intertriginosa | |
| 2022, ensayo clínico Arcutis biotherapeutics79 | 332 | Ensayo clínico aleatorizado fase III | Eficacia y seguridad de roflumilast tópico al 0,3% vs. control con vehículo en psoriasis en placas e intertriginosa a 52 semanas. | El 45% del grupo con roflumilast tópico alcanzó el IGA objetivo (mejoría ≥2 respecto al basal) vs. 6,1% en el grupo control | |
| 2022, Lebwohl MG et al.27 | 439 (ensayo DERMIS-1) y 442 (ensayo DERMIS 2) | Ensayos clínicos aleatorizados fase III | Eficacia y seguridad de roflumilast tópico al 0,3% vs. vehículo en psoriasis en placas e intertriginosa por 8 semanas | El grupo con roflumilast tópico alcanzó en un 42,4% el IGA objetivo vs. 6,1% en grupo control (DERMIS-1) y eficacia de roflumilast tópico alcanzando un 37,5% en IGA objetivo (mejoría ≥2 respecto al basal) vs. 6,9% en grupo control (DERMIS-2) | |
| 2020, Papp A et al.49 | 97 | Ensayo clínico aleatorizado fase I (seguridad)/IIa (dosis) | Evaluar la eficacia y la seguridad de roflumilast tópico al 0,5 vs. 0,15% placebo para el tratamiento de psoriasis en placas a la semana 4 | Se alcanzó el objetivo primario (aclaramiento de placas) en el 66 y 67% de roflumilast al 0,5% y 0,15% vs. 35% en el grupo placebo. No diferencias en sus efectos secundarios | |
| Dermatitis seborreica | 2023, Zirwas MJ et al.7 | 226 | Ensayo clínico aleatorizado fase IIa | Eficacia y seguridad de roflumilast al 0,3% tópico vs. placebo en dermatitis seborreica leve/moderada a la semana 8 | Se alcanzó el IGA objetivo (aclaramiento ≥2 respecto al basal) en un 73,8% de pacientes con roflumilast vs. 40,9% en el grupo controlPerfil de seguridad adecuado |
EPOC: enfermedad pulmonar obstructiva crónica; IGA: Investigator's Global Assessment Scale; PSSI: Psoriasis Scalp Severity Index; RS: Revisión sistemática;
La aprobación por la FDA de roflumilast tópico en dermatitis seborreica se realizó en abril de 2023, tras la publicación de los resultados de un EC en fase IIa multicéntrico y controlado con placebo, que evaluaba la eficacia y la seguridad de roflumilast al 0,3% en 226 pacientes con dermatitis seborreica >3 meses duración y con un IGA≥3 (≥ moderado) con afectación <20% de la superficie corporal, incluyendo cuero cabelludo, cara, tronco y áreas intertriginosas7. Se alcanzó el IGA objetivo (aclaramiento ≥2 respecto al basal) en el 73,8% de individuos con roflumilast, vs. 40,9% en el grupo control (p<0,001). La diferencia fue significativa desde la semana 2 de tratamiento. No se registró una tasa superior de EA en el grupo de roflumilast comparado con en el grupo control.
Uso del roflumilast fuera de indicación en dermatologíaEncontramos en la literatura diversos estudios sobre el uso fuera de aprobación de roflumilast en dermatología, la mayoría pequeñas series o EC iniciales (tabla 545,48,51–53,56–63,87). Encontramos 4 estudios clínicos sobre roflumilast tópico, todos ellos EC. En dermatitis atópica, un EC fase IIa (n=40) no alcanzó los objetivos propuestos con roflumilast tópico al 0,5% vs. placebo a las 16 semanas. El objetivo primario era la proporción de pacientes que lograban una reducción de al menos un 75% en el índice de gravedad del eccema de manos (HECSI75)51. Otro EC aleatorizado fase IIa posterior (n=136) demostró una mejoría en el EASI a las 12 semanas con roflumilast tópico al 0,15%, superior a la obtenida con la concentración al 0,05% y superior a placebo. Sin embargo, estos resultados no resultaron estadísticamente significativos52. Se encuentran en proceso de realización 2 EC que analizan el efecto de roflumilast tópico en eccema crónico de manos53 y otro en rosácea pápulopustulosa54. El EC en eccema crónico de manos (n=230) es una fase IIa que evalúa la eficacia y la seguridad de roflumilast tópico al 0,3 vs. 0,1% y vs. placebo, evaluados a la semana 12. Por su parte, el EC en rosácea pápulopustulosa es una fase II completado (n=40) y pendiente de publicación, que evalúa la eficacia de roflumilast al 0,5% vs. placebo. Recientemente, un estudio preclínico encontró mayores niveles de PDE4 en la piel de pacientes con vitíligo. Tras la aplicación de roflumilast tópico se observó una reducción de los niveles de PDE4 y mejoría parcial de las lesiones cutáneas55.
Estudios clínicos sobre el uso fuera de indicación del roflumilast en dermatología
| Dermatosis | Año, autores | N | Tipo de estudio | Objetivos del estudio | Resultados |
|---|---|---|---|---|---|
| Psoriasis | 2023, Gyldenløve M et al.45 | 46 | Ensayo clínico aleatorizado fase IIINCT04549870 | Evaluar la eficacia y la seguridad de roflumilast oral en psoriasis en placas | En la semana 12, un 35% de los pacientes alcanzaron un PASI 75 vs. 13% de grupo placebo (p=0,014). Dos pacientes requirieron discontinuación por efectos adversos de roflumilast. El más frecuente fue la diarrea |
| Psoriasis | 2021, Egeberg A et al.56 | 1 | Caso clínico | Varón de 48 años con psoriasis en placas tratado con roflumilast oral 500μg/día | Aclaramiento completo de las lesiones en la semana 24 de tratamiento. Sin efectos adversos |
| Psoriasis | 2023, Gyldenløve M et al.57 | 1 | Caso clínico | Evaluar la eficacia y la seguridad a largo plazo del roflumilast oral en el paciente del estudio anterior56 | A los 18 meses de tratamiento, el paciente se mantuvo con PASI 0 y sin efectos adversos reseñables |
| Psoriasis | 2017, Michels K et al.48 | 1 | Caso clínico | Reporte de caso clínico de un varón de 59 años con EPOC y psoriasis eritrodérmica tratado satisfactoriamente de ambas enfermedades con roflumilast oral 500μg/día | Mejoría de la psoriasis de forma casual tras tratamiento de su EPOC |
| Hidradenitis supurativa | 2022, Ring et al.58 | 1 | Caso clínico | Evaluar la respuesta a roflumilast oral en un paciente con HS axilar severa y fallo a adalimumab e infliximab | Respuesta adecuada, con disminución en número de lesiones, sin efectos adversos reseñables a los 3 mesesAsoció pérdida de peso de 9kg |
| Aftosis oral recurrente | 2022, Gyldenløve et al.59 | 2 | Serie de casos | Evaluar la respuesta a roflumilast oral en 2 pacientes con aftosis oral recurrente que no cumplían los criterios de enfermedad de Behçet | Respuesta completa de las lesiones de forma precoz (2-3 semanas) y mantenida a los 3 meses de inicio del tratamiento. Buen perfil de seguridad |
| Enfermedad de Behçet | 2023, Peñuelas et al.62 | 1 | Caso clínico | Respuesta a roflumilast oral 250μg/día en un paciente con enfermedad de Behçet refractaria | Respuesta favorable al tratamiento con roflumilast y sin efectos adversos destacables |
| Eccema numular | 2022, Gyldenløve et al.60 | 1 | Caso clínico | Respuesta a roflumilast oral 500μg/día en una paciente de 69 años con eccema numular refractario a corticoides tópicos, UVB, metotrexato y azatioprina | Respuesta temprana precoz (2 semanas) y aclaramiento completo de las lesiones a los 3 meses de inicio del tratamiento. Buen perfil de seguridad |
| Liquen plano erosivo | 2023, Fage et al.61 | 1 | Caso clínico | Respuesta a roflumilast oral en una paciente con liquen plano erosivo oral refractario a corticoides tópicos y orales, metotrexato, ciclosporina, azatioprina, apremilast y adalimumab | Práctica resolución de las lesiones a los 3 meses de inicio del tratamiento, inicialmente concomitante con prednisona 7,5mg en dosis descendente (2,5mg a los 3 meses de roflumilast) |
| Dermatitis atópica | Ensayo clínico51 | 40 | Ensayo clínico fase IIaNCT01856764 | Eficacia y seguridad de roflumilast tópico al 0,5% vs. placebo en dermatitis atópica | No se alcanzaron resultados superiores a placebo en el grupo con roflumilast |
| Dermatitis atópica | Ensayo clínico52 | 136 | Ensayo clínico fase IIaNCT04773587 | Evaluar la eficacia y la seguridad de roflumilast tópico al 0,15% vs. roflumilast tópico al 0,05% placebo en dermatitis atópica | Disminución del EASI de 6,4 puntos en el grupo de roflumilast al 0,15%, de 6 puntos en el grupo de roflumilast al 0,05% y de 4,8 puntos en el grupo control, sin resultar estadísticamente significativo. Buen perfil de seguridad |
| Eccema de manos | Ensayo clínico63 | 40 | Ensayo clínico fase IV en proceso de reclutamientoNCT05682859 | Evaluar la eficacia y la seguridad de roflumilast oral vs. placebo en eccema crónico de manos | Resultados pendientes de publicación |
| Eccema de manos | Ensayo clínico53 | 230 | Ensayo clínico fase IIa completadoNCT04378569 | Evaluar la eficacia y la seguridad de roflumilast tópico al 0,3 vs. 0,1% y vs. placebo en eccema crónico de manos | Resultados pendientes de publicación |
| Rosácea | Ensayo clínico54 | 40 | Ensayo clínico fase II completado pendiente de publicación de resultados NCT05278624 | Evaluar la eficacia y la seguridad de roflumilast tópico al 0,5% vs. placebo en rosácea papulopustulosa | Resultados pendientes de publicación |
HS: hidradenitis supurativa; UVB: fototerapia con radiación ultravioleta-B.
En cuanto a roflumilast oral fuera de ficha técnica, encontramos 4 artículos sobre su uso en psoriasis (tabla 545,48,56,57). El grupo de Gyldenløve et al. ha reportado recientemente su eficacia en psoriasis en placas a dosis de 500μg/día en un EC fase III (n=46) vs. placebo, alcanzando en la semana 12 un 35% del grupo intervención el PASI 75 vs. 13% del grupo placebo (p=0,014). Se reportaron EA mayoritariamente leves45. Recientemente, el mismo grupo publicó los resultados con roflumilast oral en el primer paciente con psoriasis al que se le indicó este fármaco, un varón de 48 años con una psoriasis en placas refractaria56 y posteriormente, publicó la respuesta a largo plazo (18 meses) de este individuo57. Se ha descrito su utilidad en otro caso clínico: un varón de 59 años en el que se trató simultáneamente su EPOC y su psoriasis48. En ambos casos, se empleó roflumilast a dosis de 500μg/día y no se reportaron efectos adversos destacables. Al margen de la psoriasis, encontramos 5 artículos publicados sobre roflumilast oral en enfermedad dermatológica (tabla 558–62): una serie de casos y 4 casos clínicos aislados, la mayoría de estos reportados por un mismo centro asistencial de Dinamarca. Ring et al. describieron un caso de hidradenitis supurativa refractaria con afectación axilar y fallo a adalimumab e infliximab, con una buena respuesta clínica con roflumilast a las 12 semanas, y con pérdida de peso asociada58. Gyldenløve et al. reportaron 2 casos de aftosis oral recurrente tratados con roflumilast oral 500μg/día, que presentaron una respuesta adecuada y muy rápida, a partir las 2-3 semanas, y que se ha mantenido a los 3 meses de tratamiento59. Igualmente, describieron un caso de eccema numular con fallo a múltiples tratamientos, que alcanzó una respuesta precoz y mantenida con roflumilast oral, sin efectos adversos reseñables60. Al igual que en un caso de liquen plano oral erosivo refractario a tratamientos de primera línea y dependiente de corticoides sistémicos. El roflumilast oral permitió reducir la dosis de prednisona a 2,5mg/día a los 3 meses61. Un grupo español reportó recientemente un caso de enfermedad de Behçet refractaria tratada exitosamente con roflumilast 250μg/día, sin efectos adversos significativos62. Por último, se encuentra en fase de reclutamiento un EC en fase IV (n=40) con roflumilast oral a dosis de 500μg/día vs. placebo en eccema crónico de manos63.
Dermatosis que potencialmente podrían beneficiarse del roflumilastDado el mecanismo de acción similar a apremilast, y por la posibilidad de presentar en ellas la PDE4 elevada, múltiples dermatosis en las que se ha utilizado fuera de indicación este fármaco podrían beneficiarse del roflumilast oral o tópico (tabla 6). Entre ellas, encontramos dermatosis eminentemente autoinmunes como el vitíligo o la alopecia areata3, enfermedades eritematodescamativas similares a la psoriasis como la pitiriasis rubra pilaris64 o el síndrome de Sneddon-Wilkinson65, enfermedades ampollosas como el pénfigo vulgar o la epidermólisis bullosa adquirida3, genodermatosis como el pénfigo benigno familiar (enfermedad de Hailey-Hailey)66 o las ictiosis3. Otras enfermedades en las que apremilast puede ser útil son la hidradenitis supurativa67, el liquen plano cutáneo68 o en otras dermatitis liquenoides y de interfase69, lupus eritematoso cutáneo70 o sarcoidosis cutánea71. De especial interés puede ser su aplicación en la morfea, una enfermedad relativamente frecuente y donde los IPDE4 han demostrado reducir la fibrosis dérmica y, además, se han registrado buenos resultados con apremilast en esta entidad72–74.
Uso fuera de indicación del apremilast, y potenciales usos del roflumilast en dermatología
| Alopecia areata3 | Alopecia frontal fibrosante3 |
|---|---|
| Alopecia cicatricial central centrífuga3 | Dermatitis actínica crónica3 |
| Dermatitis de interfase liquenoide69 | Dermatitis atópica3 |
| Dermatitis seborreica recalcitrante3 | Eccema crónico de manos3 |
| Eccema numular3 | Enfermedad de Behçet3 |
| Epidermólisis ampollosa adquirida3 | Enfermedades perforantes3 |
| Eritema anular centrífugo3 | Eritema multiforme recurrente3 |
| Eritema nudoso leproso3 | Estomatitis aftosa recurrente3 |
| Foliculitis decalvante3 | Granuloma anular3 |
| Granulomatosis orofacial3 | Hidradenitis supurativa67 |
| Ictiosis lamelar3 | Lesiones cutáneas de dermatomiositis3 |
| Liquen plano68 | Liquen plano mucoso3 |
| Liquen plano pilaris3 | Lupus eritematoso cutáneo discoide70 |
| Morfea72–74 | Pioderma gangrenoso3 |
| Penfigoide p-2003 | Pitiriasis rubrapilaris64 |
| Prúrigo nodular3 | Pustulosis palmo-plantar3 |
| Queratodermia palmoplantar3 | Rosácea3 |
| Sarcoidosis71 | Síndrome de Sneddon-Wilkinson65 |
| Síndrome SAPHO3 | Vitíligo3 |
| Pénfigo vulgar3 | Pénfigo benigno familiar66 |
| Úlceras orales3 |
SAPHO: sinovitis acné pustulosis hiperostosis osteítis.
El manejo de dermatosis inflamatorias moderadas o graves requiere frecuentemente el empleo de inmunomoduladores o inmunosupresores, a menudo usados fuera de indicación en dermatología. Pese al aumento que suponen de nuestro arsenal las moléculas pequeñas y los agentes biológicos, existe la necesidad de contar con nuevas terapias inmunomoduladoras de menor coste y buen perfil de seguridad75–77. Una gran ventaja del roflumilast es su bajo coste: en España de alrededor de 30€/mes en la formulación oral de 500μg/día e igualmente económico en otros países59. De hecho, su precio es inferior al de inmunosupresores clásicos como la ciclosporina oral o el metotrexato subcutáneo. Una segunda ventaja es su excelente perfil de seguridad, con escasas contraindicaciones, y EA en su mayoría gastrointestinales, muy similar a lo reportado con apremilast. En cuanto a EA graves, aunque todavía una relación no esclarecida, se ha asociado a roflumilast con fibrilación auricular. Igualmente, su relación con el suicidio es controvertida y no ha sido replicada en estudios posteriores37,43. Es un fármaco con >10 años en el mercado, en los cuales no se han descrito nuevos EA, ni efectos acumulativos deletéreos derivados de su uso continuado en el tiempo44,45. Sin embargo, los EA gastrointestinales pueden ser muy molestos y llevar a la suspensión del fármaco a un número significativo de pacientes, por lo que es fundamental su titulación adecuada, con un incremento progresivo de la dosis. En general, se recomienda su inicio a dosis de 250μg/día con o sin alimentos y siempre a la misma hora del día. Si la respuesta es adecuada y no hay EA destacables, se debe escalar a la dosis óptima de 500μg/día. Se ha ensayado su uso hasta un año, aunque puede mantenerse a criterio médico por más tiempo23.
Dentro de las ventajas de roflumilast también se encuentran su cómoda posología y la posibilidad de doble aplicación tópica y oral78. Además, puede producir baja de peso asociada a una mejoría del perfil metabólico y de la resistencia a insulina, por lo que podría ser ideal para pacientes con dermatosis y sobrepeso, como en pacientes hidradenitis supurativa58. Sin embargo, esto requiere ser demostrado en estudios prospectivos con un seguimiento adecuado.
En cuanto a su uso tópico, el roflumilast debe emplearse una vez al día, aplicando una pequeña capa sobre la piel afectada. Aún no está disponible en España.
Su aplicación en dermatología es paralela a los estudios previos con apremilast, otro IPDE4 con una afinidad similar a la PDE4 y sin una mayor frecuencia de efectos secundarios, si bien no hay estudios que comparen este perfil de EA entre apremilast y roflumilast79. En nuestra revisión hemos encontrado que el roflumilast se ha empleado fuera de ficha técnica en su presentación oral en diversas dermatosis (tabla 545,48,51–54,57–63,87), entre ellas la psoriasis, hidradenitis supurativa58, aftosis oral recurrente59, enfermedad de Behçet62, liquen erosivo oral61 y eccema numular60. Además, su analogía farmacocinética y farmacodinámica con apremilast permite hipotetizar que puede ser útil en múltiples enfermedades cutáneas. Sin embargo, la evidencia es aún muy limitada para hacer recomendaciones al respecto. Probablemente, en años venideros serán aprobadas nuevas indicaciones de roflumilast oral o tópico en dermatología, y es necesaria la familiarización de los dermatólogos con este fármaco.
LimitacionesLa presente revisión tiene la limitación de ser narrativa y no una revisión sistemática o metaanálisis. Asimismo, muchos de los estudios incluidos, especialmente en los usos fuera de indicación del roflumilast son series de casos, o tienen muestras pequeñas, o un diseño retrospectivo. Además, sus potenciales usos son extrapolados de apremilast por analogía farmacocinética y farmacodinámica. Todos estos factores dificultan la generalización de los hallazgos informados y sus conclusiones.
ConclusionesRoflumilast es un fármaco aprobado en dermatología de forma tópica para el tratamiento de la psoriasis en placas y la dermatitis seborreica leve/moderada. Existen reportes y estudios en su mayoría de pequeño tamaño que avalan la utilidad del roflumilast oral en psoriasis, hidradenitis supurativa, aftosis oral recurrente, eccema numular o liquen plano, entre otros. Su perfil de seguridad es muy favorable, es de bajo coste y está ampliamente disponible. Son necesarios nuevos estudios controlados que evalúen su eficacia en dermatosis inflamatorias, y permitan instaurar nuevas indicaciones aprobadas para esta prometedora molécula.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.