Los linfomas cutáneos primarios (LCP) son un conjunto de entidades poco frecuentes. En febrero del 2018 se describieron los resultados del primer año de funcionamiento del Registro de linfomas cutáneos primarios de la AEDV. En el presente trabajo actualizamos los resultados tras 5 años de funcionamiento.
Pacientes y métodosRegistro de enfermedad de pacientes con LCP. Se recogieron datos prospectivamente de los pacientes, incluyendo diagnóstico, tratamientos, pruebas realizadas y estado actual del paciente. Se realizó un análisis descriptivo.
ResultadosEn diciembre del 2021 se había incluido a un total de 2020 pacientes en el Registro, pertenecientes a 33 hospitales españoles. El 59% fueron hombres, la edad media fue de 62,2 años. Se agruparon en 4grandes grupos diagnósticos: micosis fungoide/síndrome de Sézary (1.112, 55%), LCP de células B (547, 27,1%), trastornos linfoproliferativos de células T CD30+(222, 11%) y otros linfomas T (116, 5,8%). La mayoría presentó estadio T1, encontrándose actualmente casi el 75% en remisión completa (43,5%) o enfermedad estable (EE; 27%). Los tratamientos más usados fueron corticoides tópicos (1.369, 67,8%), fototerapia (890, 44,1%), cirugía (412, 20,4%) y radioterapia (384, 19%).
ConclusiónLas características del paciente con LCP en España no difieren de otras series. El mayor tamaño del registro permite precisar mejor los datos con respecto a los resultados del primer año. Este registro facilita al grupo de linfomas de la AEDV realizar investigación clínica, surgiendo ya trabajos publicados de dicho registro.
Primary cutaneous lymphomas (PCL) are uncommon. Observations based on the first year of data from the Spanish Registry of Primary Cutaneous Lymphomas (RELCP, in its Spanish abbreviation) of the Spanish Academy of Dermatology and Venereology (AEDV) were published in February 2018. This report covers RELCP data for the first 5 years.
Patients and methodsRELCP data were collected prospectively and included diagnosis, treatments, tests, and the current status of patients. We compiled descriptive statistics of the data registered during the first 5 years.
ResultsInformation on 2020 patients treated at 33 Spanish hospitals had been included in the RELCP by December 2021. Fifty-nine percent of the patients were men; the mean age was 62.2 years. The lymphomas were grouped into 4 large diagnostic categories: mycosis fungoides/Sézary syndrome, 1112 patients (55%); primary B-cell cutaneous lymphoma, 547 patients (27.1%); primary CD30+lymphoproliferative disorders, 222 patients (11%), and other T-cell lymphomas, 116 patients (5.8%). Nearly 75% of the tumors were registered in stage I. After treatment, 43.5% achieved complete remission and 27% were stable at the time of writing. Treatments prescribed were topical corticosteroids (1369 [67.8%]), phototherapy (890 patients [44.1%]), surgery (412 patients [20.4%]), and radiotherapy (384 patients [19%]).
ConclusionThe characteristics of cutaneous lymphomas in Spain are similar to those reported for other series. The large size of the RELCP registry at 5 years has allowed us to give more precise descriptive statistics than in the first year. This registry facilitates the clinical research of the AEDV's lymphoma interest group, which has already published articles based on the RELCP data.
Los linfomas cutáneos primarios (LCP) son un grupo heterogéneo de entidades que presentan como característica común la proliferación primaria de linfocitos de diferentes estirpes (T, B o natural killer) a nivel de la piel, con la posible posterior extensión de la enfermedad en sangre periférica, ganglios linfáticos e incluso otros órganos, con capacidad de progresión, disminución de la calidad de vida y potencial gravedad1.
La baja prevalencia de estas enfermedades, en conjunto con su frecuente difícil manejo, convierte a los registros clínicos en una herramienta muy útil. La Academia Española de Dermatología y Venereología (AEDV) inició en diciembre del 2016 un registro clínico multicéntrico de LCP2. En febrero del 2018 se publicaron los resultados del primer año de registro3. El objetivo de este estudio es describir los resultados tras 5 años de registro, incidiendo en las características clínicas de los pacientes y tratamientos empleados en los centros participantes.
Material y métodosEl Registro de linfomas cutáneos primarios (RELCP) de la AEDV es un registro de enfermedad multicéntrico prospectivo. Los centros se pueden unir al estudio si tienen una consulta monográfica o especializada de linfomas cutáneos. Todos los pacientes fueron diagnosticados según los criterios diagnósticos propuestos por la World Health Organization y la European Organisation for Research and Treatment of Cancer (WHO-EORTC)1. En cada centro participante se incluyó a todos los pacientes diagnosticados de linfoma cutáneo que acudieron a la consulta, con el único criterio de exclusión de la negativa a participar en el estudio por parte del paciente. La información se recoge de forma protocolizada mediante un sistema online de recogida de datos (Openclinica open source software, versión 3.1, Waltham, EE. UU.) de la Unidad de Investigación de la Fundación AEDV. El análisis estadístico de los datos se realiza mediante el programa Stata (versión 17 Statacorp, Texas, EE. UU.). El estudio fue clasificado por la AEMPS como no EPA (no postautorización) y aprobado por el CEIC del Hospital 12 de Octubre (16/175) y por parte de todos los centros participantes, cumpliendo con la declaración de Helsinki y la legislación vigente. Todos los pacientes han dado su consentimiento informado por escrito para participar.
El Registro presenta visitas de inclusión y seguimiento. En la visita de inclusión se recogieron datos demográficos y relacionados con el diagnóstico, como la fecha, el tipo de linfoma según la clasificación WHO y el estadio según el consenso actual para la clasificación TNM (TNMB en micosis fungoide/síndrome de Sézary [MF/SS]) propuesta por la International Society for Cutaneous Lymphomas y la Cutaneous Lymphoma Task Force de la EORTC4-6. También se recogieron las pruebas diagnósticas y los tratamientos realizados. En las visitas de seguimiento se recogieron la fecha de la última visita y el estado de la enfermedad: remisión completa (RC) (100% de aclaramiento desde la última visita), remisión parcial (50-99% de aclaramiento desde la última visita), enfermedad estable (< 25 a < 50% de aclaramiento desde la última visita), enfermedad progresiva (≥ 25% de progresión desde la última visita), fallecimiento o recaída, así como la presencia en ese momento de enfermedad cutánea, ganglionar, visceral y sanguínea.
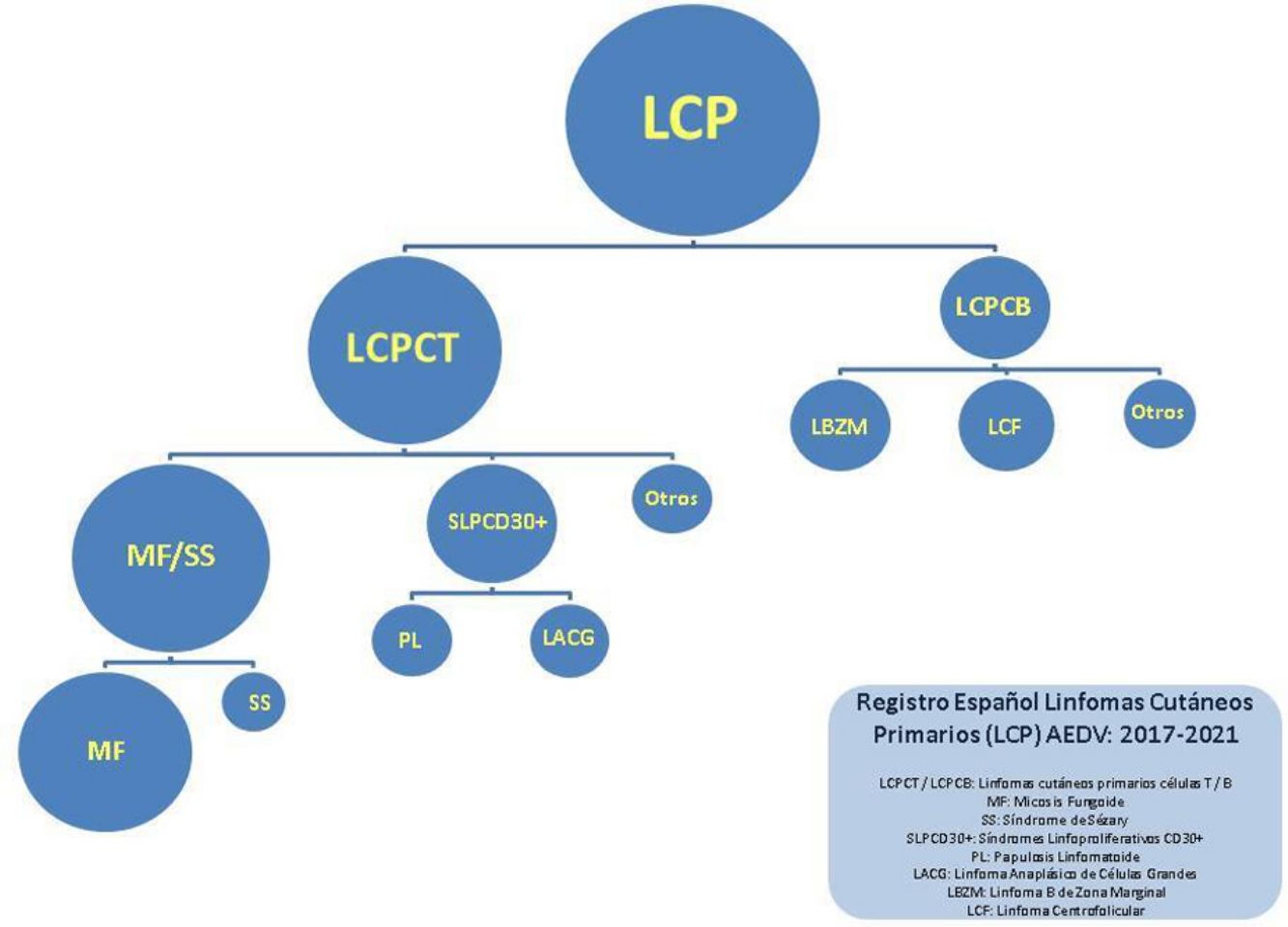
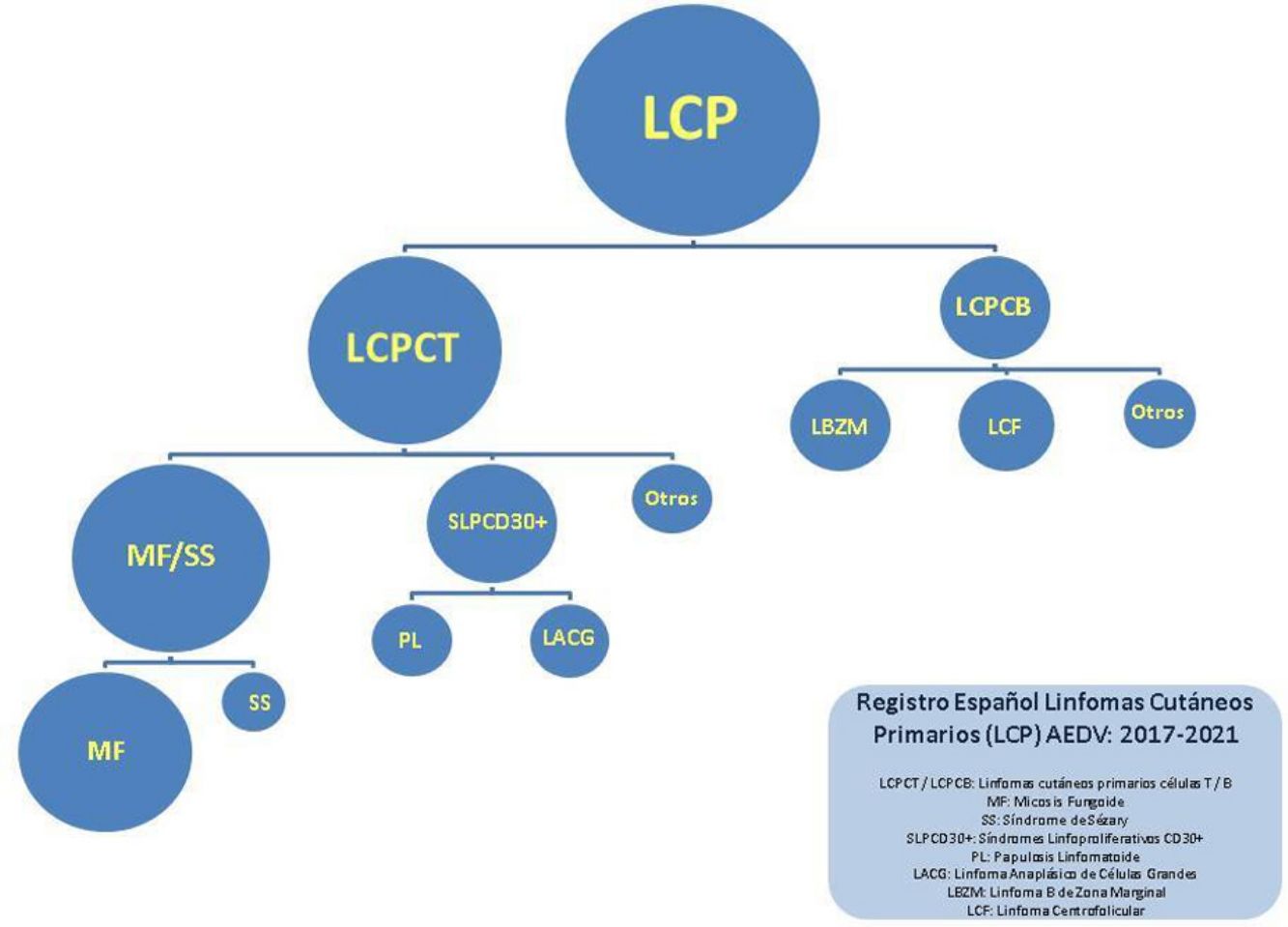
En este trabajo se han separado los linfomas en 4 grandes grupos: MF/SS, trastornos linfoproliferativos de células T CD30+(LTCD30+; abarca papulosis linfomatoide y linfoma anaplásico de células grandes), otros LCP de células T (OLT) y LCP de células B (LCCB). Se ha realizado un análisis descriptivo utilizando los porcentajes y los datos absolutos de las variables cualitativas, la media y la desviación estándar (DE) en las variables continuas simétricas y la mediana junto a cuartiles en las variables continuas no simétricas.
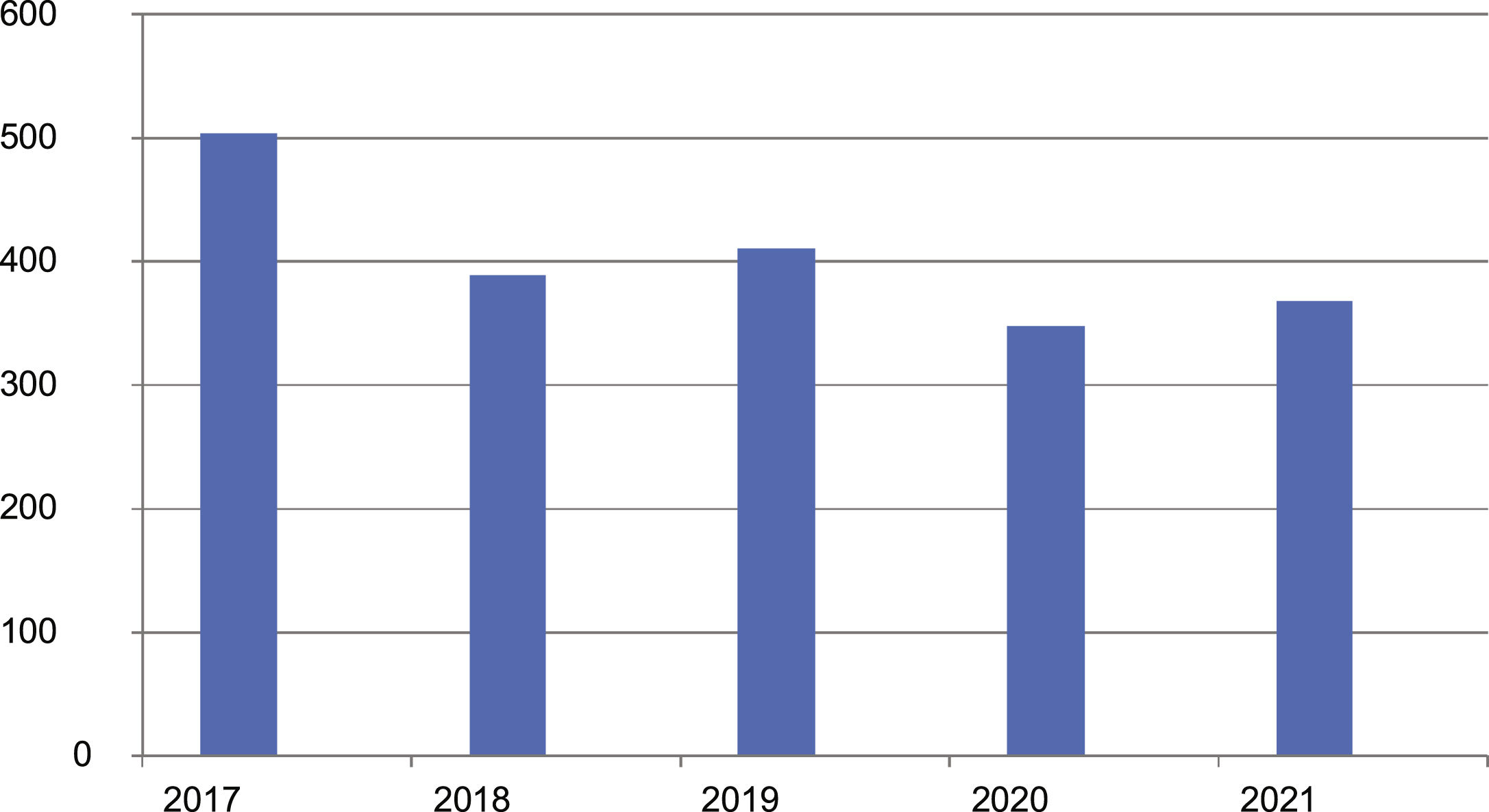
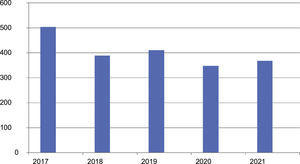
ResultadosEn el momento del análisis, diciembre del 2021, el registro incluía datos de 2.020 pacientes pertenecientes a 33 hospitales del territorio español. La muestra abarcaba a 830 mujeres y 1.190 hombres con una edad media de 62,2 años (DE 15,6) y edad media al inicio de 55,7 años (DE 15,9). Los pacientes presentaron edades de inicio desde los 10 hasta los 97 años. La duración media de la enfermedad fue de 5,1 años, con DE 5,8. La evolución del reclutamiento (o inclusión) de casos en el Registro en estos 5 primeros años se detalla en la figura 1.
La distribución de los pacientes en los distintos grupos fue la siguiente: 1.112 (55%) con MF/SS, 222 (11%) con LTCD30+, 116 (5,8%) con OLT y 574 (27,1%) con LCCB. Los 23 restantes (1,2%) fueron casos no clasificados. El desglose completo de los diversos tipos de linfomas se detalla en la tabla 1.
Se recogen el total de linfomas incluidos en el registro según diagnóstico EORTC, ordenados por frecuencia
| Diagnóstico EORTC | n | % |
|---|---|---|
| Micosis fungoide sin otro calificativo | 882 | 43,7 |
| Linfoma de células B de la zona marginal | 280 | 13,9 |
| Linfoma de células B centrofolicular | 229 | 11,3 |
| Micosis fungoide foliculotropa | 171 | 8,5 |
| Papulosis linfomatoide | 152 | 7,5 |
| Enfermedad linfoproliferativa de células T CD4+ de célula pequeña/mediana | 76 | 3,8 |
| Linfoma anaplásico de célula grande | 70 | 3,5 |
| Síndrome de Sézary | 56 | 2,8 |
| Linfoma de células B difuso de célula grande tipo piernas | 31 | 1,5 |
| Otros linfomas | 22 | 1,1 |
| Linfoma de células T periférico no especificado | 20 | 1,0 |
| Linfoma de células T subcutáneo tipo paniculitis-like | 7 | 0,3 |
| Linfoma de células T gamma-delta | 3 | 0,1 |
| Linfoma de células T acral CD8+ | 3 | 0,1 |
| Reticulosis pagetoide | 2 | 0,1 |
| Linfoma de células T CD8+ epidermotropo agresivo | 2 | 0,1 |
| Linfoma de células NK/T extranodal tipo nasal | 2 | 0,1 |
| Linfoma de células B intravascular | 2 | 0,1 |
| Linfoma de células B difuso de célula grande VEB+ | 2 | 0,1 |
| Piel laxa granulomatosa | 1 | 0,0 |
| Linfoma de células T folicular helper | 1 | 0,0 |
| Síndrome linfoproliferativo hydroa vacciniforme-like | 1 | 0,0 |
| Úlcera mucocutánea VEB+ | 1 | 0,0 |
| Linfoma de células T angioinmunoblástico | 1 | 0,0 |
| Neoplasia de células dendríticas plasmocitoides | 1 | 0,0 |
| Linfoma de Hodgkin | 1 | 0,0 |
| Síndromes linfoproliferativos postrasplante | 1 | 0,0 |
| Total | 2020 | 100 |
Dentro del grupo de MF/SS los cuadros más frecuentes correspondieron a MF clásica (882, 79,3% del grupo MF/SS, 43,7% del total); 171 pacientes fueron diagnosticados de MF foliculotropa (15,3% del grupo MF/SS) y 56 de SS (5% grupo MF/SS).
Los LCCB son el segundo grupo más frecuente dentro del registro. Dentro de este conjunto, el linfoma B de zona marginal (LZM) y el linfoma B centrofolicular (LCF) constituyen la mayoría de la casuística, con 280 (51,2%) y 229 (41,9%) casos, respectivamente.
En el grupo de trastornos linfoproliferativos de células T CD30+ (LTCD30+), la papulosis linfomatoide supone aproximadamente el doble de casos que el linfoma anaplásico de células grandes CD30+: 152 (68,5%) por 70 (31,5%).
El último grupo recoge otros linfomas T menos habituales. Dentro de estos, el más frecuentemente observado en el registro ha sido la enfermedad linfoproliferativa T CD4+ de células pequeñas/medianas (76 casos, 65,5% del total de OLT).
EstadiosEn la tabla 2 se recoge de forma separada la afectación TNM/TNMB en el total de la muestra. Más de la mitad de los pacientes presentaron al diagnóstico un estadio T1 (1065, 52,7%), de los cuales 604 se encontraban en T1a (29,9% del total). Quinientos pacientes presentaban un estadio en piel T2 (24,8%), 273 un T3 (13,5%) y 92 un T4 (4,6%). En los 90 casos restantes el grado de afectación cutánea se recogió como desconocido o «no aplicable» en el registro.
Desglose de estadios TNM (TNMB para MF/SS) en los distintos compartimentos, sobre el total de la muestra
| MF/SS | Linfomas no-MF/SS | |||||
|---|---|---|---|---|---|---|
| Estadio | n | % | Estadio | n | % | |
| Estadio T (piel) | T1 | 110 | 9,9 | T1 | 125 | 13,8 |
| T1a | 286 | 25,7 | T1a | 318 | 35 | |
| T1b | 172 | 15,5 | T1b | 54 | 5,9 | |
| T2 | 95 | 8.5 | T2 | 27 | 3 | |
| T2a | 98 | 8.8 | T2a | 92 | 10,1 | |
| T2b | 128 | 11,5 | T2b | 43 | 4,7 | |
| T3 | 98 | 8,8 | T2c | 17 | 1,9 | |
| T4 | 89 | 8 | T3 | 36 | 4,0 | |
| Desconocido | 36 | 3,2 | T3a | 49 | 5,4 | |
| T3b | 90 | 9,9 | ||||
| T4 | 3 | 0,3 | ||||
| Desconocido | 54 | 5,9 | ||||
| Estadio N (ganglionar) | N0 | 988 | 88,8 | N0 | 823 | 90,6 |
| N1 | 44 | 3 | N1 | 20 | 2,2 | |
| N2 | 3 | 1,3 | N2 | 6 | 0,7 | |
| N3 | 6 | 0,5 | N3 | 4 | 0,4 | |
| Nx | 25 | 2,2 | Nx | 2 | 0,2 | |
| Desconocido | 46 | 4,1 | Desconocido | 59 | 6,5 | |
| Estadio M (visceral) | M0 | 1062 | 95,5 | M0 | 844 | 93 |
| M1 | 2 | 0,2 | M1 | 4 | 0,4 | |
| Desconocido | 48 | 4,3 | Desconocido | 60 | 6,6 | |
| Estadio B (sangre periférica)* MF/SS | B0 | 970 | 87,2 | |||
| B1 | 32 | 2,9 | ||||
| B2 | 43 | 3,9 | ||||
| Desconocido | 67 | 6 | ||||
MF/SS: micosis fungoide/síndrome de Sézary.
La inmensa mayoría de los pacientes no presentó enfermedad ganglionar (1.811, 89,7%). En 132 casos (6,5%) dicha afectación se registró como desconocida, no evaluada o no aplicable. Tan solo 77 pacientes presentaron enfermedad ganglionar (3,8%). La afectación visceral al diagnóstico resultó muy infrecuente, objetivándose únicamente en 6 casos (0,3%).
Las diferencias entre linfomas MF/SS y no MF/SS se encuentran desglosadas en la tabla 2. Se debe señalar, respecto al grupo MF/SS, que únicamente el 6,8% de los pacientes presentó afectación en sangre periférica.
En la tabla 3 se recoge la estadificación clínica global de los pacientes con MF/SS. Más de la mitad de los pacientes se encontraban en estadio I (826/1.112, 74,3%), de los cuales la mayoría presentaba estadio IA (518, 46,6% del total del grupo); 184 casos (16,6%) presentaban enfermedad avanzada (estadio igual o superior a IIB). El porcentaje de pacientes en los cuales no se tuvo constancia del estadio fue del 6,3%.
Distribución por estadios clínicos en el grupo de pacientes MF/SS, haciendo referencia al momento de inclusión en el registro
| Estadio clínico | n | % |
|---|---|---|
| IA | 518 | 46,6 |
| IB | 308 | 27,7 |
| IIA | 32 | 2,9 |
| IIB | 92 | 8,3 |
| IIIA | 18 | 1,6 |
| IIIB | 17 | 1,5 |
| IVA1 | 45 | 3,7 |
| IVA2 | 9 | 0,8 |
| IVB | 3 | 0,3 |
| Desconocido | 70 | 6,3 |
| Total | 1112 | 100 |
MF/SS: micosis fungoide/síndrome de Sézary.
En la práctica totalidad de los 2020 pacientes se realizaron pruebas analíticas de laboratorio (1.980, 98%) y se procedió con un examen histológico en todos ellos, entre los cuales fueron precisas técnicas de inmunohistoquímica en 1.909 (94,5%) y biología molecular en 1.358 (67,2%).
En 1.491 pacientes se obtuvieron imágenes clínicas (73,8%) y en 1.677 se llevaron a cabo pruebas complementarias radiológicas (1.677, 83%).
Tratamientos empleadosEn la tabla 4 se muestra el abanico de tratamientos empleados en el total de la muestra del registro. Los corticoides tópicos fueron con diferencia el fármaco prescrito con más frecuencia (1.369 pacientes, 67,8% del total). A continuación, figuran la fototerapia (890 pacientes, 44,1%) en sus diversas modalidades, la cirugía (412, 20,4%) y la radioterapia (384, 19%).
Desglose de los diferentes tratamientos empleados en el manejo de los LCP en el registro
| Tratamiento | n | % |
|---|---|---|
| Esteroides tópicos | 1369 | 67,8 |
| Mostaza nitrogenada tópica | 23 | 1,1 |
| Carmustina tópica (BCNU) | 24 | 1,2 |
| Bexaroteno tópico | 31 | 1,5 |
| PUVA | 484 | 24,0 |
| Re-PUVA | 34 | 1,7 |
| UVB banda estrecha | 372 | 18,4 |
| Baño de electrones | 66 | 3,3 |
| Radioterapia | 384 | 19,0 |
| Quimioterapia sistémica | 246 | 12,2 |
| Cirugía | 412 | 20,4 |
| Retinoides sistémicos | 92 | 4,6 |
| Interferón | 163 | 8,1 |
| Anticuerpos de fusión con toxinas | 6 | 0,3 |
| Inhibidores de deacetilasa de histona | 11 | 0,5 |
| Anticuerpos anti-CD20 IV | 107 | 5,3 |
| Anticuerpos anti-CD20 sc | 71 | 3,5 |
| Trasplante de médula ósea | 25 | 1,2 |
IV: intravenosa; PUVA: psoralenos más radiación ultravioleta A; Re-PUVA: PUVA en combinación con retinoides; SC. subcutánea.
En cuanto al número de tratamientos empleados por paciente, aproximadamente 2terceras partes de la muestra recibieron uno (713 pacientes, 35,3%) o 2tratamientos (623, 30,9%); 327 pacientes precisaron 3 líneas terapéuticas distintas (16,2%) y hasta en 316 casos (15,7%) fue necesario llegar hasta 4 o más tratamientos. Únicamente en 41 pacientes (2,0%) no se empleó ninguna terapia para el manejo de la enfermedad.
EvoluciónLa evolución y la respuesta al tratamiento de los pacientes del registro se encuentra recogida en las tablas 5 y 6. A grandes rasgos se observó que algo más de la mitad de los pacientes (1.134, 56,1%) alcanzan una respuesta terapéutica, la mayoría de ellos completa. Algo más de la cuarta parte (546, 27%) se han mantenido estables y aproximadamente el 10% de los pacientes han tenido una evolución negativa hacia la progresión de su enfermedad o fallecimiento.
Desglose de las respuestas al tratamiento en grupos MF/SS y no MF/SS
| Estado actual paciente | MF/SS | No MF/SS | Total | |||
|---|---|---|---|---|---|---|
| N | % | n | % | n | % | |
| Remisión completa | 307 | 27,6 | 574 | 63,2 | 881 | 43,6 |
| Remisión parcial | 197 | 17,7 | 59 | 6,5 | 256 | 12,7 |
| Enfermedad estable | 413 | 37,1 | 133 | 14,6 | 546 | 27,0 |
| Enfermedad progresiva | 78 | 7,0 | 32 | 3,5 | 110 | 5,4 |
| Pérdida de seguimiento | 54 | 4,9 | 63 | 6,9 | 117 | 5,8 |
| Fallecimiento | 55 | 4,9 | 31 | 3,4 | 86 | 4,3 |
| Recaída | 7 | 0,6 | 15 | 1,7 | 22 | 1,1 |
| Desconocido | 1 | 0,1 | 1 | 0,1 | 2 | 0,1 |
MF/SS: micosis fungoide/síndrome de Sézary.
Evolución por compartimentos en grupos MF/SS y no MF/SS
| Estado actual | MF/SS | No MF/SS (resto) | Total | |||
|---|---|---|---|---|---|---|
| n | % | n | % | n | % | |
| Enfermedad cutánea actual | ||||||
| No | 344 | 30,9 | 622 | 68,5 | 966 | 47,8 |
| Sí | 711 | 63,9 | 238 | 26,2 | 949 | 47,0 |
| Desconocido | 57 | 5,1 | 48 | 5,3 | 105 | 5,2 |
| Enfermedad ganglionar actual | ||||||
| No | 937 | 84,3 | 810 | 89,2 | 1747 | 86,5 |
| Sí | 64 | 5,8 | 20 | 2,2 | 84 | 4,2 |
| Desconocido | 111 | 10,0 | 78 | 8,6 | 189 | 9,4 |
| Enfermedad visceral actual | ||||||
| No | 962 | 86,5 | 802 | 88,3 | 1764 | 87,3 |
| Sí | 16 | 1,4 | 8 | 0,9 | 24 | 1,2 |
| Desconocido | 134 | 12,1 | 98 | 10,8 | 232 | 11,5 |
| Enfermedad sanguínea actual | ||||||
| No | 896 | 80,6 | 713 | 79,0 | 1609 | 79,9 |
| Sí | 64 | 5,8 | 8 | 0,9 | 72 | 3,6 |
| Desconocido | 152 | 13,7 | 182 | 20,2 | 334 | 16,6 |
MF/SS: micosis fungoide/síndrome de Sézary.
En cuanto a la afectación aislada a nivel de cada compartimento, actualmente el 47,6% (962) de los pacientes presentan enfermedad cutánea y el 47,0% (950) se encuentra libres de enfermedad en piel, no disponiendo de datos del 5,4% restante. El 4,2 (84), el 1,2 (24) y el 3,6% (72) de los pacientes presentan al finalizar el estudio afectación ganglionar, visceral y de sangre periférica, respectivamente.
El desglose comparativo entre el grupo MF/SS y los linfomas no MF/SS se detalla también en dichas tablas 5 y 6. La principal diferencia se aprecia en el porcentaje de pacientes con remisión completa, lo cual se ve reflejado en el porcentaje de aquellos que presentan enfermedad cutánea actual: más del 60% de pacientes no MF/SS se encuentran en RC, mientras que menos del 30% de MF/SS presentan en este momento dicha situación. Además, el porcentaje de pacientes con enfermedad progresiva en el grupo MF/SS dobla al del grupo no MF/SS (7% vs. 3,5%).
DiscusiónLos LCP son un conjunto de enfermedades raras, con una incidencia baja estimada en aproximadamente 1/100.000 personas/año7. Diversos estudios de Alemania8, Reino Unido9, Noruega10, Dinamarca11 y Francia12 reflejan tasas de incidencia entre 2,9 y 4 casos × 106/año. Dicha baja frecuencia fue el motivo de iniciar este registro nacional hace 5 años, el cual nació con el objetivo de facilitar la investigación colaborativa, dando ya sus primeros frutos a lo largo de estos años con diversas publicaciones en revistas internacionales13-15. Además a lo largo de estos años hemos podido apreciar que la incorporación de pacientes al registro se ha mantenido estable, oscilando en una horquilla entre 348 y 411 pacientes por año, tras los 504 que se incluyeron en el año inicial (hecho previsible teniendo en cuenta la gran incorporación inicial de todos los casos prevalentes no incidentes en los centros participantes). La inclusión de números muy parecidos en el primer año y los sucesivos se explica en gran parte por el notable aumento de los centros participantes en el estudio, que ha progresado desde los 16 iniciales hasta 33 en la actualidad.
En cuanto a los resultados, la proporción de los diagnósticos en nuestra serie es similar a la descrita en la literatura1,16, aunque con pequeñas diferencias. Los LCCT suponen el 72% aproximadamente del registro, por el 27% de LCCB. La MF (incluyendo sus variantes) fue la enfermedad más frecuente con algo más de la mitad de los casos (52,3%), seguida de los LZM (13,9%) y LCF (11,3%). En contraste con la última actualización de la WHO-EORTC se observó una ligera mayor proporción de MF y de LCCB1. La media de edad al diagnóstico ha sido de 55,6 años. En cuanto a la distribución por sexos, se aprecia una relación hombre/mujer de 1,4:1. Estos datos resultan similares a los referidos en el estudio descriptivo del primer año del Registro3. La proporción de LZM y LCF dentro del grupo de LCCB, así como la de PL y LACG en el grupo de LTCD30+, han resultado muy similares a las del primer año3. Continúa llamando la atención la práctica igualdad en la proporción de LZM y LCF, lo cual no se refleja en las últimas revisiones a gran escala1,16, pero ya ha sido descrito en otros estudios8. El perfil de los LTCD30+ no difiere de lo descrito en la literatura1,17,18. La PL, con el doble de casos que el LACG y la enfermedad linfoproliferativa T CD4+ de células pequeñas/medianas, continúa siendo en frecuencia el segundo trastorno linfoproliferativo cutáneo T (10,5% de los casos, 7,5% del total).
Los pacientes en fases avanzadas son un porcentaje reducido del global de los incluidos en el Registro. En el grupo MF/SS representa el 16,5% de los casos y únicamente el 8,2% de MF/SS se encuentran en estadio III-IV. Respecto al resto de linfomas este porcentaje también es muy bajo. En nuestro registro podría interpretarse que los pacientes con MF/SS presentan una peor evolución, con una proporción de pacientes con enfermedad progresiva que duplica la observada en el grupo no MF/SS, presentando este último grupo el doble de RC postratamiento en relación con el grupo MF/SS.
Entre las limitaciones del registro está la posibilidad de que los diagnósticos no sean precisos (dado que no son centralizados) y la variabilidad entre los distintos centros, ya que si bien las guías clínicas sirven para unificar procedimientos y tratamientos existen variaciones insalvables entre unos centros y otros (p. ej., las derivadas de la mayor o menor capacidad de recursos diagnósticos menos accesibles, como pueden ser las pruebas genéticas). La proporción de enfermos puede verse alterada porque en algunos centros aquellos pacientes con formas clínicas más graves o avanzadas son controlados por los servicios de Hematología. Sin embargo, la inclusión de pacientes consecutivos en todos los centros y el gran número de centros participantes deberían limitar el sesgo de selección y hacer la muestra muy representativa de la realidad nacional.
ConclusionesEn líneas generales, las características clínicas del paciente con linfoma primario cutáneo en España resultan similares a otras series publicadas en la literatura. El clásico porcentaje 75-25% para MF/SS respecto a otros linfomas se respeta en nuestra serie. La MF es con diferencia la entidad más frecuente, seguida por los LZM y los LCF. La mayoría de los pacientes se encuentran en estadios precoces de la enfermedad, presentando en más del 50% de los casos una respuesta completa/parcial tras los distintos tratamientos y en un 25% una enfermedad estable.
El Registro de linfomas cutáneos de la AEDV permite la realización de estudios clínicos sobre estas enfermedades raras y facilita la accesibilidad a grupos de pacientes para estudios posteriores, incluso prospectivos.
Conflicto de interesesLa Fundación Piel Sana Academia Española de Dermatología y Venereología es la promotora del Registro Español de Linfoma Cutáneo Primario (RELCP). Kyowa Kirin colabora en gastos de mantenimiento del registro. Las compañías colaboradoras no participan en el diseño o desarrollo de los estudios, en la preparación de los manuscritos ni en las decisiones sobre su publicación.
Marina de Vega (Fundación Piel Sana AEDV), monitora de registro.