Los indicadores de calidad son una herramienta clave como garantía de calidad y homogenización de la asistencia sanitaria. En este contexto, la Academia Española de Dermatología y Venereología ha diseñado el proyecto CUDERMA (Certificación de unidades de dermatología), una iniciativa que busca definir indicadores de calidad para certificar unidades de dermatología en distintos ámbitos, entre los que se seleccionaron psoriasis y dermato-oncología de forma inicial. Este estudio tuvo por objetivo consensuar los aspectos a evaluar por los indicadores, siguiendo un proceso estructurado para la revisión bibliográfica y elaboración de un set preliminar de indicadores, revisado por un grupo multidisciplinar de expertos, para su evaluación mediante un Consenso Delphi. Un panel de 28 dermatólogos evaluó los indicadores y los clasificó como «básicos» o «de excelencia», generando un conjunto de 84 indicadores consensuados que serán estandarizados para diseñar la norma con la que certificar las unidades de dermato-oncología.
Quality indicators are crucial for standardizing and guaranteeing the quality of health care practices. The Spanish Academy of Dermatology and Venereology (AEDV) launched the CUDERMA Project to define quality indicators for the certification of specialized units in dermatology; the first 2areas selected were psoriasis and dermato-oncology. The aim of this study was to achieve consensus on what should be evaluated by these indicators using a structured process comprising a literature review and selection of an initial list of indicators to be evaluated in a Delphi consensus study following review by a multidisciplinary group of experts. The selected indicators were evaluated by a panel of 28 dermatologists and classified as either «essential» or «of excellence». The panel agreed on 84 indicators, which will be standardized and used to develop the certification standard for dermato-oncology units.
En las últimas décadas se ha producido un incremento importante de casos de cáncer de piel1,2. Los estudios más recientes estiman una incidencia anual global de 3,6 casos de melanoma cutáneo por 100.000 habitantes y 79,1 casos de cáncer cutáneo no-melanoma3. En España las cifras oscilan entre 3,6 y 14 casos por 100.000 habitantes en el caso del melanoma1,4, y entre 79,7 y 88,7 para el cáncer de piel no-melanoma1.
Además de la elevada incidencia de estas patologías, el cáncer de piel produce una morbimortalidad significativa2,3, acontecimiento especialmente relevante en ciertos cánceres cutáneos no melanoma de baja incidencia pero que producen una morbimortalidad importante (cáncer de células de Merkel, dermatofibrosarcoma, linfomas cutáneos). Esta morbimortalidad conlleva una pérdida de años de vida potenciales considerable5,6, con la repercusión económica que deriva de ello. Más allá de los costes directos de la atención médica del paciente, así como de los costes asociados a la mortalidad por esta causa, la morbilidad asociada al cáncer cutáneo incurre en un coste indirecto notable, debido al absentismo laboral5. De hecho, el cáncer cutáneo representa la segunda causa de discapacidad en Dermatología7, y tanto el melanoma como el grupo de cáncer cutáneo no melanoma se encuentran entre los 25 tipos de cáncer que mayor discapacidad producen3.
Ante esta realidad, las unidades de dermato-oncología especializadas son clave para el abordaje de los pacientes8. No obstante, la labor asistencial de dichas unidades en España es heterogénea9, por lo que es necesario establecer unos objetivos evaluables que definan aquellos aspectos esenciales para la asistencia sanitaria en dermato-oncología y que permitan mejorar la calidad asistencial de las unidades.
La definición de indicadores de calidad pone de manifiesto el grado en que la infraestructura, los recursos disponibles o el desempeño de la unidad garantizan un estándar de calidad mínimo. Por ello, estos indicadores se han erigido como una estrategia especialmente útil para evaluar la actividad de un servicio o unidad, identificar aspectos de mejora de este, así como para certificar unidades funcionales10,11.
El proyecto CUDERMA (Certificación de Unidades de Atención en Dermatología) es una propuesta de la Academia Española de Dermatología y Venereología (AEDV) para crear un conjunto de indicadores que permitan certificar las unidades funcionales de dermatología, promoviendo la calidad en la asistencia sanitaria. El proyecto CUDERMA se plantea en tres fases. La primera pretende identificar aquellos conceptos que deben ser evaluados por los indicadores de calidad. En una segunda fase se normalizarán y estandarizarán los aspectos consensuados previamente, estableciendo nombre, definición, estándar, nivel objetivo de cumplimiento y evidencias de cumplimiento. Una vez definida la norma se certificarán las unidades. El objetivo de este estudio fue consensuar aquellos aspectos que deben incluir los indicadores para la certificación de las unidades de dermato-oncología.
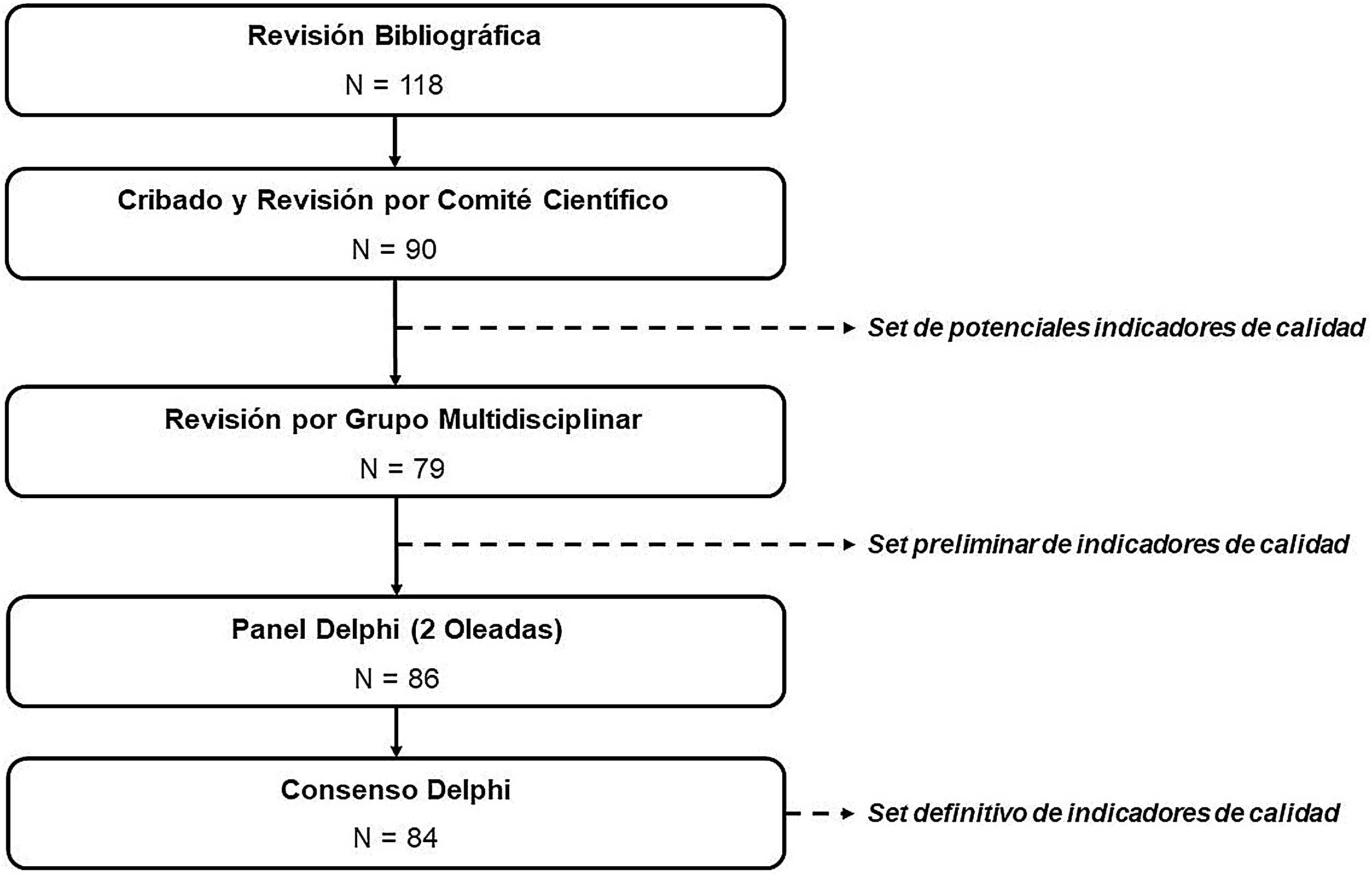
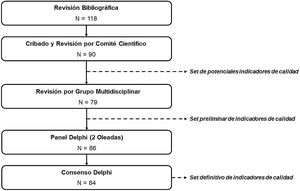
Material y métodosPara la selección de los conceptos que deben ser evaluados por los indicadores de calidad se diseñó un proceso estructurado basado en la identificación y el cribado de potenciales indicadores, seguido del consenso de aquellos aspectos relevantes para certificar unidades de dermato-oncología a través de la metodología Delphi (fig. 1).
El método Delphi busca alcanzar el consenso de un grupo de participantes, conocido como panel Delphi, por medio de cuestionarios individuales. En rondas sucesivas, los panelistas valoran los aspectos propuestos mediante escalas Likert, además de poder aportar comentarios. Las respuestas obtenidas en una ronda se emplean para diseñar cuestionarios personalizados en la siguiente. Así, en última instancia, permiten determinar el grado de consenso sobre cada aspecto evaluado12-14.
En este caso, el proyecto se dividió en 3 etapas: 1)identificación de potenciales indicadores; 2)revisión por un grupo de expertos multidisciplinar, y 3)Consenso Delphi.
Grupo de trabajoEl proyecto CUDERMA fue liderado por un grupo de trabajo compuesto por 4 miembros del grupo coordinador y un comité científico formado por 7 dermatólogos con experiencia en dermato-oncología (material suplementario, Tabla A.1), todos miembros del grupo español de dermato-oncología y cirugía de la AEDV. El grupo contó con el apoyo de 3 metodólogos.
Fase 1: Identificación de potenciales indicadores de calidadLa identificación de los indicadores se realizó mediante una revisión bibliográfica estructurada de acuerdo con las pautas descritas por la metodología PRISMA (Preferred Reporting Items in Systematic Reviews and Meta-Analyses) (material suplementario, Tabla A.2).
Las referencias identificadas en la revisión contenían información sobre aspectos relevantes a evaluar para la certificación de unidades de dermato-oncología, desde las que se tomaron los indicadores potenciales. El grupo de trabajo se encargó de cribar los indicadores identificados en la literatura, además de proponer nuevos indicadores.
Los indicadores resultantes se clasificaron como «estructura», «proceso» y «resultado», según si medían características esenciales que deben estar presentes en una unidad de dermato-oncología, pautas seguidas por esta para el desempeño de su labor asistencial; o resultados obtenidos por su actividad10, respectivamente. El resultado obtenido fue el set de potenciales indicadores de calidad.
Fase 2: Revisión por el grupo multidisciplinarEl set de indicadores potenciales se presentó a un grupo multidisciplinar compuesto por 11 expertos (material suplementario, Tabla A.1): 2 especialistas en Medicina Nuclear, 2 en Oncología Médica, 2 en Oncología Radioterápica, 3 en Anatomía Patológica y 2 en Radiodiagnóstico.
Los expertos del grupo multidisciplinar valoraron la pertinencia de cada indicador en un cuestionario. También pudieron realizar comentarios, sugerir modificaciones y proponer indicadores nuevos.
El grupo de trabajo elaboró el listado preliminar de indicadores tras revisar las respuestas recibidas.
Fase 3: Consenso DelphiLos indicadores contemplados en el listado preliminar se presentaron a un panel Delphi compuesto por dermatólogos especialistas en dermato-oncología (material suplementario, Tabla A.1). Estos expertos consensuaron los aspectos que deben ser evaluados para certificar unidades de dermato-oncología. El consenso se llevó a cabo en dos rondas, según indica la metodología Delphi.
En la primera ronda se diseñó un cuestionario que incluía el nombre y la definición de cada indicador. Los dermatólogos otorgaron una puntuación a cada indicador comprendida entre 1 y 9, empleando el 1 cuando el indicador se consideraba irrelevante y 9 cuando su relevancia era máxima. Además, los panelistas clasificaron los indicadores como «básico» (aspectos esenciales para el funcionamiento de la unidad de dermato-oncología) o «de excelencia» (aspectos que representan un valor añadido para el funcionamiento de la unidad, consecución de resultados de salud y mejora continua). Se permitió a los panelistas incluir comentarios o modificaciones para cada indicador, así como proponer nuevos indicadores.
Las respuestas recibidas en la primera ronda permitieron estudiar si los indicadores se comprendieron correctamente, así como las nuevas propuestas de indicadores recibidas, con el fin de incluirlas en la segunda ronda. Tras esto se diseñaron los cuestionarios personalizados para cada panelista empleando como base los cuestionarios de la primera oleada. Los nuevos cuestionarios incluyeron la puntuación y el grado otorgados por el experto a cada indicador en la primera ronda, la puntuación promedio obtenida y la proporción de panelistas que establecieron el grado «básico» para cada indicador en la primera ronda. En la segunda ronda no se aceptaron nuevas propuestas de indicadores de calidad.
Para determinar el consenso alcanzado se analizaron las respuestas obtenidas en la segunda oleada mediante el método RAND/UCLA, empleando métodos estadísticos para resumir las respuestas del panel Delphi y establecer el grado de consenso15. De esta forma, se generaron 3 regiones de puntuación (1-3, 4-6 y 7-9) donde ubicar la mediana de las puntuaciones de cada indicador. Además, para caracterizar las respuestas se estimaron la media y la desviación estándar de los resultados obtenidos.
En primera instancia se midió el nivel de acuerdo alcanzado. Cuando 2/3 o más panelistas puntuaron el indicador en la región de la mediana se consideró alcanzado «acuerdo». Si 1/3 o más de las respuestas se ubicaron dentro de la región 1-3 y otro tercio o más de las respuestas pertenecieron a la región 7-9, se consideró «desacuerdo» para ese indicador. En el resto de las situaciones se estableció un acuerdo «indeterminado».
A continuación, en aquellos indicadores en los que se alcanzó «acuerdo» o este fue «indeterminado», se determinó si el acuerdo era a favor o en contra de la inclusión del indicador. En los casos en los que la mediana se encontraba en la región 7-9, la inclusión se consideró «apropiada». Cuando la mediana se ubicó en la región 1-3, la inclusión se definió como «inapropiada». La inclusión de los indicadores cuya mediana de puntuación se situó en el rango 4-6 se estableció como «dudosa».
La metodología descrita se adaptó para definir el grado «básico» o «de excelencia» de cada indicador. Cuando más de 2/3 de los panelistas otorgaron el mismo grado para un indicador, se aceptó el consenso para dicho grado. En caso contrario el grado se consideró «indeterminado». Finalmente, el grupo de trabajo revisó todos los indicadores con consenso «dudoso» para su inclusión, el nivel de acuerdo «indeterminado», o donde no se consensuó el grado. En esta reunión se valoró la inclusión/exclusión de estos indicadores, así como el grado apropiado para ellos.
ResultadosFase 1: Identificación de potenciales indicadores de calidadLa revisión bibliográfica permitió identificar 121 publicaciones (material suplementario, Figura A.1), de las cuales se eliminaron 94 en un primer cribado. La lectura detallada de las 27 publicaciones restantes permitió incluir 118 indicadores en un primer listado16-42.
El grupo de trabajo revisó los indicadores obtenidos de la literatura científica y elaboró un set formado por 90 indicadores potenciales: 36 de estructura, 52 de proceso y 2 de resultado.
Fase 2: Revisión por el grupo multidisciplinarLa revisión realizada por el grupo multidisciplinar permitió reformular las definiciones de los indicadores, su clasificación y, finalmente, reducir el número de indicadores contemplados en el set preliminar hasta 79: 24 de estructura, 51 de proceso y 4 de resultado.
Fase 3: Consenso DelphiLos 79 indicadores incluidos en el set preliminar (tabla 1), avalados por el grupo multidisciplinar, se presentaron al panel Delphi, compuesto por 31 dermatólogos, en la primera ronda.
Indicadores de calidad presentados al panel Delphi
| Indicador | Definición | Fuente (n.° de citas) |
|---|---|---|
| Indicadores de Estructura | ||
| Personal de la Unidad | ||
| 1. Comité multidisciplinar para la evaluación individual de los pacientes | La Unidad dispone de un comité multidisciplinar que cuenta con la participación de profesionales de distintas especialidades, entre las que se puede citar: Oncología Médica, Dermatología, Oncología Radioterápica, Medicina Nuclear, Anatomía Patológica, Radiología, unidades quirúrgicas (Cirugía General, Cirugía Plástica, Cirugía Maxilofacial, etc.), Cuidados Paliativos, personal de Enfermería, Salud Mental, Otorrinolaringología, Farmacia, Trabajo Social o Medicina de Familiaa | (5)24,25,34,38,43 |
| Características de la Unidad | ||
| 2. Unidad integrada en un hospital con Servicio de Urgencias | La Unidad está integrada en un hospital con Servicio de Urgencias para garantizar la continuidad de la asistencia | (3)23,30,42 |
| 3. Unidad integrada en un Servicio de Dermatología con instalaciones para la hospitalización | La Unidad está integrada en un Servicio de Dermatología que tenga acceso a instalaciones de hospitalización, propios del Servicio de Dermatología o de servicios de otras especialidades involucradas en el tratamiento de patologías dermato-oncológicas, para garantizar la continuidad de la asistencia | (2)23,42 |
| 4. Unidad integrada en un hospital con Unidad del Dolor | La Unidad está integrada en un hospital con Unidad de Dolor para garantizar la continuidad de la asistencia | (1)34 |
| 5. Unidad integrada en un hospital con Unidad de Cuidados Paliativos | La Unidad está integrada en un hospital con Unidad de Cuidados Paliativos para garantizar la continuidad de la asistencia | (1)34 |
| 6. Instalaciones ambulatorias y administración de fármacos intravenosos | La Unidad dispone de instalaciones para la asistencia ambulatoria que incluyen la infusión de medicación intravenosa | (1)42 |
| 7. Consulta externa ambulatoria especializada | La Unidad dispone de consultas externas ambulatorias especializadas para realizar la valoración y el seguimiento de los pacientes | (1)42 |
| 8. Unidad con comunicación directa con atención primaria | La Unidad cuenta con un sistema para garantizar la comunicación directa y fluida con los especialistas de atención primaria que derivan a los pacientes a la Unidad | Comité científico |
| Servicios específicos de la Unidad | ||
| 9. Consulta ambulatoria de enfermería especializada | La Unidad dispone de una consulta ambulatoria de enfermería especializada en pacientes dermato-oncológicos | (2)23,42 |
| 10. Evaluación de pruebas y test durante los días laborales | La Unidad garantiza su disponibilidad para la evaluación de pruebas y test de cualquier tipo (analíticas, imagen y/o dermatológicas) durante los días laborales de la semana | (1)23 |
| 11. Servicios y herramientas de salud digital (teledermato-oncología) | La Unidad tiene acceso a herramientas telemáticas de salud digital para poder fomentar el uso de la teledermato-oncología para técnicas de cribado y priorización de pacientes, así como para la monitorización de los casos que se estimen oportunos | (4)20,25,30,42 |
| 12. Vía rápida de valoración por otros especialistas | La Unidad dispone de una vía rápida para que pacientes con tumores complejos, localmente avanzados o metastásicos, sean valorados en un plazo corto por los especialistas necesarios (oncólogo, radioterapeuta…) | Panel Delphi |
| Técnicas y pruebas diagnósticas en la Unidad | ||
| 13. Acceso a dermatoscopios | La Unidad tiene acceso a dermatoscopios | (1)30 |
| 14. Acceso a radioterapia | La Unidad tiene acceso a las herramientas necesarias para la realización de radioterapia en los pacientes que atiende | (2)21,24 |
| 15. Acceso a técnicas de ultrasonido | La Unidad tiene acceso a técnicas de ultrasonido | (2)24,34 |
| 16. Acceso a la realización de analíticas de sangre completas | La Unidad tiene acceso a la realización de analíticas de sangre completas | (1)25 |
| 17. Acceso a fototerapia | La Unidad tiene acceso a tratamientos fototerapéuticos para el abordaje de pacientes con linfomas cutáneos | (3)27,28,34 |
| 18. Acceso a microscopia confocal | La Unidad tiene acceso a técnicas de microscopia confocal | (1)30 |
| 19. Acceso a técnicas diagnósticas de imagen | La Unidad tiene acceso a técnicas de PET-TC, RMN, TAC y ecografía | (3)34,39,43 |
| 20. Acceso a técnicas de estudios moleculares y genéticos | La Unidad tiene acceso a técnicas para estudios moleculares y genéticos | (2)34,43 |
| 21. Acceso a cirugía micrográfica de Mohs | La Unidad dispone de los medios para practicar cirugía micrográfica de Mohs clásica o diferida en parafina | (1)34 |
| 22. Acceso a biopsias de ganglio centinela | La Unidad tiene acceso a la realización de biopsias selectivas del ganglio centinela | (1)43 |
| 23. Acceso a electroquimioterapia | La Unidad tiene acceso a electroquimioterapia | (2)34,43 |
| 24. Acceso a crioterapia | La Unidad tiene acceso a crioterapia | (1)43 |
| 25. Acceso a técnicas citogenéticas | La Unidad tiene acceso a técnicas citogéneticas para el cribado de tumores en situaciones de comportamiento incierto (borderline) | (1)36 |
| 26. Acceso a cirugía menor ambulatoria | La Unidad tiene acceso a un quirófano que dispone de la infraestructura adecuada para llevar a cabo cirugía menor ambulatoria | Panel Delphi |
| 27. Acceso a cirugía con anestesia general o sedación | La Unidad tiene acceso a un quirófano que dispone de la infraestructura adecuada para llevar a cabo cirugías con anestesia general o sedación | Panel Delphi |
| Indicadores de Proceso | ||
| Registros y archivos de información del paciente | ||
| 28. Registro de pacientes tratados en la Unidad | La Unidad lleva a cabo un registro actualizado de los pacientes tratados en el servicio | (1)42 |
| 29. Registro de antecedentes del paciente | La Unidad registra en la historia clínica de los pacientes sus antecedentes en relación con su patología dermato-oncológica | (1)39 |
| 30. Informe histológico completo en melanoma | La Unidad recoge un informe histológico completo de todos los pacientes con melanoma, que debe contener la siguiente información: 1) descripción macroscópica de la pieza quirúrgica y de la lesión; 2) diagnóstico de melanoma primario; 3) indicación de carácter infiltrante o in situ; 4) índice de Breslow; 5) nivel de infiltración de Clark; 6) presencia de ulceración; 7) índice mitótico: mitosis/mm2 de tumor; 8) estado de los márgenes quirúrgicos (afectación o no); 9) distancia a los márgenes quirúrgicos laterales y basal; 10) regresión y porcentaje; 11) microsatélites histológicos; 12) presencia de infiltrado linfocitario y tipo; 13) infiltración linfovascular, y 14) presencia de nevus asociados | (1)38 |
| 31. Informe histológico completo en carcinoma epidermoide | La Unidad recoge un informe histológico completo de todos los pacientes con carcinoma epidermoide, que debe contener la siguiente información: 1) localización; 2) grado de diferenciación histológica; 3) tamaño de la lesión; 4) patrón de crecimiento; 5) espesor en profundidad del componente infiltrante (en mm); 6) existencia de invasión perineural y/o linfovascular; 7) grosor del nervio afectado (≥0,1mm o <0,1mm); 8) estatus de los márgenes quirúrgicos; 9) nivel de invasión de Clark; 10) presencia de desmoplasia; 11) presencia de tumor budding (gemación tumoral); 12) ratio tumor / estroma (deseable, pero poco probable que se recoja de manera sistemática), y 13) afectación ganglionar (tamaño del ganglio, número de ganglios, presencia de extensión extracapsular) | Comité científico |
| 32. Informe histológico completo en carcinoma basocelular | La Unidad recoge un informe histológico completo de todos los pacientes con carcinoma basocelular, que debe contener la siguiente información: 1) tamaño tumoral; 2) diferenciación histológica; 3) patrón de crecimiento; 4) nivel de invasión de Clark; 5) existencia de invasión perineural o linfovascular; 6) grosor del nervio afectado, y 7) estado de los márgenes quirúrgicos.De forma opcional se recogerá la presencia de células sombra, claras, sebocitos, células anillo plasmocitoides, etc.; la presencia de estructuras tubulares, y la presencia de espacios pseudoglandulares | Comité científico |
| 33. Informe histológico completo en linfoma cutáneo | La Unidad recoge un informe histológico completo de todos los pacientes con linfoma cutáneo, que debe contener la siguiente información: 1) tipo de linfoma cutáneo: células T o células B; 2) nivel / áreas de infiltración linfocitaria y tejidos afectados; 3) presencia de epidermotropismo; 4) presencia de células atípicas, tipo (células alargadas, células de Sézary, etc.) y localización (piel, periférica, ganglio linfático, etc.); 5) presencia de agrupaciones de linfocitos (microabscesos de Pautrier); 6) presencia de angiodestrucción, y 7) información inmunohistoquímica: biomarcadores CD1a, CD3, CD4, CD5, CD7, CD8, CD10, CD19, CD20, CD21, CD30, CD45RO, BCL-2, BCl-6, PD-1, TOX y Ki 67 | Comité científico |
| 34. Informe anatomopatológico tras la BSCG | La Unidad, tras la realización de BSCG, registra en el informe anatomopatológico: 1) descripción de la región ganglionar intervenida; 2) número de ganglios metastásicos; 3) dimensiones máximas del implante tumoral del ganglio linfático; 4) presencia de extensión extracapsular; 5) número de ganglios extirpados; 6) número de ganglios con metástasis (la proporción únicamente no es válida); 7) localización de la/s metástasis en el ganglio/s afectos; 8) tamaño de la metástasis mayor, y 9) extensión extracapsular | (3)34,36,43 |
| 35. Registro de pacientes en tratamiento con fármacos onco-específicos | La Unidad lleva a cabo un registro actualizado de los pacientes tratados con fármacos onco-específicos | (1)42 |
| 36. Registro de la satisfacción del paciente con el tratamiento recibido | La Unidad registra el grado de satisfacción de los pacientes con los servicios que prestan en la Unidad, entre los que cabe destacar el propio tratamiento, el seguimiento de la enfermedad, el trato con el/la especialista o la información recibida, entre otros | (1)25 |
| 37. Registro de PRO | La Unidad registra PRO de forma periódica en los pacientes tratados en la Unidad | (1)25 |
| 38. Base de datos | La Unidad elabora una base de datos actualizada de los siguientes tumores: melanoma y carcinoma epidermoide | Panel Delphi |
| Calidad y organización de la Unidad | ||
| 39. Vía de acceso urgente al servicio de la Unidad | La Unidad dispone de una asistencia a demanda al menos de lunes a viernes con el objetivo de garantizar al paciente la atención por un especialista en dermato-oncología | (1)42 |
| 40. Biopsia escisional como técnica de referencia | La técnica de biopsia preferentemente empleada por la Unidad es la biopsia escisional, que ofrece mejores resultados que la biopsia incisional o la biopsia por afeitado (realizadas en casos excepcionales) | (1)36 |
| 41. Aplicación de márgenes quirúrgicos de seguridad | Toda lesión clínicamente sospechosa de melanoma cutáneo primario es biopsiada y remitida al servicio de anatomía patológica para la confirmación histológica del diagnóstico. La biopsia es escisional siempre que es posible, con un margen quirúrgico entre 2 y 5mm, y se extiende en profundidad hasta la fascia muscular (sin incluirla).Empleando melanoma a modo de ejemplo, en función del espesor de la pieza extirpada (grosor micrométrico de Breslow) se comprueba la distancia a los márgenes quirúrgicos laterales que deberá ser: 1) in situ: 0,5cm de distancia; 2) ≤1mm de Breslow: 1 cm; 3) 1-2mm de Breslow: 1cm (2cm en localizaciones anatómicas en las que es factible); y 4) >2mm de Breslow: 2cm | (2)38,43 |
| 42. Proceso de verificación de seguridad quirúrgica | La Unidad lleva a cabo el proceso de verificación de seguridad tras la realización de escisiones quirúrgicas de lesiones tumorales en la piel. Este proceso comprende la verificación previa a la intervención (mediante un check-list quirúrgico) y la verificación de muestras extirpadas y localizaciones | (2)38,43 |
| 43. Cirugía electiva realizada por cirujanos/as de la Unidad | Las cirugías programadas se realizan solo por cirujanos de la Unidad especializados en dermato-oncología. Algunos tipos de cirugías podrán ser realizadas en colaboración con otros especialistas | (1)42 |
| 44. Estadificación inicial de un melanoma de alto riesgo | El tiempo de demora entre la visita inicial de un melanoma de alto riesgo pT3b o pT4 y la realización del estudio de extensión completo (analítica general; TC o PET-TC y RMN cerebral) es inferior a 6 semanas | Panel Delphi |
| Protocolos y guías clínicas en la Unidad | ||
| 45. Protocolos clínicos actualizados | La Unidad dispone de un documento actualizado en el que se recoja y describa el diagnóstico, el tratamiento y el seguimiento del paciente con cáncer cutáneo. El protocolo podrá llevar asociados los PNT de los procedimientos que cada hospital estime necesarios. El protocolo debe estar actualizado al menos cada 2años y debe estar disponible para los profesionales (formato digital y/o papel) | (5)24,25,38,42,43 |
| 46. Protocolos actualizados para el tratamiento de eventos adversos | La Unidad dispone de un protocolo propio actualizado y/o sigue las recomendaciones de las guías de práctica clínica nacionales y/o internacionales que describan los procedimientos que deben seguirse en caso de que se produzcan eventos adversos propios de la medicación empleada en dermato-oncología | Comité científico |
| Calidad y organización del personal de la Unidad | ||
| 47. Formación actualizada del personal sanitario | La Unidad garantiza que el personal sanitario que forma parte del equipo participa, al menos una vez al año, en una actividad de formación en materia de dermato-oncología | (4)21,25,30,39 |
| 48. Formación del personal sanitario en habilidades comunicativas | La Unidad garantiza la formación del personal sanitario que la compone en habilidades comunicativas | (2)16,39 |
| 49. Equipo multidisciplinar identificable asignado por paciente | Cada paciente debe tener asignado un equipo multidisciplinar de especialistas específico e identificable, designado como responsable de su asistencia | (1)38 |
| Control y calidad al diagnóstico del paciente | ||
| 50. Evaluación de pacientes por comité multidisciplinar | La Unidad realiza la toma de decisiones y propuesta terapéutica de cada caso mediante el trabajo conjunto de un comité multidisciplinar | (2)38,43 |
| 51. Exéresis en pacientes con lesión sospechosa | Los pacientes con lesión sospechosa de melanomab remitidos desde atención primaria son evaluados y se les realiza la exéresis de la lesión antes de 7 días hábiles | (2)38,43 |
| 52. Valoración completa de los pacientes en la primera visita | Aquellos pacientes con sospecha clínica de cáncer de piel deberán tener cumplimentado por su dermatólogo en la historia clínica una hoja de anamnesis con las siguientes características: 1) evolución de la lesión: cronología y síntomas o signos que motivan la consulta; 2) palpación de cadena ganglionar; 3) descripción macroscópica de la lesión: localización, tamaño, pigmentación, tipo clínico, ulceración, palpación, presencia de pápulas o nódulos, tamaño, áreas de regresión, etc.; 4) descripción del estudio dermatoscópico de la lesión, y 5) documentación iconográfica de la lesión | (2)38,43 |
| 53. Emisión del informe histológico de forma efectiva | Las muestras de aquellos pacientes con sospecha clínica de cáncer deben remitirse al servicio de anatomía patológica etiquetada como «biopsia urgente» (en caso de melanoma y carcinoma de células de Merkel), evitando tiempos de demora (2 días hábiles máximo), como almacenamiento temporal en el quirófano, etc. El informe del estudio anatomopatológico debe estar disponible en el curso de 2 semanas, siendo posible la extensión del plazo en el caso de emplear técnicas especiales para su análisis que requieran plazos más amplios | (2)38,43 |
| 54. Prescripción del tratamiento complementario en pacientes que lo requieren | La Unidad prescribe los tratamientos complementarios que pueden precisar determinados pacientes en un plazo inferior a 30 días tras acabar la estadificación inicial del tumor | (1)38 |
| Seguimiento del paciente: hospitalizaciones | ||
| 55. Participación en hospitalización del paciente | El ingreso hospitalario no interrumpe la continuidad de la asistencia: el equipo de la Unidad supervisa el tratamiento y la asistencia durante la hospitalización | (1)42 |
| 56. Tratamiento antitrombótico en hospitalizados | Se indica tratamiento antitrombótico en profilaxis para todos los pacientes con patología dermato-oncológica que lo requieran, según protocolo | (1)42 |
| Seguimiento del paciente: evaluación de los tratamientos | ||
| 57. Propuesta de tratamiento adyuvante | La Unidad ofrece a sus pacientes la posibilidad de recibir tratamiento adyuvante a los pacientes antes de 60 días desde la última cirugía | (2)38,43 |
| 58. Acceso a todos los tratamientos disponibles | La Unidad garantiza el acceso de los pacientes a todos los tratamientos descritos en las guías de práctica clínica para el tratamiento de su patología | (2)34,40 |
| 59. Pruebas complementarias rutinarias en pacientes con metástasis | La Unidad realiza pruebas complementarias de forma rutinaria en pacientes con metástasis diagnosticadas en fase asintomática subsidiarias de un tratamiento temprano con intención curativa | (1)36 |
| 60. Pacientes identificados como no candidatos a tratamiento activo | La Unidad identifica y refleja en historia clínica a aquellos pacientes oncológicos que por su condición de salud no son candidatos a recibir tratamiento activo | (2)38,43 |
| 61. Conciliación farmacoterapéutica | La Unidad realiza una conciliaciónc y seguimiento de los fármacos y medicación concomitante que recibe el paciente en la valoración inicial de la patología y al alta médica | (2)38,43(1)44 |
| 62. Programa de vigilancia clínica y de laboratorio de efectos secundarios | La Unidad dispone de un programa de vigilancia para prevenir, detectar y tratar precozmente efectos secundarios asociados al tratamiento | (1)42 |
| 63. Prevención primaria de las lesiones tumorales en la piel | La Unidad participa en actividades de prevención primaria de las lesiones dermato-oncológicas | (3)38,39,43 |
| Seguimiento del paciente: medidas adicionales | ||
| 64. Seguimiento periódico mediante la realización de hemogramas | La Unidad realiza una monitorización periódica y sistemática del hemograma en los pacientes tratados con fármacos inmunosupresores cada 3-6 meses | (1)42 |
| 65. Seguimiento periódico de pacientes | La Unidad realiza un seguimiento estrecho de los pacientes en tratamiento cada 3 meses durante los dos primeros años desde el inicio de la terapia y cada 6 meses para los 3 años posteriores. El seguimiento se puede realizar con escáner de TAC, RMN y/o PET | (5)17,32,33,36,43 |
| 66. Seguimiento rutinario de la historia clínica | La Unidad realiza un seguimiento rutinario de la historia clínica de sus pacientes, de forma que la historia clínica refleja el seguimiento de todo el proceso de la enfermedad | (1)31 |
| 67. Seguimiento dermatoscópico digital | La Unidad realiza seguimiento dermatoscópico digital en pacientes con síndrome nevus displástico, nevus displástico múltiple, antecedentes personales de nevus y/o antecedentes personales de melanoma múltiple | Comité científico |
| 68. Estudio de mortalidad en pacientes | La Unidad completa un análisis descriptivo anual de mortalidad por causa que incluye los casos de exitus asociados a procesos tumorales, estadio TNM inicial, supervivencia global del paciente y causa secundaria de fallecimiento | (3)25,38,43 |
| Seguimiento de pacientes: control y tratamiento de enfermedades | ||
| 69. Terapia antiviral en pacientes HBsAg | Todos los pacientes de la Unidad positivos para HBsAg reciben fármacos antivirales mientras son tratados con un fármaco inmunosupresor. La prescripción de estos fármacos se realiza de forma coordinada con hepatología | (1)42 |
| 70. Programa de cribado de cáncer de piel | La Unidad dispone de programas específicos para el cribado de cáncer de piel, que contemplan el seguimiento e identificación de pacientes con alto riesgo de desarrollar cáncer cutáneo, así como el acceso prioritario de tumores dermatológicos desde atención primaria | (1)25 |
| 71. Cribado de TB | La Unidad realiza un cribado de TB previamente a iniciar una terapia inmunosupresora mediante test específicos y radiografía de tórax | (1)42 |
| 72. Cribado de VHB | La Unidad realiza un cribado de VHB previamente a iniciar una terapia inmunosupresora mediante test específicos | (1)42 |
| Comunicación activa con el paciente | ||
| 73. Educación sanitaria del paciente | La Unidad fomenta la educación sanitaria del paciente para mejorar sus conocimientos sobre la patología y los tratamientos que recibe | (6)25,26,29-31,33 |
| 74. Información adecuada al paciente | La Unidad informa al paciente y/o sus familiares sobre las opciones terapéuticas que ofrece su enfermedad y facilita las opciones terapéuticas específicas para su caso, promoviendo la toma de decisiones compartida | (3)26,30,31 |
| 75. Información beneficio / riesgo sobre tratamientos disponibles | Se documenta en la historia clínica que el paciente ha recibido la información adecuada respecto a beneficios y riesgos antes de iniciar un tratamiento | (1)42 |
| 76. Información de acceso a la Unidad | La Unidad dispone de un medio para facilitar a los pacientes los datos de contacto de la Unidad (teléfono de contacto y horario de atención) | (1)42 |
| 77. Actividad en asociaciones de pacientes | La Unidad participa de forma activa en eventos de asociaciones de pacientes como formaciones, actividades de divulgación, etc. | Comité científico |
| Aportación a la investigación | ||
| 78. Proyecto de investigación científica | La Unidad lleva a cabo o participa en proyectos de investigación sobre dermato-oncología y difunde los nuevos hallazgos | (4)25,26,35,42 |
| 79. Acceso a ensayos clínicos | La Unidad tiene la posibilidad de incluir a sus pacientes en ensayos clínicos | (1)34 |
| 80. Participación en proyectos internacionales | La Unidad participa en proyectos internacionales como congresos, redes, investigaciones, etc. | (1)25 |
| 81. Participación en grupos o redes de patología dermato-oncológica | La Unidad participa en grupos cooperativos o redes nacionales/internacionales de patología dermato-oncológica | Panel Delphi |
| Indicadores de Resultado | ||
| Variables clínicas de desempeño de la Unidad | ||
| 82. Registro de infecciones posquirúrgicas | La Unidad registra en la historia clínica de los pacientes con afecciones dermato-oncológicas la aparición o ausencia de infecciones producidas como consecuencia de un procedimiento quirúrgico realizado por la Unidad. El porcentaje de pacientes cuya historia clínica presenta registrada la aparición de infecciones producidas tras una intervención quirúrgica es superior al 80% | Comité científico |
| 83. Registro de eventos adversos | La Unidad registra en la historia clínica de los pacientes con afecciones dermato-oncológicas la aparición o ausencia de eventos adversos producidos como consecuencia de una terapia adyuvante o paliativa prescrita por la Unidad. El porcentaje de pacientes cuya historia clínica presenta registrada la aparición de eventos adversos es superior al 80% | (1)38 |
| 84. Reintervenciones por márgenes afectos | La Unidad reporta una proporción inferior al 20% de reintervenciones por márgenes afectos en exéresis primaria de aquellos casos de carcinoma de células basales y carcinoma de células escamosas | Comité científico |
| 85. Correlación diagnóstica clínico-patológica | La Unidad reporta una proporción superior al 75% de neoplasias con diagnóstico clínico correcto, entendiendo este como la correlación entre el diagnóstico de presunción clínico y el diagnóstico final histológico (asumiendo este último como el gold standard de diagnóstico) | Comité científico |
| 86. Pacientes con melanoma cutáneo a los que se realiza disección ganglionar completa tras BSCG positiva | El porcentaje de pacientes con melanoma cutáneo a los que se realiza la disección ganglionar completa tras una BSGC positiva es inferior al 20% | Panel Delphi |
BSCG: biopsia selectiva de ganglio centinela; CT: computarized tomography (tomografía computarizada); HBsAg: antígeno de superficie del virus de la hepatitis B; PET: positron emission tomography; PNT: procedimiento normalizado de trabajo; PRO: patient reported outcome; RMN: resonancia magnética nuclear; TAC: tomografía axial computarizada; TB: tuberculosis; VHB: virus de la hepatitis B.
Los/as especialistas que forman parte del comité multidisciplinar dependerán de la/s enfermedad/es dermato-oncológica/s que aborda la unidad.
Se considera lesión sospechosa de melanoma si presenta uno o varios de los criterios ABCDEF: A) lesión de forma asimétrica; B) bordes irregulares y dentados; C) color heterogéneo; D) diámetro >0,6cm; E) evolución brusca sobre su tamaño, color y grosor, y F) «patito feo»: se considera aquella lesión pigmentaria que se muestra diferente al resto de las lesiones de un mismo paciente.
«Proceso formal [llevado a cabo por el farmacéutico/a hospitalario] que consiste en valorar el listado completo y exacto de la medicación previa del paciente conjuntamente con la prescripción farmacoterapéutica después de la transición asistencial. Discrepancias duplicadas o interacciones entre el tratamiento crónico y el hospitalario deben comentarse con el médico y, si procede, modificar la prescripción médica.»
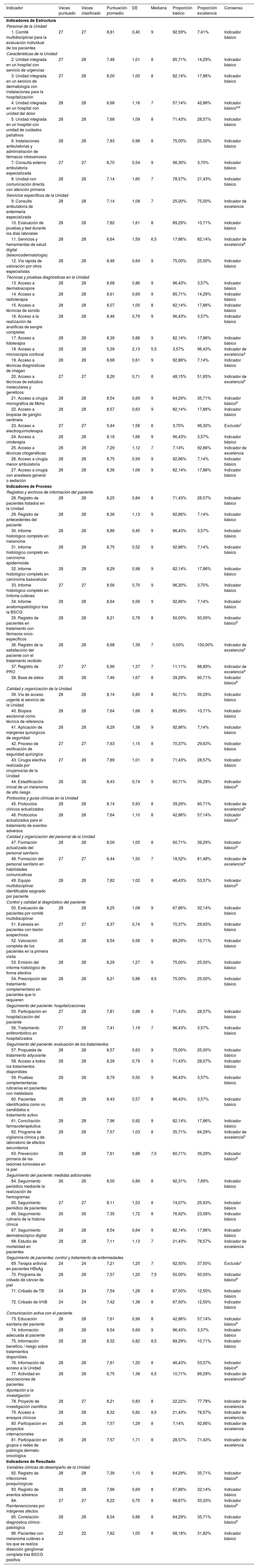
De cara a la segunda ronda se añadieron 7 indicadores nuevos (3 de estructura, 3 de proceso y 1 de resultado), de manera que los expertos evaluaron 86 indicadores en total (tabla 1). En esta ronda se recibieron los cuestionarios cumplimentados de 28 dermatólogos.
Los resultados obtenidos en la segunda ronda, así como el consenso alcanzado en cuanto a la inclusión/exclusión de los indicadores y su grado («básico» vs. «de excelencia»), se presentan en la tabla 2.
Consenso: Resultados del panel Delphi
| Indicador | Veces puntuado | Veces clasificado | Puntuación promedio | DE | Mediana | Proporción básico | Proporción excelencia | Consenso |
|---|---|---|---|---|---|---|---|---|
| Indicadores de Estructura | ||||||||
| Personal de la Unidad | ||||||||
| 1. Comité multidisciplinar para la evaluación individual de los pacientes | 27 | 27 | 8,81 | 0,40 | 9 | 92,59% | 7,41% | Indicador básico |
| Características de la Unidad | ||||||||
| 2. Unidad integrada en un hospital con servicio de urgencias | 27 | 28 | 7,48 | 1,01 | 8 | 85,71% | 14,29% | Indicador básico |
| 3. Unidad integrada en un servicio de dermatología con instalaciones para la hospitalización | 27 | 28 | 8,00 | 1,00 | 8 | 82,14% | 17,86% | Indicador básico |
| 4. Unidad integrada en un hospital con unidad del dolor | 28 | 28 | 6,68 | 1,16 | 7 | 57,14% | 42,86% | Indicador básicoa,b |
| 5. Unidad integrada en un hospital con unidad de cuidados paliativos | 28 | 28 | 7,68 | 1,09 | 8 | 71,43% | 28,57% | Indicador básico |
| 6. Instalaciones ambulatorias y administración de fármacos intravenosos | 28 | 28 | 7,93 | 0,98 | 8 | 75,00% | 25,00% | Indicador básico |
| 7. Consulta externa ambulatoria especializada | 27 | 27 | 8,70 | 0,54 | 9 | 96,30% | 3,70% | Indicador básico |
| 8. Unidad con comunicación directa con atención primaria | 28 | 28 | 7,14 | 1,60 | 7 | 78,57% | 21,43% | Indicador básico |
| Servicios específicos de la Unidad | ||||||||
| 9. Consulta ambulatoria de enfermería especializada | 28 | 28 | 7,14 | 1,08 | 7 | 25,00% | 75,00% | Indicador de excelencia |
| 10. Evaluación de pruebas y test durante los días laborales | 28 | 28 | 7,82 | 1,61 | 8 | 89,29% | 10,71% | Indicador básico |
| 11. Servicios y herramientas de salud digital (teleoncodermatología) | 28 | 28 | 6,64 | 1,59 | 6,5 | 17,86% | 82,14% | Indicador de excelenciaa |
| 12. Vía rápida de valoración por otros especialistas | 28 | 28 | 8,46 | 0,64 | 9 | 75,00% | 25,00% | Indicador básico |
| Técnicas y pruebas diagnósticas en la Unidad | ||||||||
| 13. Acceso a dermatoscopios | 28 | 28 | 8,68 | 0,86 | 9 | 96,43% | 3,57% | Indicador básico |
| 14. Acceso a radioterapia | 28 | 28 | 8,61 | 0,69 | 9 | 85,71% | 14,29% | Indicador básico |
| 15. Acceso a técnicas de sonido | 28 | 28 | 8,07 | 1,05 | 8 | 82,14% | 17,86% | Indicador básico |
| 16. Acceso a la realización de analíticas de sangre completas | 28 | 28 | 8,46 | 0,79 | 9 | 96,43% | 3,57% | Indicador básico |
| 17. Acceso a fototerapia | 28 | 28 | 8,39 | 0,88 | 9 | 82,14% | 17,86% | Indicador básico |
| 18. Acceso a microscopia confocal | 28 | 28 | 5,39 | 2,13 | 5,5 | 3,57% | 96,43% | Indicador de excelenciaa |
| 19. Acceso a técnicas diagnósticas de imagen | 28 | 28 | 8,68 | 0,61 | 9 | 92,86% | 7,14% | Indicador básico |
| 20. Acceso a técnicas de estudios moleculares y genéticos | 27 | 27 | 8,26 | 0,71 | 8 | 48,15% | 51,85% | Indicador de excelenciab |
| 21. Acceso a cirugía micrográfica de Mohs | 28 | 28 | 8,54 | 0,69 | 9 | 64,29% | 35,71% | Indicador básicob |
| 22. Acceso a biopsias de ganglio centinela | 28 | 28 | 8,57 | 0,63 | 9 | 82,14% | 17,86% | Indicador básico |
| 23. Acceso a electroquimioterapia | 27 | 27 | 5,44 | 1,58 | 6 | 3,70% | 96,30% | Excluidoc |
| 24. Acceso a crioterapia | 28 | 28 | 8,18 | 1,66 | 9 | 96,43% | 3,57% | Indicador básico |
| 25. Acceso a técnicas citogenéticas | 28 | 28 | 7,29 | 1,12 | 7 | 7,14% | 92,86% | Indicador de excelencia |
| 26. Acceso a cirugía menor ambulatoria | 28 | 28 | 8,75 | 0,59 | 9 | 92,86% | 7,14% | Indicador básico |
| 27. Acceso a cirugía con anestesia general o sedación | 28 | 28 | 8,36 | 1,06 | 9 | 82,14% | 17,86% | Indicador básico |
| Indicadores de Proceso | ||||||||
| Registros y archivos de información del paciente | ||||||||
| 28. Registro de pacientes tratados en la Unidad | 28 | 28 | 8,25 | 0,84 | 8 | 71,43% | 28,57% | Indicador básico |
| 29. Registro de antecedentes del paciente | 28 | 28 | 8,36 | 1,13 | 9 | 92,86% | 7,14% | Indicador básico |
| 30. Informe histológico completo en melanoma | 28 | 28 | 8,86 | 0,45 | 9 | 96,43% | 3,57% | Indicador básico |
| 31. Informe histológico completo en carcinoma epidermoide | 28 | 28 | 8,75 | 0,52 | 9 | 92,86% | 7,14% | Indicador básico |
| 32. Informe histológico completo en carcinoma basocelular | 28 | 28 | 8,29 | 0,98 | 9 | 82,14% | 17,86% | Indicador básico |
| 33. Informe histológico completo en linfoma cutáneo | 27 | 27 | 8,56 | 0,70 | 9 | 96,30% | 3,70% | Indicador básico |
| 34. Informe anatomopatológico tras la BSCG | 28 | 28 | 8,64 | 0,56 | 9 | 92,86% | 7,14% | Indicador básico |
| 35. Registro de pacientes en tratamiento con fármacos onco-específicos | 28 | 28 | 8,21 | 0,79 | 8 | 50,00% | 50,00% | Indicador básicob |
| 36. Registro de la satisfacción del paciente con el tratamiento recibido | 28 | 28 | 6,68 | 1,39 | 7 | 0,00% | 100,00% | Indicador de excelenciaa |
| 37. Registro de PRO | 27 | 27 | 6,96 | 1,37 | 7 | 11,11% | 88,89% | Indicador de excelenciaa |
| 38. Base de datos | 28 | 28 | 7,46 | 1,67 | 8 | 39,29% | 60,71% | Indicador básicob |
| Calidad y organización de la Unidad | ||||||||
| 39. Vía de acceso urgente al servicio de la Unidad | 28 | 28 | 8,14 | 0,80 | 8 | 60,71% | 39,29% | Indicador básico |
| 40. Biopsia escisional como técnica de referencia | 28 | 28 | 7,64 | 1,68 | 8 | 89,29% | 10,71% | Indicador básico |
| 41. Aplicación de márgenes quirúrgicos de seguridad | 28 | 28 | 8,29 | 1,38 | 9 | 92,86% | 7,14% | Indicador básico |
| 42. Proceso de verificación de seguridad quirúrgica | 27 | 27 | 7,63 | 1,15 | 8 | 70,37% | 29,63% | Indicador básico |
| 43. Cirugía electiva realizada por cirujanos/as de la Unidad | 27 | 28 | 7,89 | 1,01 | 8 | 71,43% | 28,57% | Indicador básico |
| 44. Estadificación inicial de un melanoma de alto riesgo | 28 | 28 | 8,43 | 0,74 | 9 | 60,71% | 39,29% | Indicador básicob |
| Protocolos y guías clínicas en la Unidad | ||||||||
| 45. Protocolos clínicos actualizados | 28 | 28 | 8,14 | 0,93 | 8 | 39,29% | 60,71% | Indicador de excelenciab |
| 46. Protocolos actualizados para el tratamiento de eventos adversos | 28 | 28 | 7,64 | 1,10 | 8 | 42,86% | 57,14% | Indicador básicob |
| Calidad y organización del personal de la Unidad | ||||||||
| 47. Formación actualizada del personal sanitario | 28 | 28 | 8,00 | 1,05 | 8 | 60,71% | 39,29% | Indicador básicob |
| 48. Formación del personal sanitario en habilidades comunicativas | 27 | 27 | 6,44 | 1,50 | 7 | 18,52% | 81,48% | Indicador de excelenciaa |
| 49. Equipo multidisciplinar identificable asignado por paciente | 28 | 28 | 7,82 | 1,02 | 8 | 46,43% | 53,57% | Indicador básicob |
| Control y calidad al diagnóstico del paciente | ||||||||
| 50. Evaluación de pacientes por comité multidisciplinar | 28 | 28 | 8,25 | 1,08 | 9 | 67,86% | 32,14% | Indicador básico |
| 51. Exéresis en pacientes con lesión sospechosa | 27 | 27 | 8,37 | 0,74 | 9 | 70,37% | 29,63% | Indicador básico |
| 52. Valoración completa de los pacientes en la primera visita | 28 | 28 | 8,54 | 0,58 | 9 | 89,29% | 10,71% | Indicador básico |
| 53. Emisión del informe histológico de forma efectiva | 28 | 28 | 8,29 | 1,27 | 9 | 75,00% | 25,00% | Indicador básico |
| 54. Prescripción del tratamiento complementario en pacientes que lo requieren | 28 | 28 | 8,21 | 0,88 | 8,5 | 75,00% | 25,00% | Indicador básico |
| Seguimiento del paciente: hospitalizaciones | ||||||||
| 55. Participación en hospitalización del paciente | 27 | 28 | 7,81 | 0,88 | 8 | 71,43% | 28,57% | Indicador básico |
| 56. Tratamiento antitrombótico en hospitalizados | 27 | 28 | 7,41 | 1,19 | 7 | 96,43% | 3,57% | Indicador básico |
| Seguimiento del paciente: evaluación de los tratamientos | ||||||||
| 57. Propuesta de tratamiento adyuvante | 28 | 28 | 8,57 | 0,63 | 9 | 75,00% | 25,00% | Indicador básico |
| 58. Acceso a todos los tratamientos disponibles | 28 | 28 | 8,39 | 0,79 | 9 | 71,43% | 28,57% | Indicador básico |
| 59. Pruebas complementarias rutinarias en pacientes con metástasis | 28 | 28 | 8,79 | 0,50 | 9 | 96,43% | 3,57% | Indicador básico |
| 60. Pacientes identificados como no candidatos a tratamiento activo | 28 | 28 | 8,43 | 0,57 | 8 | 96,43% | 3,57% | Indicador básico |
| 61. Conciliación farmacoterapéutica | 28 | 28 | 7,96 | 0,92 | 8 | 82,14% | 17,86% | Indicador básico |
| 62. Programa de vigilancia clínica y de laboratorio de efectos secundarios | 28 | 28 | 7,57 | 1,03 | 8 | 35,71% | 64,29% | Indicador de excelenciab |
| 63. Prevención primaria de las lesiones tumorales en la piel | 28 | 28 | 7,61 | 0,88 | 7,5 | 60,71% | 39,29% | Indicador básicob |
| Seguimiento del paciente: medidas adicionales | ||||||||
| 64. Seguimiento periódico mediante la realización de hemogramas | 26 | 26 | 8,00 | 0,89 | 8 | 92,31% | 7,69% | Indicador básico |
| 65. Seguimiento periódico de pacientes | 27 | 27 | 8,11 | 1,53 | 8 | 74,07% | 25,93% | Indicador básico |
| 66. Seguimiento rutinario de la historia clínica | 26 | 26 | 7,35 | 1,72 | 8 | 76,92% | 23,08% | Indicador básico |
| 67. Seguimiento dermatoscópico digital | 28 | 28 | 8,54 | 0,64 | 9 | 82,14% | 17,86% | Indicador básico |
| 68. Estudio de mortalidad en pacientes | 28 | 28 | 7,11 | 1,13 | 7 | 21,43% | 78,57% | Indicador de excelencia |
| Seguimiento de pacientes: control y tratamiento de enfermedades | ||||||||
| 69. Terapia antiviral en pacientes HBsAg | 24 | 24 | 7,21 | 1,25 | 7 | 62,50% | 37,50% | Excluidoc |
| 70. Programa de cribado de cáncer de piel | 28 | 28 | 7,57 | 1,20 | 7,5 | 50,00% | 50,00% | Indicador básicob |
| 71. Cribado de TB | 24 | 24 | 7,54 | 1,28 | 8 | 87,50% | 12,50% | Indicador básico |
| 72. Cribado de VHB | 24 | 24 | 7,42 | 1,38 | 8 | 87,50% | 12,50% | Indicador básico |
| Comunicación activa con el paciente | ||||||||
| 73. Educación sanitaria del paciente | 28 | 28 | 7,61 | 0,99 | 8 | 42,86% | 57,14% | Indicador básicob |
| 74. Información adecuada al paciente | 28 | 28 | 8,54 | 0,69 | 9 | 96,43% | 3,57% | Indicador básico |
| 75. Información beneficio / riesgo sobre tratamientos disponibles | 28 | 28 | 8,32 | 0,82 | 8,5 | 89,29% | 10,71% | Indicador básico |
| 76. Información de acceso a la Unidad | 28 | 28 | 7,61 | 1,20 | 8 | 46,43% | 53,57% | Indicador básicob |
| 77. Actividad en asociaciones de pacientes | 28 | 28 | 6,75 | 1,38 | 6,5 | 10,71% | 89,29% | Indicador de excelenciaa |
| Aportación a la investigación | ||||||||
| 78. Proyecto de investigación científica | 28 | 27 | 8,21 | 0,83 | 8 | 22,22% | 77,78% | Indicador de excelencia |
| 79. Acceso a ensayos clínicos | 28 | 28 | 8,32 | 0,82 | 8,5 | 21,43% | 78,57% | Indicador de excelencia |
| 80. Participación en proyectos internacionales | 28 | 28 | 7,57 | 1,29 | 8 | 7,14% | 92,86% | Indicador de excelencia |
| 81. Participación en grupos o redes de patología dermato-oncológica | 28 | 28 | 7,57 | 1,71 | 8 | 28,57% | 71,43% | Indicador de excelencia |
| Indicadores de Resultado | ||||||||
| Variables clínicas de desempeño de la Unidad | ||||||||
| 82. Registro de infecciones posquirúrgicas | 28 | 28 | 7,39 | 1,10 | 8 | 64,29% | 35,71% | Indicador básicob |
| 83. Registro de eventos adversos | 28 | 28 | 7,96 | 0,69 | 8 | 67,86% | 32,14% | Indicador básico |
| 84. Reintervenciones por márgenes afectos | 27 | 27 | 8,22 | 0,75 | 8 | 66,67% | 33,33% | Indicador básicob |
| 85. Correlación diagnóstica clínico-patológica | 28 | 28 | 8,04 | 0,88 | 8 | 64,29% | 35,71% | Indicador básicob |
| 86. Pacientes con melanoma cutáneo a los que se realiza disección ganglionar completa tras BSCG positiva | 22 | 22 | 7,82 | 1,05 | 8 | 68,18% | 31,82% | Indicador básico |
BSCG: biopsia selectiva de ganglio centinela; HBsAg: antígeno de superficie del virus de la hepatitis B; PRO: patient reported outcome; TB: tuberculosis; VHB: virus de la hepatitis B.
Inclusión del indicador según el criterio del comité científico dado que el panel Delphi no alcanzó consenso acerca de la adecuación del indicador.
El resultado final del consenso fue un conjunto de 84 indicadores (26 de estructura, 53 de proceso y 5 de resultado). De estos, 68 recibieron el grado de «básico» y 16 «de excelencia».
DiscusiónEl proyecto CUDERMA busca estandarizar los requisitos mínimos que deben presentar las unidades funcionales de dermatología para garantizar su calidad y homogeneizar la asistencia sanitaria. Este estudio constituye la primera fase del proyecto CUDERMA dirigido a dermato-oncología. Su objetivo fue consensuar un conjunto de aspectos que permitirían definir una unidad con un perfil adecuado para el seguimiento y tratamiento de pacientes dermato-oncológicos.
Algunos aspectos «básicos» consensuados por los panelistas fueron: a)la presencia de un comité multidisciplinar para el abordaje de los pacientes; b)el acceso a servicios de hospitalización, urgencias, etc. dentro del propio servicio de dermatología o del hospital; c)el acceso a un conjunto de técnicas o terapias imprescindibles para el tratamiento de pacientes con cáncer de piel; d)la realización de informes histológicos completos en distintos tipos de tumores; e)el desarrollo de procedimientos que garanticen la seguridad quirúrgica, o f)el cumplimiento de tiempos concretos para distintos procedimientos.
Los expertos determinaron como aspectos «de excelencia»: a)el registro de medidas de resultado comunicadas por pacientes (PRO, del inglés Patient Reported Outcomes), como la calidad de vida o la satisfacción con el tratamiento; b)la formación en habilidades comunicativas del personal que la compone; o c)la investigación, entre otros.
Si bien este estudio presenta el primer conjunto de indicadores destinado a la certificación de unidades de dermato-oncología, no se trata del primer set de indicadores en este campo. La primera iniciativa española para definir indicadores se llevó a cabo en 2012, liderada por la Sociedad Andaluza de Calidad Asistencial (SADECA). Aquel era un proyecto orientado hacia el melanoma, en el que participó un grupo interdisciplinar de 14 expertos que evaluaron distintos indicadores tomados de la literatura científica mediante técnicas de grupo nominal38. En contrapartida, el proyecto CUDERMA tiene un planteamiento más transversal, que pretende abarcar todos los tipos de cáncer cutáneo, así como una metodología diferente, basada en el método Delphi. Además, el único objetivo de los indicadores propuestos por SADECA fue determinar la calidad asistencial. De hecho, otros proyectos han incorporado estos indicadores como herramienta para medir la labor de las unidades39,43.
Por otra parte, en 2015 se realizó otro estudio para evaluar la adecuación de la infraestructura de las unidades de dermato-oncología. Los responsables de los servicios de dermatología cumplimentaron una encuesta online que les preguntaba sobre la disponibilidad de distintas técnicas o terapias, acceso a instalaciones concretas, registros, circuitos de pacientes…34.
En cualquier caso, todos los indicadores publicados previamente fueron contemplados durante la ejecución del presente estudio y se presentan en el conjunto de indicadores consensuados. Sin embargo, el análisis de los otros proyectos expone la principal fortaleza del presente estudio: la metodología aplicada. El proceso estructurado basado en la metodología Delphi aseguró el rigor al identificar indicadores potenciales, así como la participación de un número elevado de expertos.
Otra de las diferencias del proyecto CUDERMA con las iniciativas previas, que otorga otra fortaleza a considerar, reside en la clasificación de «básico» o «de excelencia». Esta división permite homogeneizar la atención en todas las unidades mediante unos requisitos mínimos para la certificación, y que los centros de mayor experiencia y recursos disponibles puedan aspirar a un nivel de excelencia.
Por su parte, la participación del grupo multidisciplinar en el estudio también le confiere una robustez importante. La visión de otras especialidades dotó a los indicadores de una perspectiva asistencial más amplia, contemplando su papel en el abordaje del cáncer cutáneo. A pesar de que la participación del grupo multidisciplinar se entiende como una fortaleza, cabe destacar que su participación no fue directa en el panel Delphi, sino en una fase previa. Atendiendo esta posible limitación, se trató de preservar sus aportaciones tal y como fueron recibidas.
Por último, en el proyecto CUDERMA se separó el consenso de los conceptos a medir y la definición de los indicadores (nombre, definición, estándar, nivel objetivo de cumplimiento y evidencias de cumplimiento) en dos fases diferenciadas. De esta forma, los aspectos consensuados en este estudio serán estandarizados para la posterior certificación de unidades, demostrando entonces la pertinencia de los aspectos consensuados para garantizar la calidad asistencial en dermato-oncología.
ConclusiónEste estudio permitió consensuar un conjunto de aspectos a evaluar en indicadores de calidad que permitan certificar unidades de dermato-oncología. Algunos aspectos que los dermatólogos determinaron como esenciales para el funcionamiento de las unidades fueron: abordaje de la patología mediante un comité multidisciplinar; acceso a una amplia variedad de servicios, técnicas y terapias; realización de informes histológicos completos; disposición de procedimientos que garanticen la seguridad quirúrgica, y cumplimiento de tiempos en los procedimientos. La inclusión de PRO en la práctica clínica o la promoción de la investigación científica se consideraron aspectos determinantes de la excelencia de las unidades.
FinanciaciónEl proyecto ha sido impulsado y financiado por la Academia Española de dermatología y Venereología (AEDV) con una beca sin restricciones de Abbvie.
La actividad de investigación científica realizada en la Unidad de Melanoma del Hospital Clínic de Barcelona es parcialmente apoyada por las becas PI15/00716, PI15/00956, PI18/00959, PI22/01457 y PI18/00419, procedentes del Fondo de Investigaciones Sanitarias (España), del CIBER de Enfermedades Raras del Instituto de Salud CarlosIII, cofinanciada por ISCIII – Subdirección General de Evaluación y European Regional Devel Fund (ERDF), «A way to make Europe»; AGAUR 2017 SGR 1134 y el Programa CERCA de la Generalitat de Catalunya (España); European Commission under the 6th Framework Programme, Diagnoptics, y European Commission under the HORIZON2020 Framework Programme, iTobos (965221) y Qualitop (875171); National Cancer Institute (NCI) del National Institute of Health (NIH) de Estados Unidos (CA83115). También recibe una beca de la Fundació La Marató de TV3, 201331-30 y 201923-30 (Cataluña, España); y una beca de «Fundación Científica de la Asociación Española Contra el Cáncer» GCB15152978SOEN (España). Una parte de su trabajo se realiza en el Centro Esther Koplowitz (Barcelona).
La actividad de investigación científica de Javier Cañueto es parcialmente apoyada por la beca GRS2139/A/20 (Gerencia Regional de Salud de Castilla y León), por el Instituto de Salud CarlosIII (PI21/01207), cofinanciada por fondos FEDER y por el «Programa de Intensificación del ISCIII» (número de beca INT20/00074).
Conflicto de interesesÍñigo Martínez de Espronceda Ezquerro ha participado en Advisory Boards para LeoPharma y Sanofi. El patrocinador no ejerció influencia en el diseño y la ejecución del estudio, la toma, el manejo, el análisis y la interpretación de los datos, la preparación, la revisión y la aprobación del manuscrito, o la decisión de enviarlo para su publicación.
Sebastian Podlipnik ha participado en Advisory Boards para GalenicumDerma. El patrocinador no ejerció influencia en el diseño y la ejecución del estudio, la toma, el manejo, el análisis y la interpretación de los datos, la preparación, la revisión y la aprobación del manuscrito, o la decisión de enviarlo para su publicación.
Javier Cañueto ha participado en Advisory Boards de Almirall, Sanofi-Genzyme, Hoffman La Roche, Regeneron e InflaRx. Ha recibido honorarios como ponente para Sanofi, Almirall, LeoPharma, Abbvie, SunPharma y Regeneron, y su labor de investigación ha sido patrocinada por Castle Biosciences y Sanofi-Regeneron. Los patrocinadores no ejercieron influencia en el diseño y la ejecución del estudio, la toma, el manejo, el análisis y la interpretación de los datos, la preparación, la revisión y la aprobación del manuscrito, o la decisión de enviarlo para su publicación.
Alberto de la Cuadra-Grande es empleado de Pharmacoeconomics & Outcomes Research Iberia (PORIB), una consultora especializada en evaluación económica de intervenciones en salud e investigación de resultados en salud, que ha recibido honorarios por parte de la AEDV para prestar soporte metodológico a lo largo de todo el proyecto.
Carlos Serra Guillén, David Moreno, Lara Ferrándiz, Javier Domínguez-Cruz, Pablo de la Cueva, Yolanda Gilaberte y Salvador Arias-Santiago declaran no tener conflicto de intereses en este trabajo.
Los autores desean agradecer a Miguel Ángel Casado y Araceli Casado-Gómez, empleados de Pharmacoeconomics & Outcomes Research Iberia (PORIB), su inestimable colaboración para la realización de este proyecto.
Grupo Multidisciplinar
Medicina Nuclear. Gómez-Caminero, Felipe, Complejo Asistencial Universitario de Salamanca; Vidal-Sicart, Sergi, Hospital Clínic de Barcelona.
Oncología Médica. García-Castaño, Almudena, Hospital Universitario Marqués de Valdecilla; Muñoz-Couselo, Eva, Hospital Universitario Vall d’Hebron.
Oncología Radioterápica. Jurado-Martín, Enrique, Hospital San Pedro de Logroño; Pérez-Romansanta, Luis Alberto, Complejo Asistencial Universitario de Salamanca.
Anatomía Patológica. Fernández-Flores, Ángel, Hospital del Bierzo; Ríos-Martín, Juan José, Hospital Virgen de la Macarena; Rodríguez-Peralto, José Luis, Hospital Universitario 12 de Octubre.
Radiodiagnóstico. Arias-Rodríguez, Piedad, Complejo Asistencial Universitario de Salamanca]; Asensio-Calle, José Francisco, Complejo Asistencial Universitario de Salamanca.
Grupo de Consenso
Azcona-Rodríguez, Maialen, Complejo Hospitalario de Navarra; Bennassar, Antoni, Clínica Rotger, Grupo QuirónSalud; Boada-García, Aram, Hospital Universitari Germans Trias i Pujol; Boix, Julián, Hospital de la Plana; Botella-Estrada, Rafael, Hospital la Fe de Valencia; Carrera-Álvarez, Cristina, Hospital Clínic de Barcelona; Deza, Gustavo, Hospital del Mar, Institut Mar de Investigacions Mèdiques; Diago-Irache, Adrián, Hospital Universitario Miquel Servet; Estrach, Maria Teresa, Hospital Clínic de Barcelona; Ferrándiz-Pulido, Carla, Hospital Universitario Vall d’Hebron; Fuente, María José, Hospital Universitari Germans Trias i Pujol; Izu-Belloso, Rosa, Hospital Universitario de Basurto; Jaka, Ane, Hospital Universitari Germans Trias i Pujol; Martí, Rosa María, Hospital Universitario Arnau de Vilanova; Martínez-López, Antonio, Hospital Universitario Virgen de las Nieves; Nagore-Enguídanos, Eduardo, Instituto Valenciano de Oncología; Oscoz-Jaime, Saioa, Complejo Hospitalario de Navarra; Paradela, Sabela, Complejo Hospitalario Universitario de A Coruña; Pujol i Vallverdú, Ramón M., Hospital del Mar; Redondo-Bellón, Pedro, Clínica Universitaria de Navarra; Román-Curto, Concepción, Complejo Asistencial Universitario de Salamanca; Tejera-Vaquerizo, Antonio, Hospital San Juan de Dios de Córdoba; Instituto Dermatológico GlobalDerm; Tercedor-Sánchez, Jesús, Hospital Universitario Virgen de las Nieves; Vázquez-Doval, Francisco Javier, Dermaclinic de Logroño; Vílchez-Márquez, Francisco Javier, Hospital Universitario Virgen de las Nieves; Yélamos, Oriol, Hospital de la Santa Creu i Sant Pau, Centro Médico Teknon.