Las infecciones de transmisión sexual (ITS) están aumentando en España. La estrategia tradicional para el control de las infecciones venéreas se basa principalmente en el cribado y tratamiento de ITS en pacientes con prácticas sexuales de riesgo. En los últimos años, se están estudiando nuevas estrategias de prevención primaria y secundaria interesantes para reducir las ITS en poblaciones con elevado riesgo para su adquisición. Entre ellas, las de mayor interés por la evidencia obtenida son el uso de la doxiciclina y el de las vacunas meningocócicas B. Los especialistas en dermatología y venereología han de estar informados sobre estas novedades que pueden tener un impacto en el modo en el que se manejen las infecciones venéreas en todo el mundo. Se ha realizado una revisión de la evidencia científica actualizada de estas nuevas estrategias de prevención primaria y secundaria interesantes para controlar las ITS en poblaciones con elevado riesgo para su adquisición.
Sexually transmitted infections (STIs) are increasing in Spain. The traditional strategy for STI control is mainly based on screening and treatment of STIs in patients with risky sexual practices. In recent years, new interesting primary and secondary prevention strategies are being studied to reduce the incidence rate of STIs in high-risk populations. The most interesting one, based on the evidence obtained, is the use of doxycycline and meningococcal B vaccines. Specialists in dermatology and venereology must be informed about these new developments that may have an impact on the way in which STIs are managed worldwide. This is a scientific evidence review of these new interesting primary and secondary prevention strategies to control STIs in a high-risk population.
Las infecciones de transmisión sexual (ITS) están aumentando en España1, debido especialmente al incremento de las ITS bacterianas. Los hombres cisgénero que tienen sexo con hombres (HSH), las mujeres transgénero y los trabajadores sexuales se ven afectados de manera desproporcionada2. La incidencia de infecciones venéreas es especialmente alta entre las personas que mantienen relaciones sexuales sin preservativo. El uso de este método ha caído de forma dramática en los últimos años, especialmente en algunos grupos como sucede con los usuarios de profilaxis previa a la exposición (PrEP) al virus de la inmunodeficiencia humana (VIH), que protege contra el VIH pero no ofrece protección contra otras ITS.
Además de la promoción del uso del preservativo, útil, pero insuficiente3, la estrategia tradicional para el control de las infecciones venéreas se ha basado en el cribado y tratamiento de ITS en pacientes con prácticas sexuales de riesgo4. En países con más recursos, las serologías de lúes y las pruebas moleculares para clamidia y gonorrea trimestrales (y su tratamiento en caso necesario) son la base del control de las ITS bacterianas entre las personas con riesgo elevado para la adquisición de ITS5. Sin embargo, en los países con menos recursos, el diagnóstico tiende a ser sindrómico y el tratamiento empírico, dada la falta de acceso a pruebas diagnósticas sensibles y rápidas. El manejo empírico de las ITS deja fuera de control por tanto a los pacientes asintomáticos cuyo cribado es fundamental para el control de estas infecciones6.
En los últimos años, se están estudiando nuevas estrategias de prevención primaria y secundaria interesantes para reducir/controlar las ITS en poblaciones con elevado riesgo para su adquisición. Entre ellas, las de mayor interés por la evidencia conseguida son el uso de la doxiciclina y el de las vacunas meningocócicas B. Consideramos que los especialistas en dermatología y venereología han de estar informados sobre estas novedades que sabemos tienen ya un impacto en el modo en el que se manejan las infecciones venéreas en todo el mundo.
Doxi-PEP / Doxi-PrEPDefinición: Ingesta preventiva de doxiciclina antes (Doxi-PrEP), durante o después (Doxi-PEP) de eventos sexuales de riesgo, sin haber tenido contacto sexual con una persona con una ITS diagnosticada.
Modo de uso: En el caso de Doxi-PEP7,8, se toma una dosis única de 200mg de doxiciclina dentro de las primeras 24h y no más tarde de 72h después de sexo oral/anal/vaginal no protegido. Por otro lado, la Doxi-PrEP9,10 se refiere a la ingesta continua (100mg/24h) de doxiciclina para prevenir la adquisición de una ITS.
Ventajas: La doxiciclina es una tetraciclina de segunda generación de espectro moderado de fácil acceso, rápida absorción y elevada biodisponibilidad. Tiene un sólido perfil de seguridad y generalmente se tolera bien12. Es el tratamiento de primera línea para Chlamydia trachomatis, de segunda línea para sífilis y tiene actividad contra Neisseria gonorrhoeae en entornos donde la resistencia a tetraciclinas es baja, y las contraindicaciones para su uso y las interacciones medicamentosas son limitadas.
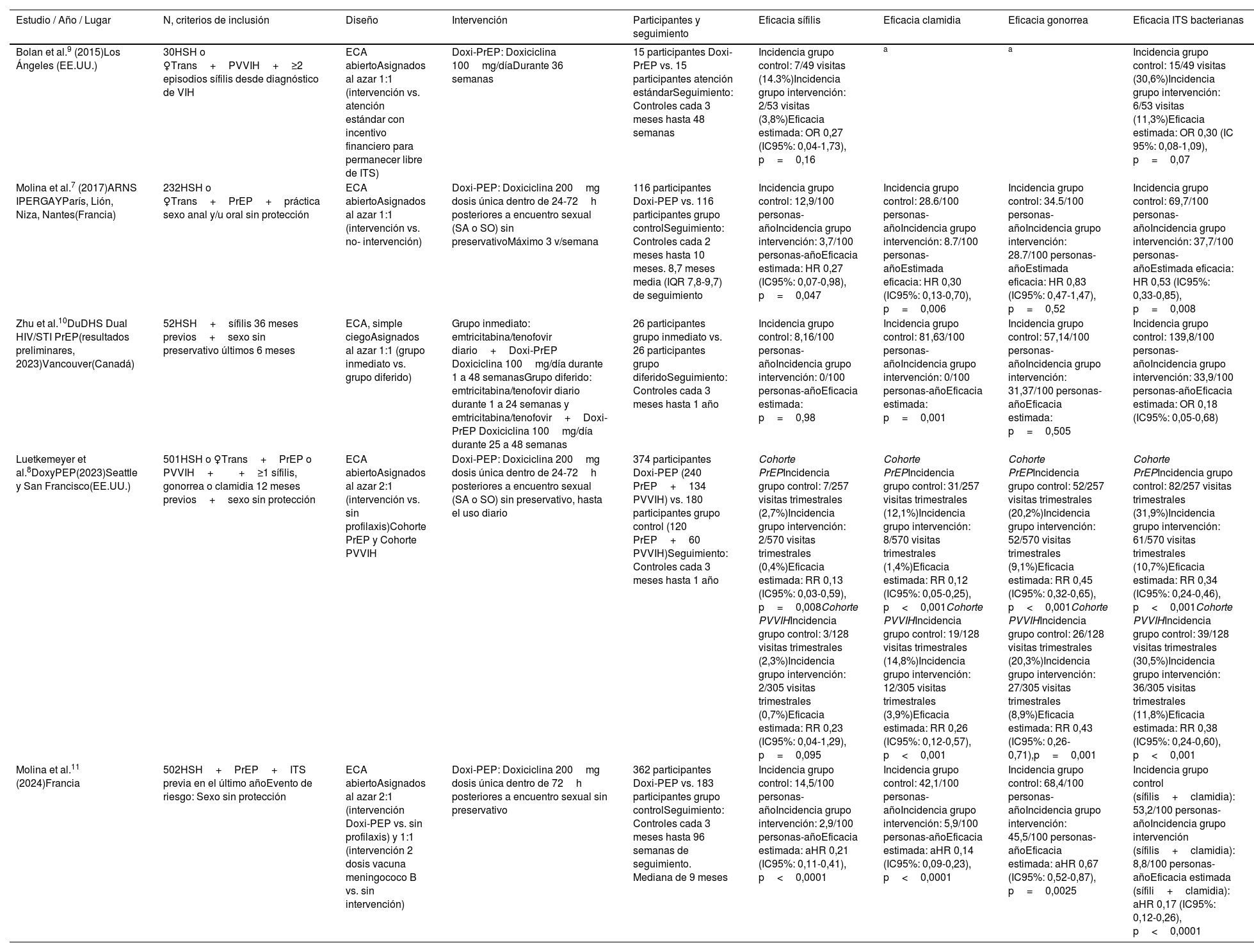
¿Cuál es la evidencia en el uso de doxiciclina para la prevención de las infecciones venéreas bacterianas?Se han publicado 5 ensayos controlados aleatorios7–11 (ECA) (tabla 1) sobre la prevención de ITS con doxiciclina en HSH y, en algunos casos, en mujeres transgénero. En todos los estudios o bien estaban usando simultáneamente PrEP contra el VIH (PrEP-VIH) o tenían una infección por VIH confirmada (PVVIH).
Resumen de los ensayos clínicos aleatorizados (ECA) sobre el uso de la doxiciclina como método de prevención de las ITS bacterianas
| Estudio / Año / Lugar | N, criterios de inclusión | Diseño | Intervención | Participantes y seguimiento | Eficacia sífilis | Eficacia clamidia | Eficacia gonorrea | Eficacia ITS bacterianas |
|---|---|---|---|---|---|---|---|---|
| Bolan et al.9 (2015)Los Ángeles (EE.UU.) | 30HSH o ♀Trans+PVVIH+≥2 episodios sífilis desde diagnóstico de VIH | ECA abiertoAsignados al azar 1:1 (intervención vs. atención estándar con incentivo financiero para permanecer libre de ITS) | Doxi-PrEP: Doxiciclina 100mg/díaDurante 36 semanas | 15 participantes Doxi-PrEP vs. 15 participantes atención estándarSeguimiento: Controles cada 3 meses hasta 48 semanas | Incidencia grupo control: 7/49 visitas (14.3%)Incidencia grupo intervención: 2/53 visitas (3,8%)Eficacia estimada: OR 0,27 (IC95%: 0,04-1,73), p=0,16 | a | a | Incidencia grupo control: 15/49 visitas (30,6%)Incidencia grupo intervención: 6/53 visitas (11,3%)Eficacia estimada: OR 0,30 (IC 95%: 0,08-1,09), p=0,07 |
| Molina et al.7 (2017)ARNS IPERGAYParís, Lión, Niza, Nantes(Francia) | 232HSH o ♀Trans+PrEP+práctica sexo anal y/u oral sin protección | ECA abiertoAsignados al azar 1:1 (intervención vs. no- intervención) | Doxi-PEP: Doxiciclina 200mg dosis única dentro de 24-72h posteriores a encuentro sexual (SA o SO) sin preservativoMáximo 3 v/semana | 116 participantes Doxi-PEP vs. 116 participantes grupo controlSeguimiento: Controles cada 2 meses hasta 10 meses. 8,7 meses media (IQR 7,8-9,7) de seguimiento | Incidencia grupo control: 12,9/100 personas-añoIncidencia grupo intervención: 3,7/100 personas-añoEficacia estimada: HR 0,27 (IC95%: 0,07-0,98), p=0,047 | Incidencia grupo control: 28.6/100 personas-añoIncidencia grupo intervención: 8.7/100 personas-añoEstimada eficacia: HR 0,30 (IC95%: 0,13-0,70), p=0,006 | Incidencia grupo control: 34.5/100 personas-añoIncidencia grupo intervención: 28.7/100 personas-añoEstimada eficacia: HR 0,83 (IC95%: 0,47-1,47), p=0,52 | Incidencia grupo control: 69,7/100 personas-añoIncidencia grupo intervención: 37,7/100 personas-añoEstimada eficacia: HR 0,53 (IC95%: 0,33-0,85), p=0,008 |
| Zhu et al.10DuDHS Dual HIV/STI PrEP(resultados preliminares, 2023)Vancouver(Canadá) | 52HSH+sífilis 36 meses previos+sexo sin preservativo últimos 6 meses | ECA, simple ciegoAsignados al azar 1:1 (grupo inmediato vs. grupo diferido) | Grupo inmediato: emtricitabina/tenofovir diario+Doxi-PrEP Doxiciclina 100mg/día durante 1 a 48 semanasGrupo diferido: emtricitabina/tenofovir diario durante 1 a 24 semanas y emtricitabina/tenofovir+Doxi-PrEP Doxiciclina 100mg/día durante 25 a 48 semanas | 26 participantes grupo inmediato vs. 26 participantes grupo diferidoSeguimiento: Controles cada 3 meses hasta 1 año | Incidencia grupo control: 8,16/100 personas-añoIncidencia grupo intervención: 0/100 personas-añoEficacia estimada: p=0,98 | Incidencia grupo control: 81,63/100 personas-añoIncidencia grupo intervención: 0/100 personas-añoEficacia estimada: p=0,001 | Incidencia grupo control: 57,14/100 personas-añoIncidencia grupo intervención: 31,37/100 personas-añoEficacia estimada: p=0,505 | Incidencia grupo control: 139,8/100 personas-añoIncidencia grupo intervención: 33,9/100 personas-añoEficacia estimada: OR 0,18 (IC95%: 0,05-0,68) |
| Luetkemeyer et al.8DoxyPEP(2023)Seattle y San Francisco(EE.UU.) | 501HSH o ♀Trans+PrEP o PVVIH++≥1 sífilis, gonorrea o clamidia 12 meses previos+sexo sin protección | ECA abiertoAsignados al azar 2:1 (intervención vs. sin profilaxis)Cohorte PrEP y Cohorte PVVIH | Doxi-PEP: Doxiciclina 200mg dosis única dentro de 24-72h posteriores a encuentro sexual (SA o SO) sin preservativo, hasta el uso diario | 374 participantes Doxi-PEP (240 PrEP+134 PVVIH) vs. 180 participantes grupo control (120 PrEP+60 PVVIH)Seguimiento: Controles cada 3 meses hasta 1 año | Cohorte PrEPIncidencia grupo control: 7/257 visitas trimestrales (2,7%)Incidencia grupo intervención: 2/570 visitas trimestrales (0,4%)Eficacia estimada: RR 0,13 (IC95%: 0,03-0,59), p=0,008Cohorte PVVIHIncidencia grupo control: 3/128 visitas trimestrales (2,3%)Incidencia grupo intervención: 2/305 visitas trimestrales (0,7%)Eficacia estimada: RR 0,23 (IC95%: 0,04-1,29), p=0,095 | Cohorte PrEPIncidencia grupo control: 31/257 visitas trimestrales (12,1%)Incidencia grupo intervención: 8/570 visitas trimestrales (1,4%)Eficacia estimada: RR 0,12 (IC95%: 0,05-0,25), p<0,001Cohorte PVVIHIncidencia grupo control: 19/128 visitas trimestrales (14,8%)Incidencia grupo intervención: 12/305 visitas trimestrales (3,9%)Eficacia estimada: RR 0,26 (IC95%: 0,12-0,57), p<0,001 | Cohorte PrEPIncidencia grupo control: 52/257 visitas trimestrales (20,2%)Incidencia grupo intervención: 52/570 visitas trimestrales (9,1%)Eficacia estimada: RR 0,45 (IC95%: 0,32-0,65), p<0,001Cohorte PVVIHIncidencia grupo control: 26/128 visitas trimestrales (20,3%)Incidencia grupo intervención: 27/305 visitas trimestrales (8,9%)Eficacia estimada: RR 0,43 (IC95%: 0,26-0,71),p=0,001 | Cohorte PrEPIncidencia grupo control: 82/257 visitas trimestrales (31,9%)Incidencia grupo intervención: 61/570 visitas trimestrales (10,7%)Eficacia estimada: RR 0,34 (IC95%: 0,24-0,46), p<0,001Cohorte PVVIHIncidencia grupo control: 39/128 visitas trimestrales (30,5%)Incidencia grupo intervención: 36/305 visitas trimestrales (11,8%)Eficacia estimada: RR 0,38 (IC95%: 0,24-0,60), p<0,001 |
| Molina et al.11 (2024)Francia | 502HSH+PrEP+ITS previa en el último añoEvento de riesgo: Sexo sin protección | ECA abiertoAsignados al azar 2:1 (intervención Doxi-PEP vs. sin profilaxis) y 1:1 (intervención 2 dosis vacuna meningococo B vs. sin intervención) | Doxi-PEP: Doxiciclina 200mg dosis única dentro de 72h posteriores a encuentro sexual sin preservativo | 362 participantes Doxi-PEP vs. 183 participantes grupo controlSeguimiento: Controles cada 3 meses hasta 96 semanas de seguimiento. Mediana de 9 meses | Incidencia grupo control: 14,5/100 personas-añoIncidencia grupo intervención: 2,9/100 personas-añoEficacia estimada: aHR 0,21 (IC95%: 0,11-0,41), p<0,0001 | Incidencia grupo control: 42,1/100 personas-añoIncidencia grupo intervención: 5,9/100 personas-añoEficacia estimada: aHR 0,14 (IC95%: 0,09-0,23), p<0,0001 | Incidencia grupo control: 68,4/100 personas-añoIncidencia grupo intervención: 45,5/100 personas-añoEficacia estimada: aHR 0,67 (IC95%: 0,52-0,87), p=0,0025 | Incidencia grupo control (sífilis+clamidia): 53,2/100 personas-añoIncidencia grupo intervención (sífilis+clamidia): 8,8/100 personas-añoEficacia estimada (sífili+clamidia): aHR 0,17 (IC95%: 0,12-0,26), p<0,0001 |
aHR: adjusted Hazard Ratio; ECA: ensayo clínico aleatorizado; HSH: hombre que tiene sexo con hombres; OR: Odds Ratio; PrEP: profilaxis preexposición al VIH; PVVIH: persona que convive con el VIH; RR: riesgo relativo; SA: sexo anal; SO: sexo oral; VIH: virus inmunodeficiencia humana; ♀Trans: mujer transexual.
Bolan et al.9 presentaron un primer estudio preliminar con 30 PVVIH aleatorizados en 2 brazos, Doxi-PEP vs. control. El grupo de Molina et al.7 realizó un primer estudio publicado en 2018 con 232 pacientes aleatorizados a Doxi-PEP vs. no intervención, se les permitía tomar máximo 3 dosis de 200mg de doxiciclina por semana. Zhu et al.10 presentaron en 2021 un estudio de tratamiento dual. En el «grupo inmediato» se les daba PrEP frente al VIH+Doxi-PrEP y en el «grupo diferido» se les daba PrEP frente al VIH y a partir de la semana 25 se añadía la Doxi-PrEP. Posteriormente, Luetkemeyer et al.8 presentaron sus resultados con 501 participantes divididos en 2 cohortes, una de pacientes en PrEP frente al VIH y otra cohorte de PVVIH. Al final incluyeron 374 participantes en el grupo Doxi-PEP vs. 180 participantes en el grupo control. Finalmente, el grupo de Molina et al.11 presentó en 2023 los resultados de un ECA abierto con participantes asignados al azar 2:1 (intervención Doxi-PEP vs. sin profilaxis) y 1:1 (intervención 2 dosis vacuna meningococo B vs. sin intervención), con un total de 362 pacientes en Doxi-PEP vs. 183 participantes en grupo control.
Eficacia en la prevención de la sífilis: La incidencia de sífilis se redujo en todos los estudios entre los participantes que utilizaron Doxi-PEP. La reducción en comparación con los grupos de control osciló entre el 73 y 87%. Este descenso fue sustancial (73% y 77%) pero no estadísticamente significativo en el subgrupo de PVVIH. En el estudio de Zhu et al.10 la incidencia de sífilis disminuyó de 8,2 a 0 por 100 personas-año observadas, sin ser estadísticamente significativo debido a un bajo número de diagnósticos de sífilis. Sin embargo, en todas las cohortes y estudios en usuarios PrEP-VIH7,8,11, la reducción de la incidencia de sífilis fue estadísticamente significativa.
Eficacia en la prevención de la infección porC. trachomatis: La incidencia de infecciones por C. trachomatis se redujo significativamente en todos los estudios7,8,10,11 incluidos entre los participantes que usaron doxiciclina preventiva en comparación con los controles, con una reducción en la incidencia que osciló entre el 70 y 89%. Esta reducción se observó tanto en usuarios de PrEP-VIH o PVVIH. Ninguno de los estudios diferenció entre los serovares D-K y L1-L3 de C. trachomatis.
Eficacia en la prevención de la infección porN. gonorrhoeae: Se observó una reducción en la incidencia de gonorrea en todos los estudios, pero los datos fueron mucho más heterogéneos. La reducción en la incidencia de gonorrea osciló entre el 17 y 57% y fue estadísticamente significativa solamente en algunos estudios8,11. Estos resultados podrían explicarse por la susceptibilidad regional de los gonococos a las tetraciclinas.
Eficacia global en la prevención de las ITS bacterianas: Tomando los datos en conjunto, se observó una reducción en la incidencia combinada de las ITS bacterianas medidas. En el estudio de Molina et al.11 solo se valoraron las infecciones por sífilis y clamidia, y la reducción combinada de ambas fue del 83%. En el resto, la reducción de la incidencia de sífilis, infecciones por C. trachomatis y gonorrea así como su resultado combinado osciló entre el 47 y 82%.
¿Qué dudas nos presenta?Efectos adversos (EA): En los ECA7–11 (tabla 1 del material adicional) los EA gastrointestinales como náuseas, vómitos o diarrea se encontraron entre las reacciones adversas más comunes. Sin embargo, no hubo diferencias estadísticamente significativas en los EA graves en los grupos de tratamiento vs. los grupos control7–11. La fotosensibilidad es un EA clásicamente asociado a las tetraciclinas. Aunque la evidencia con doxiciclina en concreto no es alta, sí se recomienda fotoprotección durante el período de toma del antibiótico13. Las alteraciones del hemograma, así como de la función hepática o renal son raros, aunque se recomienda seguimiento analítico con el uso prolongado de doxiciclina.
Eficacia en mujeres cisgénero: El único estudio14 que ha investigado la prevención de las ITS con doxiciclina en mujeres cisgénero no observó una reducción significativa en la incidencia de las infecciones venéreas. Esto podría deberse a un patrón distinto de resistencia a antibióticos, ya que el estudio se realizó en Kenia. Sin embargo, los autores apuntan también a una posible baja adherencia a la doxiciclina por parte de las mujeres participantes que debería tenerse en cuenta. Se necesitan, por tanto, más estudios para evaluar la eficacia de esta medida preventiva en mujeres-cis.
¿Serán adherentes los pacientes? En el ensayo de Luetkemeyer et al.8 el 86% de los participantes informaron haber tomado adecuadamente Doxi-PEP de manera constante. El 71% informó que nunca dejaron de tomarse la doxiciclina durante el estudio y la mediana del número de dosis mensuales fue de 4 dosis (rango 1 a 10). Desconocemos si estas cifras de adherencia se mantendrían con el tiempo o si 4 dosis mensuales serían suficientes en nuestra población.
¿Qué puede suceder con la resistencia a los antibióticos? Desde una perspectiva de salud pública, la principal preocupación con respecto al uso preventivo de doxiciclina gira en torno a su potencial de promover resistencias antimicrobianas, no solo entre las bacterias causantes de ITS sino también en otras bacterias o en el microbioma de los usuarios:
- •
N. gonorrhoeae: En el estudio de Luetkemeyer et al.8 en el momento de la inclusión el 26,7% de las cepas aisladas y cultivadas mostraban resistencia a las tetraciclinas. Durante el transcurso del estudio la proporción resistencia a tetraciclinas del grupo Doxi-PEP fue mayor vs. control (38,5% vs. 12,5%). En el estudio de Molina et al.7 se detectó resistencia a tetraciclina en todos los casos cultivados (tanto al inicio como en el transcurso del estudio), pero el grupo Doxi-PEP tuvo una mayor proporción de aislamientos con CMI>8mg/l para tetraciclina vs. los controles (33,3% vs. 18,9%).
- •
M. genitalium: En el estudio de Molina et al.7 en una muestra pequeña (14 casos) no se observaron diferencias entre los grupos en términos de resistencias.
- •
C. trachomatis: No se detectaron resistencias en las infecciones por C. trachomatis, aunque existe el potencial riesgo de seleccionar cepas con el uso prolongado15.
- •
S. aureus: En el estudio de Molina et al.7 se estudió la presencia de S. aureus resistente a la meticilina (SARM) en el hisopo de faringe entre los participantes. Durante el estudio, ambos grupos experimentaron un aumento en las detecciones de SARM sin que las diferencias fueran significativas. En el estudio de Luetkemeyer et al.8 sí hubo diferencias estadísticamente significativas y tasas más altas en el grupo de doxiciclina (mes 6: 21,6% [grupo doxiciclina] vs. 10,3% [grupo control]; mes 12: 16,1% vs. 8,3%).
- •
Escherichia coli portadora de beta-lactamasa de espectro extendido (E. coli BLEE): En el estudio de Molina et al.7 se observó un aumento de E. coli BLEE en anorrecto en ambos grupos sin detectar diferencias entre ellos.
- •
Microbiota: La ingesta prolongada de doxiciclina parece tener efectos moderados y transitorios sobre la flora oral, respiratoria y gastrointestinal; sin embargo, los datos sobre este tema son limitados, principalmente debido al tamaño relativamente pequeño de los estudios15.
La IUSTI (International Union against Sexually Transmitted Infections)16 se ha posicionado con un documento publicado en junio de este año (2024) en el que reconoce la evidencia alcanzada por esta estrategia, pero también señala las sombras que aún presenta en cuanto a posibilidad de resistencias, impacto en salud pública, etc. La IUSTI recomienda tomar decisiones en relación con Doxi-PEP de forma individualizada, teniendo en cuenta múltiples factores, como la infección que se quiere prevenir, la capacidad de asistencia del centro en concreto, la posibilidad de realizar una monitorización a nivel de salud pública o la posible implicación de los pacientes en su salud. Antepone además como criterio ineludible la correcta información al usuario en cuanto a limitaciones en la evidencia y posibilidad de EA. Otras sociedades17–19 se han posicionado en contra del uso general de doxiciclina preventiva en personas sexualmente activas, pero sí consideran el uso de la Doxi-PEP en casos seleccionados.
La Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) ha publicado un posicionamiento20 explicando que la doxiciclina no está aprobada para su uso en la prevención de las ITS; por lo tanto, su uso en este contexto se considera fuera de indicación. Recomiendan valorar la prescripción de Doxi-PEP de manera individualizada en HSH o mujeres transgénero que tienen sexo con hombres y que han presentado reiteradas infecciones venéreas en el último año. Esta decisión debe ser compartida con el paciente.
Uso de las vacunas meningocócicas B como método preventivo contra la infección por N. gonorrhoeaeN. gonorrhoeae, una bacteria de difícil control: El gonococo ha desarrollado resistencia a todas las clases de antibióticos21. Además, las infecciones faríngeas y rectales suelen ser asintomáticas22,23, contribuyendo a la aparición de resistencia a los antibióticos y su posterior transmisión22. Ante el incremento preocupante en la incidencia de gonococo, la OMS ha desarrollado una estrategia global con el objetivo de reducir la gonorrea en un 90% para 203024. La infección gonocócica no origina una inmunidad natural protectora de nuevos episodios 25. Además, los humanos son el único huésped natural de N. gonorrhoeae y no disponemos de modelos animales adecuados de este proceso, lo que dificulta la creación de una «vacuna antigonococo». Se han probado 4 candidatas a vacunas gonocócicas en ensayos clínicos en humanos y ninguna de ellas obtuvo protección contra la gonorrea25–28. Sin embargo, este campo se ha visto revitalizado gracias a datos epidemiológicos recientes29–37 que sugieren que las vacunas meningocócicas B pueden proporcionar protección cruzada contra la gonorrea.
¿Por qué las vacunas meningocócicas B pueden proteger frente a N. gonorrhoeae?Se han descrito 12 serogrupos de Neisseria meningitidis basados en la cápsula de polisacárido. De estos, 6 serogrupos (MenA, MenB, MenC, MenW, MenX y MenY) son responsables de casi toda la enfermedad meningocócica invasiva en todo el mundo38. Se encuentran disponibles varias vacunas conjugadas contra la cápsula de polisacárido de MenA, MenC, MenW y MenY. La pauta de vacunación recomendada por la Asociación Española de Pediatría incluye la vacunación sistemática frente al MenB, MenC y MenACWY. Actualmente en España se encuentran disponibles 8 vacunas antimeningocócicas inactivadas: 3 monovalentes frente al serogrupo C, 3 tetravalentes frente a los serogrupos A, C, W e Y (MenACWY) y 2 monovalentes frente al serogrupo B39.
Existen actualmente 2 vacunas disponibles frente a la enfermedad invasora por meningococo B39:
- •
Vacuna biantigénica (fHbp, Trumenba®, Pfizer): Compuesta por 2 variantes de la proteína de unión al factor H (fHbp). La fHbp es una proteína subcapsular esencial para evadir la respuesta inmune del huésped, que se expresa en casi todas las cepas de meningococo B y es capaz de generar respuesta de anticuerpos en humanos.
- •
Vacuna tetraantigénica (4CMenB, Bexsero®, GSK): Contiene 3 antígenos subcapsulares del meningococo B (adhesina A de Neisseria meningitidis o NadA, la fHbp y el antígeno de Neisseria que se une con la heparina o NHBA) combinados con vesículas de membrana externa (OMV) de la cepa de Neisseria meningitidis NZ 98/254.
N. meningitidis y N. gonorrhoeae pertenecen al mismo género y comparten un 80-90% de identidad secuencia del genoma38. Se plantea que esta similitud pueda ser responsable de una protección cruzada entre las vacunas meningocócicas del serogrupo B y N. gonorrhoeae. Un análisis bioinformático ha identificado que un homólogo de 20 de las 22 principales proteínas meningocócicas OMV de la vacuna 4CMenB está presente en N. gonorrhoeae (16 proteínas tienen >90% de identidad y 2 proteínas tienen >80% de identidad con el antígeno de la vacuna meningocócica), y el antígeno NHBA 4CMenB comparte >67% de identidad con el NHBA de cepas de N. gonorrhoeae40.
¿Cuál es la evidencia en vida real de la eficacia de la vacuna meningocócica B en la prevención de la infección por gonorrea?Se han llevado a cabo varios estudios en vida real desde 2009 a 202329–37 en países como Cuba, Nueva Zelanda, Noruega, Canadá y EE.UU. (tabla 2). La mayoría de los resultados disponibles pertenecen a estudios de cohortes, casos-controles retrospectivos y de datos ecológicos de informes nacionales de vigilancia epidemiológica. Los datos de eficacia de la vacuna meningocócica B han sido basados en la reducción de las tasas de incidencia de infecciones notificadas por N. gonorrhoeae tras la vacunación de ciertas poblaciones con vacunas combinadas con OMV (MeNZB™ de Nueva Zelanda, VA-MENGOC-BC de Cuba) o al comparar las tasas de incidencia N. gonorrhoeae tras la vacunación con 4CMenB vs. vacunación con MenACWY. La eficacia de la vacunación completa fue del 31-44% para la prevención de la gonorrea, en el período posterior a la vacunación, en contraste con otras ITS. El estudio de Paynter et al.30 evidenció que la eficacia de la vacuna MeNZB™ contra hospitalización por gonorrea fue del 24%. Por otro lado, el estudio Wang et al.34 observó una eficacia vacunal baja después de 36 meses (23,2% IC95%: 0-47,5%) vs. 6-36 meses (34,9% IC95%: 15,0-50,1%) tras vacunación y una menor eficacia vacunal en pacientes con infecciones repetidas por gonococo.
Resumen de los estudios sobre el uso de la vacuna del meningococo B como método de prevención de la infección gonocócica
| Estudio / Año / Lugar | Diseño / Objetivos | Población | Resultados |
|---|---|---|---|
| Whelan et al.29 (2016)Noruega | Estudio de cohorte retrospectivoAsociación entre cobertura vacuna meningocócica B durante 1988-1992 (63% niños 13-15 años fueron vacunados) y tasas nacionales de gonorrea durante 1993-2008 | Personas>16 añosCohorte de individuos, 63% nacidos entre 1973 y 1976 (n=93.611) | Tasas de gonorrea disminuyeron entre hombres (IRR 0,68, IC95%: 0,51-0,93) y mujeres (IRR 0,58, IC95%: 0,42-0,8) de 20-24 años después de campaña de vacunaciónNo efecto en otros grupos de edad |
| Paynter et al.30 (2017)Nueva Zelanda | Estudio de cohorte retrospectivoEficacia de la vacuna meningocócica B de Nueva Zelanda (81% población de 0-20 años recibió vacuna en respuesta a una epidemia) en las tasas de hospitalización por gonorrea | Cohorte de individuos nacidos entre 1984 y 1999 (n=935.496) | Eficacia de la vacuna meningocócica B de Nueva Zelanda contra a hospitalización por gonorrea fue del 24% (IC95%: 1 a 42%) |
| Petousis-Harris et al.31 (2017)Nueva Zelanda | Estudio retrospectivo casos-controles en clínicas de salud sexualEficacia de la vacuna meningocócica B de Nueva Zelanda contra la gonorrea | Adultos jóvenes de 15-30 años, nacidos entre 1984 y 1998+Diagnosticados con gonorrea o clamidia, o ambas14.730 casos y controles para los análisis | 1241 casos de gonorrea, 12.487 casos de clamidia y 1002 casos de gonorrea+clamidiaPersonas completamente vacunadas tienen menos probabilidad de ser caso que control (511 [41%] vs. 6424 [51%]; OR ajustada 0,69 [IC95%: 0,61-0,79]; p<0,0001)Efectividad vacuna meningocócica B de Nueva Zelanda: 31% (IC95%: 21-39) (tras ajustar por etnia, área geográfica y sexo) |
| Longtin et al.32 (2017)Canadá | Estudio de cohorte retrospectivoSe analizaron los casos de notificaciones de gonorrea durante los períodos previos y posteriores a la vacunación con la vacuna 4CMenBEn la región de Saguenay-Lac-Saint-Jean de la provincia de Quebec (Canadá) se inició una campaña de vacunación a gran escala de personas de 6 meses a 20 años de edad entre mayo y diciembre de 2014La cobertura general de vacunación fue del 82% en el grupo objetivo | Personas de 6 meses a 20 años en 2014Casos notificados a salud pública durante el período de prevacunación (enero de 2006 a junio de 2014) y posvacunación (de julio de 2014 a junio de 2017)Se analizaron dos grupos de edad: de 14 a 20 años y ≥21 años) | Casos de gonorrea en personas de 14-20 años disminuyeron un 59% en el período posterior a la vacunación y en ≥21 años aumentaron los casosNo diferencias estadísticamente significativas (IC95%: ≥22% a 84%; p=0,1) debido al pequeño número de casos |
| Azze33 (2020)Cuba | Estudio de cohorte retrospectivoRecolectaron muestras de suero, saliva y orofaringe de estudiantes de secundaria que habían sido vacunados previamente con VA-MENGOC-BC durante su infanciaFueron revacunados con una 3.a dosis durante el estudio | Personas de 3 meses a 24 años entre 1989 y 1993Las tasas de incidencia de gonorrea se evaluaron con respecto a la vacunación VA-MENGOC-BC: períodos de prevacunación (antes de 1989) y posvacunación | Datos epidemiológicos mostraron una rápida disminución en la incidencia de gonorrea tras una campaña de vacunación masiva (1988 a 1990), en contraste con otras ITSTasas de incidencia en los grupos de edad no vacunados también disminuyeron, probablemente debido a la inmunidad de rebañoLa incidencia de gonorrea se redujo paralelamente a la enfermedad meningocócica de 1989 a 1993 (381,9 y 190,3 casos de gonorrea×100.000 habitantes, respectivamente) (r=0,9607, p=0,001). Hasta 1995 volvió a mostrar una tendencia ascendente (411,7×100.000), para luego volver a disminuir (r=0,9501, p=0,008) |
| Wang et al.34 (2022)Australia | Estudio de casos y controles entre pacientes adheridos al programa de vacunación 4CMenB iniciado en 2018Se utilizaron controles de clamidia para estimar la EV en el análisis primario para controlar posibles efectos de confusión, como el comportamiento sexual de alto riesgo asociado con infecciones de transmisión sexualEl impacto de la vacuna se estimó utilizando índices de incidencia comparando el núm. de casos en cada año después del inicio del programa de vacunación vs. casos en cohorte de edad equivalente durante los años previos a la vacunación | Personas adheridas al programa: bebés hasta 12 meses de edad (esquema de 3 dosis de 4CMenB) y estudiantes en 10.o grado (aproximadamente a los 15 años de edad reciben 2 dosis de 4CMenB) | Tres años después de la implementación del programa de vacunación infantil, se estimó que la eficacia de la vacuna de 2 dosis en adolescentes era del 33,2% (IC95%: 15,9-47,0%) para la gonorreaSe demostraron estimaciones de EV más bajas después de 36 meses después de la vacunación (23,2% [IC95%: 0-47,5%)>36 meses después de la vacunación en comparación con 34,9% [IC95%: 15,0-50,1%] dentro de 6-36 meses)Se encontraron estimaciones de EV más altas después de excluir a los pacientes con infecciones repetidas por gonorrea (37,3%, IC95%: 19,8-51,0%)Para los casos de gonorrea coinfectados con clamidia se mantuvo la EV (44,7% [IC95%: 17,1-63,1%]) |
| Abara et al.35 (2022)EE.UU. (New York City and Philadelphia) | Estudio retrospectivo casos-controlesSe analizaron los casos de gonorrea y clamidia junto a los registros de inmunización frente a 4CMenB (vacunación completa con 2 dosis, vacunación parcial con una dosis o ninguna vacunación)Identificaron infecciones de gonorrea y clamidia en personas de 16-23 años | Adultos jóvenes de 16 a 23 años con infección por gonorrea entre 1 de enero de 2016 y 31 de diciembre de 201818.099 infecciones por gonorrea12.4876 infecciones por clamidia24.731 coinfecciones de gonorrea y clamidia en 109.737 individuos (7692 vacunados, 4032 habían recibido al menos una dosis, 3596 al menos 2 dosis y 64 3 dosis) | En comparación con no vacunación, la vacunación completa (APR 0,60, IC95%: 0,47-0,77; p<0,0001) y la vacunación parcial (0,74, 0,63-0,88; p=0,0012) protegieron contra la gonorreaVacunación completa tuvo una eficacia del 40% (IC95%: 23-53) y la parcial del 26% (12-37)MenB-4C no protegió contra la coinfección por gonorrea y clamidia en este estudio |
| Bruxvoort et al.36 (2022)EE.UU. (California) | Estudio de cohorte emparejado de 2016 a 2020 para examinar la asociación de la vacuna meningocócica recombinante del serogrupo B (4CMenB) que contiene OMV con la infección por gonorrea entre adolescentes y adultos jóvenes en Kaiser Permanente Southern CaliforniaLos receptores de 4CMenB se emparejaron en una proporción de 1:4 con los receptores de la vacuna conjugada de polisacárido dirigida a los serotipos A, C, W e Y (MenACWY) que no habían recibido 4CMenB y fueron seguidos para detectar gonorrea incidente | Se examinó la asociación de gonorrea e infección por clamidia entre 6641 receptores de 4CMenB y 26.471 receptores de MenACWY, en adolescentes y adultos jóvenes | Durante el seguimiento, las tasas de incidencia de gonorrea por 1000 personas-año (IC95%) fueron de 2,0 (1,3-2,8) para los receptores de 4CMenB y 5,2 (4,6-5,8) para los receptores de MenACWYEn los análisis ajustados, las tasas de gonorrea fueron un 46% más bajas entre los que recibieron 4CMenB frente a MenACWY (HR 0,54; IC95%: 0,34-0,86), pero las tasas de clamidia fueron similares entre los grupos de vacunas (HR, 0,98; IC95%: 0,82-1,17) |
| Robinson et al.37 (2023)Portland (Oregón) (EE.UU.) | Estudio de cohorte emparejado para examinar la asociación de la vacuna meningocócica recombinante del serogrupo B (4CMenB) que contiene OMV con la infección por gonorrea entre estudiantes, personal y parte del personal médico en la Universidad de Oregón y en la Universidad Estatal de OregónSe evaluó si la recepción de la vacuna basada en OMV se asoció con una menor prevalencia de gonorrea que la recepción de vacuna no basada en OMVLos casos de gonorrea se determinaron desde un mes hasta 2 años después de la vacunación (2015) hasta el final del estudio (31 de marzo de 2018) | Universitarios 18 a 29 años (♀ y ♂)15.760 receptores de una o más dosis de vacunas basadas en OMV vs. 15.212 beneficiarios de una o más dosis de vacunas no basadas en OMV | 24 casos de gonorrea receptores de vacunas basadas en OMV vs. 44 casos en receptores de vacunas no basadas en OMVLa vacuna basada en OMV tuvo una eficacia del 47% (IC95%: 13-68%) para prevenir la gonorrea entre los receptores de 18 a 29 años |
| Raccagni et al.41 (2023)Italia | Estudio de casos y controles no apareadoEvaluó la efectividad de 4CMenB (2016-2021) contra la gonorrea en HSH PVVIH con un diagnóstico previo de ITS | Casos HSH PVVIH con ≥1 gonorreaControles HSH PVVIH ≥1 infección por sífilis, clamidia o virus del papiloma humano anal1051 HSH PVVIH (103 casos, 948 controles); 349 (33%) recibieron 2 dosis de la vacuna 4CMenBMediana de seguimiento fue de 3,8 años (2,1-4,3 años) | Estimación no ajustada de EV contra la gonorrea fue del 42% (IC95%: 6-64%; p=0,027)Regresión logística mostró que la EV contra la gonorrea siguió siendo significativa (44%; IC95%: 9-65%; p=0,020) después de ajustar |
| Molina et al.11 (2024)Francia | ECA abiertoPacientes asignados al azar 2:1 (intervención Doxi-PEP vs. sin profilaxis) y 1:1 (intervención 2 dosis vacuna 4CMenB vs. sin intervención) | 544 HSH+PrEP+ITS previa en último año+práctica de sexo sin protección | 225 sujetos infectados122 en brazo sin vacuna (incidencia 77,1/100 personas-año) vs. 103 en brazo vacuna 4CMenB (incidencia 58,3/100 personas-año)Análisis intermedio no se observaron diferencias estadísticamente significativas en las tasas de incidencia acumulativa de gonorrea, aHR 0,78 (IC95%: 0,80-1,01, p=0,061) |
4CMenB: vacuna contra el meningococo del serogrupo B a base de 4 componentes; aHR: adjusted Hazard Ratio; APR: adjusted prevalence ratios; ECA: ensayo clínico aleatorizado; EV: eficacia vacunal; HSH: hombre que tiene sexo con hombres; IRR: incidence rate ratios; PVVIH: persona que convive con el VIH; VIH: virus de la inmunodeficiencia humana.
Hasta la fecha se han publicado los datos de 2 estudios11,41 (tabla 2). El estudio de Raccagni et al.41, un estudio de casos y controles no pareado, evaluó la efectividad de la vacunación (EV) de la vacuna 4CMenB contra la gonorrea en PVVIH con un diagnóstico previo de infecciones venéreas. Se incluyeron 1051 PVVIH (103 casos y 948 controles), 349 de 1051 (33%) recibieron 2 dosis de la vacuna 4CMenB. La mediana de seguimiento fue de 3,8 años (2,1-4,3 años). La estimación no ajustada de la EV contra la gonorrea fue del 42% (IC95%: 6-64%; p=0,027). La regresión logística mostró que la EV contra la gonorrea siguió siendo significativa (44%; IC95%: 9-65%; p=0,020) después de ajustar por algunos factores.
Recientemente, se han publicado los resultados del estudio DOXYVAC de Francia11. Se trata de un estudio multicéntrico, aleatorizado, controlado con placebo y doble ciego, fase 3 para evaluar la eficacia de 2 dosis 4CMenB en la prevención de la infección N. gonorrhoeae (sintomática o asintomática), de la actividad bactericida sérica contra meningococo B y gonococo, así como la tolerancia a la vacuna. Se incluyeron 720 participantes entre 18 y 40 años, HSH en PrEP-VIH a los que se les había diagnosticado alguna ITS bacteriana en los últimos 12 meses. Se asignaron al azar 1:1 a 4CMenB vs. placebo. No se observaron diferencias estadísticamente significativas en las tasas de incidencia acumulativa de gonorrea en ninguna localización (anal, faríngea o urinaria).
Actualmente, existen varios estudios42–46 en marcha que podrán responder en un futuro próximo mejor cuál es la eficacia real (tabla 2 del material adicional) en este tipo de poblaciones.
¿Qué dudas nos presenta?¿Cada cuánto se debe revacunar a los pacientes? Se supone una probable corta duración de la protección inducida por la vacuna, que se ha calculado entre 6 y 12 meses36. Por tanto, serían esenciales las dosis de refuerzo. En este sentido, el grupo de Hui et al.47 sugiere una dosis de refuerzo administrada en promedio cada 3 años.
¿Será eficaz contra la infección asintomática? Estudios sobre vacunas diseñadas para proteger contra la enfermedad meningocócica B han demostrado que son muy efectivas contra la enfermedad sintomática invasiva, pero no tienen un impacto real en los portadores. Si la vacunación reduce solamente la infección sintomática por N. gonorrhoeae, podría ocurrir que menos HSH buscarán control/tratamiento de estas infecciones, lo cual sería contraproducente para el control de la transmisión48–50. Será interesante observar el impacto de la vacuna en la infección asintomática por N. gonorrhoeae51.
¿Será eficaz contra todas las cepas? Como ocurre con todas las vacunas, si la vacuna no es igualmente eficaz contra todas las cepas de N. gonorrhoeae, la vacunación podría introducir una presión selectiva favoreciendo cepas más difíciles de prevenir o tratar48. Esta posibilidad hace imprescindible una monitorización estrecha de las cepas de N. gonorrhoeae en caso de implementarse la vacunación.
¿A quién debemos ofrecer la vacuna? Whittles et al.52 recomendaron valorar la vacunación con la vacuna 4CMenB a HSH en clínicas de salud sexual en Inglaterra según su riesgo individual. Si bien esta estrategia podría parecer el primer paso lógico para reducir radicalmente los casos de N. gonorrhoeae, este enfoque excluye a muchas personas que podrían beneficiarse de la vacuna. Un enfoque alternativo sería vacunar adolescentes, idealmente antes de su inicio sexual, pudiendo contribuir a la protección contra la gonorrea y aumentar la inmunidad rebaño contra N. meningitidis. Sin embargo, esta segunda estrategia podría presentar un menor impacto en el diagnóstico poblacional de la gonorrea y además sería menos eficiente53.
ConclusionesAunque la evidencia disponible es cada vez mayor, las consecuencias a largo plazo del uso de la doxiciclina profiláctica y de la vacunación con 4CMenB para prevenir la infección por N. gonorrhoeae presentan aún muchas dudas. En España, ambas medidas se consideran fuera de indicación.
Según las principales instituciones, la prescripción de la Doxi-PEP se debería valorar de manera individualizada en HSH o mujeres transgénero que han presentado reiteradas infecciones venéreas en el último año. La decisión sobre esta prescripción debe acompañarse de las adecuadas actividades de vigilancia e investigación. Se recomienda monitorizar el impacto de la profilaxis antibiótica en relación con la aparición de resistencias antimicrobianas, los posibles cambios en el microbioma, así como los posibles cambios en la dinámica epidemiológica de las ITS.
Por otro lado, la evidencia actual apunta a que vacunar con la vacuna 4CMenB en poblaciones de riesgo para adquirir ITS, incluso asumiendo una protección parcial, podría tener un impacto considerable en la incidencia de gonorrea en estos grupos. Sin embargo, nos falta aún información sobre la posible diferencia del impacto de la vacuna en la infección asintomática o sintomática, así como su eficacia en distintas localizaciones de infección.
Con estas premisas, consideramos que debe valorarse de forma individualizada la idoneidad del uso de ambas medidas en usuarios seleccionados con elevado riesgo de adquisición de infecciones venéreas, como podrían ser algunos usuarios de PrEP.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.