El paciente con melanoma avanzado, metastásico o de alto riesgo, cuenta con opciones de tratamiento sistémico, inmunoterapia y terapias dirigidas, que han mejorado significativamente su supervivencia. El 50% de los pacientes con melanoma presentan mutación del gen BRAF. La toma de decisiones en cuanto a la secuencia óptima de tratamiento sistémico debe tener en cuenta factores relacionados con el medicamento, factores clínicos del paciente, así como los propios del tumor. Aunque la combinación ipilimumab-nivolumab es la que proporciona mejores resultados de supervivencia en todos los pacientes, la toxicidad asociada y el perfil de las terapias diana las puede hacer recomendables como primera línea en pacientes en determinadas situaciones clínicas. El objetivo de esta revisión es proporcionar un algoritmo de toma de decisiones en cuanto a la primera línea de tratamiento sistémico, inmunoterapia vs. terapias dirigidas, en el paciente con melanoma avanzado con mutación BRAF.
Systemic treatment with immunotherapy or targeted therapy can significantly improve survival in patients with advanced (metastatic or high-risk) melanoma. Fifty percent of patients with melanoma have a BRAF mutation. Decisions on optimal sequencing of systemic treatments should take into account drug- and tumor-related factors and patient characteristics. Although the combination of ipilimumab and nivolumab is associated with the best survival outcomes, it is associated with significant toxicity. Targeted therapy may be a more favorable option in certain clinical situations. We review the literature on immunotherapy and targeted therapy in melanoma and present an algorithm for guiding decision-making on their use as first-line systemic treatments for advanced BRAF-mutated melanoma.
El tratamiento sistémico del paciente con melanoma metastásico ha experimentado una transformación destacable durante la última década. La supervivencia global estimada en la séptima edición de la American Joint Committe on Cancer, inferior al 20% a los 5años para los pacientes con estadioIV, se ha incrementado hasta el 50% en los pacientes tratados con inmunoterapia y terapias dirigidas (inhibidores de BRAF y M)1,2. Si bien la inmunoterapia representa la única opción terapéutica en pacientes con tumores sin mutación del gen BRAF, aquellos pacientes con tumores que expresan esta mutación pueden beneficiarse tanto de la inmunoterapia como de las terapias dirigidas.
El objetivo de esta revisión es proporcionar elementos objetivos basados en la evidencia más reciente para facilitar la toma de decisiones en cuanto a la primera elección de tratamiento sistémico, o secuencia de tratamiento óptima, en el paciente con melanoma avanzado con mutación BRAF V600.
Estrategias terapéuticas para el paciente con melanoma avanzadoActualmente existen dos estrategias para el tratamiento sistémico del paciente con melanoma tanto en el escenario de adyuvancia como en el de enfermedad metastásica irresecable: inmunoterapia y terapias dirigidas (tabla 1).
Medicamentos para el tratamiento sistémico del melanoma actualmente disponibles en la práctica clínica
| Estrategia | Medicamento | Mecanismo de acción | Vía | Dosificación en la práctica clínica |
|---|---|---|---|---|
| Inhibidores de puntos de control inmune | Ipilimumab | Anti-CTLA4 | i.v. | Ipilimumab 3mg/kg, cada 3semanas, hasta un total de 4dosis |
| Nivolumab | Anti-PD1 | i.v. | Nivolumab 240mg cada 2semanas o 480mg cada 4semanas | |
| Pembrolizumab | Anti-PD1 | i.v. | Pembrolizumab 200mg cada 3semanas o 400mg cada 6semanas | |
| Ipilimumab-nivolumab | Anti-CTLA4 +Anti-PD1 | i.v. | Nivolumab 1mg/kg y ipilimumab 3mg/kg cada 3semanas las primeras 4dosis. A continuación, nivolumab 240mg cada 2semanas o 480mg cada 4semanas | |
| Terapias dirigidas | Dabrafenib +Trametinib | iBRAF-MEK | Oral | Dabrafenib 150mg/12h.Trametinib 2mg/24h |
| Vemurafenib +Cobimetinib | iBRAF-MEK | Oral | Vemurafenib 960mg/12h.Cobimetinib 60mg/24h durante 21días, seguido de 7días de descanso, en ciclos repetidos de forma mantenida | |
| Encorafenib +Binimetinib | iBRAF-MEK | Oral | Encorafenib 450mg/24h.Binimetinib 45mg/12h |
En cuanto a la inmunoterapia, el melanoma cutáneo es un tipo tumoral con alta inmunogenicidad, derivada de una elevada carga mutagénica consecuencia de la exposición solar que lo desencadena3. Esta inmunogenicidad se traduce en la liberación de autoantígenos tumorales que, procesados por las células presentadoras de antígeno, interactúan con receptores linfocitarios favorecedores de la respuesta inmune, conocidos como puntos de control inmunológico (immune checkpoints), que pueden ser de dos tipos: CTLA4 y PD1. La inmunoterapia del melanoma se basa en el uso de inhibidores de puntos de control inmunológico (immune checkpoint inhibitors [IPCI]), anticuerpos anti-CTLA4 y anti-PD1 que actúan bloqueando estos receptores antagonistas, y con ello favoreciendo la actuación de los linfocitosT frente a las células tumorales4.
Las terapias diana o dirigidas están orientadas a contrarrestar los efectos de mutaciones somáticas presentes en las células tumorales y que favorecen una proliferación celular descontrolada5. La mutación del gen BRAF está presente aproximadamente en el 50% de los melanomas cutáneos, de las cuales el 90% se corresponden con la mutación BRAF V600E6,7. Esta prevalencia de la mutación BRAF en melanoma cutáneo lleva a que las terapias dirigidas solo se puedan ofrecer aproximadamente en la mitad de los pacientes con melanoma. La terapia diana efectiva actual requiere la administración simultánea de inhibidores de BRAF y MEK.
Factores clínicos y terapéuticos para la toma de decisiones sobre la primera línea de tratamiento sistémicoLa toma de decisiones en cuanto a la primera línea de tratamiento sistémico debe tener en cuenta los perfiles diferenciales de ambas estrategias, factores relacionados con el medicamento en sí, factores individuales del paciente (comorbilidades), así como los propios del tumor (comportamiento, progresión, etc.) (tabla 2).
Factores que deben considerarse en la toma de decisiones sobre la primera línea de tratamiento sistémico en pacientes con melanoma avanzado
| Relacionados con el medicamento | Relacionados con el tumor | Factores clínicos del paciente |
|---|---|---|
| • Resultados de supervivencia• Inicio de la respuesta• Duración de la respuesta• Toxicidad• Vía de administración• Aspectos regulatorios | • Carga tumoral• Velocidad de progresión• Localización metastásica: metástasis cerebrales• Sintomatología | • Enfermedad autoinmune• Inmunosupresores: corticoides, otros• Trasplante de órgano sólido• Performance status• Preferencia personal |
El seguimiento a largo plazo de los ensayos clínicos tanto de la monoterapia con anti-PD1 (nivolumab, pembrolizumab) como de los regímenes combinados de inhibidores de BRAF-MEK proporcionan supervivencias globales a los 5años en alrededor del 50% de los pacientes tratados2. Sin embargo, el régimen de inmunoterapia combinada ipilimumab-nivolumab es el esquema terapéutico que proporciona los mejores resultados de supervivencia a largo plazo, por lo que inicialmente se considera a esta combinación como primera línea preferida en pacientes con melanoma metastásico no resecable8–10. No obstante, debido al mayor riesgo de toxicidad grave asociado a esta combinación, la terapia inicial con monoterapia anti-PD1 (nivolumab, pembrolizumab) es igualmente aceptada como primera línea terapéutica10,11.
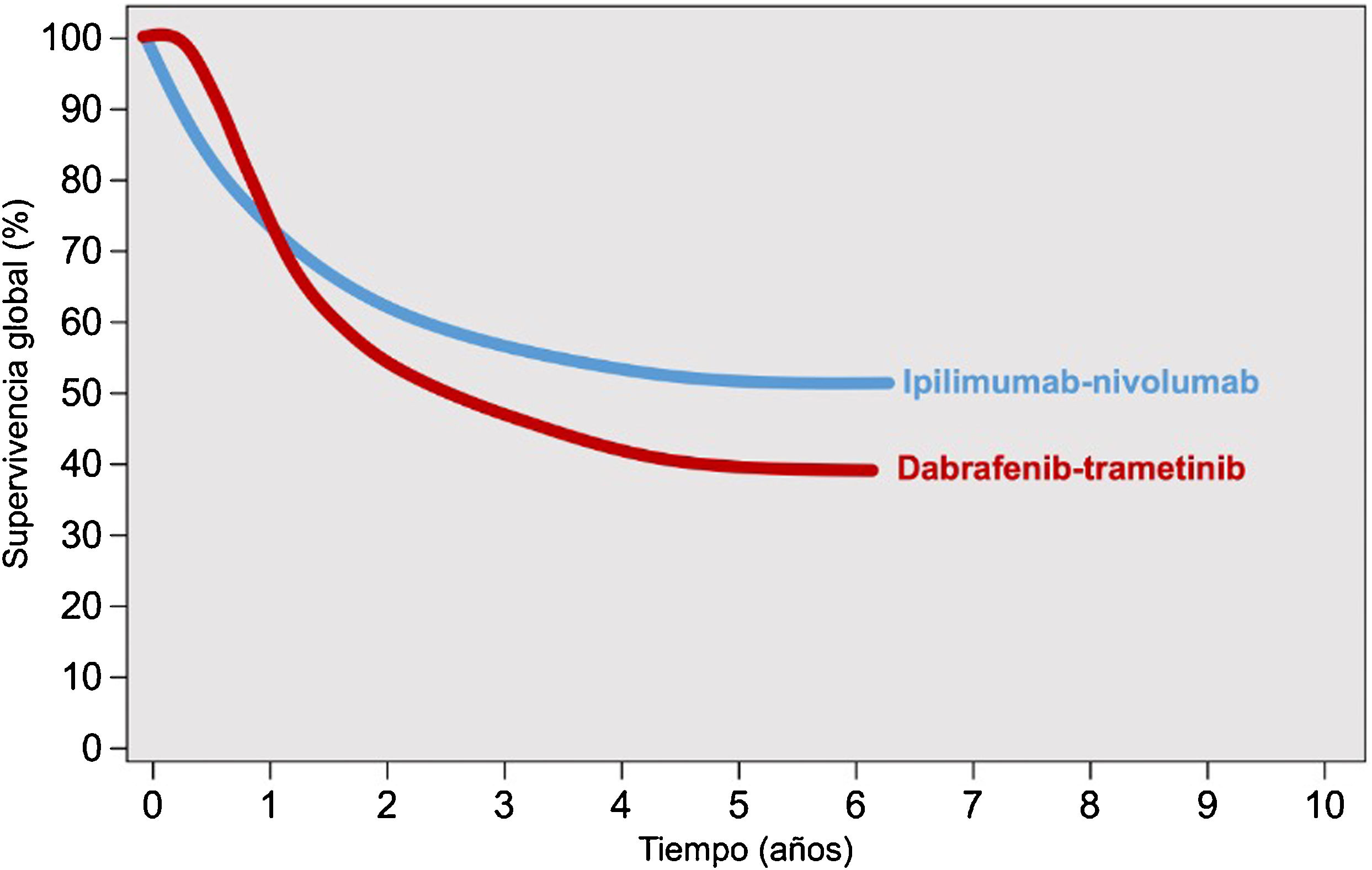
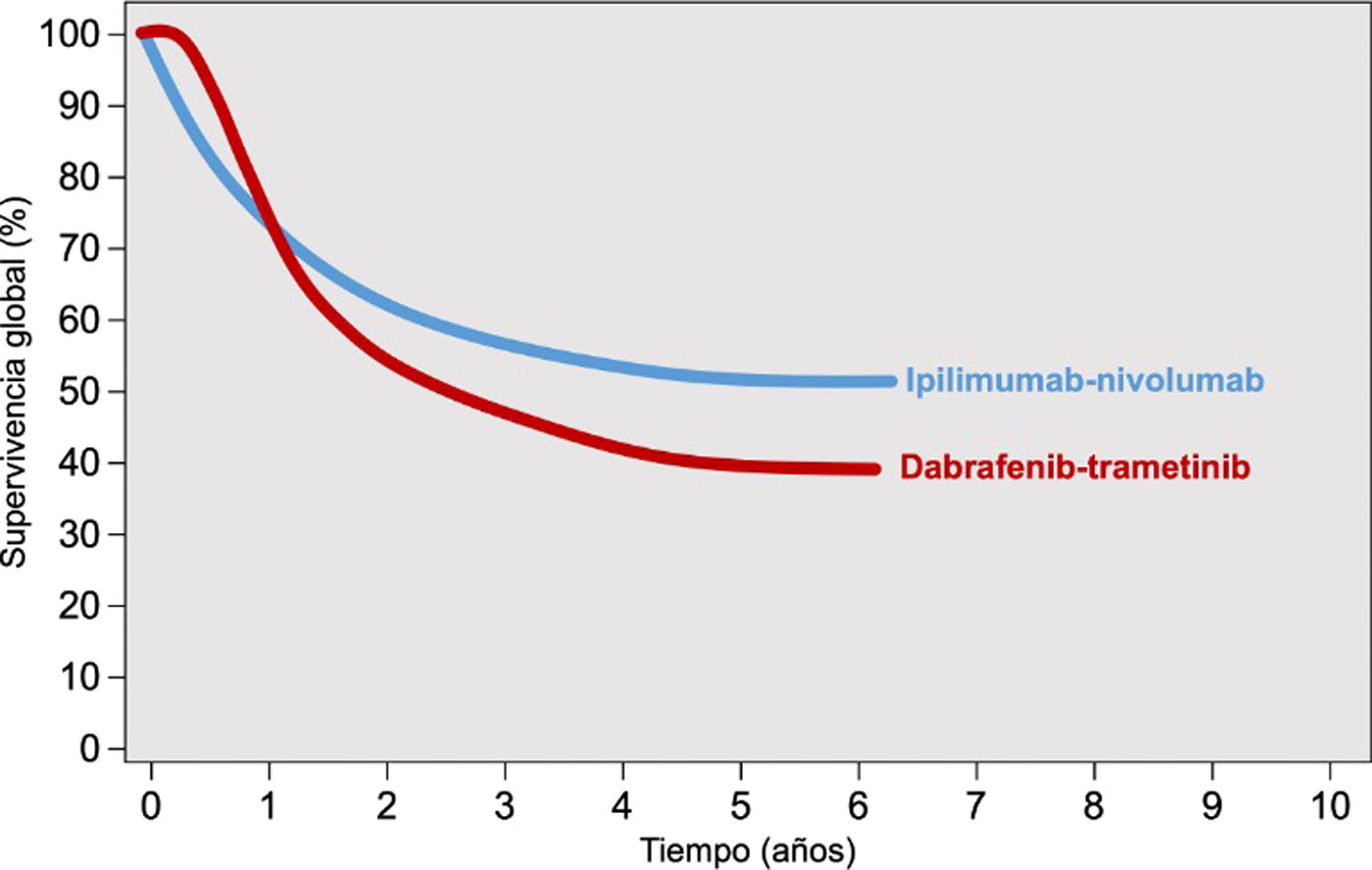
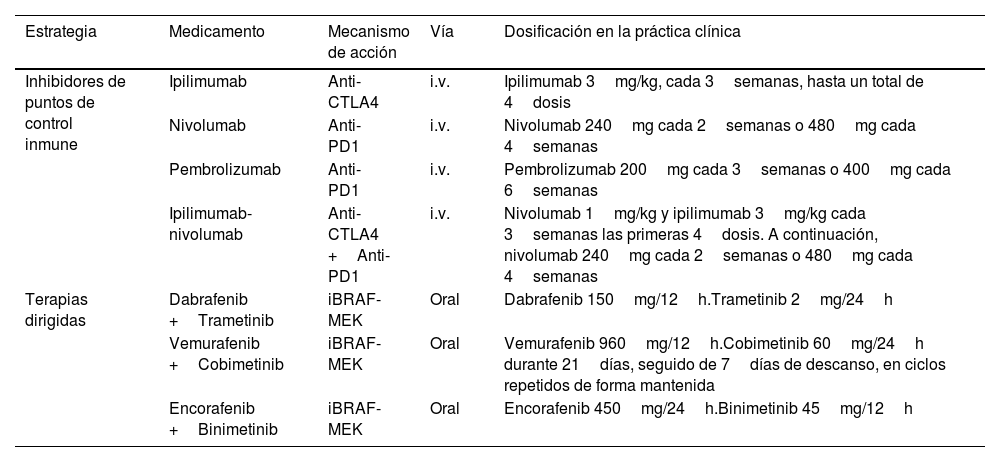
Los inhibidores de los puntos de control inmunológico y las terapias dirigidas presentan diferencias sustanciales en cuanto al patrón de respuesta terapéutica. Los inhibidores de BRAF-MEK, por su propio mecanismo de acción, se asocian con una respuesta terapéutica más rápida que los anti-PD1 y anti-CTLA4. Esta diferente dinámica de respuesta terapéutica se explicita en las curvas de supervivencia de los ensayos clínicos de cada una de estas opciones, que muestran un inicio más «amesetado» en los pacientes tratados con terapia diana, mejor supervivencia en el corto plazo, frente a una caída inicial más abrupta de la supervivencia en los tratados con inmunoterapia hasta que comienza a observarse su beneficio sobre la supervivencia (fig. 1)2. Por el contrario, el tratamiento con IPCI se asocia a una respuesta terapéutica más duradera, incluso después de la suspensión del tratamiento. En el caso de las terapias diana, la suspensión del tratamiento suele seguirse de una rápida progresión de la enfermedad, por lo que se considera una opción de tratamiento mantenido12,13. Aparte de este patrón de respuesta terapéutica, ambas estrategias presentan un perfil de seguridad también diferente. La inmunoterapia suele acompañarse de efectos tóxicos de grado3-4 en el 14% de los pacientes tratados con anti-PD1, y en hasta el 45% de los tratados con ipilimumab, efectos inmunomediados que con frecuencia son irreversibles14,15. Sin embargo, los inhibidores de BRAF-MEK se asocian a toxicidad moderada-grave, grado3-4, en el 41% de los pacientes, con frecuencia reversibles con el ajuste de dosis o con la suspensión del tratamiento16.
Patrón de respuesta de la inmunoterapia combinada anti-CTLA4 y terapia dirigida con inhibidores de BRAF-MEK.
Fuente: adaptado de Michielin et al.2.
Por último, ambos grupos terapéuticos presentan también diferente vía de administración, lo que puede representar un elemento a considerar entre las preferencias del paciente (tabla 1).
Factores clínicos del pacienteFactores clínicos individuales, como las comorbilidades o los tratamientos concomitantes, son también elementos relevantes en la decisión sobre la primera línea terapéutica. En este sentido, se ha observado un riesgo de acontecimientos adversos inmunomediados significativamente mayor en pacientes con melanoma tratados con inmunoterapia y con enfermedad autoinmune basal, con respecto a pacientes sin enfermedad autoinmune17. Estos resultados se repitieron en otro estudio sobre melanoma y otros tipos de cáncer tratados con anti-PD1, con una mayor frecuencia de toxicidad inmunomediada en pacientes con enfermedad autoinmune previa (65,9% vs. 39,9%), aunque la diferencia no fue significativa en cuanto a efectos tóxicos graves (grado3-4)18. La combinación de ipilimumab-nivolumab en pacientes con enfermedad autoinmune previa desencadenó una reagudización de la enfermedad de base en el 33% de los pacientes, riesgo que se observó especialmente en pacientes con enfermedad inflamatoria intestinal y cuadros reumatológicos, y en aquellos con tratamiento inmunosupresor19.
Igualmente, se ha observado un aumento del riesgo de progresión y muerte en pacientes con cáncer en tratamiento con IPCI y que recibían corticosteroides por cualquier motivo (tratamiento paliativo, metástasis cerebrales, etc.) frente a los que no tomaban corticosteroides (HR: 1,54; IC95%: 1,24-1,91; p=0,0001), resultados que se mantuvieron en los estudios sobre pacientes con melanoma (HR: 1,75; IC95%: 1,07-2,88; p=0,03)20. En pacientes trasplantados también se ha observado una tasa de rechazo del órgano del 50%, aunque en estos estudios se redujo el régimen de inmunosupresión en la mayoría de los pacientes21. Sin embargo, cuando se ha mantenido la inmunosupresión la frecuencia de rechazo se redujo de forma llamativa (6% de rechazo recuperable con respuesta tumoral, 6% de rechazo irrecuperable con respuesta tumoral), por lo que se sugiere que el mantenimiento de la inmunosupresión durante el tratamiento con IPCI podría no afectar a la eficacia de la inmunoterapia y podría reducir el riesgo de rechazo del trasplante21. En cualquier caso, y considerando los datos disponibles, en pacientes con melanoma BRAF mutado y enfermedad autoinmune y/o tratamiento inmunosupresor una primera línea basada en terapias diana podría ser una opción prudente en el paciente con melanoma avanzado, siempre que no prevalezcan otros factores clínicos a priorizar.
La capacidad funcional del paciente con melanoma avanzado (performance status) ha sido estudiada como un factor predictor de respuesta terapéutica, a pesar de que los ensayos clínicos no incluyen a pacientes con capacidad funcional reducida (PS≥2). Un metaanálisis demostró que el tratamiento con IPCI mejoró la supervivencia independientemente del performance status del paciente22. Sin embargo, en pacientes tratados con dabrafenib-trametinib se demostró una diferencia significativa en la supervivencia libre de progresión en pacientes con capacidad funcional reducida (PS≥1 vs. PS=0)23,24.
Factores relacionados con el tumorLa carga o volumen tumoral, la velocidad de progresión y los síntomas asociados a esta dinámica de progresión son factores que deben incorporarse a la toma de decisiones sobre la primera línea terapéutica.
En relación con la carga tumoral y la velocidad de progresión, un análisis agregado de los ensayos clínicos sobre dabrafenib-trametinib demostró una mayor supervivencia a los 2años de los pacientes con LDH normal, con menos de tres localizaciones metastásicas y menor enfermedad medible24. No obstante, en el escenario de baja carga tumoral los IPCI también han demostrado mejores resultados de supervivencia25,26. Sin embargo, es posible que el perfil de toxicidad que ofrecen los inhibidores de BRAF-MEK y la posibilidad de seguir contando con la inmunoterapia en caso de recaída sean factores favorecedores para priorizar las terapias diana como primera línea terapéutica en pacientes con baja carga tumoral. De hecho, un reciente editorial en el que se pregunta sobre el papel de los inhibidores de BRAF-MEK en el tratamiento del melanoma defiende la indicación de los iBRAF-MEK en pacientes con la menor carga tumoral, y entre ellos los candidatos a adyuvancia. En este escenario, los resultados son similares a la inmunoterapia y, además, la eficacia de la terapia anti-PD1 en caso de recaída durante el tratamiento con inhibidores de BRAF es elevada27.
Pero los inhibidores de BRAF-MEK, en este caso por su rapidez de respuesta, podrían también priorizarse como primera línea terapéutica en pacientes con tumores en fase de crecimiento rápido sintomático y con compromiso vital inminente. En este caso, independientemente de una duración de una respuesta terapéutica más corta, la prioridad consistiría en alcanzar el control de la enfermedad en el menor tiempo posible. Con este objetivo, la guía clínica EADO recomienda el uso de iBRAF-MEK como primera línea en pacientes con tumores mutados, alta carga tumoral y curso agresivo o LDH elevada11.
El impacto de la progresión tumoral y la sintomatología asociada se relaciona también con la localización de las metástasis, como ocurre en el paciente con metástasis cerebrales en progresión, acompañado habitualmente de sintomatología tratada con corticosteroides, y por lo tanto probablemente mejores candidatos a una primera línea terapéutica basada en iBRAF-MEK28. En el paciente con diseminación tumoral de alta carga, aunque sin riesgo vital inminente, la doble inmunoterapia con ipilimumab-nivolumab, por la supervivencia demostrada, se consideraría el tratamiento de primera elección8,9,29,30.
Propuesta para la toma de decisiones en el paciente con melanoma BRAF mutadoTratamiento adyuvante y neoadyuvanteLos IPCI y las terapias dirigidas han demostrado beneficios de supervivencia libre de enfermedad después de la resección completa de la metástasis (adyuvancia). Por ello, las guías de práctica clínica recomiendan terapia adyuvante con anti-PD1 en todos los pacientes con melanoma estadiosIIIA-IIID como régimen preferido, independientemente del estatus BRAF, o con inhibidores de BRAF-MEK para aquellos con mutación BRAF V60010,11 (tabla 3).
Indicaciones y situación regulatoria de las diferentes opciones de inmunoterapia y terapia dirigida disponibles en la actualidad
| Medicamento | Adyuvancia | Metástasis irresecable |
|---|---|---|
| Ipilimumab | No autorizado | AEMPS: tratamiento del melanoma avanzado (irresecable o metastásico) en adultos y adolescentes de 12años y mayores |
| Nivolumab | AEMPS: adultos con melanoma con metástasis ganglionar después de resección completa.Indicación limitada a pacientes con melanoma estadioIIIC yIIID después de resección completaaFDA: Pacientes con melanoma estadioIIB-IIC después de resección completa | AEMPS: tratamiento del melanoma avanzado (irresecable o metastásico) en adultos |
| Pembrolizumab | AEMPS: melanoma con metástasis ganglionar después de resección completa.Indicación limitada a pacientes con melanoma estadioIIIC yIIID después de resección completaa.FDA, EMA: adultos y adolescentes de 12años o más con melanoma estadioIIB, IIC y III después de resección completa | AEMPS: tratamiento en adultos y adolescentes a partir de 12años de edad con melanoma avanzado (irresecable o metastásico) |
| Ipilimumab-nivolumab | FDA, EMA, AEMPS: no autorizado | AEMPS: tratamiento del melanoma avanzado (irresecable o metastásico) en adultos |
| Dabrafenib +Trametinib | FDA, EMA: melanoma estadioIII, con mutación BRAF V600, después de resección completa.No financiado en Españab | AEMPS: adultos con melanoma no resecable o metastásico con mutación BRAF V600 |
| Vemurafenib +Cobimetinib | FDA, EMA, AEMPS: no autorizado | AEMPS: adultos con melanoma no resecable o metastásico con una mutación BRAF V600 |
| Encorafenib +Binimetinib | FDA, EMA, AEMPS: no autorizado | AEMPS: adultos para el tratamiento del melanoma no resecable o metastásico con mutación BRAF V600 |
AEMPS: Agencia Española de Medicamentos y Productos Sanitarios; EMA: European Medicines Agency; FDA: Food and Drug Administration.
La Dirección General de Cartera Común de Servicios del Sistema Nacional de Salud (SNS) de España ha emitido resolución de financiación para pembrolizumab y nivolumab limitando su utilización al tratamiento adyuvante de pacientes con melanoma en estadiosIIIC yIIID y con afectación de los ganglios linfáticos, que hayan sido sometidos a resección completa.
A partir de los resultados de los ensayos faseIII, la Food and Drug Administration (FDA) ha autorizado la adyuvancia en pacientes con tumores primarios, no metastásicos, de alto riesgo (estadioIIB-IIC), por lo que la guía NCCN ya incluye la recomendación de monoterapia con pembrolizumab en este escenario clínico (tabla 3)10,31, indicación que no se encuentra autorizada en nuestro medio.
En cuanto al novedoso escenario de neoadyuvancia, los estudios iniciales de ipilimumab-nivolumab antes de la disección ganglionar demostraron respuestas patológicas completas en el 61% de los ganglios metastásicos, aunque con una frecuencia de toxicidad grado3-4 del 22%32. Un ensayo faseII acaba de demostrar un claro beneficio de supervivencia libre de enfermedad a los 2años en los pacientes tratados con pembrolizumab antes y después de la intervención (neoadyuvancia +adyuvancia) con respecto a los tratados solo después de la disección ganglionar, adyuvancia (72% vs. 49%; p=0,004)33.
La decisión en cuanto a la estrategia preferida en pacientes con melanoma BRAF mutado en este escenario clínico también deberá considerar el perfil de comorbilidades del paciente y la toxicidad esperada del medicamento. En este sentido, en países en los que la adyuvancia con dabrafenib-trametinib está autorizada, y siguiendo la recomendación de inhibidores de BRAF-MEK en pacientes con baja carga tumoral, las terapias dirigidas parecen resultar una opción de primera elección en el escenario de adyuvancia en pacientes con melanoma BRAF mutado27.
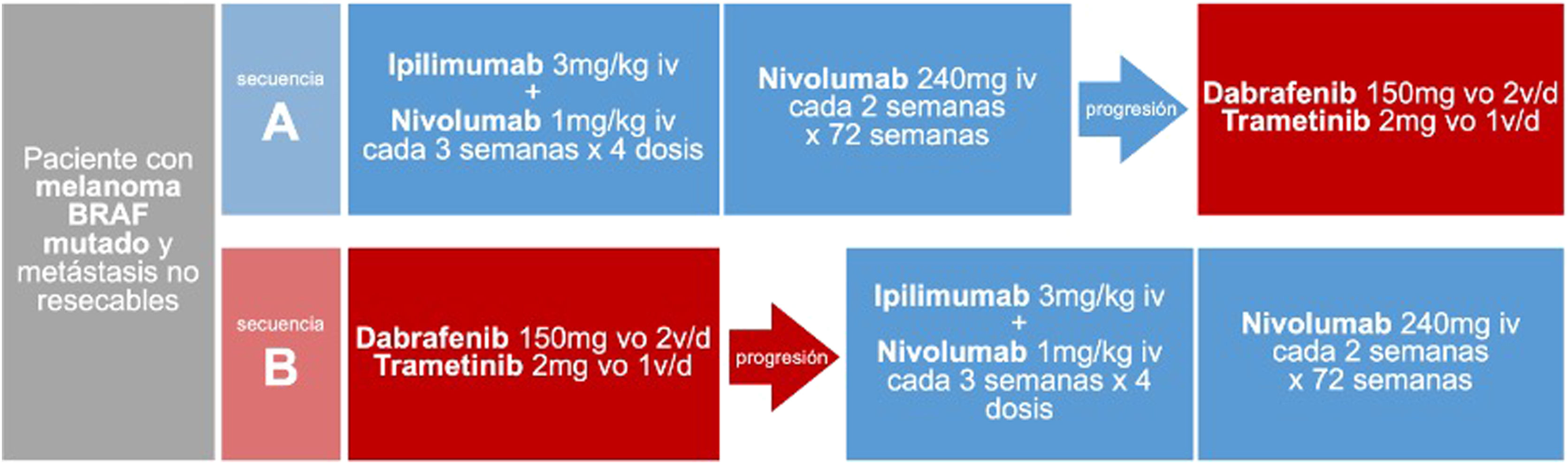
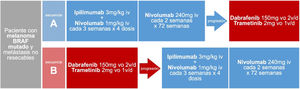
Secuencia de tratamiento sistémico inicial del paciente con melanoma BRAF mutado y metástasis irresecablesAdemás de las evidencias basadas en comparaciones indirectas, mecanismos de acción, perfiles de seguridad y vías de administración, la reciente publicación del ensayo clínico faseIII DREAMseq aporta evidencia directa en cuanto a la secuencia de tratamiento sistémico inicial en pacientes con tumores BRAF mutado. Este ensayo ha comparado, en pacientes con melanoma metastásico irresecable y mutación BRAFV600 sin tratamiento previo para la enfermedad metastásica ni adyuvancia, el inicio de tratamiento con ipilimumab-nivolumab seguido de dabrafenib-trametinib en caso de progresión, con la secuencia de inicio dabrafenib-trametinib seguido de ipilimumab-nivolumab en caso de progresión (fig. 2). La supervivencia global a los 2años ha resultado claramente a favor del inicio con ipilimumab-nivolumab (71,8% vs. 51,5%; p=0,01). Esta ventaja de supervivencia se mantuvo en todos los subgrupos de pacientes, incluso en aquellos que supuestamente muestran mejor respuesta inicial con dabrafenib-trametinib (performance status0, LDH normal, carga tumoral baja consistente en menos de tres localizaciones metastásicas)34. Además, la tasa de respuesta objetiva global fue similar en los pacientes iniciados con ipilimumab-nivolumab que con dabrafenib-trametinib (46,0% vs. 43,0%). Sin embargo, en caso de progresión y cambio de tratamiento, dabrafenib-trametinib mantuvo una respuesta terapéutica similar a la alcanzada como primera línea (47,8%), mientras que ipilimumab-nivolumab alcanzó una respuesta objetiva inferior a la alcanzada como primera línea (29,6%), resultados que sugieren que ipilimumab-nivolumab parece menos efectivo después de progresión a una primera línea con dabrafenib-trametinib34. En cuanto a la seguridad, las diferencias en la frecuencia de eventos adversos de grado ≥3 no fueron significativas en ambas secuencias de tratamiento, aunque sí se observó una mayor frecuencia de eventos tóxicos de grado4 en el grupo de inicio con ipilimumab-nivolumab34.
Secuencias de tratamiento comparadas en el ensayo clínico DREAMseq de pacientes con melanoma BRAF mutado metastásico irrecable34.
Estos resultados llevan a los autores a concluir que en pacientes con melanoma BRAF mutado la combinación ipilimumab-nivolumab, seguida de iBRAF-MEK en caso necesario, debería ser la secuencia terapéutica de elección en la mayoría de los pacientes. Sin embargo, esto puede no ser aplicable a pacientes tratados previamente con inmunoterapia o que hayan recibido adyuvancia con anti-PD1, anti-CTLA4 o inhibidores de BRAF-MEK, pacientes que fueron excluidos del ensayo clínico34. Por otra parte, aunque no ha sido analizado en un ensayo clínico comparativo, las comparaciones indirectas de los datos a largo plazo de los ensayos pivotales, así como los datos de registros de práctica clínica, pueden respaldar igualmente el tratamiento inicial con monoterapia anti-PD1.
En el ensayo faseII SECOMBIT, aunque sin comparaciones formales, la secuencia inicial de ipilimumab-nivolumab seguida de encorafenib-binimetinib alcanzó la mejor supervivencia global a los 3años (62%)35. La mejor tasa de respuesta global de ipilimumab-nivolumab (57,9%) se observó cuando la combinación fue administrada en una secuencia sándwich consistente en encorafenib-binimetinib durante 8semanas seguido de nivolumab-ipililumab, y encorafenib-binimetinib en caso de progresión35. Los autores del estudio destacan que esta estrategia «sándwich» puede incrementar la respuesta inicial manteniendo el beneficio a largo plazo (Ensayo faseII EBIN-EORTC ClinicalTrials.gov identifier: NCT03235245).
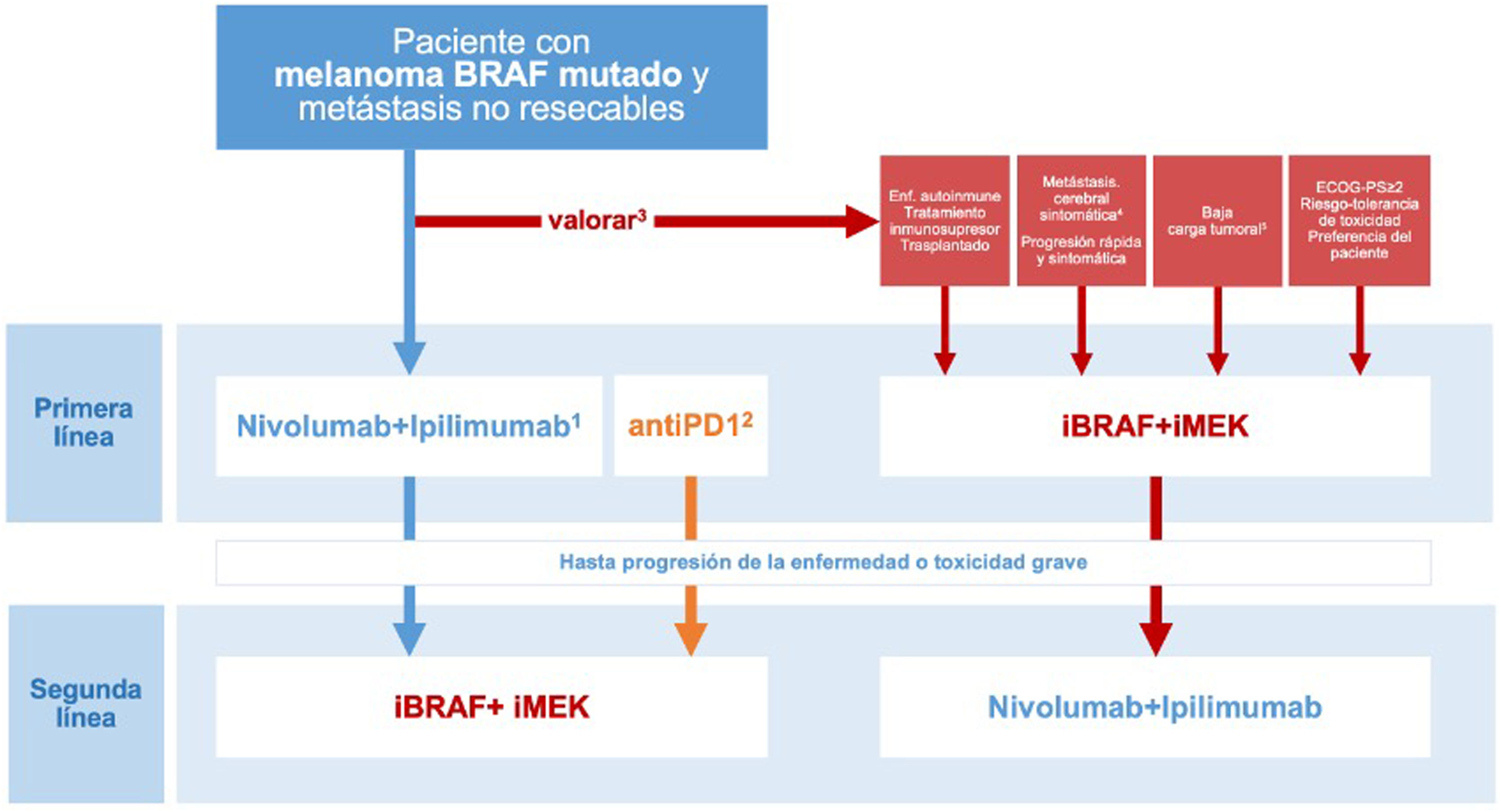
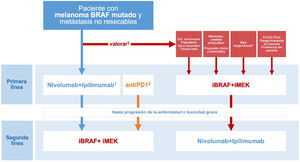
Las conclusiones derivadas del ensayo clínico DREAMseq, junto con las evidencias indirectas y la experiencia previa con iBRAF-MEK, permiten plantear un algoritmo de toma de decisiones orientado a individualizar el tratamiento en función de todas las circunstancias concurrentes, optimizando los resultados de supervivencia y al mismo tiempo reduciendo la variabilidad en la práctica clínica (fig. 3). No obstante, esta propuesta quedará pendiente de revisión a medida que los ensayos clínicos, actualmente en desarrollo y que exploran diferentes secuencias de tratamiento, continúen ofreciendo resultados relevantes para la práctica clínica.
Toma de decisiones sobre la primera línea de tratamiento sistémico en pacientes con melanoma cutáneo BRAF mutado. 1.La combinación ipilimumab-nivolumab debe considerarse como la primera línea en la mayoría de las situaciones clínicas. 2.Las comparaciones indirectas de los resultados a largo plazo de los ensayos pivotales, así como los datos de registros de práctica clínica, respaldan que la secuencia basada en monoterapia con un anti-PD1 (nivolumab o pembrolizumab) pueda ofrecer los mismos resultados que la terapia inicial con anti-CTLA4 +anti-PD1. 3.El comité multidisciplinar valorará la existencia de factores clínicos y relacionados con la progresión tumoral que favorezcan el inicio del tratamiento sistémico con inhibidores de BRAF-MEK. 4.La necesidad de tratamiento con corticosteroides a dosis altas como tratamiento sintomático de las metástasis cerebrales representa un factor limitante para la inmunoterapia. 5.Parámetros objetivos definitorios de una situación de baja carga tumoral: LDH normal, ≤3localizaciones metastásicas, suma de los diámetros máximos de las lesiones diana <44mm.
ECOG-PS: Eastern Cooperative Oncology Group performance status.
Los autores declaran no tener ningún conflicto de intereses.