Las opciones terapéuticas para el tratamiento de la hidradenitis supurativa (HS) son limitadas y se reducen conforme aumenta la gravedad de la enfermedad1,2. El apremilast es un inhibidor de la fosfodiesterasa 4 que ejerce una acción inmunomoduladora, bloqueando parcialmente la expresión de citoquinas proinflamatorias e induciendo la expresión de citoquinas antiinflamatorias3. Actualmente está indicado en pacientes adultos diagnosticados de psoriasis en placas y/o artritis psoriásica que no responden a la terapia sistémica convencional. Basándose en la hipótesis de que el apremilast actúa sobre diversas células implicadas en la patogenia de la HS (células T, células natural killer, neutrófilos, monocitos y células dendríticas) se han desarrollado estudios para demostrar su eficacia en esta enfermedad4,5.
Se realizó un estudio observacional, descriptivo y retrospectivo incluyendo pacientes diagnosticados de HS que recibieron tratamiento con apremilast desde enero de 2015 hasta febrero de 2020 en nuestro centro. En las tablas 1 y 2 se resumen los resultados de las variables clínicas, de eficacia y de seguridad. En total se incluyeron 7 pacientes (3 mujeres y 4 hombres) con una edad media de 37,43 años. La mayoría presentaba enfermedad grave (Hurley iii) al inicio del tratamiento, siendo el fenotipo predominante el tipo i o axilar y el IiI o glúteo. Entre los antecedentes patológicos encontramos 3 pacientes con psoriasis concomitante, otro que asociaba pioderma gangrenoso y acné (síndrome PASH) y un paciente con una leucemia linfática crónica en remisión parcial. Respecto al tratamiento previo recibido 2 pacientes eran naives a tratamiento biológico, uno de ellos por el antecedente de neoplasia y el otro por fobia a las agujas. Se discontinuó el tratamiento en 2 pacientes en la semana 12 por fallo terapéutico.
Resumen de las características de los pacientes incluidos en nuestra serie (n=7)
| Casos | Edad (años) | Sexo (M/V) | IMC (kg/m2) | Antecedentes patológicos | Fenotipo HS predominante | Tratamientos sistémicos previos al apremilast | Motivo inicio del apremilast | Motivo interrupción del apremilast | Hurley basal | PGA (basal/sem 24) | IHS4 (basal/sem 24) | DLQI (basal/sem 24) | VAS dolor (basal/sem 24) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 43 | M | 31,6 | Psoriasis, depresión | I | Antibióticos oralesAdalimumabInfliximab | Falta de respuesta a tratamientos previos | Falta respuesta terapéutica a los 3 meses | III | 4/- | 20/- | 20/- | 7/- |
| 2 | 36 | V | 28,6 | Psoriasis, hipertensión arterial, diabetes mellitus 2 | III | Antibióticos oralesCorticoides sistémicosAdalimumabInfliximabUstekinumab | Falta de respuesta a tratamientos previos | En curso | III | 5/5 | 60/50 | 18/16 | 10/8 |
| 3 | 46 | M | 34 | Ninguno | I | Antibióticos oralesCorticoides sistémicosAdalimumabInfliximab | Falta de respuesta a tratamientos previos | En curso | III | 4/3 | 20/20 | 18/13 | 6/5 |
| 4 | 27 | V | 21 | Síndrome PASH | II | Antibióticos oralesAdalimumab | Respuesta paradójica a anti.TNF | En curso | III | 3/3 | 40/20 | 18/10 | 9/3 |
| 5 | 20 | V | 25,7 | Ninguno | III | Antibióticos orales | Fobia a agujas | En curso | II | 2/2 | 9/2 | 12/5 | 6/3 |
| 6 | 37 | V | 36,3 | Psoriasis, talasemia | I | Antibióticos oralesCorticoides sistémicosAdalimumabInfliximabUstekinumab | Falta de respuesta a tratamientos previos | En curso | III | 4/3 | 25/8 | 22/6 | 8/6 |
| 7 | 53 | M | 28 | Leucemia linfática crónica | III | Antibióticos oralesCorticoides sistémicos | Comorbilidades (neoplasia concomitante) | Falta de respuesta terapéutica a los 3 meses | III | 4/- | 24/- | 30/- | 10/- |
DLQI: Dermatology Life Quality Index; IHS4: International HS Severity Score System; IMC: índice de masa corporal; PASH: pioderma gangrenoso, acné e hidradenitis supurativa; PGA: Physician's Global Assessment; VAS: Visual Analogical Scale, dolor expresado de 0-10.
| Vossen et al. | Kerdel et al. | Nuestra serie | |
|---|---|---|---|
| Características basales | |||
| N. intervención | 15 | 20 | 7 |
| Tiempo de seguimiento (semanas) | 16 | 24 | 24 |
| PGA basal medio | 3 | 2,7 | 3,71 |
| Edad media (años) | 35,7 | 32,5 | 37,43 |
| Sexo (F/M) | 12/3 | 14/6 | 3/4 |
| DLQI basal medio | 14,6 | 11 | 19,71 |
| VAS dolor medio (0-10) | 5 | 2,6 | 8 |
| Eficacia y seguridad | n/N, % (semana) | ||
|---|---|---|---|
| HiSCR50 | 8/15; 53,3 (16) | 12/20; 60 (24) | 3/7; 43 (24) |
| Reducción VAS dolor≥2 puntos | - | 6/20; 30 (24) | 4/7; 57 (24) |
| Reducción PGA≥1punto | - | 10/20; 50 (24) | 2/7; 29 (24) |
| Reducción DLQI≥30% | - | - | 3/7; 43 (24) |
| ≥1 efecto adverso | 6/15; 40 (16) | 9/20; 45 (24) | 2/7; 28,6 (24) |
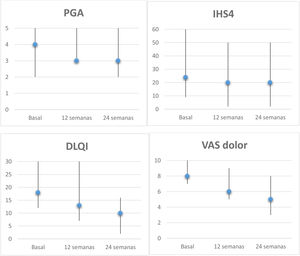
En el análisis por intención de tratar, a la semana 24 el 43% de los pacientes alcanzó HiSCR50. Observamos una reducción del VAS de dolor≥2puntos en el 57% de los pacientes y una reducción de PGA≥1 punto en 29%, con una disminución del DLQI≥30% en el 43% en la semana 24. La evolución de las distintas escalas de respuesta (IHS4, PGA, VAS dolor y DLQI) a las 12 y 24 semanas se recoge en la figura 1. El análisis a los 6 meses mostró una reducción significativa del dolor (p=0,042) y el impacto de la enfermedad sobre la calidad de vida (p=0,043). Respecto a la seguridad solo 2 pacientes presentaron efectos adversos gastrointestinales leves que no obligaron a interrumpir el tratamiento.
Evolución de las escalas de los pacientes con HS tratados con apremilast. Mediana y rango (basal, semana 12 y 24) de PGA, IHS4, DLQI y VAS dolor (0-10). Análisis de la reducción a los 6 meses mediante la prueba Wilcoxon para muestras apareadas: PGA, p=0,157; IHS4, p=0,068; DLQI, p=0,043 y VAS dolor, p=0,042. DLQI: Dermatology Life Quality Index; IHS4: International HS Severity Score System; PGA: Physician's Global Assessment; VAS: Visual Analogical Scale.
En los últimos años se han publicado diversas series que apoyan el uso del apremilast como alternativa terapéutica en los pacientes con HS3. Además, recientemente se han realizado 2 ensayos clínicos. El primero4, un ensayo clínico aleatorizado doble ciego (n=15), que evaluó la eficacia y tolerancia del apremilast durante 16 semanas. El segundo5, un ensayo clínico abierto fase 2 (n=20), evaluó la eficacia y seguridad en pacientes con HS leve-moderada durante 24 semanas. El porcentaje de respuesta fue similar en ambos ensayos clínicos alcanzando HiSCR50 en el 60% de los pacientes, con una reducción del VAS de dolor de al menos 2 puntos en el 30% de los casos en la semana 24. En cuanto a la seguridad hasta el 45% de los pacientes presentaron al menos un efecto adverso, siendo el más frecuente la diarrea.
Si comparamos las características basales de los pacientes de nuestra serie y las de los ensayos clínicos comentados (tabla 2), encontramos una edad media similar, un leve predominio de sexo masculino, con un valor medio de PGA y de DLQI basal superior en nuestra serie. En cuanto a la eficacia encontramos un porcentaje similar de pacientes que alcanzaron HiSCR50, con una reducción del VAS de dolor considerablemente superior en la semana 24. Por tanto, a pesar de incluir un perfil de pacientes con enfermedad basal más grave y con mayor afectación de la calidad de vida, la proporción de respuesta terapéutica fue similar. Creemos que, debido al carácter retrospectivo de nuestra serie, hemos recogido un porcentaje menor de efectos adversos.
A pesar de que la psoriasis y la HS pueden compartir mecanismos patogénicos, su asociación es poco frecuente. Hasta la fecha solo hemos encontrado un caso en la literatura sobre el uso del apremilast en un paciente diagnosticado de ambas enfermedades6. En nuestra serie hasta 3 pacientes presentaban ambas, 2 de ellos presentando buena respuesta tanto en la HS como en la psoriasis. El tercero interrumpió el tratamiento por fallo primario en la HS.
El apremilast podría ser una alternativa en aquellos pacientes con HS que han agotado otras opciones terapéuticas que han demostrado mayor evidencia. Creemos que los pacientes con HS que pueden beneficiarse del apremilast son aquellos con antecedentes neoplásicos, reacciones paradójicas a anti-TNF, infecciones activas y que rechacen tratamientos subcutáneos o parenterales.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.