El abordaje terapéutico de las manifestaciones cutáneas de las enfermedades raras es complejo. El objetivo principal de este trabajo consistió en determinar el impacto de la formulación magistral de dispensación hospitalaria en la calidad de vida de los pacientes con genodermatosis.
Material y métodosSe diseñó un estudio descriptivo transversal. Se incluyeron pacientes con genodermatosis que recibieron tratamientos tópicos elaborados y dispensados por el Servicio de Farmacia Hospitalaria del Complejo Hospitalario Universitario de Pontevedra. Se recogieron datos demográficos, cuestionarios generales y específicos sobre la calidad de vida, y cuestionarios que evaluaban los tratamientos administrados y la adherencia terapéutica.
ResultadosSe incluyeron 9 pacientes. Se observó que, tras la terapia con fórmulas magistrales, hubo una reducción estadísticamente significativa del impacto en la calidad de vida de los pacientes. La satisfacción con los productos fue 2,8 sobre 25 (siendo 0 la mejor puntuación). La adherencia terapéutica superó el 89%.
ConclusionesLa formulación magistral permite el acceso a medicamentos huérfanos y no comercializados para numerosas enfermedades raras. Su impacto en la calidad de vida de los pacientes afectos de estas enfermedades ha sido escasamente estudiado. En la serie de pacientes que se presenta, la elaboración y dispensación hospitalaria de fórmulas magistrales específicas conllevó efectos positivos en su calidad de vida. Este estudio inicial ha derivado en otro trabajo multicéntrico, centrado en las ictiosis, donde previsiblemente aumentará el número de pacientes a incluir y permitirá confirmar nuestros resultados.
Cutaneous manifestations are complicated to treat in rare diseases. The main aim of this study was to analyze the impact of compounded drugs prepared by hospital pharmacists on the quality of life of patients with genodermatoses.
Material and methodsWe undertook a cross-sectional study of patients with genodermatoses treated with topical medications compounded and dispensed by the pharmacy at Complejo Hospitalario Universitario in Pontevedra, Spain. We collected demographic data and answers to questionnaires examining generic and disease-specific quality of life, treatment satisfaction, and treatment adherence.
ResultsNine patients were included. We observed a significant improvement in health-related quality of life following treatment with compounded drugs. Satisfaction with the topical medications was 2.8 on a scale of 0 (greatest satisfaction) to 25. Treatment adherence was 59%.
ConclusionsDrug compounding facilitates access to orphan drugs that are not available for many rare diseases. Few studies, however, have analyzed impact on quality of life in this setting. In this series of patients with genodermatoses, topical medications compounded and dispensed by a hospital pharmacy improved health-related quality of life. This preliminary study has given rise to a multicenter study of compounding for ichthyosis. We expect that analysis of a larger sample will confirm our findings.
En Europa, el término enfermedades raras (ER) define a aquellas enfermedades que afectan a menos de 1 de cada 2.000 personas1. La definición es diferente en los Estados Unidos de América (EUA), donde se consideran ER aquellas presentes en menos de 200.000 personas2. La mayoría de estos trastornos tienen una base genética y su tratamiento es muy complejo.
Un gran número de ER conllevan afectación de la piel. Hasta la fecha, no se dispone de medicamentos huérfanos comercializados para la afectación cutánea de las ER. Además, aunque se han reportado casos clínicos y series de casos que muestran la eficacia de algunos tratamientos tópicos, la mayoría de ellos solo pueden ser prescritos fuera de ficha técnica.
La formulación magistral permite el acceso a estas terapias y posibilita adaptar el fármaco a la zona anatómica a tratar, pudiendo escoger el vehículo más apropiado y con mayor absorción. Cabe destacar que la formulación magistral se rige según unas directrices reguladoras y de calidad, refrendadas por el Consejo de Europa en su resolución CM/ResAP (2011), de 1 de enero de 20113 y en España en el Real Decreto 175/2001, de 23 de febrero4. No obstante, existen grandes diferencias en relación con la cobertura sanitaria y su dispensación. Existen también otras dificultades como la falta de consenso en cuanto a la concentración de los medicamentos y tipo de excipientes, lo que conlleva una elaboración muy heterogénea del producto final.
Desde el año 2017, el Servicio de Farmacia de nuestro hospital, el Complejo Hospitalario Universitario (CHU) de Pontevedra (España), en cooperación con otros centros del Sistema Nacional de Salud, forma parte de un proyecto cuyo objetivo es promover el desarrollo de fórmulas magistrales para los pacientes con ER5. Se pretende mejorar la calidad de vida de estos pacientes mediante el desarrollo constante de fórmulas magistrales haciendo al paciente partícipe de ello.
Las ER con afectación cutánea más comunes en el Servicio de Dermatología de nuestro hospital son las ictiosis, la epidermólisis ampollosa (EA) y la esclerosis tuberosa (ET). Para su tratamiento disponemos de las siguientes fórmulas magistrales: N-acetilcisteína 10% O/W y carbocisteína 10% O/W para ictiosis6–10, alantoína 6% O/W para EA11–13 y rapamicina 0,4% O/W para ET9,14–18. La selección de dichas fórmulas se basó en la eficacia demostrada en diversos trabajos publicados, así como en la experiencia de uso de las mismas en nuestro centro, donde el acceso a dichas terapias es posible por la elaboración y dispensación personalizada por el Servicio de Farmacia Hospitalaria8,10.
El objetivo principal de este trabajo consistió en determinar el impacto de la formulación magistral individualizada y de dispensación hospitalaria, sobre la calidad de vida de los pacientes con genodermatosis. Como objetivos secundarios se trató de evaluar la satisfacción de los pacientes con las características organolépticas de los productos y la adherencia terapéutica.
Material y métodosSe realizó un estudio descriptivo transversal. Se incluyeron pacientes con diagnóstico genético de genodermatosis, que recibían tratamientos tópicos elaborados y dispensados por el Servicio de Farmacia del CHU de Pontevedra. Estos pacientes se reclutaron entre marzo y diciembre de 2019, desde la Unidad de Dermatología Pediátrica, donde realizaban seguimiento con una periodicidad al menos semestral.
De los pacientes que cumplían los criterios de inclusión, tras un muestreo consecutivo, se registraron datos demográficos, tipo de genodermatosis, fórmula magistral recibida y duración del tratamiento.
Para evaluar el impacto de las fórmulas magistrales individualizadas en la calidad de vida, se emplearon dos cuestionarios diferentes. El primero de ellos genérico sobre calidad de vida en dermatología (Dermatology Life Quality Index [DLQI], usando el Childreńs Dermatology Life Quality Index [CDLQI] para pacientes pediátricos entre 4 y 16 años), y el segundo cuestionario, específico sobre calidad de vida relacionada con la genodermatosis correspondiente (Ichthyosis Quality of Life–32 items [IQoL-32]19, para los pacientes con ictiosis, Quality of Life evaluation in Epidermolysis Bullosa questionnaire [QOLEB]20 para los pacientes con EA, y una modificación del Childhood Atopic Dermatitis Impact Scale21 para ET [CADIS-mod]22). Cada paciente debía responder ambos cuestionarios (genérico y específico) dos veces, la primera refiriéndose al periodo antes de comenzar el tratamiento, y la segunda en referencia a la situación en el momento de responder el cuestionario con el tratamiento ya establecido. Para la utilización de todos los cuestionarios se obtuvo el permiso de los autores.
Se diseñó un cuestionario para cuantificar la satisfacción de los pacientes con las características organolépticas de los productos. Este cuestionario constaba de 5 preguntas respecto al olor, color, extensibilidad, textura y posibilidad de teñir la ropa. Su puntuación variaba de 0 a 5 en cada ítem, siendo 0 la mejor puntuación y 5 la más desfavorable (25: peor puntuación total).
La adherencia terapéutica se midió recogiendo las visitas de los pacientes al Servicio de Farmacia Hospitalaria, donde se dispensaba el tratamiento tópico, y estableciendo una correlación entre las visitas programadas y las reales.
El protocolo del estudio fue aprobado por el Comité Ético de Investigación Clínica (CEIC) de Galicia y clasificado por la Agencia Española de Medicamentos y Productos Sanitarios como «Estudio posautorización con diseño diferente al de seguimiento prospectivo».
Para el análisis estadístico se empleó el programa R-Statistics (versión R i386 3.4.2). Se calcularon la distribución de frecuencias para las variables cualitativas, y la media y la desviación típica para las variables cuantitativas. Para comparar las medias se empleó la distribución T-Student. Se consideró estadísticamente significativo un valor p<0,05.
Se debe destacar que de este estudio inicial ha derivado otro trabajo multicéntrico centrado en las ictiosis, donde previsiblemente aumentará el número de pacientes a incluir y permitirá obtener datos más fehacientes («Registro de pacientes con ictiosis a tratamiento con fórmulas magistrales u otros fármacos tópicos en condiciones de práctica clínica diaria», aprobado por el Comité de Ética de la Investigación con Medicamentos de Galicia, código de registro 2020/502).
ResultadosSe incluyeron 9 pacientes (7/9 varones, edad media de 19 años [mediana 13]) (tabla 1); 5 de ellos padecían ictiosis (3 ictiosis lamelares, 1 ictiosis recesiva ligada a X y 1 ictiosis vulgar), 2 sufrían EA (1 EA distrófica pruriginosa y 1 EA juntural tipo no Herlitz) y los otros 2 presentaban ET.
Características de los 9 pacientes incluidos
| Sexo | Edada(años) | Enfermedad | Fórmula magistral | Tx Duración (meses) | DLQI/CDLQI pre-Tx | DLQI/CDLQIpos-Tx | |
|---|---|---|---|---|---|---|---|
| Paciente 1 | M | 4 | Ictiosis lamelar | N-acetilcisteína 10% O/W | 39 | 15 | 6 |
| Carbocisteína 10% O/W | |||||||
| Paciente 2 | M | 6 | Ictiosis lamelar | N-acetilcisteína 10% O/W | 40 | 20 | 9 |
| Carbocisteína 10% O/W | |||||||
| Paciente 3 | M | 6 | Ictiosis lamelar | N-acetilcisteína 10% O/W | 27 | 12 | 2 |
| Carbocisteína 10% O/W | |||||||
| Paciente 4 | M | 13 | Ictiosis recesiva ligada a X | Carbocisteína 10% O/W | 3 | 28 | 0 |
| Paciente 5 | M | 53 | Ictiosis vulgar | N-acetilcisteína 10% O/W | 19 | 21 | 10 |
| Carbocisteína 10% O/W | |||||||
| Paciente 6 | F | 22 | EA distrófica pruriginosa | Alantoína 6% O/W | 2 | 4 | 4 |
| Paciente 7 | M | 21 | EA juntural tipo no Herlitz | Alantoína 6% O/W | 15 | 1 | 1 |
| Paciente 8 | F | 38 | ET | Rapamicina 0,4% O/W | 73 | 17 | 0 |
| Paciente 9 | M | 7 | ET | Rapamicina 0,4% O/W | 41 | 5 | 5 |
EA: epidermólisis ampollosa; ET: esclerosis tuberosa; F: femenino; M: masculino; O/W: aceite en agua; Tx: tratamiento.
Las fórmulas magistrales administradas fueron las previamente descritas en la introducción (tabla 2). La duración del tratamiento varió de 2 a 73 meses (media de 29 meses; mediana de 27 meses).
Fórmulas magistrales elaboradas
| N-acetilcisteína 10%+Urea 5% O/W | |
| Ingredientes | Cantidad |
| N-acetilcisteína | 10,00g |
| Urea | 5,00g |
| Glicerina | 5,00g |
| Hidróxido de sodio | 2,00g |
| Agua estéril | 51,50ml |
| Neo PCL O/Wa | 25,00g |
| Esencia de romero | 1,50ml |
| Carbocisteína 10%+Urea 5% O/W | |
| Ingredientes | Cantidad |
| Urea | 5,00g |
| Agua estéril | 44,00ml |
| Neo PCL O/Wa | 25,00g |
| Carbocisteína | 10,00mg |
| Glicerina | 15,00g |
| Hidróxido de sodio | 1,00g |
| Alantoína 6% O/W | |
| Ingredientes | Cantidad |
| Alantoína | 6,00g |
| Glicerina | 5,00g |
| Neo PCL O/Wa | 25,00g |
| Agua estéril | 64,00ml |
| Rapamicina 0,4% O/W | |
| Ingredientes | Cantidad |
| Rapamicina | 400,00mg |
| Glicerina | 0,50g |
| Crema O/W | 100,00g |
O/W: aceite en agua.
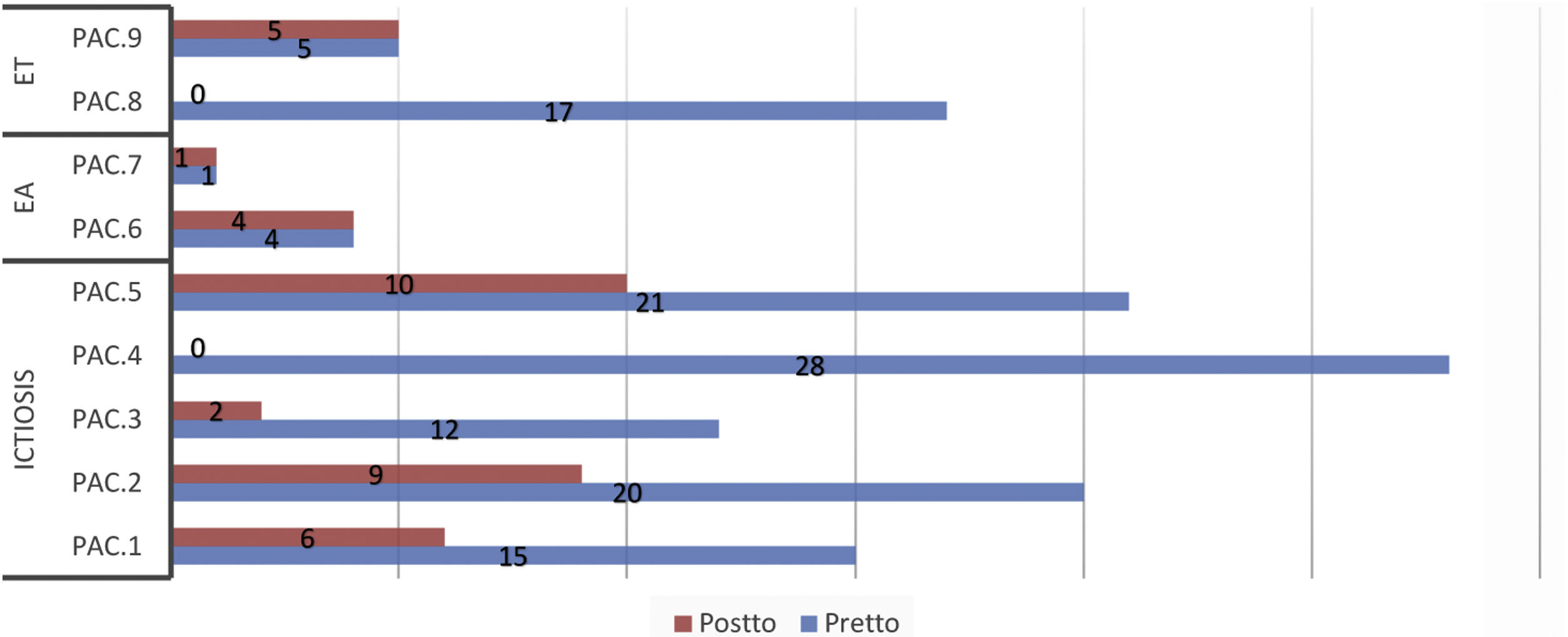
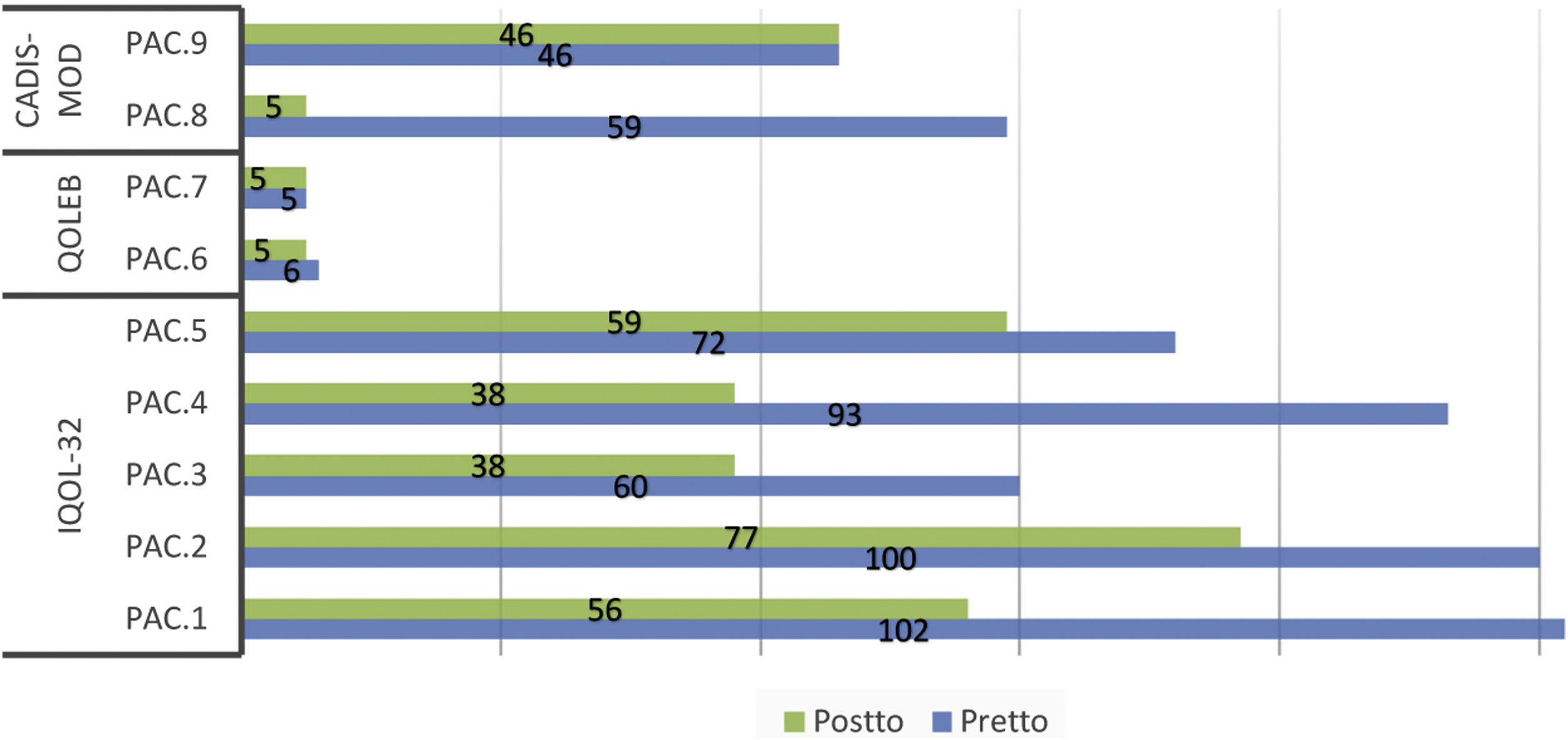
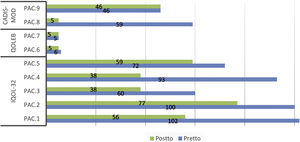
Se observó una reducción en las puntuaciones medias de los cuestionarios de calidad de vida, tanto generales como específicos, tras la administración de las fórmulas magistrales (tabla 3). Esta reducción fue estadísticamente significativa para el DLQI/CDLQI y para el IQoL-32. En el 55% de los pacientes, el impacto en la calidad de vida disminuyó al menos 2 niveles de DLQI/CDLQI tras la administración del tratamiento tópico correspondiente. En todos los pacientes afectos de ictiosis se evidenció una disminución en las puntaciones de los cuestionarios de calidad de vida, tanto genéricos como específicos. Sin embargo, no existieron cambios en el cuestionario genérico en los pacientes con EA y solo uno de los pacientes mejoró un punto en el cuestionario específico. En cuanto a la ET, solo uno de los 2 pacientes mejoró el resultado de los cuestionarios genérico y específico tras el tratamiento. La puntuación individualizada en cada uno de los cuestionarios se muestra en las figuras 1 y 2.
Media y desviación típica de los cuestionarios de calidad de vida
| Pretratamiento | Postratamiento | Valor p | |
|---|---|---|---|
| DLQI/CDLQI | 13,7±9,0 | 4,1±3,7 | 0,007 |
| IQoL-32 | 85,4±18,5 | 53,6±16,3 | 0,008 |
| QOLEB | 5,5±0,7 | 5,0±0 | 0,25 |
| CADIS-mod | 52,5±9,2 | 25,5±29,0 | 0,25 |
CADIS-mod: modified Childhood Atopic Dermatitis Impact Scale Caregiver Quality of Life; CDLQI: Children's Dermatology Life Quality Index; DLQI: Dermatology Life Quality Index; IQoL-32: Ichthyosis Quality of Life–32 items; QOLEB: Quality of Life in Epidermolysis Bullosa.
Puntuaciones del cuestionario genérico de calidad de vida (DLQI/CDLQI) antes y después del tratamiento.
CDLQI: Children's Dermatology Life Quality Index; DLQI: Dermatology Life Quality Index; (DLQI/CDLQI puntuación: 0 a 30; grados: no efecto, efecto pequeño, efecto moderado, efecto grande, efecto extremadamente grande).
EA: epidermólisis ampollosa; ET: esclerosis tuberosa; Pac: Paciente; pretto: pretratamiento; postto: postratamiento.
Puntuaciones de los cuestionarios específicos de calidad de vida antes y después del tratamiento*.
CADIS-mod: modified Childhood Atopic Dermatitis Impact Scale Caregiver Quality of Life (puntuación: 0 a 100, 100 peor efecto; versión para adultos: 0 a 84, 84 peor efecto); IQoL-32: Ichthyosis Quality of Life–32 items (puntuación: 0 a 128, 128 peor efecto); QOLEB: Quality of Life in Epidermolysis Bullosa (puntuación: 0 a 51, 51 peor efecto).
Pac: Paciente; pretto: pretratamiento; postto: postratamiento.
*Se utilizó una traducción no validada del cuestionario validado QOLEB.
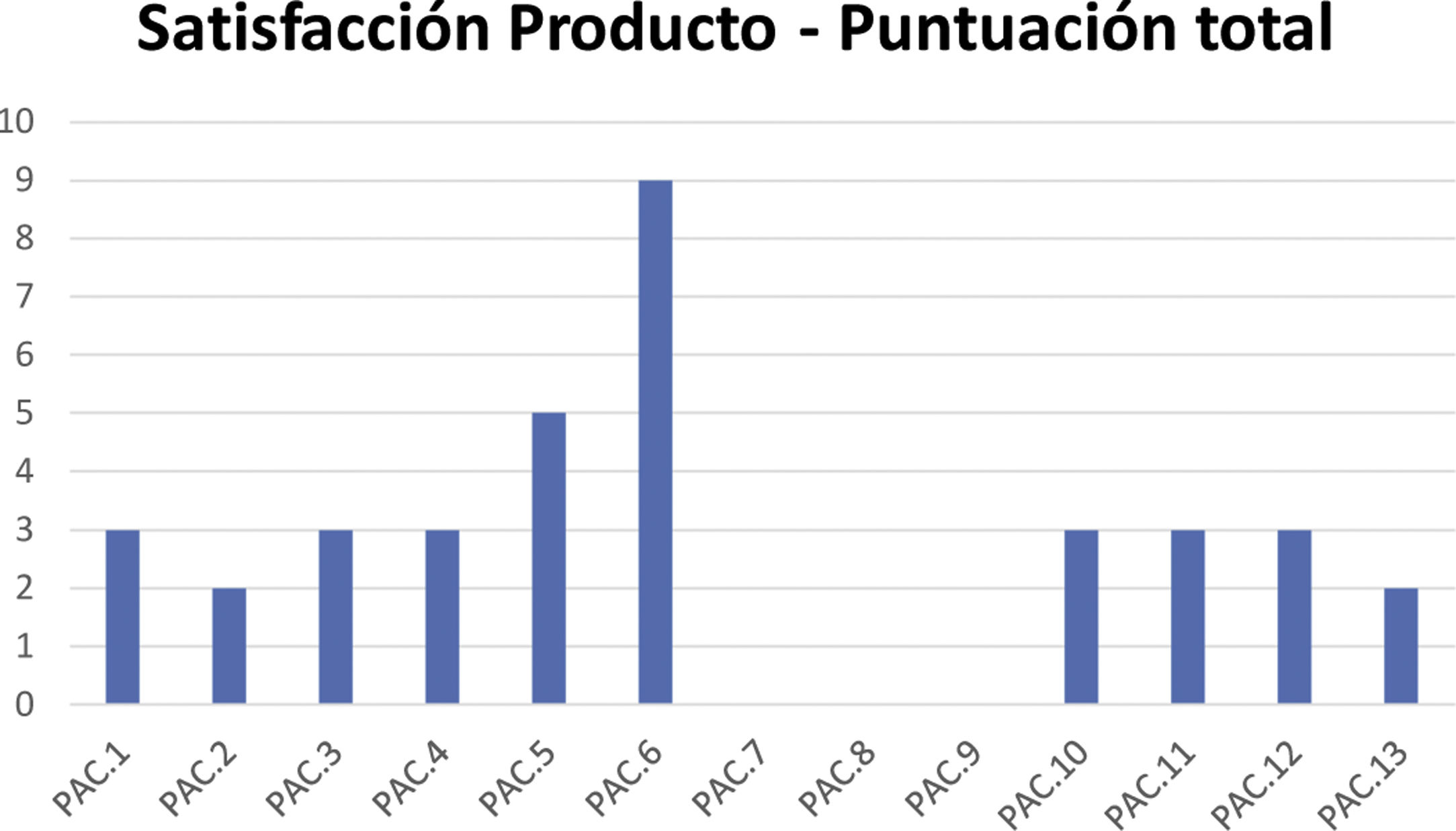
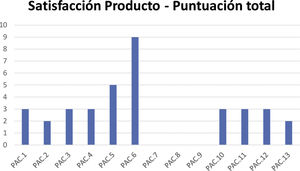
La puntuación media del cuestionario sobre la satisfacción con las características organolépticas de los productos fue 2,8, con una mediana de 3 (fig. 3).
La correlación entre las visitas planificadas para la recogida del tratamiento y las visitas reales fue mayor del 89% en todos los casos.
DiscusiónEste trabajo objetivó una mejoría en la calidad de vida de la mayoría de los pacientes con genodermatosis tratados con fórmulas magistrales.
Los pacientes con ictiosis que se reportan experimentaron una mejoría significativa en su calidad de vida, objetivada en los cuestionarios tanto genéricos como específicos. La N-acetilcisteína y la urea son efectivas para el tratamiento de la ictiosis congénita6–9. Sin embargo, la principal desventaja de la N-acetilcisteína es su mal olor, dificultando la adherencia al tratamiento6–9. La carbocisteína es una molécula semejante que evita este problema y muestra una eficacia similar9,10. Hasta la fecha, no se han realizado estudios que analicen el impacto de estas terapias en la calidad de vida. Dreyfus et al.23 y Mazereeuw-Hautier et al.24 investigaron los factores que influyen sobre la calidad de vida de los pacientes con ictiosis. En sus trabajos concluyen que existe una población más vulnerable sobre la que el impacto de la enfermedad es mayor. Esta población estaría compuesta, fundamentalmente, por pacientes de sexo femenino con presencia de síntomas como el dolor o la afectación de la movilidad, signos como la descamación grave, deterioro de las relaciones interpersonales y repercusión en la vida diaria debido al coste económico de la enfermedad. Los autores sugieren que estos pacientes deben ser la diana principal sobre la que centrar la mejora en el manejo terapéutico23. Como muestra este estudio que se presenta, un tratamiento personalizado y sin coste directo para el paciente podría ser muy beneficioso.
En el caso de la EA, existen numerosos artículos que analizan su impacto en la calidad de vida, y se han desarrollado múltiples escalas para medir este efecto20,25–29. La alantoína ha sido designada por la Comisión Europea y por la FDA como medicamento huérfano para el tratamiento de la EA13. A pesar de que los ensayos clínicos sobre su eficacia y seguridad se han publicado recientemente11,12, no hemos encontrado datos sobre su impacto en la calidad de vida de los pacientes. En este trabajo, solo uno de los 2 pacientes con EA experimentó una ligera mejoría en su calidad de vida tras la administración de alantoína. En el paciente 6, la crema de alantoína al 6% mejoró la cicatrización de las lesiones, pero su efectividad no se correlacionó con un descenso en las puntuaciones del DLQI, mejorando únicamente un punto en el QOLEB. El paciente 7 presentaba una EA distrófica pruriginosa, un tipo de EA que no suele presentar erosiones, lo que puede explicar la ausencia de respuesta terapéutica.
Con respecto al uso de rapamicina tópica en ET, gran parte de la literatura postula que es un tratamiento eficaz y seguro para el tratamiento y prevención de los angiofibromas faciales9,14–18. El beneficio es mayor si se aplica en edades tempranas14. Suele ser un tratamiento bien tolerado, pero a menudo provoca irritación local, sobre todo aplicado en forma de solución. Crall et al. reflejan que la presencia de angiofibromas faciales, así como las escasas opciones de tratamiento médico, afectan significativamente a la calidad de vida de los pacientes con ET y a sus cuidadores22. También refieren que, aunque la rapamicina tópica es efectiva, existen dificultades para el acceso al medicamento22. En este estudio, la aplicación del fármaco en el paciente adulto obtuvo una excelente respuesta y una gran mejoría en la calidad de vida (paciente 8). Por el contrario, no se objetivaron cambios en el CDLQI ni en el CADIS-mod en el paciente pediátrico (paciente 9). Esto podría haberse debido al menor número de lesiones y a su carácter más incipiente en el niño.
Respecto a la satisfacción de los pacientes con las características organolépticas de los productos, en todos los casos la puntuación fue menor de 10, y solo en 2 pacientes fue mayor de 3 (puntuación de 0 a 25, peor valor: 25). Esto refleja una satisfacción general con las fórmulas magistrales, mostrando los beneficios de una elaboración y dispensación individualizadas. La dispensación de los medicamentos por el Servicio de Farmacia de nuestro hospital, las consultas periódicas en el Servicio de Dermatología, y la comunicación continua entre estos dos servicios, contribuyeron a una mejor relación con los pacientes y a un mayor conocimiento de su satisfacción con las características organolépticas de los productos. Esta retroalimentación permitió una mejora continua y una adaptación de las fórmulas magistrales a las necesidades específicas de cada paciente, provocando su empoderamiento y haciéndolos partícipes de la elaboración del producto final. Esto se ha reflejado también en una mayor adherencia a los tratamientos por parte de los pacientes evaluados.
Se precisan estudios prospectivos y con un mayor número de pacientes que permitan confirmar los efectos de estas terapias en la calidad de vida de los pacientes con genodermatosis.
LimitacionesUna de las principales limitaciones de este estudio es el bajo número de pacientes incluidos, y con genodermatosis muy diversas. Asimismo, existe la posibilidad de un sesgo de memoria, ya que una copia de cada uno de los cuestionarios sobre calidad de vida se respondió de forma retrospectiva. Debe puntualizarse que se utilizó un cuestionario no validado para evaluar la satisfacción con las características de los productos.
ConclusionesLa formulación magistral permite el acceso a medicamentos huérfanos y no comercializados que son efectivos. En la población estudiada, las fórmulas magistrales mejoraron significativamente la calidad de vida de los pacientes con ictiosis. La elaboración individualizada y la dispensación directa en los hospitales tienen un impacto positivo en la adherencia terapéutica y en el empoderamiento de los pacientes en el control de su enfermedad. Sería muy interesante poder extender la formulación magistral hospitalaria a otras patologías para aumentar el número de pacientes beneficiados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores queremos agradecer a Jennifer Huang, Sarah L. Chamlin, John Frew, Isabelle Dreyfus y Dedee F. Murrel por su permiso para utilizar los cuestionarios de impacto en calidad de vida, además de por el uso del cuestionario DLQI/CDLQI.