La dermatitis atópica (DA) moderada-grave tiene un impacto significativo en la vida de los pacientes, muchos de los cuales requieren tratamiento sistémico para controlar los síntomas (p. ej., prurito). Algunos tratamientos son usados fuera de indicación. Este estudio describió características sociodemográficas y clínicas, patrones de tratamiento, uso de recursos sanitarios (URS) y costes asociados en adultos con DA que iniciaron tratamiento sistémico o fototerapia en la práctica habitual.
MétodosEste estudio observacional retrospectivo de historias clínicas electrónicas en la base de datos BIG-PAC identificó adultos con diagnóstico previo de DA (CIE-9: 691.8 o 692.9) que comenzaron con corticosteroides orales, inmunosupresores, biológicos o fototerapia entre el 01/01/2012 y el 31/12/2016. Se siguió a los pacientes durante tres años desde el inicio del tratamiento, hasta el 31/12/2019. Los datos sobre las características clínicas de los pacientes, patrones de tratamiento, URS y costes se analizaron de forma descriptiva.
ResultadosLos pacientes (n = 1995) tenían una edad media de 60 años, 64% eran mujeres, con una media de 23 años desde el diagnóstico (84% tenían≥18 años al inicio de la DA). Las principales comorbilidades fueron ansiedad (38%), hipertensión arterial (36%) y dislipidemia (35%). La mayoría de los pacientes utilizaron corticosteroides orales como primer tratamiento sistémico (84%; duración media 29 días) e inmunosupresores en 13% de los pacientes (duración media 117 días, ciclosporina en 5% y metotrexato en 4%). La mitad de los pacientes requirieron una segunda línea de tratamiento sistémico y 12% una tercera. El uso de inmunosupresores y biológicos aumentó simultáneamente con las líneas de tratamiento. Aproximadamente 13% de los pacientes recibieron tratamientos sistémicos de forma continua durante los tres años de seguimiento. El coste medio por paciente a tres años fue de 3.835 euros, con un coste medio anual de 1.278 euros.
ConclusionesLos resultados sugieren una alta carga económica y de comorbilidad en esta población del mundo real de adultos con DA, y la necesidad de nuevos tratamientos sistémicos indicados para DA.
Moderate–severe atopic dermatitis (AD) has a significant impact on patients’ lives, with many requiring systemic treatment to manage symptoms (e.g., pruritus). Several drugs are used off-label to treat AD. This study describes sociodemographic/clinical characteristics, treatment patterns, health resource use (HRU) and costs in adults with AD who initiated systemic treatment or phototherapy in routine practice.
MethodsThis retrospective observational study of electronic medical records in the BIG-PAC database identified adults with prior diagnosis of AD (ICD-9: 691.8 or 692.9) starting oral corticosteroids, immunosuppressants, biologics or phototherapy between 01/01/2012 and 31/12/2016. Patients were followed for 3 years from treatment initiation, up to 31/12/2019. Data on patient characteristics, treatment patterns, HRU and costs were analyzed descriptively.
ResultsPatients (N = 1995) had a mean age of 60 years, 64% were female, with a mean time of 23 years since diagnosis (84% were ≥18 years at AD onset). Main comorbidities were anxiety (38%), arterial hypertension (36%) and dyslipidemia (35%). Most patients used oral corticosteroids as first systemic (84%; median duration 29 days) and immunosuppressants in 13% of patients (median duration 117 days, 5% cyclosporine and 4% methotrexate). Half of patients required a second line systemic and 12% a third line. The use of immunosuppressants and biologics increased with treatment lines. About 13% of patients received systemic treatments continuously over the 3-year follow-up. The average 3-year per patient cost was 3835 euros, with an average annual cost of 1278 euros.
ConclusionsResults suggest a high comorbidity and economic burden in this real-world adult population with AD, and the need for systemic treatments indicated for use in AD.
La dermatitis atópica (DA) es una enfermedad cutánea inflamatoria recidivante crónica1 que se caracteriza por prurito intenso y lesiones eccematosas inflamatorias2. La DA afecta normalmente a 10–20% de los niños, mientras que la prevalencia en adultos se sitúa alrededor de 1 a 10%3–5. Un estudio reciente reveló una prevalencia de la DA del 7,2% en la población adulta en España5. Las formas moderadas-graves pueden representar entre 41 y 69% de los pacientes con DA en España, sobre la base de diferentes criterios de gravedad5,6.
La DA moderada-grave tiene un impacto económico importante, que afecta a la calidad de vida y a la esfera psicosocial de los pacientes y sus familiares, principalmente a causa del prurito, que puede desencadenar cuestiones relacionadas con el sueño y trastornos psiquiátricos (p. ej., ansiedad, depresión)4–7. En los pacientes adultos, la DA puede afectar también a la productividad laboral1,6.
El objetivo del tratamiento es reducir los síntomas y el número de recidivas, y controlar al mismo tiempo la enfermedad a largo plazo8–10. En el momento de realizar el estudio, los tratamientos recomendados en las guías para las formas moderadas-graves incluían corticosteroides tópicos e inhibidores de la calcineurina, fototerapia, corticosteroides orales a corto plazo, inmunosupresores convencionales (ciclosporina, micofenolato de mofetilo, azatioprina y metotrexato, no estando indicados los tres últimos para DA), y el anticuerpo monoclonal dupilumab1,11,12.
Aunque diversos estudios recientes han descrito la carga de la enfermedad en España13,14, existe evidencia limitada sobre el uso de los tratamientos a lo largo del tiempo y el impacto económico de la enfermedad en condiciones de práctica clínica habitual.
Este estudio describió las características sociodemográficas y clínicas, los patrones terapéuticos, el URS y los costes en adultos con DA que iniciaron tratamiento con fármacos sistémicos o fototerapia en el ámbito del mundo real en España.
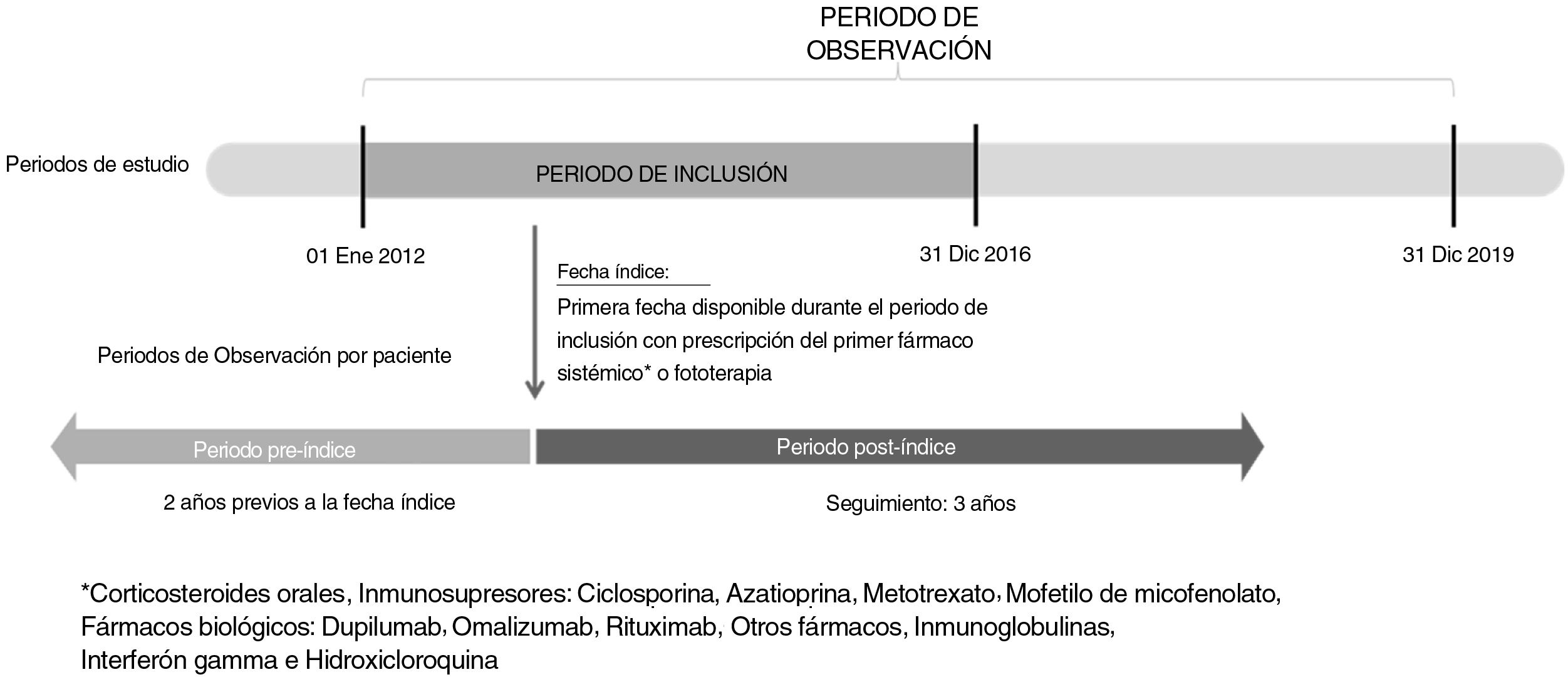
Pacientes y métodosDiseño del estudioEstudio longitudinal, retrospectivo y no intervencionista basado en las historias clínicas electrónicas incluidas en la base de datos Big-Pac en España, que fue realizado para describir las características sociodemográficas/clínicas, patrones de tratamiento, URS y costes asociados. Se incluyó en el mismo a los pacientes adultos con DA que habían iniciado recientemente un tratamiento con fármacos sistémicos (inmunosupresores orales, corticosteroides sistémicos, o fármacos biológicos) o fototerapia entre el 01/01/2012 y el 31/12/2016 (es decir, periodo de inclusión; fig. 1). Se realizó seguimiento a los pacientes durante tres años, desde la fecha de inicio del primer tratamiento sistémico o fototerapia (es decir, fecha índice), hasta el 31/12/2019. Se utilizó un periodo pre-índice de dos años para verificar que no se habían documentado previamente registros de fármacos sistémicos o fototerapia.
Se respetó la confidencialidad de los datos (anónimos y disociados) en cumplimiento de la Ley Orgánica 3/2018, de 5 de diciembre sobre Protección de datos personales y garantía de derechos (https://www.boe.es/eli/es/lo/2018/12/05/3). El estudio fue aprobado por el Comité de Ética del Consorci Sanitari de Terrassa (Barcelona, España), y fue realizado conforme a los principios éticos de la Declaración de Helsinki y la legislación aplicable en España.
Fuente de los datosLos datos se obtuvieron de la base de datos Big-Pac (Atrys Health-Real Life Data, Madrid, España), que recopila historias clínicas electrónicas anonimizadas de atención primaria y secundaria, registros de dispensación de fármacos y otras bases de datos complementarias de siete regiones españolas. La población asignada a los centros de salud de los que se extrajeron los datos incluía a 1.867.108 habitantes en el momento de la extracción, pudiendo considerarse representativos de la población española15. La base de datos está registrada en European Network of Centers for Pharmacoepidemiology and Pharmacovigilance (ENCePP®) (http://www.encepp.eu/encepp/viewResource.htm?id=29236#)
Población de estudioSe incluyó a los pacientes que cumplieron los criterios de inclusión siguientes en la fecha índice: a) con registro de diagnóstico de DA previo a la fecha índice, de acuerdo con los códigos International Classification of Diseases, Ninth Revision, Clinical Modification (ICD-9-CM) (691.8 – otras DA y estados relacionados, o 692.9 – dermatitis de contacto y otros eccemas, causa inespecífica, incluyendo «alérgico» o «atópico» en el campo de diagnóstico «descripción» de la base de datos), b) iniciaron tratamiento con fototerapia o fármacos sistémicos entre el 01/01/2012 y el 31/12/2016, c) edad de al menos 18 años, d) paciente incluido en el programa de prescripciones para la obtención de las recetas médicas (con registro constatado de la dosis diaria, el intervalo de tiempo y la duración de cada tratamiento administrado; dos o más recetas durante el periodo de seguimiento); e) con dos o más registros sanitarios, f) continuamente registrados en la base de datos durante al menos tres años desde la fecha índice. Se excluyó a los pacientes cuando: a) habían sido derivados a otros centros, estaban desplazados o fuera del área, b) estaban permanentemente institucionalizados, c) tenían una enfermedad terminal o d) tenían antecedentes de fototerapia o medicación sistémica en el periodo de dos años previo a la fecha índice.
Solo se incluyó en el análisis a los pacientes con código ICD-9-CM relacionado con DA documentado durante al menos una prescripción de tratamiento sistémico durante el periodo de inclusión.
Criterios de valoración y variables del estudioSe obtuvieron los datos sociodemográficos y clínicos en la fecha índice, o previamente a la misma, incluyendo edad, sexo, IMC, tiempo desde el diagnóstico de DA, edad al iniciarse la DA. Se describieron las comorbilidades clínicamente relevantes más frecuentes (frecuencia≥5%) sobre la base de los códigos ICD-9-CM (Material Suplementario Tabla 1). Se calcularon el número medio (DE) de comorbilidades por paciente. Se extrajeron los tratamientos tópicos para DA en los seis meses previos a la fecha índice, así como los tratamientos concomitantes seleccionados (Material Suplementario Tabla 2; códigos ATC16).
Se obtuvieron los tratamientos sistémicos y la fototerapia en la fecha índice y a lo largo del periodo de seguimiento. Se construyeron líneas de tratamiento (Línea 1, Línea 2, Línea 3 o Línea > 3). Se registraron el(los) primer(os) tratamiento(s) o fototerapia(s) iniciado(s) dentro del periodo de inclusión (tratamiento índice o terapia de primera línea) prescritos en monoterapia o combinación (cuando se prescribía más de un fármaco el mismo día). Para las líneas de tratamiento subsiguientes se definió la combinación como el uso concomitante de dos o más fármacos sistémicos o fototerapia. Los cambios del tratamiento índice o las líneas de tratamiento subsiguientes incluyen: a) discontinuación: fin del tratamiento sistémico o fototerapia con la existencia de un intervalo entre dispensaciones sucesivas≥60 días de duración, b) cambio: fin del tratamiento sistémico o fototerapia con inicio de un nuevo tratamiento sistémico dentro del periodo de 60 días siguiente al fin del tratamiento previo o c) adición: inicio de un nuevo tratamiento sistémico o fototerapia mientras se sigue prescribiendo el tratamiento previo. La duración del tratamiento para un fármaco específico se determinó como el tiempo (días) desde el inicio de dicho fármaco a la fecha de discontinuación o cambio. El tratamiento sistémico continuo durante el seguimiento de tres años se definió como la falta de discontinuación del tratamiento sistémico (excluyendo corticosteroides orales) dentro de dicho periodo de tiempo17.
El URS se describió sobre la base de los recursos registrados durante el periodo de seguimiento de tres años, utilizándose para calcular los costes sanitarios asociados (consultas médicas, días de hospitalización, visitas a urgencias, solicitudes de diagnóstico o terapia, prescripción de fármacos) y los costes no sanitarios (es decir, días de baja). Solo se consideró para el análisis el URS asociado a los códigos ICD-9-CM dermatológicos, exceptuando los días de baja, ya que no tienen código ICD-9-CM vinculado. Los costes se expresaron como coste medio por paciente (media/unidad) por año, así como el coste total en el periodo de seguimiento de tres años. Los costes unitarios se detallan en el Material Suplementario Tabla 3 (año 2019). Las tarifas se obtuvieron de la contabilidad analítica, exceptuando lo referente a medicación y días de baja. Las prescripciones médicas se cuantificaron conforme al precio de venta al público por envase en el momento de la prescripción18. Los días de baja se consideraron en virtud del salario medio interprofesional19. Este estudio no consideró los costes directos no sanitarios pagados por el paciente/familiar, ya que no están registrados en la base de datos.
Análisis estadísticosLos datos fueron analizados descriptivamente. Para las variables categóricas se aportaron las frecuencias absolutas y relativas. Las variables continuas fueron reportadas utilizando medias, desviación estándar (DE), mediana, y percentiles 25° y 75° de la distribución (rango intercuartílico). Los resultados se presentaron de manera global y por tratamiento índice. Cuando faltaron datos, se aportó el número de valores ausentes. Se utilizó el programa SPSSWIN, versión 23 para el análisis.
ResultadosDe los 1.867.108 pacientes incluidos en la base de datos Big-Pac, se incluyeron 1.995 en el análisis (Supl. fig. 1).
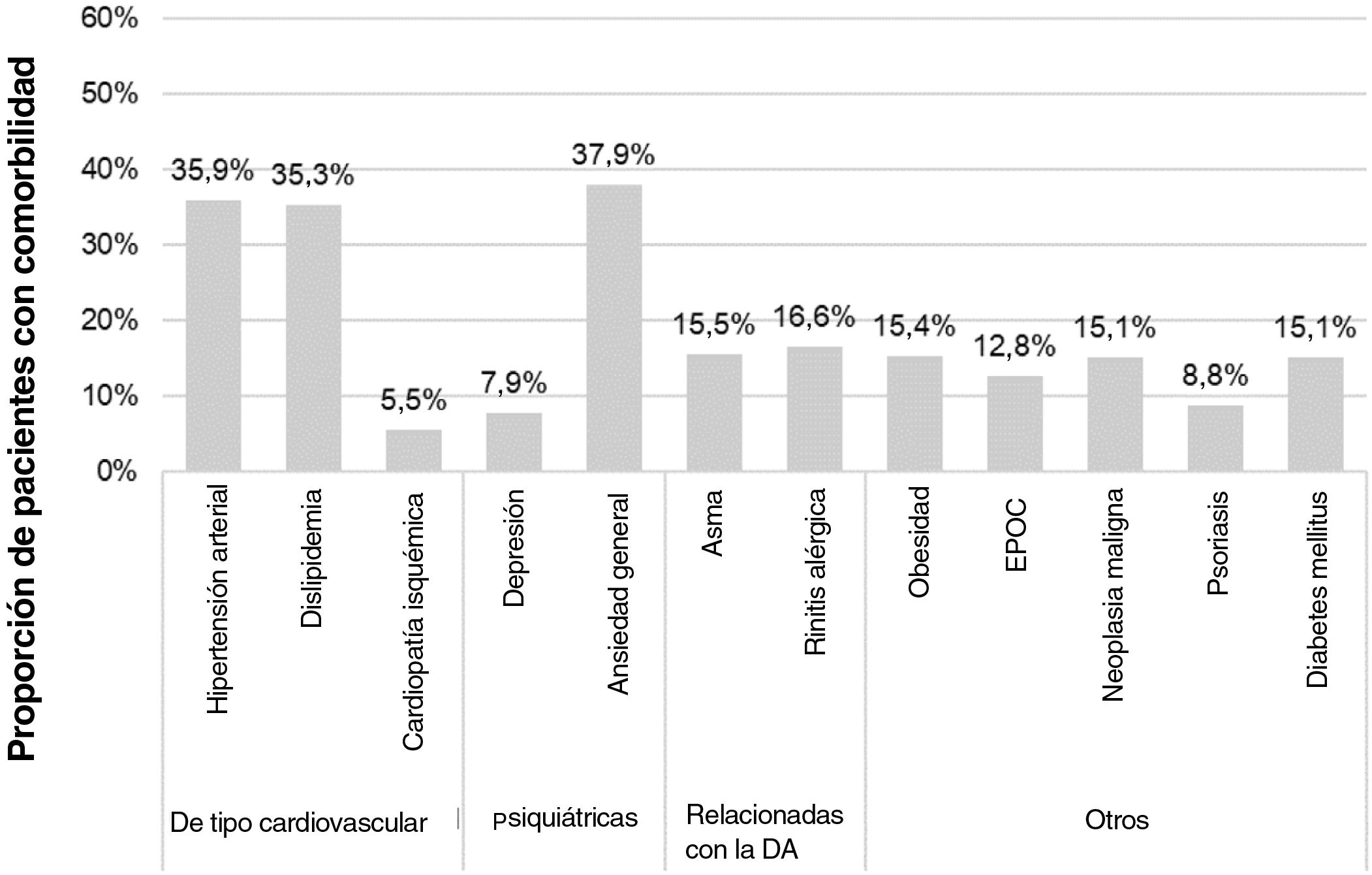
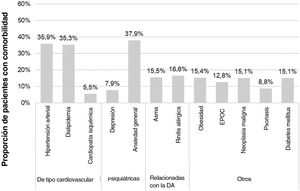
Características sociodemográficas y clínicasLa edad media (DE) en la fecha de índice fue de 59,8 (17,3) años, siendo mujeres 64,4% de los pacientes (n = 1.285). Entre los pacientes de los que se disponía de datos (n = 1.189), el IMC medio (DE) fue de 29,5 (6) kg/m2. El tiempo medio (DE) desde el diagnóstico de DA fue de 23,2 (13,4) años, correspondiendo 84% al inicio de la DA en adultos. Las principales comorbilidades fueron ansiedad general (37,9%), hipertensión arterial (35,9%) y dislipidemia (35,3%) (fig. 2). Los antibióticos, antihistamínicos y antidepresivos estuvieron presentes en 46,8%, 29,9% y 26,7% de los pacientes en la fecha índice, respectivamente (tabla 1).
Características sociodemográficas y clínicas
| Características | N=1.995 |
|---|---|
| Edad (media, DE), años | 59,8 (17,3) |
| Grupos deedad, n (%) | |
| 18–44 años | 422 (21,2) |
| 45–64 años | 680 (34,1) |
| ≥65 años | 893 (44,8) |
| Sexo, % mujeres | 1.285 (64,4) |
| Tiempo desde el diagnóstico de la DA (media DE), años | 23,2 (13,4) |
| Edad de inicio de la DA, n (%) | 8,8 (1,3) |
| <14 años | 142 (7,1) |
| 14–17 años | 177 (8,9) |
| 18–60 años | 1.445 (72,4) |
| >60 años | 231 (11,6) |
| IMC (media, DE), kg/m2 | 29,5 (6)a |
| Número de comorbilidades crónicas por paciente, media (DE) | 2,5 (1,4) |
| Tratamientos previos y concomitantes | |
| Tratamientosno sistémicos en los seis meses previos a la fecha índice,n (%) | |
| Corticosteroides tópicos | 629 (31,5%) |
| Inmunomoduladores tópicos | 38 (1,9%) |
| Tratamientos concomitantes en la fecha índice, n (%) | |
| Antihistamínicos | 596 (29,9%) |
| Antibióticos | 933 (46,8%) |
| Antidepresivos | 528 (26,7%) |
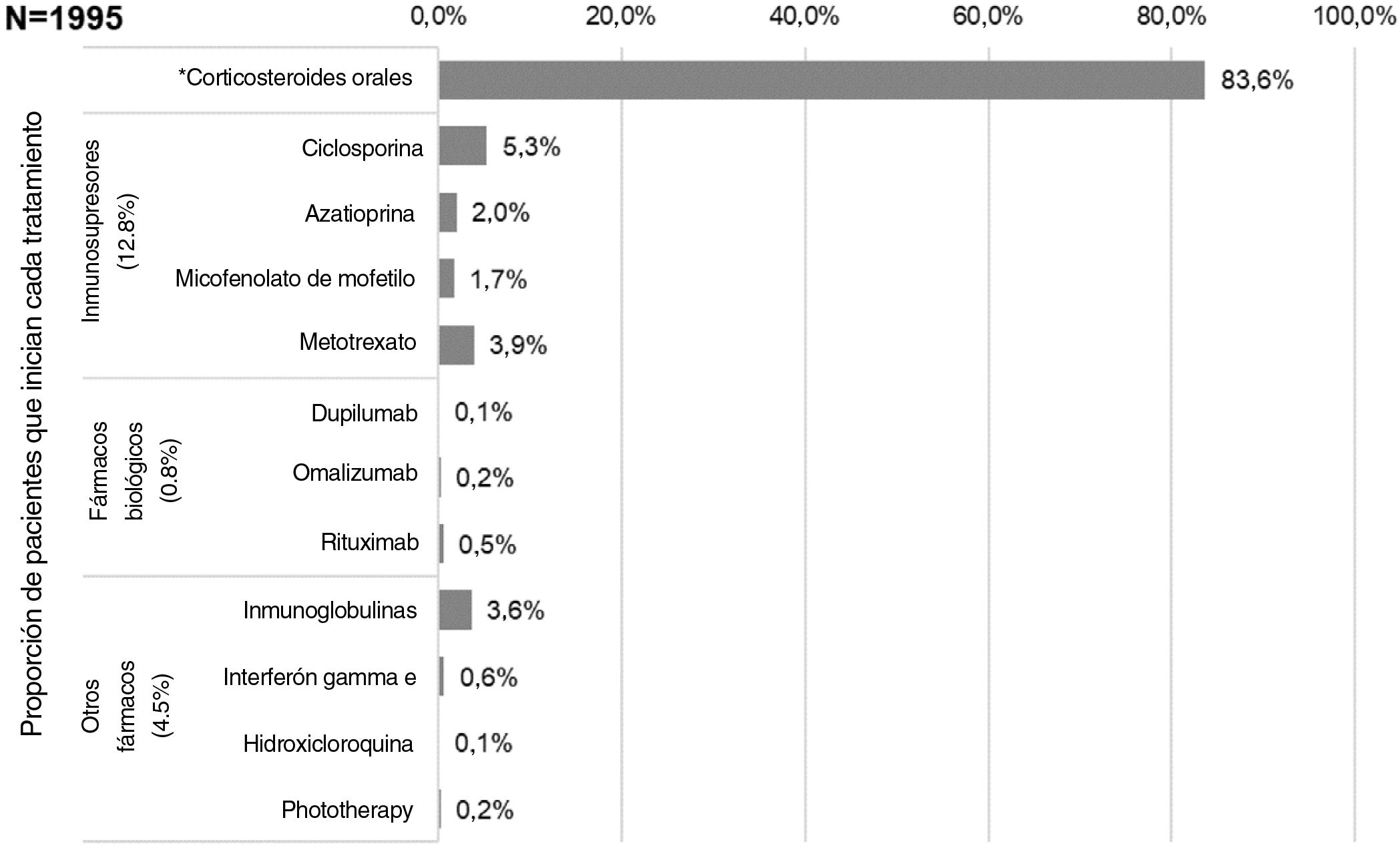
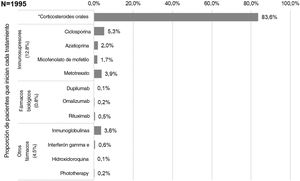
Los primeros tratamientos sistémicos o fototerapia que iniciaron los pacientes en la fecha índice (es decir, Línea 1) fueron (fig. 3): corticosteroides orales (83,6%; n = 1.668), inmunosupresores (12,8%; n = 256 principalmente ciclosporina [5,3%] y metotrexato [3,9%]), fármacos biológicos (0,8%; n = 15), otros fármacos sistémicos (4,3%; n = 86) y fototerapia (0,2%; n = 3). La mayoría de los pacientes recibieron estos primeros tratamientos sistémicos como monoterapia (98,4 vs. 1,7% en combinación, siendo los corticosteroides orales la principal terapia en combinación). La mediana de la duración (RIC) de las terapias de primera línea se presenta en la tabla 2.
Duración de los tratamientos índice sistémicos de índice
| Variable | N=1.995 | |
|---|---|---|
| Duración por tipo de tratamiento, | n | Mediana (RIC), días |
| Corticosteroides orales | 1.668 | 29 (8,8–53) |
| Inmunosupresores | 256 | 116,5 (49–286) |
| Ciclosporina | 106 | 86 (33–236) |
| Azatioprina | 39 | 91 (43–330,5) |
| Micofenolato de mofetilo | 33 | 242 (50–784) |
| Metotrexato | 78 | 133 (83–387) |
| Fármacos biológicos | 15 | 331 (277,5–430) |
| Dupilumab | 2 | 327,5 (310,8–344,3) |
| Omalizumab | 4 | 368 (299,5–495,5) |
| Rituximab | 9 | 331 (201–431) |
| Otros fármacos sistémicos | 86 | 30 (30–30) |
| Inmunoglobulinas | 72 | 30 (30–30) |
| Interferón gamma | 12 | 165,5 (30–310,5) |
| Hidroxicloroquina | 2 | 100 (87–113) |
Nota: La fototerapia no se presenta en esta tabla, ya que se basa en sesiones y no en tratamiento continuo.
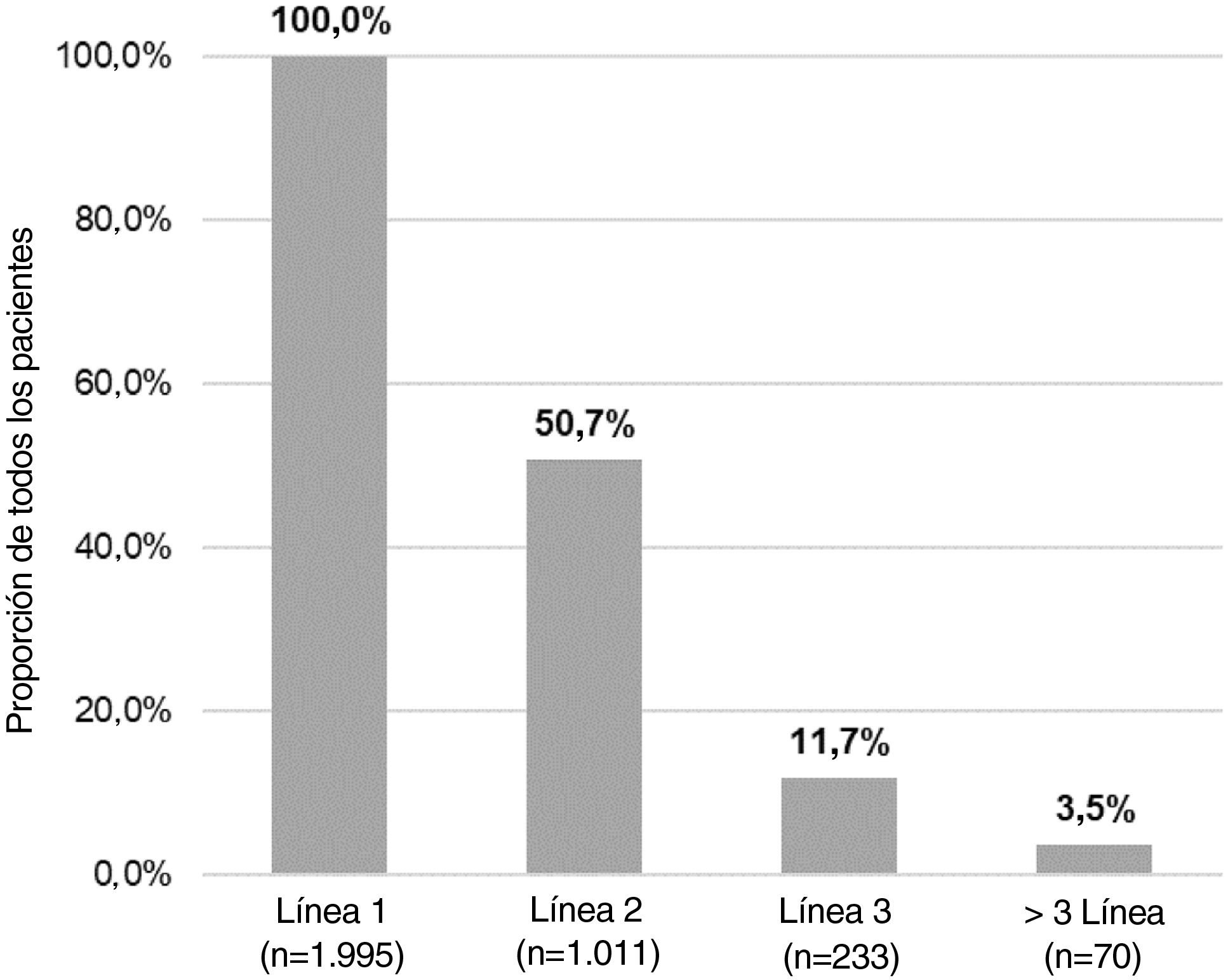
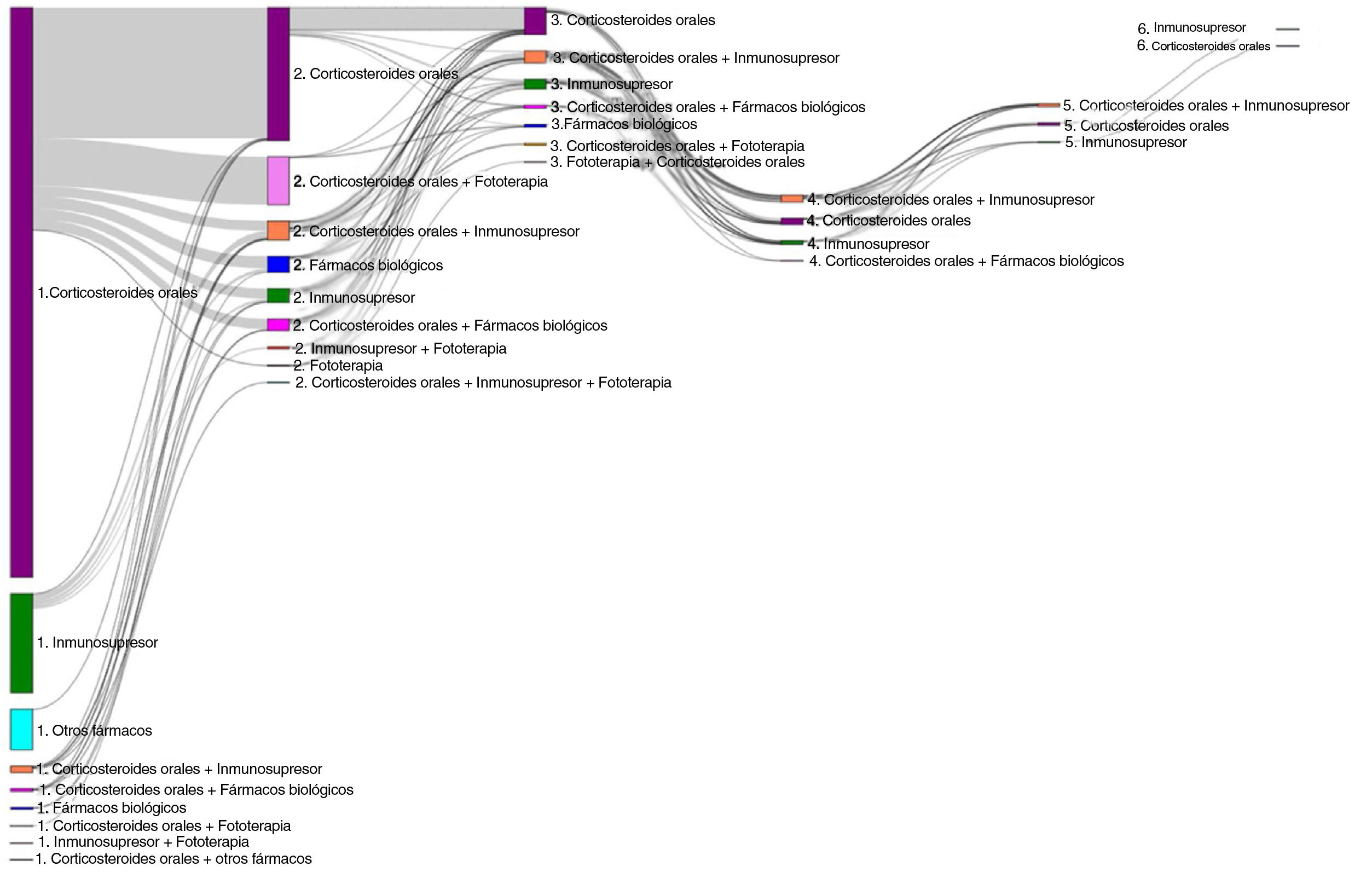
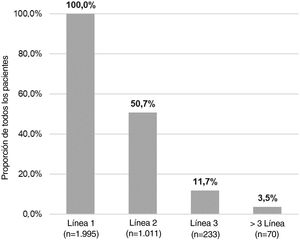
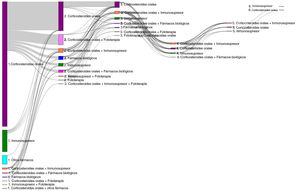
Del número total de pacientes incluidos en el estudio (n = 1.995), 50,7% (n = 1.011), 11,7% (n = 233) y 3,5% (n = 70) requirieron una segunda, tercera o cuarta línea de tratamiento sistémico, respectivamente (fig. 4). El número medio (DE) de líneas de tratamiento sistémico o fototerapia fue de 1,7 (0,8). Como se muestra en la tabla 3, el uso de corticosteroides orales fue alto en todas las líneas de tratamiento (83,6% en la Línea 1, 86,8% en la Línea 2, 74,7% en la Línea 3 y 84,3% en las Líneas > 3), mientras que los inmunosupresores fueron más frecuentemente utilizados en líneas posteriores (12,8% en la Línea 1, 14,5% en la Línea 2, 38,6% en la Línea 3, y 30% en la Líneas > 3). Los fármacos biológicos fueron más frecuentemente utilizados en la Líneas 2 (11,4%) y 3 (13,3%). El porcentaje de pacientes que recibieron fototerapia fue de 11,2%. Durante el periodo de seguimiento de tres años, 12,6% (n = 252) de los pacientes recibió tratamiento sistémico de manera continua (tabla 4). Las trayectorias terapéuticas fueron heterogéneas (fig. 5).
Distribución de los tratamientos sistémicos/fototerapia por línea terapéutica
| Tratamiento | Línea 1N=1.995 | Línea 2N=1.011 | Línea 3N=233 | Línea>3N=70 | 3 añosN=1.995 |
|---|---|---|---|---|---|
| n (%) | n (%) | n (%) | n (%) | n (%) | |
| Corticosteroides orales | 1.668 (83,6) | 877 (86,8) | 174 (74,7) | 59 (84,3) | 1.706 (85,5) |
| Inmunosupresores | 256 (12,8) | 147 (14,5) | 90 (38,6) | 21 (30) | 386 (19,4) |
| Ciclosporina | 106 (5,3) | 52 (5,1) | 15 (6,4) | 0 (0%) | 163 (8,2) |
| Azatioprina | 39 (2,0) | 19 (1,9) | 9 (3,9) | 2 (2,9) | 54 (2,7) |
| Micofenolato de mofetilo | 33 (1,7) | 22 (2,2) | 20 (8,6) | 1 (1,4%) | 46 (2,3) |
| Metotrexato | 78 (3,9) | 55 (5,4) | 47 (20,2) | 16 (22,9%) | 146 (7,3) |
| Fármacos biológicos | 15 (0,8) | 115 (11,4) | 31 (13,3) | 2 (2,9%) | 143 (7,2) |
| Dupilumab | 2 (0,1) | 24 (2,4) | 12 (5,2) | 1 (1,4%) | 34 (1,7) |
| Omalizumab | 4 (0,2) | 35 (3,5) | 5 (2,2) | 1 (1,4%) | 41 (2,1) |
| Rituximab | 9 (0,5) | 56 (5,5) | 14 (6,0) | 0 (0) | 68 (3,4) |
| Otros fármacos sistémicos | 86 (4,3) | 0 (0) | 0 (0) | 0 (0) | 86 (4,3) |
| Inmunoglobulinas | 72 (3,6) | 0 (0) | 0 (0) | 0 (0) | 72 (3,6) |
| Interferón gamma | 12 (0,6) | 0 (0) | 0 (0) | 0 (0) | 12 (0,6) |
| Hidroxicloroquina | 2 (0,1) | 0 (0) | 0 (0) | 0 (0) | 2 (0,1) |
| Fototerapia | 3 (0,2) | 212 (21,0) | 9 (3,9) | 0 (0) | 224 (11,2) |
Líneas de tratamiento sistémico/fototerapia durante el periodo de seguimiento de tres años
| Variables | N=1.995 |
|---|---|
| Número de líneas (media, DE) | 1,7 (0,8) |
| Número de clases de tratamientos sistémicos recibidos, n (%) | |
| 1 fármaco sistémico | 1.169 (58,6) |
| 2 fármacos sistémicos | 592 (29,7) |
| >2 fármacos sistémicos | 234 (11,7) |
| Pacientes por línea de tratamiento, n (%) | |
| Línea 1 | 1.995 (100) |
| Línea 2 | 1.011 (50,7) |
| Línea 3 | 233 (11,7) |
| >3 líneas | 70 (3,5) |
| Número de pacientes con tratamiento sistémico continuo, excluyendo corticosteroides orales, n (%) | |
| Primer año | 374 (18,8) |
| Primeros dos años | 334 (16,7) |
| Tres años | 252 (12,6) |
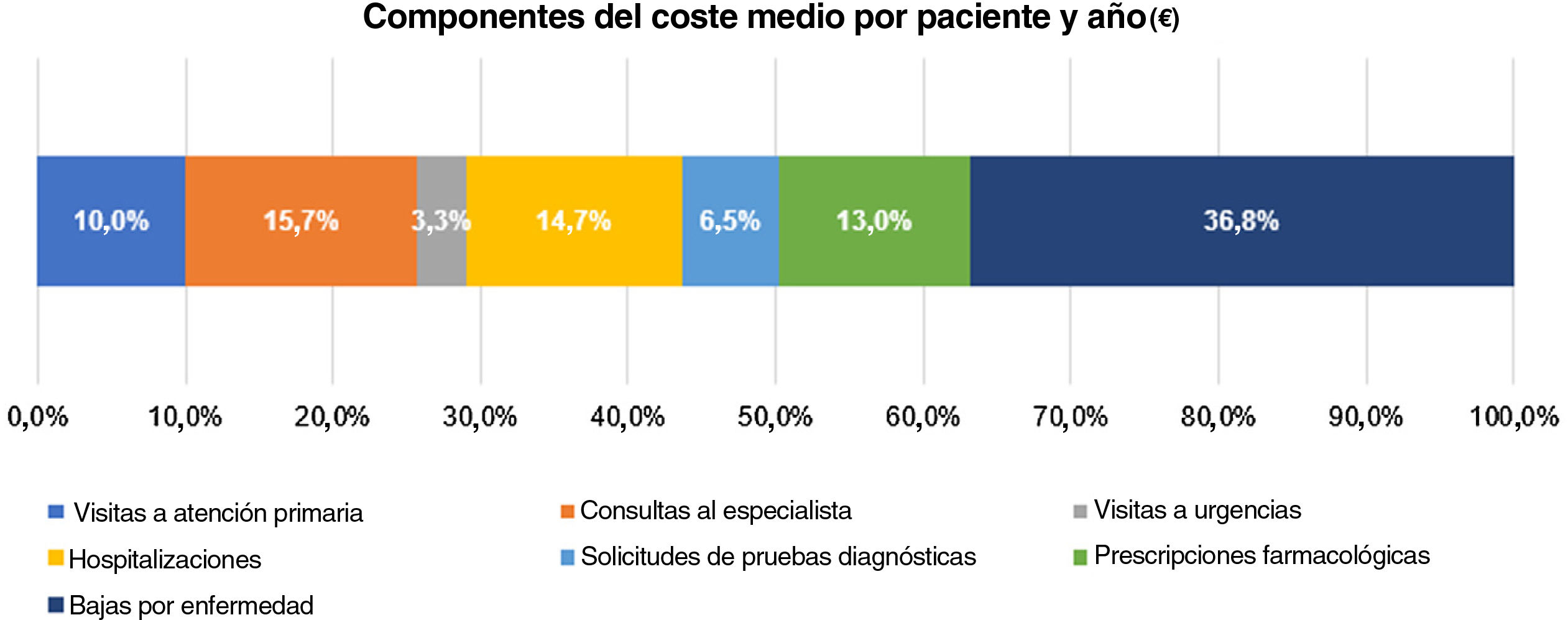
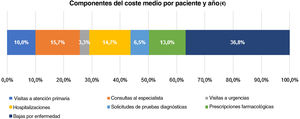
El coste anual medio (DE) por paciente fue de 1.278€ (2.079€), con los componentes de costes siguientes (fig. 6): 470€ (36,8%) bajas por enfermedad, 200€ (15,7%) consultas al especialista, 187€ (14,7%) hospitalización, 167€ (13,1%) medicación, 128€ (10%) consultas de atención primaria, 83€ (6,5%) solicitudes de pruebas diagnósticas, y 42€ (3,3%) visitas a urgencias.
El coste total por paciente en los tres años de seguimiento fue de 3.835€ (6.238€) (tabla 5).
Uso de recursos sanitarios y costes asociados
| N=1.995 | ||||
|---|---|---|---|---|
| Anual | Tres años de seguimiento | |||
| URS por paciente, media (DE) | Costes por paciente, media (DE) | URS por paciente, media (DE) | Costes por paciente, media (DE) | |
| Recursos sanitarios, media (DE) | – | 806 € (1.545 €) | – | 2.426 € (4.117 €) |
| Consultas al especialista | 1,7 (4,5) | 200 € (530€) | 5,1 (13,5) | 601 € (1.590 €) |
| Hospitalización | 0,5 (1,1) | 187 € (729€) | 1,4 (3,4) | 563 € (2.187 €) |
| Medicación | – | 167 € (732€) | – | 501 € (2.197 €) |
| Visitas atención primaria | 5,5 (3,1) | 128 € (72 €) | 16,6 (9,3) | 385 € (215 €) |
| Solicitudes de pruebas diagnósticas | 2,6 (2,4) | 83 € (78 €) | 7,7 (7,3) | 250 € (235 €) |
| Visitas a urgencias | 0,2 (0,8) | 41 € (103€) | 0,5 (2,3) | 126 € (310 €) |
| Recursos no sanitarios, media (DE) – bajas por enfermedad | 4,6 (12,4) | 470 € (1.253 €) | 13,9 (37,2) | 1.410 € (3.760 €) |
| Coste total por paciente, media (DE) | – | 1.278 € (2.079 €) | – | 3.835 € (6.238 €) |
El estudio Derma-Atopic caracterizó la carga clínica, terapéutica y económica de la DA en una población adulta del mundo real tratada con fármacos sistémicos en España. Dicho estudio aporta una perspectiva sobre el patrón de uso de los tratamientos sistémicos durante un periodo de tres años en España.
Los pacientes con DA incluidos en el estudio fueron predominantemente mujeres, diagnosticados en la en la edad adulta, con una media de 60 años en el momento de iniciarse el tratamiento sistémico, duración de la enfermedad prolongada y alta carga de comorbilidades (ej.: ansiedad, enfermedades cardiovasculares). Se encontró que la edad de inicio del tratamiento sistémico era consistente con otros estudios, basados en bases de datos sanitarias que incluían pacientes de atención primaria y secundaria en España6,13, y fuera de España20. Por el contrario, los pacientes seleccionados para participar en los estudios de recopilación de datos de atención primaria21,22, donde se aplicaron criterios de selección de edad más estrictos (p. ej., adultos de 18 a 65 años), presentaron edades medias más bajas. Las comorbilidades coexistentes relacionadas con la DA, tales como asma y rinitis alérgica (‘marcha atópica’), estuvieron presentes aproximadamente en el 16% de los pacientes del estudio actual. Esta frecuencia fue inferior a la reportada por Bruin Weller et al. 21 en 2020, donde cerca de un tercio de los pacientes con enfermedad moderada–grave padecían también asma. Los tratamientos concomitantes que incluyen antibióticos, antihistamínicos y antidepresivos, estuvieron altamente presentes en la población de estudio, lo cual subraya la carga significativa de los síntomas de la DA (p. ej., prurito) y de las comorbilidades.
Los pacientes analizados en el estudio presentaron un uso considerable de tratamientos sistémicos, y más del 50% de ellos requirió al menos dos líneas de tratamiento en el periodo de tres años del estudio. La primera línea de tratamiento se basó principalmente en cursos cortos de corticosteroides orales, los cuales estuvieron consistentemente presentes en todas las líneas de tratamiento (tanto en monoterapia como en combinación). El elevado uso de corticosteroides orales, frente a otras alternativas tales como inmunosupresores, podría explicarse por la contribución de los pacientes de atención primaria, además de los de atención secundaria, donde se esperaría un mayor uso de inmunosupresores. Los pacientes que recibieron inmunosupresores o fármacos biológicos como primera línea, siguieron en tratamiento durante periodos más prolongados (media de 117 y 331 días, respectivamente). El uso de inmunosupresores (principalmente ciclosporina y metotrexato, este último utilizado fuera de indicación) aumentó a medida que los pacientes avanzaban en el algoritmo de tratamiento, de acuerdo con las recomendaciones de las guías de tratamiento actuales1. Resulta interesante que, aunque las directrices limitan el uso de inmunoglobulina intravenosa en los niños con enfermedad refractaria, cerca de 4% de los pacientes del estudio, y 20 de los 240 pacientes incluidos en el estudio realizado por Pereyra-Rodriguez et al.12, reportaron el uso de este tratamiento en adultos. Como este estudio aporta una visión general sobre el escenario del tratamiento de la DA entre 2013 y 2019, el uso de dupilumab (financiado en España desde 2020)23 y de otros fármacos biológicos (fuera de indicación) fue escaso. Se espera que la disponibilidad de fármacos biológicos y de los inhibidores de la quinasa Janus (JAK) dé lugar a un cambio en el paradigma de tratamiento de la DA moderada-grave24, lo que requerirá una mayor caracterización de las vías terapéuticas en los años futuros.
La variabilidad de la práctica clínica y las trayectorias terapéuticas observados en el estudio confirma la naturaleza heterogénea de la enfermedad, que requiere estrategias terapéuticas individualizadas en la práctica rutinaria13,25,26. Cerca de 20% de los pacientes del estudio recibieron tratamientos sistémicos de manera continua a lo largo de un año, y un 13% durante el periodo de tres años. Estos hallazgos sugieren que, a pesar de que algunos pacientes puedan presentar la enfermedad a causa de un brote agudo que requiera intervenciones farmacológicas a corto plazo para el alivio de los síntomas, otros desarrollan un curso crónico de la enfermedad con lesiones cutáneas persistentes y prurito intenso27. Sin embargo, la falta de datos sobre las puntuaciones de gravedad, los resultados reportados por el paciente (PRO, del inglés patient reported outcomes) y los síntomas, limitaron la interpretación de estos resultados. Además, es necesaria la investigación futura que describa el tipo de facultativos que inician y prescriben tratamientos sistémicos (p. ej., médico general frente a dermatólogo) y los patrones de derivación para los pacientes de DA moderada–grave en el mundo real.
La DA supone una carga económica significativa para el sistema sanitario, los pacientes y sus familiares, especialmente en sus formas más graves1,2,28. El presente estudio estimó un coste de la DA moderada–grave en adultos de 1.278€ por paciente y año (costes sanitarios: 63%; costes indirectos: 37%). Un estudio reciente realizado en Cataluña reportó un elevado coste unitario, que ascendió a 3.397€ para los pacientes con enfermedad grave, y 2.111€ para los pacientes con enfermedad moderada, correspondiendo 75,5% a los costes sanitarios, y 24,5% a los costes indirectos6. En ambos estudios los costes indirectos basados en pérdidas de productividad estuvieron altamente representados, hallazgo que coincide con la evidencia existente, que sugiere un impacto significativo de la DA en la productividad laboral29.
Este estudio presenta ciertas limitaciones. La posible imprecisión de la codificación diagnóstica para la DA y otras comorbilidades, o la falta de información en la base de datos sobre el nivel socioeconómico y el estatus clínico, las regiones y hospitales participantes (que son confidenciales), la adherencia terapéutica, los fenotipos etc., pueden ser limitaciones potenciales para el estudio. De igual modo, puede existir una sobrerrepresentación de casos de pacientes de mayor edad con DA, lo cual puede limitar la comparación con los estudios que utilizan diferentes fuentes de datos. La validación y representatividad de la base de datos BIG-PAC ha sido previamente explorada, aunque el análisis careció del nivel socioeconómico y educativo, y del tipo de población cubierta (urbana/rural)15. Aunque persiste cierta incertidumbre sobre si los resultados obtenidos en el presente estudio podrían generalizarse a la población general de España, la evidencia publicada utilizando la base de datos BIG-PAC indica que es adecuada para realizar estudios en el ámbito del mundo real para diversas situaciones, incluyendo la DA en España13,30–33. Por otro lado, la base de datos BIG-PAC está registrada en el inventario ENCePP como fuente de datos elegible para la realización de estudios sobre farmacoepidemiología y farmacovigilancia en Europa. El tratamiento y los PRO, así como la incidencia de brotes no fueron registrados, lo cual dificulta la interpretación clínica de los resultados. El estudio intentó seleccionar pacientes que iniciaban terapia de fármacos sistémicos o fototerapia por primera vez para tratar la DA en la vida adulta. Por este motivo, los pacientes con historia previa de uso de fármacos sistémicos o fototerapia en los dos años anteriores a la fecha índice fueron excluidos. Sin embargo, no se puede descartar el uso previo de fármacos sistémicos más allá de dichos dos años. Además, los costes se basaron en la identificación de recursos asociados a la DA, una aproximación necesaria en ausencia de los códigos reales vinculados a cada recurso. Por tanto, es posible que se hayan sobreestimado algunos tipos de recursos.
ConclusionesEste estudio describió una población de adultos del mundo real con DA, tratados con fármacos sistémicos en España. Los resultados sugieren una alta comorbilidad y carga económica para el sistema sanitario, los pacientes y sus familiares. A pesar de observarse variabilidad en los patrones de tratamiento, los cursos cortos de corticosteroides orales siguieron siendo la principal opción de tratamiento, seguida de los inmunosupresores, utilizándose algunos de ellos fuera de indicación. Esto subraya la necesidad de nuevos tratamientos sistémicos indicados para la DA.
FinanciaciónEste estudio fue financiado mediante Eli Lilly and Company.
Conflicto de interesesEsther Serra ha recibido honorarios por haber actuado de asesora científica y conferenciante para Eli Lilly and Company. Esther Artime, Silvia Díaz y Teresa Huete son empleadas y accionistas minoritarias de Eli Lilly and Company. Ignacio Hernández, Laura Lledo y Antoni Sicras son empleados y accionistas minoritarios de Atrys Health S.A. en España.