El lupus eritematoso cutáneo (LEC) es una patología autoinmune crónica cutánea que se manifiesta en forma de diversos subtipos morfológicos, todos ellos compartiendo un perfil de citocinas donde el interferón tipoI (IFN-I) desempeña una función protagonista1. Estos subtipos incluyen el LEC agudo (LECA), subagudo (LECSA), intermitente (LECI) y crónico (LECC), que a su vez incluye el discoide (LECD), pernio o chilblain-lupus (CHLE) y paniculítico (LECP)1,2. Alrededor del 20% de los LEC se asocian con afectación sistémica (LES), y el 70% de los LES acaban desarrollando LEC1,2. El riesgo de desarrollo de lesiones cicatriciales en el LECC hace que su manejo precoz sea esencial. Hasta la fecha, no existen fármacos con indicación específica para el LEC, empleándose de forma off-label fármacos autorizados para el tratamiento del LES1.
Anifrolumab, un anticuerpo monoclonal anti-receptor1 de subunidad alfa de interferón (IFNAR1), fue aprobado por la Agencia Europea de Medicamentos en febrero de 2022 para el LES. Dentro de los objetivos secundarios del ensayo clínico TULIP-2 se observó su importante beneficio en el LEC, logrando una reducción del 50% en la puntuación Cutaneous Lupus Erythematosus Disease Area and Severity Index Activity (CLASI-A) en el 49% de los pacientes3. Desde entonces, su eficacia y seguridad en el manejo del LEC en práctica clínica real ha sido apoyada por la literatura4. En junio de 2023, el Ministerio de Sanidad de España aprobó la financiación de anifrolumab para LES activo moderado-grave con anticuerpos antinucleares (ANA) positivos. Presentamos nuestra experiencia en el tratamiento con anifrolumab en una serie de casos de LES con afectación grave y refractaria de LEC.
Se realizó un estudio unicéntrico descriptivo retrospectivo de todos los casos de LES con afectación cutánea refractaria que recibieron anifrolumab 300mg mensual desde julio de 2023 hasta abril de 2024 en el Servicio de Dermatología de un hospital de tercer nivel de España. Las variables del estudio incluyeron sexo, edad, subtipo de LEC, afectación sistémica del LES, autoanticuerpos, tratamientos previos, CLASI-A previo y posterior al tratamiento, tiempo de respuesta y seguimiento, optimización del tratamiento y efectos adversos.
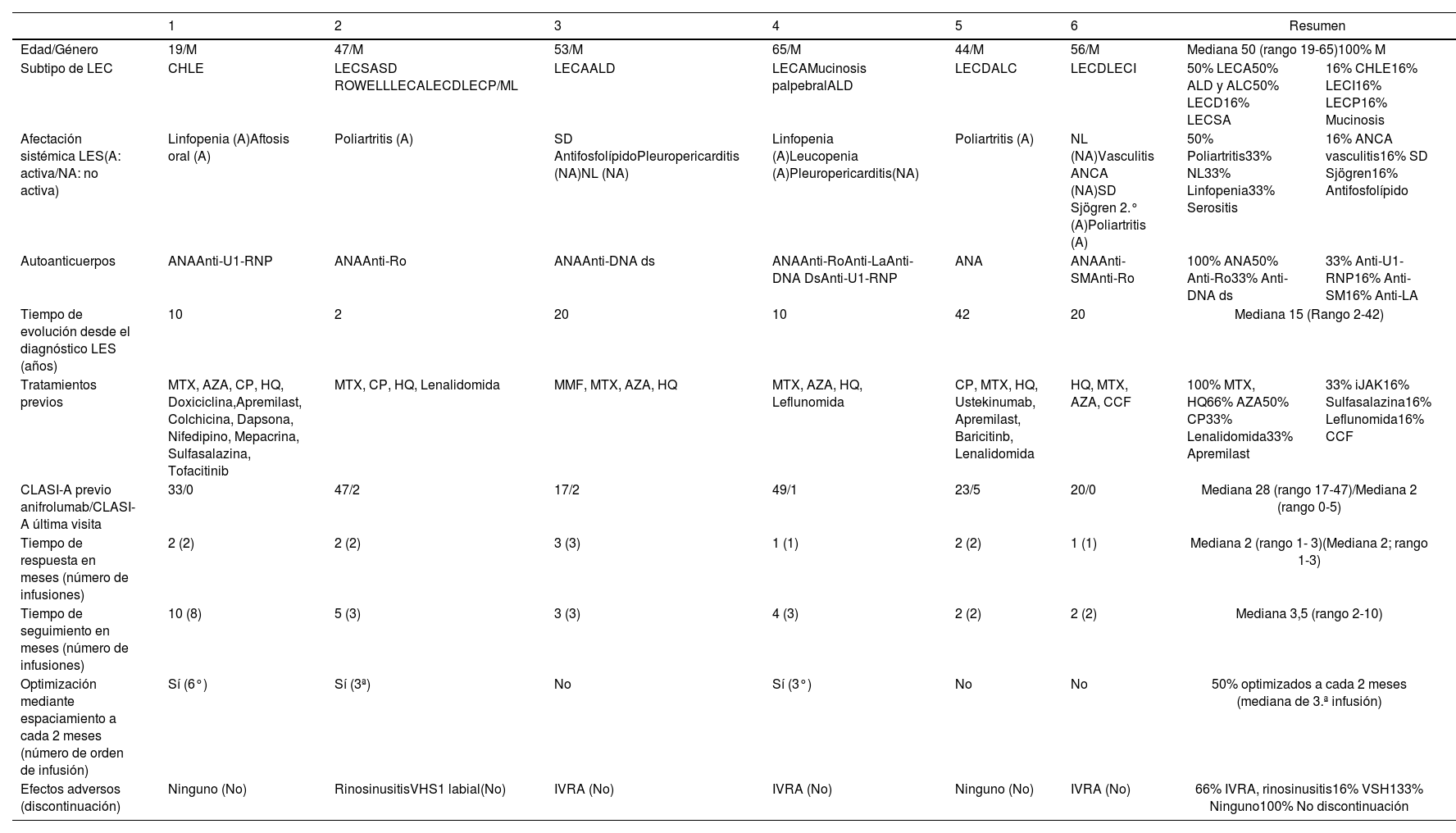
Se incluyeron 6 pacientes (tabla 1), todas ellas mujeres, con una mediana de edad de 50años (rango 19-65). La mediana de tiempo de evolución del LES fue de 15años (rango 2-42). Las afectaciones sistémicas más prevalentes fueron las hematológicas (linfopenia), poliartritis, serositis y nefropatía lúpica. El 100% expresaron ANA en sangre, siendo las especificidades anti-Ro y anti-dsDNA las más predominantes. Los subtipos de LEC más observados fueron LECD y LECA, seguidos de LECSA y CHLE. La mediana de tratamientos previos utilizados fue de 4 (rango 4-12), siendo hidroxicloroquina, metotrexato, ciclosporina, azatioprina y lenalidomida los más frecuentes. Previo al inicio del tratamiento, completaron la pauta de vacunación del virus de varicela zoster. En todas las pacientes se observó una rápida e impactante remisión de las lesiones de LEC (figs. 1 y 2) tras una mediana de 2meses de tratamiento, es decir, en dos infusiones de anifrolumab (rango 1-3). La mediana de CLASI-A se redujo de 35 (rango 17-47) a 2 (rango 0-5), manteniéndose en remisión durante el tiempo observado. En tres de las pacientes se optimizó el tratamiento, espaciando la dosis a cada 2meses sin presentar recidiva de las lesiones. El criterio de optimización fue la remisión del CLASI a menos de 3puntos de forma mantenida tras las tres primeras dosis. No se observaron cambios en el resto de manifestaciones activas del LES (hematológicas y articulares). Uno de los casos presentó recidiva precoz de las aftas orales. Cuatro pacientes refirieron infecciones de vías respiratorias altas no complicadas (IVRA) y una reactivación de virus de herpes simplex labial tipo1 (VHS1). No hubo efectos adversos graves ni se interrumpió el tratamiento.
Datos de los 6 casos de lupus eritematoso sistémico con afectación cutánea grave del estudio
| 1 | 2 | 3 | 4 | 5 | 6 | Resumen | ||
|---|---|---|---|---|---|---|---|---|
| Edad/Género | 19/M | 47/M | 53/M | 65/M | 44/M | 56/M | Mediana 50 (rango 19-65)100% M | |
| Subtipo de LEC | CHLE | LECSASD ROWELLLECALECDLECP/ML | LECAALD | LECAMucinosis palpebralALD | LECDALC | LECDLECI | 50% LECA50% ALD y ALC50% LECD16% LECSA | 16% CHLE16% LECI16% LECP16% Mucinosis |
| Afectación sistémica LES(A: activa/NA: no activa) | Linfopenia (A)Aftosis oral (A) | Poliartritis (A) | SD AntifosfolípidoPleuropericarditis (NA)NL (NA) | Linfopenia (A)Leucopenia (A)Pleuropericarditis(NA) | Poliartritis (A) | NL (NA)Vasculitis ANCA (NA)SD Sjögren 2.° (A)Poliartritis (A) | 50% Poliartritis33% NL33% Linfopenia33% Serositis | 16% ANCA vasculitis16% SD Sjögren16% Antifosfolípido |
| Autoanticuerpos | ANAAnti-U1-RNP | ANAAnti-Ro | ANAAnti-DNA ds | ANAAnti-RoAnti-LaAnti-DNA DsAnti-U1-RNP | ANA | ANAAnti-SMAnti-Ro | 100% ANA50% Anti-Ro33% Anti-DNA ds | 33% Anti-U1-RNP16% Anti-SM16% Anti-LA |
| Tiempo de evolución desde el diagnóstico LES (años) | 10 | 2 | 20 | 10 | 42 | 20 | Mediana 15 (Rango 2-42) | |
| Tratamientos previos | MTX, AZA, CP, HQ, Doxiciclina,Apremilast, Colchicina, Dapsona, Nifedipino, Mepacrina, Sulfasalazina, Tofacitinib | MTX, CP, HQ, Lenalidomida | MMF, MTX, AZA, HQ | MTX, AZA, HQ, Leflunomida | CP, MTX, HQ, Ustekinumab, Apremilast, Baricitinb, Lenalidomida | HQ, MTX, AZA, CCF | 100% MTX, HQ66% AZA50% CP33% Lenalidomida33% Apremilast | 33% iJAK16% Sulfasalazina16% Leflunomida16% CCF |
| CLASI-A previo anifrolumab/CLASI-A última visita | 33/0 | 47/2 | 17/2 | 49/1 | 23/5 | 20/0 | Mediana 28 (rango 17-47)/Mediana 2 (rango 0-5) | |
| Tiempo de respuesta en meses (número de infusiones) | 2 (2) | 2 (2) | 3 (3) | 1 (1) | 2 (2) | 1 (1) | Mediana 2 (rango 1- 3)(Mediana 2; rango 1-3) | |
| Tiempo de seguimiento en meses (número de infusiones) | 10 (8) | 5 (3) | 3 (3) | 4 (3) | 2 (2) | 2 (2) | Mediana 3,5 (rango 2-10) | |
| Optimización mediante espaciamiento a cada 2 meses (número de orden de infusión) | Sí (6°) | Sí (3ª) | No | Sí (3°) | No | No | 50% optimizados a cada 2 meses (mediana de 3.ª infusión) | |
| Efectos adversos (discontinuación) | Ninguno (No) | RinosinusitisVHS1 labial(No) | IVRA (No) | IVRA (No) | Ninguno (No) | IVRA (No) | 66% IVRA, rinosinusitis16% VSH133% Ninguno100% No discontinuación | |
A: manifestación extracutánea activa; ALC: alopecia lúpica cicatricial; ALD: alopecia lúpica difusa; ANA: anticuerpos antinucleares; Anti-DNA ds: anticuerpos anti ADN de doble cadena; Anti-SM: anticuerpo anti Smith; Anti-U1 RNP: anticuerpo anti ribonucleoproteína; AZA: azatioprina; CCF: ciclofosfamida; CHLE: chilblain lupus eritematoso; CP: ciclosporina; HQ: hidroxicloroquina; iJAK: inhibidor JAK cinasas; IVRA: infección vías respiratorias altas; LEC: lupus eritematoso cutáneo; LECA: lupus eritematoso cutáneo agudo; LECD: lupus eritematoso cutáneo discoide; LECI: lupus eritematoso cutáneo intermitente; LECP: lupus eritematoso cutáneo discoide; LECSA: lupus eritematoso cutáneo subagudo; M mujer; ML: mastitis lúpica; MMF: micofenolato de mofetilo; MTX: metotrexato; NA: manifestación extracutánea no activa; NL: nefropatía lúpica; VHS1: virus herpes simplex 1.
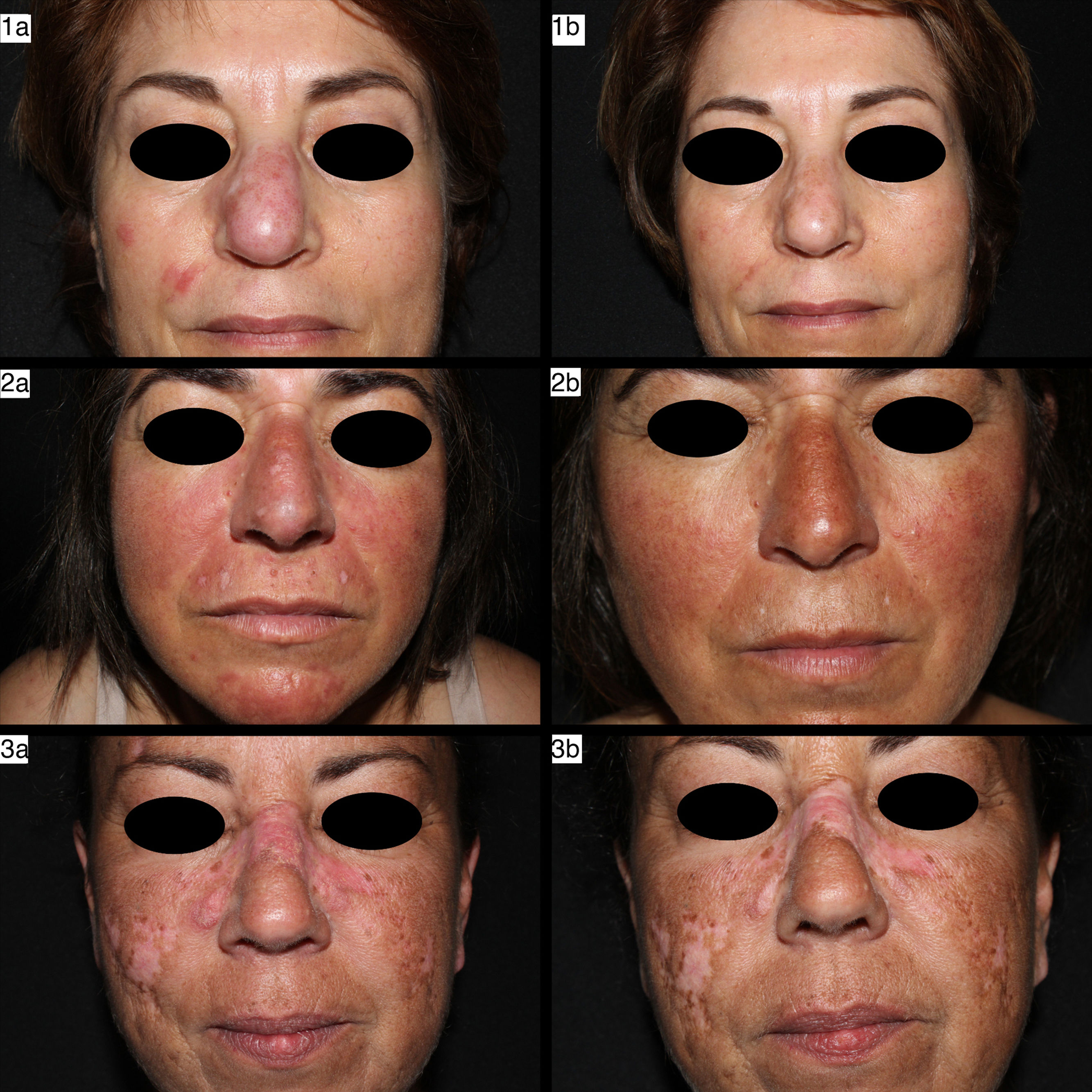
Imágenes de casos con LEC tipo LEC previo a tratamiento con anifrolumab (a) y tras dos infusiones de anifrolumab 300mg/mensual (b). En los tres casos se pueden observar la afectación facial de LECD mediante placas infiltradas eritematosas, edematosas y descamativas. Tras tratamiento con anifrolumab se observan las placas sin eritema ni infiltración, hipopigmentadas y cicatriciales. (Las imágenes1 corresponden al caso 6 de la tabla, las imágenes2 corresponden al caso 2 de la tabla, y las imágenes3 corresponden al caso 5 de la tabla.)
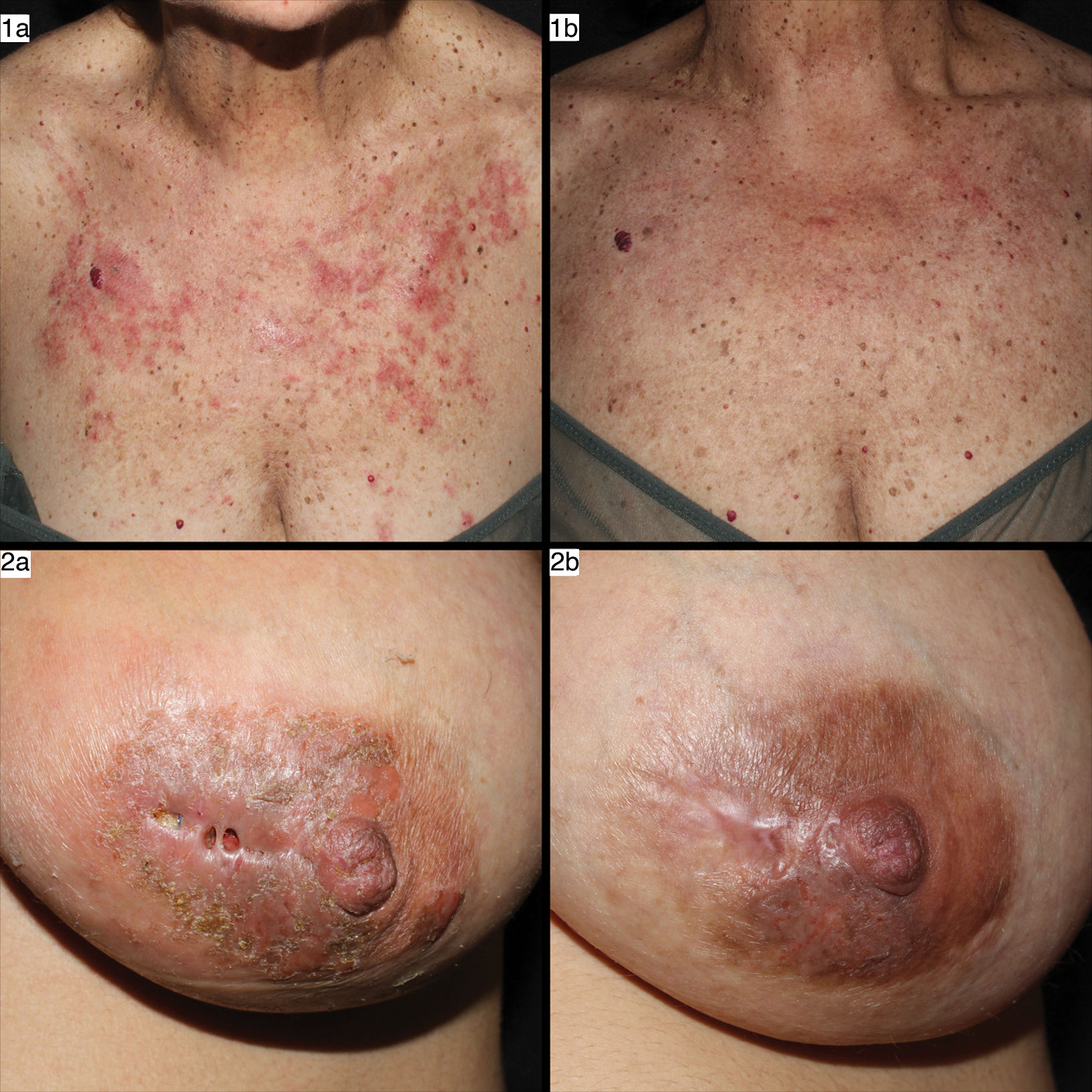
Imágenes de casos con LEC tipo LECA y LECP previo a tratamiento con anifrolumab (a) y tras dos infusiones de anifrolumab 300mg/mensual (b). Las imágenes1 corresponden al caso número 4 de la tabla, y en ellas se observan lesiones de LECA en forma de placas eritematosas y edematosas por área fotoexpuesta de aparición aguda en zona de escote que curan sin cicatriz tras el tratamiento. Las imágenes2 corresponden al caso número 2 de la tabla, y se observan lesiones de mastitis lúpica (LECP) en forma de placa indurada e infiltrada, descamativa, con afectación profunda, fisurada, que se resuelve dejando cicatriz tras el tratamiento.
La familia de IFN-I incluye cinco clases que se unen y señalizan a través del IFNAR: IFN-α, IFN-β, IFN-ω, IFN-κ e IFN-ɛ5. Anifrolumab inhibe competitivamente la unión de INF-I a IFNAR1. El IFN-α, secretado principalmente por las células dendríticas CD123, actúa como bisagra o punto de unión entre la inmunidad innata y la adaptativa en la fisiopatogenia del LEC6. Hasta la fecha, belimumab y rituximab eran los únicos fármacos biológicos aprobados para el LES, ambos dirigidos frente a los linfocitosB. Si bien han demostrado su eficacia en las manifestaciones musculoesqueléticas y viscerales del LES, su respuesta cutánea era limitada. Anifrolumab, por el contrario, parece tener un mejor perfil de eficacia a nivel cutáneo en comparación con otras afecciones del LES3,7. El bloqueo del INF-I se ha convertido en una vía prometedora en el tratamiento del LEC5.
Los datos en eficacia y seguridad del fármaco en nuestro estudio concuerdan con los observados en los ensayos clínicos y estudios en vida real4,8-10. Anifrolumab fue eficaz para el tratamiento de todas las variantes de LEC refractario, destacando su rapidez de acción4,6. Coincidiendo con la literatura, los efectos adversos detectados fueron leves y autorresolutivos, siendo las IVRA y la reactivación de VHS1 los más frecuentes9. Destacamos además la posibilidad de optimización del fármaco, con espaciamiento de las dosis, manteniendo remisiones completas en el tiempo.