Los linfomas cutáneos de células T (LCCT) como la micosis fungoide (MF) y el síndrome de Sézary (SS) son linfomas poco comunes con pronósticos variables. El objetivo del estudio fue describir la supervivencia de una cohorte de pacientes con MF/SS y evaluar aquellos factores pronósticos con impacto en la supervivencia de la enfermedad.
Material y métodosSe analizaron retrospectivamente todos los casos diagnosticados de MF/SS entre 2008 y 2022. Se evaluaron variables demográficas, parámetros histológicos, y datos analíticos. Se calcularon la supervivencia libre de progresión (PFS) y la supervivencia específica de la enfermedad (DSS).
ResultadosSe incluyeron un total de 148 casos. Ciento veintiún casos (82%) fueron diagnosticados de MF y 27 casos de SS. Treinta y siete pacientes (25%) progresaron en algún momento de la evolución. La mediana de PFS fue de 127 meses y la mediana de DSS de 135 meses. La edad >60 años, el diagnóstico de SS, la presencia de transformación a célula grande (TCG) al diagnóstico, el foliculotropismo en estadios iniciales, la elevación de Ki-67, la presencia de TCR clonal en sangre, niveles elevados de LDH y B2M, y estadios avanzados (IIB, IVA, T3, T4, N3/Nx) se asociaron con un peor pronóstico en la cohorte.
ConclusionesEl estadio IVA y la presencia de TCG al diagnóstico destacaron como factores independientes de pronóstico desfavorable. La TCG fue la variable que produjo una disminución más acentuada de la supervivencia de los pacientes estando estrechamente relacionada con la afectación cutánea tumoral y el estadio IIB.
Cutaneous T-cell lymphomas (CTCL) such as mycosis fungoides (MF) and Sézary syndrome (SS) are rare lymphomas with varying prognoses. The aim of the study was to describe the survival of a cohort of patients with MF/SS and evaluate the prognostic factors impacting disease survival.
Materials and MethodsAll cases of MF/SS diagnosed from 2008 through 2022 were retrospectively analyzed. The demographic variables, histological parameters, and analytical data were analyzed too. Progression-free survival (PFS) and disease-specific survival (DSS) were calculated.
ResultsA total of 148 cases were included. A total of 121 (82%) and 27 cases were diagnosed with MF, and SS, respectively. A total of 37 patients (25%) experienced progression at some point disease progression. The median PFS and median DSS were 127 and 135 months, respectively. Age >60 years, diagnosis of SS, the presence of large cell transformation (LCT) at diagnosis, folliculotropism in early stages, high Ki-67 expression, the presence of the clonal T-cell receptor (TCR) in blood, elevated LDH and B2M levels, and advanced stages (IIB, IVA, T3, T4, N3/Nx) were associated with worse prognosis across the entire cohort.
ConclusionsStage IVA and the presence of LCT at diagnosis stood out as independent factors of unfavorable prognosis. LCT was the variable that most significantly impacted the patients’ survival and was closely associated with tumor skin involvement and stage IIB.
La micosis fungoide (MF) y el síndrome de Sézary (SS) son los subtipos más frecuentes de linfomas cutáneos de células T (LCCT)1,2. La MF suele tener un curso indolente con supervivencias prolongadas y una buena respuesta clínica a terapias dirigidas a la piel, sin embargo, alrededor del 20-25% de los pacientes progresan a formas tumorales avanzadas3. Estas formas avanzadas de MF, así como el SS, son enfermedades agresivas de difícil tratamiento y pronóstico adverso1,2. Se desconoce todavía qué factores están implicados en esta progresión y en la supervivencia de estos linfomas.
En este estudio se describe la supervivencia libre de progresión (progression-free survival [PFS]) y la supervivencia específica de enfermedad (disease-specific survival [DSS]) de una cohorte de pacientes con MF/SS y se pretende evaluar qué factores pronósticos tienen un impacto adverso en la supervivencia de estos linfomas.
Material y métodosSe analizaron todos los casos consecutivos diagnosticados de MF y SS desde enero de 2008 hasta diciembre de 2022 en la Unidad de Linfoma Cutáneo del Hospital Universitari de Bellvitge. El diagnóstico se hizo según los criterios de la World Health Organization (WHO)-European Organization of Research and Treatment of Cancer (EORTC)2. Se recogieron datos demográficos (edad, sexo, subtipo diagnóstico, estado último control), estadio al diagnóstico y a la progresión (la estadificación TNMB se realizó de acuerdo con el propuesto por la International Society for Cutaneous Lymphoma [ISLC] – EORTC)4, parámetros histológicos (transformación a célula grande [TCG], foliculotropismo [FT], porcentaje de células CD30+, Ki-67, receptor de células T [TCR] clonal en piel) y parámetros hematológicos (LDH, beta2-microglobulina [B2M], leucocitos, linfocitos, TCR clonal en sangre). La tinción Ki-67 se consideró intensa en aquellas biopsias que expresaron un índice de proliferación Ki-67 mayor del 30% y leve en aquellas en las que fue menor del 30%. En cuanto a la LDH y la B2M, se consideraron elevadas si los valores eran mayores de 213U/L y 2,4mg/L, respectivamente.
Se consideró TCG cuando la presencia de linfocitos grandes excedía más del 25% del infiltrado dérmico o por la formación de nódulos de células grandes5.
La PFS se definió como el tiempo desde la primera respuesta objetiva al tratamiento hasta la recidiva, progresión o fallecimiento (en los pacientes que progresan) o hasta la fecha del último control (en los pacientes sin progresión); la supervivencia global (overall survival [OS]), desde la fecha de inicio del tratamiento hasta la fecha de fallecimiento por cualquier causa; y la DSS, desde la fecha del inicio del tratamiento hasta la fecha de fallecimiento a consecuencia del linfoma. Se definió progresión como el cambio de un estadio a otro superior.
Análisis estadísticoSe utilizaron análisis y gráficos con el software SPSS Statistics para el análisis estadístico. Se realizó un análisis descriptivo de frecuencias para variables categóricas y se evaluó la normalidad de las variables numéricas. Se emplearon tablas de contingencia y pruebas estadísticas para analizar relaciones entre variables. Se aplicó la prueba de Fisher o la prueba de Ji-Cuadrado según correspondiera, dependiendo del tamaño de las frecuencias esperadas. Se realizaron análisis U de Mann-Whitney para comparar variables numéricas con categóricas.
Se estimó la DSS y tasas de supervivencia a diferentes años utilizando el método de Kaplan-Meier. Se aplicó la prueba de Log-Rank para comparar grupos. Se llevaron a cabo análisis multivariantes utilizando el modelo de regresión de riesgos proporcionales de Cox, incluyendo variables significativas de análisis previos.
ResultadosSe incluyeron un total de 148 casos. En la tabla 1 se describen las características principales de los pacientes con MF y SS. La mediada de edad fue de 62 años [49-70 años], con un 63% de hombres. Ciento veintiún casos (82%) fueron diagnosticados de MF y 27 casos de SS. Al diagnóstico, los estadios iniciales ( tabla 1 se incluye también los resultados del análisis univariante Kaplan-Meier/Log-Rank de supervivencia específica de la cohorte para cada una de las variables que a continuación se detallan.
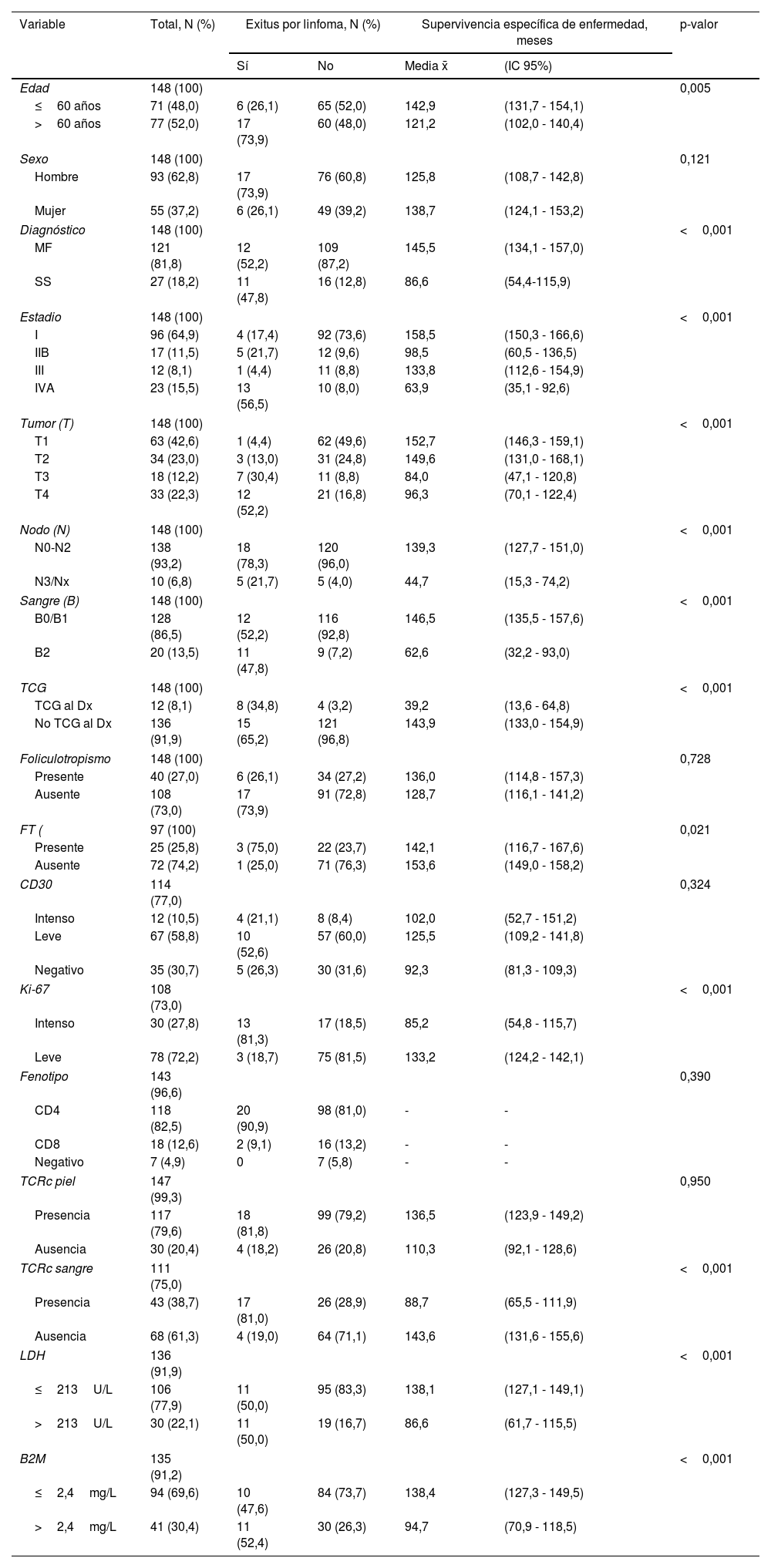
Descripción de los parámetros demográficos, estadificación TNMB al diagnóstico, parámetros histológicos y hematológicos, junto a los resultados del análisis univariante Kaplan-Meier/Log-Rank de supervivencia específica de enfermedad de la cohorte
| Variable | Total, N (%) | Exitus por linfoma, N (%) | Supervivencia específica de enfermedad, meses | p-valor | ||
|---|---|---|---|---|---|---|
| Sí | No | Media x̄ | (IC 95%) | |||
| Edad | 148 (100) | 0,005 | ||||
| ≤60 años | 71 (48,0) | 6 (26,1) | 65 (52,0) | 142,9 | (131,7 - 154,1) | |
| >60 años | 77 (52,0) | 17 (73,9) | 60 (48,0) | 121,2 | (102,0 - 140,4) | |
| Sexo | 148 (100) | 0,121 | ||||
| Hombre | 93 (62,8) | 17 (73,9) | 76 (60,8) | 125,8 | (108,7 - 142,8) | |
| Mujer | 55 (37,2) | 6 (26,1) | 49 (39,2) | 138,7 | (124,1 - 153,2) | |
| Diagnóstico | 148 (100) | <0,001 | ||||
| MF | 121 (81,8) | 12 (52,2) | 109 (87,2) | 145,5 | (134,1 - 157,0) | |
| SS | 27 (18,2) | 11 (47,8) | 16 (12,8) | 86,6 | (54,4-115,9) | |
| Estadio | 148 (100) | <0,001 | ||||
| I | 96 (64,9) | 4 (17,4) | 92 (73,6) | 158,5 | (150,3 - 166,6) | |
| IIB | 17 (11,5) | 5 (21,7) | 12 (9,6) | 98,5 | (60,5 - 136,5) | |
| III | 12 (8,1) | 1 (4,4) | 11 (8,8) | 133,8 | (112,6 - 154,9) | |
| IVA | 23 (15,5) | 13 (56,5) | 10 (8,0) | 63,9 | (35,1 - 92,6) | |
| Tumor (T) | 148 (100) | <0,001 | ||||
| T1 | 63 (42,6) | 1 (4,4) | 62 (49,6) | 152,7 | (146,3 - 159,1) | |
| T2 | 34 (23,0) | 3 (13,0) | 31 (24,8) | 149,6 | (131,0 - 168,1) | |
| T3 | 18 (12,2) | 7 (30,4) | 11 (8,8) | 84,0 | (47,1 - 120,8) | |
| T4 | 33 (22,3) | 12 (52,2) | 21 (16,8) | 96,3 | (70,1 - 122,4) | |
| Nodo (N) | 148 (100) | <0,001 | ||||
| N0-N2 | 138 (93,2) | 18 (78,3) | 120 (96,0) | 139,3 | (127,7 - 151,0) | |
| N3/Nx | 10 (6,8) | 5 (21,7) | 5 (4,0) | 44,7 | (15,3 - 74,2) | |
| Sangre (B) | 148 (100) | <0,001 | ||||
| B0/B1 | 128 (86,5) | 12 (52,2) | 116 (92,8) | 146,5 | (135,5 - 157,6) | |
| B2 | 20 (13,5) | 11 (47,8) | 9 (7,2) | 62,6 | (32,2 - 93,0) | |
| TCG | 148 (100) | <0,001 | ||||
| TCG al Dx | 12 (8,1) | 8 (34,8) | 4 (3,2) | 39,2 | (13,6 - 64,8) | |
| No TCG al Dx | 136 (91,9) | 15 (65,2) | 121 (96,8) | 143,9 | (133,0 - 154,9) | |
| Foliculotropismo | 148 (100) | 0,728 | ||||
| Presente | 40 (27,0) | 6 (26,1) | 34 (27,2) | 136,0 | (114,8 - 157,3) | |
| Ausente | 108 (73,0) | 17 (73,9) | 91 (72,8) | 128,7 | (116,1 - 141,2) | |
| FT ( | 97 (100) | 0,021 | ||||
| Presente | 25 (25,8) | 3 (75,0) | 22 (23,7) | 142,1 | (116,7 - 167,6) | |
| Ausente | 72 (74,2) | 1 (25,0) | 71 (76,3) | 153,6 | (149,0 - 158,2) | |
| CD30 | 114 (77,0) | 0,324 | ||||
| Intenso | 12 (10,5) | 4 (21,1) | 8 (8,4) | 102,0 | (52,7 - 151,2) | |
| Leve | 67 (58,8) | 10 (52,6) | 57 (60,0) | 125,5 | (109,2 - 141,8) | |
| Negativo | 35 (30,7) | 5 (26,3) | 30 (31,6) | 92,3 | (81,3 - 109,3) | |
| Ki-67 | 108 (73,0) | <0,001 | ||||
| Intenso | 30 (27,8) | 13 (81,3) | 17 (18,5) | 85,2 | (54,8 - 115,7) | |
| Leve | 78 (72,2) | 3 (18,7) | 75 (81,5) | 133,2 | (124,2 - 142,1) | |
| Fenotipo | 143 (96,6) | 0,390 | ||||
| CD4 | 118 (82,5) | 20 (90,9) | 98 (81,0) | - | - | |
| CD8 | 18 (12,6) | 2 (9,1) | 16 (13,2) | - | - | |
| Negativo | 7 (4,9) | 0 | 7 (5,8) | - | - | |
| TCRc piel | 147 (99,3) | 0,950 | ||||
| Presencia | 117 (79,6) | 18 (81,8) | 99 (79,2) | 136,5 | (123,9 - 149,2) | |
| Ausencia | 30 (20,4) | 4 (18,2) | 26 (20,8) | 110,3 | (92,1 - 128,6) | |
| TCRc sangre | 111 (75,0) | <0,001 | ||||
| Presencia | 43 (38,7) | 17 (81,0) | 26 (28,9) | 88,7 | (65,5 - 111,9) | |
| Ausencia | 68 (61,3) | 4 (19,0) | 64 (71,1) | 143,6 | (131,6 - 155,6) | |
| LDH | 136 (91,9) | <0,001 | ||||
| ≤213U/L | 106 (77,9) | 11 (50,0) | 95 (83,3) | 138,1 | (127,1 - 149,1) | |
| >213U/L | 30 (22,1) | 11 (50,0) | 19 (16,7) | 86,6 | (61,7 - 115,5) | |
| B2M | 135 (91,2) | <0,001 | ||||
| ≤2,4mg/L | 94 (69,6) | 10 (47,6) | 84 (73,7) | 138,4 | (127,3 - 149,5) | |
| >2,4mg/L | 41 (30,4) | 11 (52,4) | 30 (26,3) | 94,7 | (70,9 - 118,5) | |
B2M: beta-2-microglobulina; Dx: diagnóstico; FT: foliculotropismo; LDH: lactato deshidrogenasa; MF: micosis fungoide; SS: síndrome de Sézary; TCG: transformación célula grande; TCRc: receptor de células T clonal.
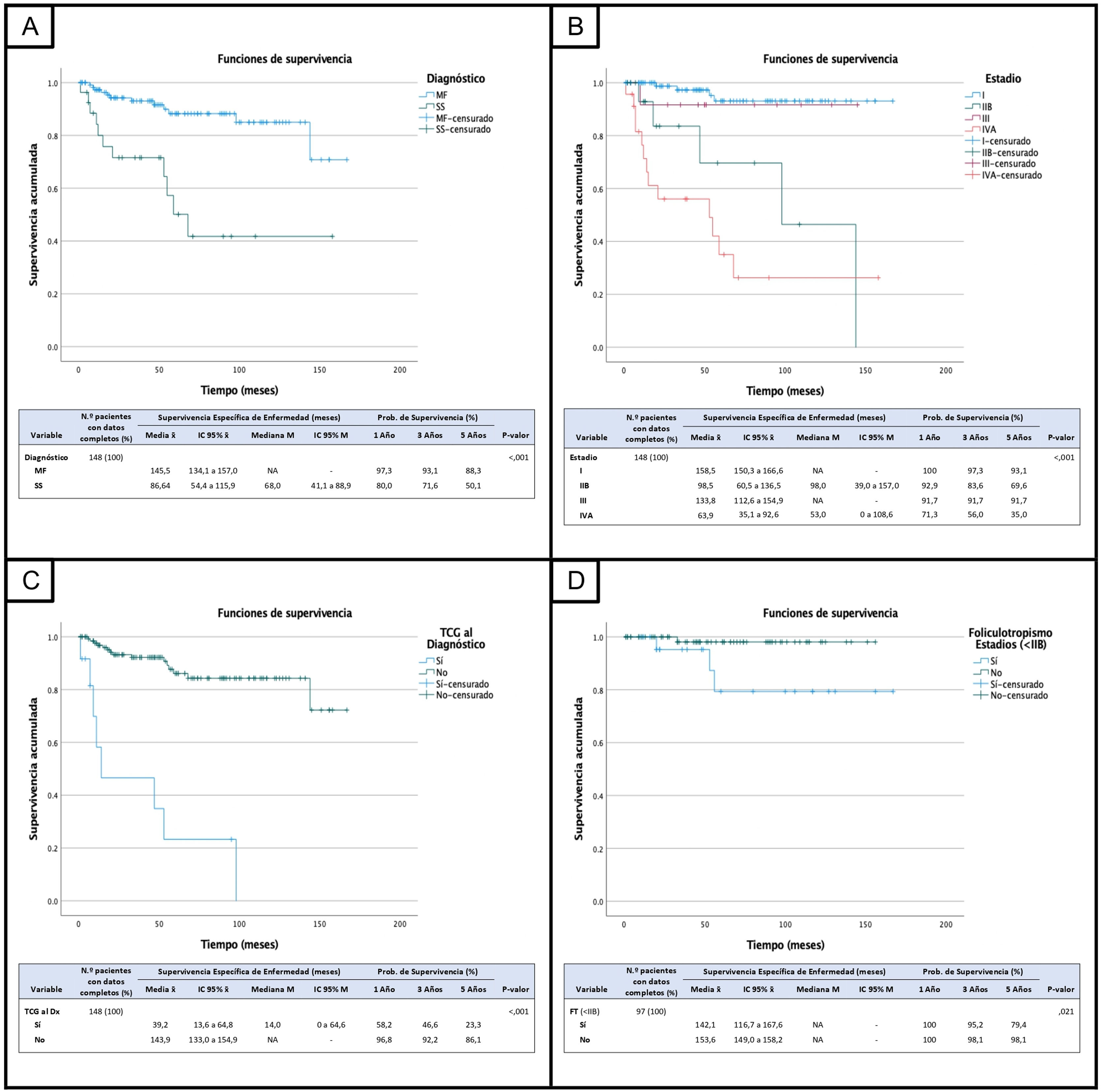
En el análisis univariante, la edad >60 años (52% de los casos) se asoció a una peor DSS con una media de supervivencia de 121 meses. No se encontraron diferencias en función del sexo. En cuanto al diagnóstico, el SS presentó peor evolución con una media de supervivencia de 86,6 meses y una probabilidad de supervivencia a los 5 años del 50%, comparado con el 88% en el grupo de MF (fig. 1A). No obstante, no se encontraron diferencias en cuanto a supervivencia comparando los pacientes con SS frente al grupo de las MF avanzadas. Respecto al estadio al diagnóstico, en la figura 1B se indica la media de DSS y la probabilidad de supervivencia a 1, 3 y 5 años para cada estadio. No se observaron diferencias estadísticamente significativas entre el estadio I y III, pero sí se observaron diferencias al compararlo con el estadio IIB y IVA. Respecto al estadio IVA, que incluye el IVA1 con afectación en sangre periférica B2 (mediana DSS 55 meses) y IVA2 en el caso de pacientes con afectación ganglionar N3 (mediana DSS 14 meses), no se encontraron diferencias entre ambos grupos. Sin embargo, al comparar la supervivencia de N3 y/o Nx (ganglios periféricos anómalos sin confirmación histológica) con la de N1 y/o N2 sí se evidenciaron diferencias. También se encontraron diferencias en la supervivencia entre los pacientes con afectación B2 (IVA), que mostraron un peor pronóstico (62,6 vs. 146,5 meses; p<0,001), que aquellos con B0 o B1.
Curvas y tablas de supervivencia específica de enfermedad (disease-specific survival [DSS]) de la cohorte de pacientes con MF/SS en las que se compara:
A) La DSS entre los pacientes con micosis fungoide (MF) y los pacientes con síndrome de Sézary (SS). B) La DSS entre estadios. C) La DSS entre pacientes con transformación a célula grande (TCG) al diagnóstico y los que no la presentaban. D) La DSS para la variable foliculotropismo (FT) entre los pacientes con un estadio menor de IIB.
En cuanto a los parámetros histológicos, la TCG se describió en el 19% de los pacientes en cualquier momento de la enfermedad y, de estos, el 43% de los casos fueron al diagnóstico. La presencia de TCG en el momento del diagnóstico demostró un efecto adverso significativo en la supervivencia de estos pacientes (fig. 1C). La presencia de FT (27% de los casos) no se asoció a una peor supervivencia sobre toda la cohorte, pero cuando se analizó sobre la población que empezó en estadios iniciales <IIB, se objetivó que los pacientes con FT presentaban una supervivencia significativamente inferior a los pacientes sin FT (fig. 1D). Por el contrario, el análisis sobre la población con estadios >IIB mostró que la población sin FT era la que presentaba una peor supervivencia. La tinción intensa de Ki-67 que se encontró en un 28% de los 108 casos estudiados, también se asociaba a peor supervivencia, con una media de 85,2 meses y una probabilidad de supervivencia a los 5 años del 50,6% en contraste con el grupo que presentó un Ki-67 leve, que fue del 92,4% (p<0,001); mientras que en la expresión de CD30 no se encontró dicha asociación. El fenotipo predominante de la serie fue CD4+ (83% de los casos) y los casos CD8+ y doble negativo CD-/CD8- suponían el 13% y el 5%, respectivamente. No se encontraron diferencias entre los diferentes fenotipos. Respecto al estudio de clonalidad, la clonalidad en piel que se documentó en el 80% de los casos estudiados no se asoció a una evolución desfavorable, mientras que los pacientes que presentaban clonalidad positiva en sangre (el 39% de los casos) mostraron una peor DSS que los pacientes sin clona (88,7 vs. 143,6 meses; p<0,001). En relación con los datos analíticos, la elevación de LDH (22%) y B2M (30%) también se asociaron a una peor supervivencia de la cohorte (p<0,001).
En el análisis multivariante, la TCG al diagnóstico (Hazard Ratio [HR] 10,41) y el estadio IVA (HR 6,29) fueron las variables que mostraron un efecto significativo independiente sobre la DSS (p<0,001).
DiscusiónDurante años se han intentado dilucidar aquellos factores o marcadores de mal pronóstico que se asocien a una elevada mortalidad, a baja supervivencia o a mayor riesgo de progresión de los linfomas6,7. En 2013, se propuso el CLIPI (Cutaneous Lymphoma International Prognostic Index), el primer índice pronóstico para linfoma cutáneo, que incluía como factores asociados a peor pronóstico en los estadios iniciales (sexo masculino, edad >60 años, placas, FT, N1/X) y para estadios avanzados (sexo masculino, edad >60 años, estadios B1/B2, N2/N3, afectación visceral) y en función de la puntuación se atribuía un bajo, intermedio o alto riesgo8. En 2015, el CLIC (Cutaneous Lymphoma International Consortium) emprendió un proyecto a gran escala denominado ProCLIPI (Prospective Cutaneous Lymphoma International Prognostic Index) diseñado para crear una base de datos internacional para LCCT con el objetivo a largo plazo de desarrollar un índice pronóstico para identificar aquellos pacientes con evolución desfavorable9,10. Se han publicado ya algunos estudios prospectivos, como el de Scarisbrick et al. que incluía casos avanzados de MF/SS, desarrollando un modelo de índice pronóstico con las variables estadio IV, edad >60 años, TCG y LDH aumentada6. La gran mayoría de estos factores, así como estos índices pronósticos, no han sido validados en la práctica clínica y hasta el momento el estadio (TNM) ha sido el marcador pronóstico de más valor predictivo4,11.
Este estudio pretende evaluar qué factores se asocian a un peor pronóstico y un mayor riesgo de progresión en una serie de 148 pacientes con MF/SS de un centro de referencia para linfoma cutáneo.
La edad avanzada (>60 años) ya se había asociado previamente con un peor pronóstico, especialmente en estadios avanzados3,6,12. Sin embargo, en esta cohorte no se pudieron evaluar otros factores, como comorbilidades y opciones de tratamiento limitadas. A pesar de que hubo un predominio de pacientes masculinos en el estudio, no se encontraron diferencias significativas en la supervivencia entre sexos.
El diagnóstico de SS se asoció con un peor curso de la enfermedad en comparación con la MF. Sin embargo, no se encontraron diferencias en cuanto a DSS entre la MF avanzada y el SS, lo cual sugiere que el estadio al inicio impacta más en el pronóstico que el tipo de diagnóstico. En concordancia con estos datos, en la figura 1B se muestra que al comparar estadios iniciales con estadio IIB y IVA se observaron diferencias estadísticamente significativas en la supervivencia. Dichas diferencias se asemejan a los datos previamente publicados donde se observan claras disimilitudes entre la mediana OS de estadios iniciales (IA-IIA) y estadios más avanzados (>IIB)1,3.
Entre los pacientes con eritrodermia, no se objetivaron diferencias en la supervivencia de los pacientes con afectación sanguínea de bajo nivel (IIIB) frente a aquellos sin (IIIA). En cambio, de acuerdo con los datos previamente publicados3,6,13, los pacientes con afectación B2 (IVA) mostraron un peor pronóstico (p<0,001) en contraste con aquellos con B0 o B1.
Además, no se evidenciaron diferencias en la supervivencia entre pacientes sin afectación ganglionar, aquellos con afectación N1 y N2, pero los pacientes con desaparición parcial o total de la arquitectura ganglionar (N3) mostraron una peor evolución. También se observó que los casos con ganglios patológicos sin estadificación (Nx) tenían un mayor riesgo de mortalidad, similar al riesgo de N3, confirmando datos recientemente publicados donde el aumento del tamaño de los ganglios linfáticos sólo mediante evaluación clínica (Nx) se asoció con un mayor riesgo de progresión12; destacando así la importancia de realizar biopsias de ganglios palpables para una correcta estadificación.
La presencia de TCG en el diagnóstico resultó ser un marcador histológico independiente de mal pronóstico, con una supervivencia aún peor que la reportada en otros estudios3,6,13,14. Además, como previamente se había descrito15, se observó que la TCG estaba más presente en estadios avanzados, predominando entre los pacientes con estadio IIIB y, específicamente, entre aquellos que poseían afectación cutánea en forma de tumor. El fenómeno de FT no mostró diferencias significativas en la supervivencia en la cohorte estudiada, pero su efecto parece variar según el estadio de la enfermedad, en concordancia con datos previamente publicados donde se objetivó que el FT actuaba como factor predictor de mala evolución en estadios tempranos8,16.
Los valores de Ki-67 y CD30 también se evaluaron, y Ki-67 intenso se asoció con un peor pronóstico, mientras que CD30 no mostró un efecto significativo. Contrariamente, Scarisbrick et al.6 objetivaron que la positividad de CD30 se asociaba a peor DSS en aquellos pacientes en fase tumoral T3, estrechamente relacionada con la TCG.
La clonalidad de las células T en piel no mostró efecto pronóstico en la supervivencia, sin embargo, sí se asoció a un peor pronóstico cuando se objetivaba TCR clonal en sangre (mediana de supervivencia 68 meses, p<0,001). De modo similar, Scarisbrick et al.6 observaron en su cohorte de MF/SS avanzada un 49% de coincidencia de clonas y una tendencia hacia una peor supervivencia en pacientes con clona sanguínea (49,8 meses), pero sin llegar a ser significativa.
Los niveles elevados de LDH y B2M se asociaron con un peor pronóstico en toda la cohorte. En la MF, varios estudios han objetivado que los niveles de LDH se asocian con un mal pronóstico en estadios avanzados6,13,17,18; sin embargo, el valor predictivo en estadios iniciales no es claro19. En nuestra cohorte, no se encontraron diferencias significativas en la supervivencia entre los fenotipos CD4+, CD8+ o doble negativos.
ConclusionesEn resumen, en este estudio se revisaron 148 casos diagnosticados de MF/SS y se observó que la edad >60 años, el diagnóstico de SS, la presencia de TCG al diagnóstico, el FT en estadios iniciales, un Ki-67 intenso, la presencia de TCR clonal en sangre, una LDH y B2M elevadas, y los estadios IIB, IVA, T3, T4 y N3/Nx fueron factores asociados a un peor pronóstico de la enfermedad. El estadio IVA y la presencia histológica de TCG de inicio representaron los dos factores predictivos independientes de pronóstico adverso para la MF/SS. Asimismo, la TCG fue la variable que produjo una disminución más acentuada de la supervivencia de los pacientes y estaba estrechamente relacionada con la afectación cutánea tumoral y el estadio IIB. Sin embargo, se necesitan más investigaciones para comprender mejor el impacto de estos factores en la supervivencia de estos pacientes.
LimitacionesSe trata de un estudio retrospectivo realizado en un solo centro, los resultados pueden carecer de generalización y no ser aplicables a otras poblaciones o regiones geográficas debido a posibles diferencias en la demografía y la atención médica. Además, la MF y el SS son patologías poco prevalentes, lo que dificulta la obtención de una muestra representativa y podría influir en la representatividad de los resultados. La falta de consideración de la variabilidad en los regímenes de tratamiento es otra limitación significativa, ya que estos tratamientos pueden afectar la progresión de la enfermedad y la supervivencia de los pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.


![Curvas y tablas de supervivencia específica de enfermedad (disease-specific survival [DSS]) de la cohorte de pacientes con MF/SS en las que se compara: A) La DSS entre los pacientes con micosis fungoide (MF) y los pacientes con síndrome de Sézary (SS). B) La DSS entre estadios. C) La DSS entre pacientes con transformación a célula grande (TCG) al diagnóstico y los que no la presentaban. D) La DSS para la variable foliculotropismo (FT) entre los pacientes con un estadio menor de IIB. Curvas y tablas de supervivencia específica de enfermedad (disease-specific survival [DSS]) de la cohorte de pacientes con MF/SS en las que se compara: A) La DSS entre los pacientes con micosis fungoide (MF) y los pacientes con síndrome de Sézary (SS). B) La DSS entre estadios. C) La DSS entre pacientes con transformación a célula grande (TCG) al diagnóstico y los que no la presentaban. D) La DSS para la variable foliculotropismo (FT) entre los pacientes con un estadio menor de IIB.](https://static.elsevier.es/multimedia/00017310/0000011500000008/v1_202409020432/S0001731023010086/v1_202409020432/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w9/t1/zx4Q/XH5Tma1a/6fSs=)



