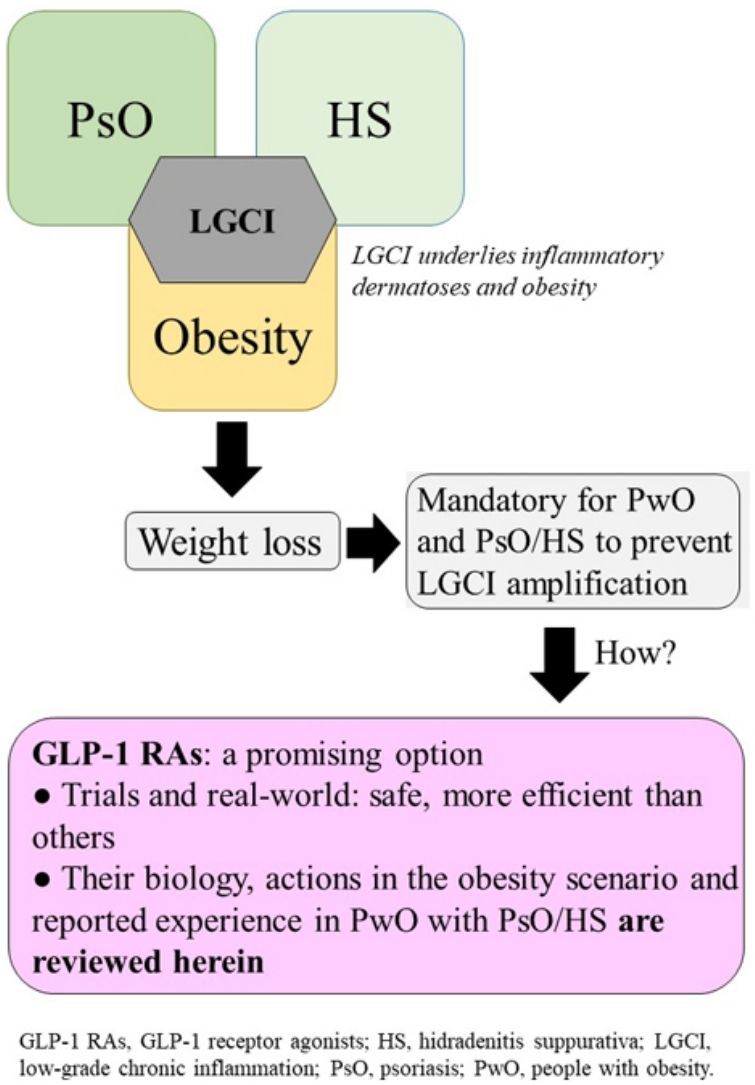
La psoriasis (PsO) y la hidradenitis supurativa (HS) se asocian frecuentemente con la obesidad. La inflamación crónica de bajo grado subyace a estas condiciones, por lo que si no se adoptan medidas para reducir el peso del paciente con obesidad y PsO o HS, estas podrían evolucionar hacia formas más graves. Este trabajo revisa las opciones farmacológicas para tratar la obesidad, profundizando en los beneficios asociados al uso novedoso de agonistas del receptor de GLP-1 (arGLP-1), que actúan sobre los centros de la saciedad. Los resultados de ensayos y vida real demuestran que esta medicación consigue mayores pérdidas de peso que orlistat, hasta recientemente el único fármaco específico para la obesidad comercializado en la Unión Europea. Aunque la experiencia con arGLP-1 en pacientes con obesidad y dermatosis inflamatorias es escasa, los resultados son alentadores, por lo que podrían constituir una herramienta útil para el manejo de su obesidad.
Psoriasis and hidradenitis suppurativa are often associated with obesity. Because chronic low-grade inflammation underlies these 2 diseases, they can progress to more severe forms in patients with obesity if weight-reduction measures are not taken. This review covers pharmacologic alternatives for treating obesity, with emphasis on the benefits associated with the novel use of glucagon-like peptide-1 (GLP-1) agonists that act on satiety receptors. These drugs have led to greater weight loss in clinical trials and real-world settings than orlistat, which until recently was the only drug approved for treating obesity in the European Union. Although experience with GLP-1 agonists in patients with obesity and inflammatory skin diseases is currently scarce, the promising results reported suggest they may offer a useful tool for managing obesity.
La obesidad es una comorbilidad frecuente en enfermedades inflamatorias crónicas como la psoriasis (PsO) y la hidradenitis supurativa (HS), en las que subyacen mecanismos patogénicos comunes muy relacionados con los que se encuentran en la obesidad. Es muy interesante determinar si las nuevas y eficaces alternativas terapéuticas que se están desarrollando para la obesidad permiten una disminución más eficaz del peso corporal, lo cual, a su vez, podría resultar beneficioso para la evolución de las dermatosis inmunomediadas.
La inflamación crónica de bajo grado y el desequilibrio inmunológico facilitan la asociación bidireccional entre obesidad y dermatosis inmunomediadasEl exceso de adiposidad disfuncional contribuye al estado inflamatorio que caracteriza al paciente con obesidad1–4. La inflamación de bajo grado subyace a la obesidad, PsO y la HS (Fig. S1 ver material adicional), por lo que cualquier intervención que atenúe los mecanismos que conducen a ese estado será positivo para cualquiera de las tres condiciones5,6. Los mecanismos que subyacen a la asociación bidireccional entre obesidad y patología inmunomediada7 no se conocen con exactitud, aunque se acepta la importancia del papel causal de la inflamación crónica y los trastornos inmunológicos (Fig. S2 ver material adicional)7,8.
La incidencia de PsO e HS se ha incrementado en los países occidentales en las últimas décadas9,10. La obesidad ha experimentado un aumento en paralelo, y podría ser responsable, al menos parcialmente, de dicho fenómeno8.
Psoriasis y obesidadExiste mayor prevalencia de obesidad en los pacientes con PsO que en la población general11–18. Por otro lado, la obesidad incrementa el riesgo de PsO6,19,20, cuya incidencia podría llegar al doble en los pacientes con obesidad de grado II/III con respecto a la de los sujetos con normopeso21. Entre los mediadores moleculares en la intersección entre ambas condiciones existen tres adipocinas: leptina, resistina y adiponectina, cuyos niveles condicionan la gravedad de la PsO en los pacientes con obesidad22–24.
Muchas complicaciones asociadas a la obesidad lo están también a la PsO. Existe mayor prevalencia de diabetes mellitus tipo 2 (DT2) en los pacientes con PsO que en la población general25. Además, la resistencia a la insulina induce dislipemia y contribuye al desarrollo de esteatosis hepática no alcohólica (EHNA)26. El riesgo cardiovascular (RCV) se incrementa en los pacientes con obesidad y PsO que presentan artritis psoriásica, en los que frecuentemente concurren también otros factores de riesgo27. Las guías de la Sociedad Europea de Cardiología plantean como objetivo que el índice de masa corporal (IMC) no supere los 25 kg/m228, por lo que el manejo precoz de la obesidad o sobrepeso asociados a la PsO podría contribuir a la prevención del RCV. Finalmente, la obesidad se asocia con peor respuesta a la farmacoterapia de la PsO (Tabla S1 ver material adicional)29,30.
Hidradenitis supurativa y obesidadExiste mayor prevalencia de obesidad en los sujetos con HS que en la población general31,32, y la HS e detecta con mayor frecuencia en niños con obesidad33. La asociación entre HS y obesidad, como sucedía con la PsO, también es bidireccional, con la inflamación de bajo grado como hilo conductor. El desequilibrio inflamatorio en la obesidad perpetúa la inflamación y la oclusión del folículo. Múltiples mecanismos moleculares, activados por mediadores inflamatorios, contribuyen a la progresión de la HS34,35.
La prevalencia de DT2 es mayor en los sujetos con HS que en la población general36. La HS también se asocia con otras condiciones clásicamente vinculadas con la obesidad, como el síndrome metabólico, el síndrome del ovario poliquístico o la enfermedad inflamatoria intestinal37–39, y los pacientes con HS están expuestos a un RCV superior al de la población general40. La obesidad perjudica la respuesta del paciente a los principales tratamientos de la HS (Tabla S1 ver material adicional)15.
Ventajas asociadas a la pérdida de peso en los pacientes con obesidad y psoriasis o hidradenitis supurativaAdemás de la mejor respuesta a los tratamientos de las dermatosis inflamatorias, otros argumentos justifican la conveniencia de la pérdida de peso para los pacientes con obesidad y PsO o HS.
- •
La pérdida de peso se asocia con una disminución de la gravedad de la PsO y mejor calidad de vida (CdV)41,42.
- •
Las pérdidas de peso superiores a 5% se asocian con una tasa mayor de actividad mínima de la enfermedad en pacientes con obesidad o sobrepeso tratados de su PsO43,44.
- •
La dieta mediterránea, que facilita la disminución del peso, reduce las lesiones psoriásicas45.
- •
La pérdida de peso en pacientes con HS conduce a una disminución relevante del número de lesiones y, en algunos casos, a la remisión de la enfermedad46.
- •
La adiposidad disfuncional se ha asociado con peores índices en la CdV, Dermatology Life Quality Index (DLQI), en pacientes con HS47.
- •
La disminución del tejido adiposo se asocia con una reducción de los mecanismos moleculares que caracterizan el estado inflamatorio sistémico48.
Dieta y ejercicio constituyen el primer escalón terapéutico que, sin embargo, resulta a menudo insuficiente para lograr una evolución favorable de la patología dermatológica, una buena respuesta a los tratamientos de esta o una reducción del RCV. Otra limitación es la pobre adherencia y altas tasas de abandonos49. Por ello, resulta conveniente explorar las opciones farmacológicas. La escasez de tratamientos capaces de lograr disminuciones significativas del peso, así como el riesgo de reganancia a partir de seis meses después de la intervención, han constituido un obstáculo para plantear el tratamiento de la obesidad en los pacientes con PsO o HS15.
Fármacos aprobados y comercializados en EspañaOrlistatEs un inhibidor de las lipasas gastrointestinales y pancreáticas que bloquea la hidrólisis de los triglicéridos y la absorción de ácidos grasos por el endotelio intestinal. Se asocia con frecuencia a eventos adversos (EA) gastrointestinales, lo cual dificulta la adherencia. Su efecto es modesto, con pérdidas de peso no superiores a 3% al cabo de 12 meses, tras los que, además, este se recupera parcialmente, aun cuando se continúe con la terapia50. No existen estudios que hayan analizado el efecto de orlistat en pacientes con obesidad y PsO o HS.
Agonistas del receptor de GLP-1Los agonistas del receptor del péptido-1 similar al glucagón (arGLP-1) han irrumpido recientemente como posible alternativa farmacológica para la pérdida de peso.
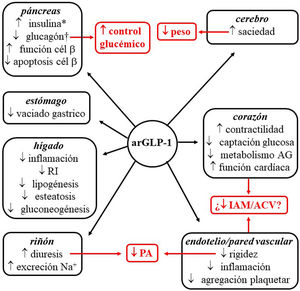
Indicaciones, acciones pleiotrópicasLos arGLP-1 son análogos de GLP-1, hormona peptídica intestinal de ∼3,3 kDa de la familia de las incretinas. Al unirse al receptor celular de GLP-1 ponen en marcha los mismos mecanismos moleculares que induce el péptido endógeno. La interacción se produce en diversos tejidos (páncreas, cerebro, miocardio, endotelio, riñón, sistema digestivo), lo que motiva que sus acciones, entre las que cabe destacar el control glucémico con mínimo riesgo de hipoglucemia, posean carácter pleiotrópico (fig. 1)51. Además, una serie de ensayos clínicos sugiere que los arGLP-1 podrían inducir protección cardiovascular52–55.
Efecto pleiotrópico de arGLP-1. Se enumeran los efectos de los arGLP-1 sobre diferentes órganos y, en rojo, sus consecuencias.
*Biosíntesis y secreción dependiente de glucosa. †Secreción dependiente de glucosa.
ACV: accidente cerebrovascular isquémico; AG: ácidos grasos; arGLP-1: agonistas del receptor de GLP-1; IAM: infarto agudo de miocardio; PA: presión arterial; RI: resistencia a la insulina.
Los arGLP-1 actualmente comercializados poseen, a excepción de dulaglutida, un peso molecular (PM) inferior a 5 kDa, y una vida media circulante superior a los cinco minutos de la molécula nativa de GLP-156. Núcleos cerebrales como el núcleo talámico paraventricular y el núcleo arcuato expresan receptores para GLP-1, aunque es el primero de ellos el que parece jugar un papel más relevante en el control de la ingesta alimentaria57,58. Los dos arGLP-1 con indicación para el tratamiento de la obesidad en la Unión Europea (UE), liraglutida (3 mg/día, administración subcutánea [s.c.]) y semaglutida (2,4 mg en una dosis semanal s.c.), poseen una homología>90% con la estructura del GLP-1 humano. Liraglutida posee una vida media de 13 h, y alcanza el tejido cerebral atravesando la barrera hematoencefálica. Se discute si esta acción la realiza mediante difusión pasiva o, por el contrario, requiere la interacción con el receptor de GLP-159-70. La molécula de semaglutida posee una cadena alifática más larga, que le confiere mayor hidrofobicidad. La incorporación de polietilenglicol no solo modifica su diana de hidrólisis por dipeptidil peptidasa-4, sino que incrementa su afinidad por la albúmina. Estas características posibilitan que su vida media circulante se alargue hasta las 165 h, y que, conjugada con la albúmina, acceda al tronco encefálico, núcleo septal e hipotálamo a través de los órganos circunventriculares60. Una vez que acceden a los centros de la saciedad, liraglutida y semaglutida actúan sobre las poblaciones de neuronas POMC y NPY/AgRP, implicadas en la actividad metabólica, y, mediante mecanismos todavía poco conocidos, consiguen que disminuya la sensación de apetito. Esta acción motiva que estos agentes constituyan una opción terapéutica para la pérdida de peso56. Aunque en menor medida, el retraso en el vaciamiento gástrico contribuye al efecto anorexígeno61.
Los ensayos clínicos llevados a cabo con arGLP-1 en pacientes con obesidad (o sobrepeso [IMC ≥ 27] con comorbilidades), o con DT2 y sobrepeso u obesidad, han logrado disminuciones del peso superiores a las documentadas con orlistat, así como a las observadas con antidiabéticos orales como los inhibidores del cotransportador sodio glucosa tipo 2 (iSGLT2) o la metformina62. En un metanálisis con más de 10.000 pacientes con obesidad se vio que los tratados con arGLP-1 perdían, en promedio, 7 kg más que los que integraban los grupos control63. Se han observado pérdidas de peso de hasta 15% tras 12 meses de tratamiento64,65, algo que solo se había logrado mediante abordajes quirúrgicos.
Posología, perfil de seguridadLos arGLP-1 con indicación para obesidad (o sobrepeso [IMC ≥ 27 kg/m2] más complicaciones) son de administración s.c., con periodicidad semanal o diaria. El uso de arGLP-1 se asocia con frecuencia a EA gastrointestinales, especialmente náusea, vómitos, diarrea o estreñimiento, transitorios y de intensidad de leve a moderada. Su aparición o gravedad pueden evitarse o mitigarse en buena medida si el escalado hasta la dosis de mantenimiento se realiza siguiendo las indicaciones, y si, mientras dure el tratamiento, se sigue una serie de pautas dietéticas y conductuales bien definidas66. En pacientes que se ciñen a estas recomendaciones, los EA pueden desaparecer tras pocos días o semanas67.
Argumentos a favor del uso de arGLP-1 para el control del peso corporal en los pacientes con obesidad y dermatosis inflamatoriasComo se ha dicho, la pérdida de peso influye positivamente en la evolución y respuesta a los tratamientos de la PsO y la HS. Es plausible especular con que los arGLP-1 podrían inducir pérdidas de peso mayores que las obtenidas con otras medidas terapéuticas, lo cual, además, podría mejorar la adherencia. Además, los arGLP-1 inducen efectos antiinflamatorios que podrían atenuar la inflamación de bajo grado que subyace a la obesidad, PsO y la HS (revisado recientemente en el contexto de la PsO y la artritis psoriásica)68. Finalmente, la mejora del control metabólico y la protección cardio-renal podrían resultar beneficiosas para reducir el RCV y manejar comorbilidades como la DT2 o el síndrome metabólico.
ArGLP-1 con indicación para obesidadComo se ha adelantado, existen dos arGLP-1 indicados para el tratamiento de la obesidad en la UE, en sujetos con IMC ≥ 30 kg/m2, o con IMC ≥ 27 kg/m2, y al menos una comorbilidad relacionada con el peso, siempre en combinación con una dieta apropiada y ejercicio físico: liraglutida 3 mg y semaglutida 2,4 mg. El segundo, aunque aprobado por la Agencia Europea de Medicamentos (EMA) y la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), no se ha comercializado todavía en España.
Liraglutida 3 mgSe administra por vía s.c. con periodicidad diaria. El programa de ensayos SCALE se diseñó para valorar, en pacientes con obesidad o sobrepeso (IMC ≥ 27 kg/m2) con comorbilidades, su eficacia y seguridad para la pérdida de peso. La tabla 1 expone los hallazgos más relevantes. En una cohorte de 3.731 pacientes se observaron pérdidas de peso de 5, 10 y 15% en 63, 33 y 14%, respectivamente, a las 56 semanas de iniciar el tratamiento (27, 11 y 4% con placebo)69, o de 6% a las 56 semanas en pacientes que ya habían perdido previamente otro 6% mediante dieta hipocalórica y ejercicio70. También se han obtenido resultados positivos en adolescentes con obesidad71, y en estudios de vida real se han documentado pérdidas de peso relevantes72–75.
Ensayos de fase 3 con arGLP-1 con indicación específica para obesidad y sobrepeso
| Ensayo | SCALE Obesity69 | SCALE Maintenance70 | STEP 177 | STEP 378 | STEP 476 |
|---|---|---|---|---|---|
| Duración (sem) | 56 | Preinclusión* + 56 | 68 | 68 | 68 |
| Grupos | Liraglutida 3 mg vs. Pl (2:1) | Liraglutida 3 mg vs. Pl (1:1) | Semaglutida 2,4 mg vs. Pl (2:1) | Semaglutida 2,4 mg vs. Pl (2:1) | Semaglutida 2,4 mg vs. Pl (2:1)† |
| Diseño | Aleatorizado/doble ciego | • Preinclusión: dieta + ejercicio• Sem 0-56: aleatorizado/doble ciego, liraglutida 3 mg o Pl | Aleatorizado/doble ciego | Aleatorizado/doble ciego | • Sem 0-20 (preinclusión):semaglutida• Sem 20-68: aleatorizado/dobleciego, semaglutida o Pl |
| Pacientes (n; IMCb) | 3.731; 38,3 kg/m2 | 422; 37,8 kg/m2 | 1.961; 37,9 kg/m2 | 611; 38,0 kg/m2 | 803; 38,4 kg/m2 |
| Pauta terapéutica | Liraglutida 3 mg SID vs. Pl (más hábitos de vida) | • Preinclusión: dieta hipocalórica + ejercicio• Sem 0-56: liraglutida 3 mg SID vs. Pl | Semaglutida 2,4 mg/sem vs. Pl (más hábitos de vida) | Semaglutida 2,4 mg/sem vs. Pl (+ hábitos de vida + dieta hipocalórica en sem 1-8) | • Sem 0-20: semaglutida 2,4 mg/sem• Sem 21-68: semaglutida 2,4 mg/sem vs. Pl |
| Pérdida de peso (%) | Liraglutida 3 mg: -8,0%, Pl: -2,6% | • Preinclusión:Liraglutida 3 mg: -5,9%,Pl -6%• Desde aleatorización hasta 56 sem después de ésta:Liraglutida 3 mg: -6,2%,Pl -0,2% | Semaglutida 2,4 mg: -14,9%, Pl: -2,4% | Semaglutida 2,4 mg: -16,0%,Pl: -5,7% | • Sem 0-68: semaglutida 2,4 mg:-17,4%, Pl: -5,0%• Sem 20-68: semaglutida 2,4 mg:-7,9%, Pl: + 6,2% |
| Abandono por EAs‡ | Liraglutida 3 mg: 9,9%,Pl: 3,8% | Liraglutida 3 mg: 8,5%, Pl 8,6% | Semaglutida 2,4 mg: 7,0%, Pl: 3,1% | Semaglutida 2,4 mg: 5,9%, Pl: 2,9% | • Sem 0-20: semaglutida 2,4 mg: 5,3%• Sem 20-68: semaglutida 2,4 mg: 2,4%, Pl: 2,2% |
Eas: eventos adversos; gr: grupo; IMCb: índice de masa corporal al inicio del ensayo; Pl: placebo; sem: semanas, semanal; SID: una vez al día.
En el periodo de preinclusión, todos los pacientes, independientemente de que más adelante se aleatorizaran a recibir lira o placebo, se sometieron a régimen de dieta hipocalórica y ejercicio, sin arGLP-1, siendo la duración de este periodo, para cada paciente, el tiempo requerido para perder ≥ 5% de su peso inicial.
En los ensayos STEP (tabla 1), diseñados para estudiar la eficacia y seguridad de semaglutida 2,4 mg (semanal, s.c.) en pacientes con obesidad, o sobrepeso (IMC ≥ 27 kg/m2) con complicaciones, se obtuvieron pérdidas de peso de entre 15 y 17% a las 68 semanas del inicio del tratamiento76–78. En uno de los ensayos se documentó una pérdida de 10% tras 20 semanas de terapia. Los sujetos que, en ese momento, cambiaron semaglutida 2,4 mg por placebo, habían recuperado la mitad del peso a las 48 semanas, mientras que, si el tratamiento se mantenía, se conseguía una pérdida de peso adicional de alrededor de 8% en ese tiempo. Tras 68 semanas con semaglutida 2,4 mg se documentaron pérdidas de 5, 10 y 15% en 88, 79 y 63% de pacientes, respectivamente76. Un reciente metanálisis concluye que semaglutida 2,4 mg y liraglutida 3 mg son más eficaces que naltrexona-bupropión (no comercializado en España) y orlistat79.
Experiencia con liraglutida y semaglutida en psoriasis e hidradenitis supurativaLiraglutida y psoriasisEn los estudios con liraglutida, los pacientes con PsO y obesidad presentaban diagnóstico de DT2, por lo que se han llevado a cabo con dosis no superiores a 1,8 mg, que son las indicadas para DT2. Aunque las series poseen tamaños muestrales limitados, los resultados son interesantes. En una cohorte de siete pacientes con DT2 y obesidad, el uso diario de liraglutida 1,2 mg logró, tras 10 semanas, una reducción del peso de 5% y una bajada del IMC de 2 kg/m280. En otro estudio, tres pacientes con DT2 y obesidad lograron una disminución del IMC de entre 0,8 y 3,8 kg/m2 tras 18 semanas con esa misma dosis de liraglutida81. Otros dos pacientes con obesidad y DT2 consiguieron pérdidas de peso de más de 5 kg y una disminución del IMC de 1,5 y 2 kg/m2 tras seis semanas de tratamiento82. Finalmente, en una serie de 20 sujetos con obesidad y DT2 se observó una pérdida promedio de 4,7 kg tras ocho semanas de tratamiento con liraglutida 1,8 mg83. En la mayor parte de estos pacientes se observaron mejoras en el índice de severidad del área de psoriasis (PASI) y, en ocasiones, disminución de las placas psoriásicas, lo que puede abrir la puerta a investigar si este tratamiento es capaz de inducir beneficios adicionales.
Semaglutida y psoriasisLa experiencia es limitada, e inexistente con la dosis de 2,4 mg. Se ha descrito el caso de un varón de 73 años con PsO, obesidad y DT2, en el que con 1 mg semanal de semaglutida se lograba, tras 10 meses, una disminución del IMC de 40,3 a 38,3 kg/m284.
Liraglutida e hidradenitis supurativaLa experiencia es muy limitada en HS. Se ha descrito el caso de una paciente de 19 años con HS y obesidad grado 2 que inició una terapia combinada con liraglutida 1,8 mg, metformina, levonorgestrel/etinilestradiol, dapsona y finasterida. Perdió 16 kg en los seis primeros meses, aunque fue recuperando peso progresivamente85. No se han descrito casos de tratamiento de la obesidad con semaglutida en pacientes con HS.
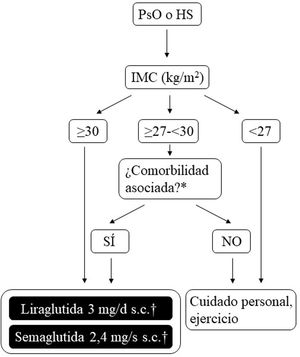
Posibilidades de uso de arGLP-1 en España para el tratamiento de la obesidadLa figura 2 plantea gráficamente las opciones existentes a día de hoy para el control del peso en España, que son aplicables a los pacientes que, además, sufren PsO o HS. Las dosis de liraglutida o semaglutida son diferentes en función de si el paciente tiene DT2 o si tiene sobrepeso (IMC ≥ 27 kg/m2) más comorbilidades u obesidad (con o sin DT2). Además, en pacientes con DT2 existe la posibilidad de utilizar semaglutida de administración oral. Los efectos de ésta sobre peso y glucemia en ensayos clínicos y en vida real son comparables a los inducidos por la formulación de uso s.c., aunque todavía no posee indicación específica para el control del peso sin DT286. De cara a evitar confusiones en la práctica clínica diaria, es importante puntualizar que liraglutida 3 mg y semaglutida 2,4 mg pueden utilizarse en pacientes con DT2, siempre y cuando estos presenten obesidad o sobrepeso más comorbilidades. Sin embargo, los pacientes con DT2 sin obesidad ni sobrepeso con comorbilidades, aunque pueden usar liraglutida 1,8 mg (diario, s.c.), y semaglutida 1 mg (semanal, s.c.) o 14 mg (diarios, oral) para su control glucémico, no deben ser tratados ni con liraglutida 3 mg ni con semaglutida 2,4 mg, porque estos no tienen indicación para esta condición. El motivo que subyace es que, ciñéndonos a las preparaciones de uso parenteral, las dosis eficaces de arGLP-1 necesarias para el control del peso corporal son mayores que las necesarias para el control glucémico.
Árbol de decisión para el uso de arGLP-1 con indicación para el control del peso en pacientes con obesidad o sobrepeso más comorbilidades. Se plantean las distintas posibilidades que varían según el paciente tenga obesidad (IMC ≥ 30 kg/m2) o sobrepeso (IMC ≥ 27-<30 kg/m2) más ≥ 1 comorbilidad asociada con el peso. Estas opciones terapéuticas pueden utilizarse para el control del peso en pacientes con dermatosis inmunomediadas que cumplan con los criterios que se acaban de describir. Semaglutida 2,4 mg, aunque cuenta con la aprobación de la EMA y la AEMPS, no se ha comercializado todavía en España.
*Al menos una comorbilidad relacionada con el peso: en el caso de liraglutida 3 mg, alteraciones de la glucemia (prediabetes o DT2), hipertensión, dislipidemia o apnea obstructiva del sueño; en el caso de semaglutida 2,4 mg, alteraciones de la glucemia (prediabetes o DT2), hipertensión, dislipidemia, apnea obstructiva del sueño o enfermedad cardiovascular.
† 3 mg, diaria, administración s.c., en monoterapia o asociada a otras medicaciones.
‡ 1,8 mg, diaria, administración s.c., en monoterapia o asociada a otras medicaciones.
AEMPS: Agencia Española de Medicamentos y Productos Sanitarios; arGLP-1: agonistas del receptor del péptido-1 similar al glucagón; DT2: diabetes mellitus tipo 2; EMA: Agencia Europea de Medicamentos; HS: hidradenitis supurativa; IMC: índice de masa corporal; MET: metformina; PsO: psoriasis; s.c.: subcutánea.
Tirzepatida, todavía no aprobada en la UE para uso específico en pacientes con obesidad, es un agonista dual de los receptores de GLP-1 y de otra incretina, el polipéptido inhibidor gástrico (GIP). En un ensayo de fase 3 en sujetos con obesidad o sobrepeso (IMC ≥ 27 kg/m2) más comorbilidades, su uso durante 18 meses consiguió disminuciones de peso que llegaron a 20,9%87.
Conclusiones- •
La inflamación de bajo grado subyace a obesidad y PsO/HS, y su evolución condiciona negativamente ambas condiciones.
- •
La pérdida de peso es beneficiosa para la evolución de PsO e HS, por la reducción del componente inflamatorio y del RCV.
- •
Los arGLP-1, al conseguir disminuciones del peso mayores que las obtenidas con otras medicaciones, pueden constituir una oportunidad terapéutica para mejorar la obesidad en los pacientes con PsO o HS, con la consiguiente reducción del RCV y, en general, mejoría de la evolución a medio o largo plazo.
- •
La formación de equipos multidisciplinares integrados por dermatólogos y endocrinólogos puede contribuir a un mejor manejo de los pacientes en los que concurren obesidad/sobrepeso y dermatosis inmunomediadas.
Laboratorios Novonordisk ha colaborado mediante la financiación de servicios de Medical Writing.
Conflicto de interesesEva Vilarrasa ha recibido honorarios por consultoría y/o como oradora y/o para viajes y/o ha participado en ensayos clínicos patrocinados por Abbvie, Almirall, Amgen, Boehringer Ingelheim, Bristol-Meyers Squibb, Celgene, Gebro, Isdin, Janssen, LEO Pharma, Lilly, Merck Serono, MSD, Novartis, Pfizer, Roche, Sandoz, Sanofi y UCB.
Joana Nicolau ha recibido honorarios por presentaciones y consultorías por parte de Sanofi, Novo Nordisk, Lilly, Boehringer-Ingelheim, Fresenius, AstraZeneca, Fresenius, Dexcom, Amgen y Senseonics.
Pablo de la Cueva ha participado como asesor y/o investigador y/o ponente con los siguientes laboratorios farmacéuticos: Abbvie, Almirall, BMS, Boehringer-Ingelheim, Celgene, Janssen Cilag, LEO Pharma, Lilly, MSD, Novartis, Novo Nordisk, Pfizer, Roche, Sanofi y UCB.
Albert Goday ha recibido honorarios por proyectos de investigación, consultoría, docencia de posgrado, y ha participado en ensayos clínicos patrocinados por Almirall, Ascensia, Colegio de Farmacéuticos de Barcelona, Esteve, Federación Farmacéutica, Fundación Catalana Síndrome de Down, Fundació Gol i Gorina, Instituto de Salud Carlos III, Jansen, Lilly, Menarini, MSD, Mutuam, Novo Nordisk, Pronokal, RedGDPS, Rovi, Sanofi Aventis.
Fernando Gallardo ha recibido honorarios como ponente, consultor o ayuda de asistencia a cursos y congresos y/o proyecots de investigación de compañias: Janssen, Abbvie, UCB, Amgen, Bristol, Lilly, Novartis, Almirall, Leo Pharma.
Antonio Martorell ha recibido honorarios y/o viajes subvenciones y/o ha actuado como miembro del consejo asesor de Novartis, Abbvie, Janssen Cilag, UCB, Lilly, LEO Pharma, L’Oreal, Sanofi, Boehringer Ingelheim, Almirall, Bristol Myers Squibb y Amgen. También ha trabajado como investigador principal en ensayos clínicos respaldados por Abbvie, UCB, Janssen, Bristol Myers Squibb, Lilly, Galderma, Sanofi y Novartis.
José Manuel Carrascosa ha participado como IP/SI y/o ponente invitado y/o advisor para Almirall, Janssen, Abbvie, UCB, Boehringer-Ingelheim, Lilly, Novartis, Amgen, BMS y Sandoz.