La dermatitis atópica (DA) es una enfermedad cutánea crónica caracterizada por brotes de lesiones eccematosas pruriginosas que implican un deterioro en la calidad de vida del paciente1,2. Su origen es multifactorial, encontrando dentro de su patogénesis una desregulación inmunitaria caracterizada por un incremento de la respuesta linfocitaria Th2 cutánea que ocasiona una elevación de interleucinas (IL): IL-4, IL-5, IL-13, IL-25 e IL-313.
Hasta la aparición del tratamiento biológico con el dupilumab en el 2007, el primer anticuerpo monoclonal contra IL-4/IL-13, el tratamiento de la DA moderada-grave suponía un reto terapéutico, derivado de la falta de fármacos eficaces con buen perfil de seguridad de forma prolongada1,2. Desde entonces, otros tratamientos dirigidos se han ido aprobando, entre los que destaca el tralokinumab (2021), un anticuerpo monoclonal dirigido contra IL-13 que impide su interacción con el receptor IL-13Rα1/IL-4Rα3–5. El objetivo de este estudio fue evaluar la efectividad y seguridad del tralokinumab en DA moderada-grave en la práctica clínica.
Se realizó un estudio descriptivo retrospectivo de todos los pacientes con DA moderada-grave refractaria a ciclosporina tratados con tralokinumab (vía subcutánea con dosis de inducción de 600mg seguido de 300mg cada 2 semanas) durante al menos 16 semanas desde junio de 2022 a febrero de 2023 en un hospital de tercer nivel de España. Los datos se recogieron a partir las historias clínicas electrónicas de los pacientes, incluyendo: sexo, edad, posología, duración del tratamiento y tratamientos previos. La efectividad se evaluó mediante las escalas SCORing Atopic Dermatitis (SCORAD) y Validated Investigator Global Assessment for Atopic Dermatitis (vIGA-ADTM) basal y a las 16 y 24 semanas6,7.
Las variables de resultado principales del estudio fueron la proporción de pacientes que alcanzó una respuesta entre 0 y 1 en la escala vIGA-AD (vIGA-AD 0-1) las semanas 16 y 24 de tratamiento, así como la reducción de al menos el 75% respecto a su valor basal en la escala SCORAD (SCORAD-75). Como variables secundarias se incluyeron la disminución de al menos el 90% respecto a su valor basal en la escala SCORAD (SCORAD-90), así como el «aclaramiento total de la enfermedad» o SCORAD de 0 (SCORAD-0) entre dichas semanas. Por último, se evaluó la seguridad del fármaco recogiendo todos los efectos adversos (EA) y sus suspensiones.
Se incluyeron 14 pacientes, cuyas características sociodemográficas y tratamientos previos se resumen en la tabla 1. Las medianas de las puntuaciones basales fueron: SCORAD-56 (rango 21-72) y vIGA-AD 4 (rango 1-4). La mediana de duración del tratamiento fue de 24 semanas (rango 16-32). Todos los pacientes se evaluaron en la semana 16. Sin embargo, en el momento del análisis, solo la mitad de los pacientes habían completado un tiempo suficiente de tratamiento que incluyera la evaluación de la semana 24 (7/13; 53,8%). Un paciente fue excluido por exitus no relacionado con la enfermedad estudiada.
Resultados de la cohorte analizada y resultados observados en los ensayos clínicos pivotales ECZTRA 1, ECZTRA 2 y ECZTRA 3
| Cohorte analizada | |||
|---|---|---|---|
| Total | 14 | ||
| Mujeres, n (%) | 8 (57,1) | ||
| Mediana y rango de edad (años) | 29 (18-85) | ||
| Tratamientos previos, n (%) | |||
| Corticoides tópicos | 14 (100) | ||
| Corticoides orales | 14 (100) | ||
| Antihistamínicos orales | 14 (100) | ||
| Ciclosporina oral | 11 (78,6) | ||
| Dupilumab | 3 (21,4) | ||
| Upadacitinib | 2 (14,2) | ||
| Escalas de gravedad basal, mediana (rango) | |||
| SCORAD basal | 56 (21-72) | ||
| vIGA-AD | 4 (1-4) | ||
| Pacientes evaluados estudio, n (%) | 13 (92,9) | ||
| Motivos de exclusión evaluación, n (%) | |||
| Exitus causa ajena tratamiento | 1 (7,1) | ||
| Evaluación eficacia tratamiento, n (%) | Semana 16 (n=13) | Semana 24 (n=7) | |
| SCORAD-75 | 11 (84,6) | 5 (71,4) | |
| SCORAD-90 | 3 (23,1) | 2 (28,6) | |
| vIGA-AD 0-1 | 11 (84,6) | 5 (71,4) | |
| Aclaramiento total | 1 (7,7) | 2 (28,6) | |
| Efectos adversos, n (%) | |||
| Xeroftalmia y prurito ocular | 5 (38,4) | ||
| Reacción punto inyección | 2 (13,4) | ||
| Suspensión tratamiento, n (%) | 3 (23,1) | ||
| Falta de eficacia | 2 (15,4) | ||
| Efectos adversos | 1 (7,7) | ||
| Resultados observados en ensayos clínicos, % | ECZTRA 1 | ECZTRA 2 | ECZTRA 3 |
| vIGA-AD 0-1 en semana 16 | 15,8 | 22,2 | 21,4 |
| Efectos adversos | 76,4 | 66 | 67,9 |
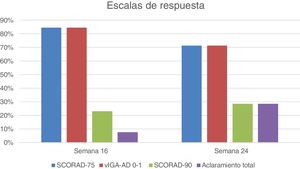
En relación con las variables principales, en la semana 16, 11 pacientes (11/13; 84,6%) alcanzaron una respuesta de vIGA-AD 0-1, así como un SCORAD-75 (Gráfica 1). En la semana 24, 5 de los 7 pacientes evaluados (5/7; 71,4%) alcanzaron vIGA-AD 0-1 y SCORAD-75. Respecto a las variables secundarias, 3 pacientes alcanzaron SCORAD-90 en la semana 16 (3/13; 23,1%) y 2 en la semana 24 (2/7; 28,6%). Un paciente (1/13; 7,7%) y 2 pacientes (2/7; 28,6%) lograron aclaramiento total en las semanas 16 y 24, respectivamente. Tres pacientes (3/13; 23,1%) suspendieron el tralokinumab, 2 de ellos (2/13; 15,4%) por ineficacia tras una mediana de tiempo de tratamiento de 7 meses (rango 5-9) y uno (1/13; 7,7%) por una reacción en la zona de inyección.
La mitad de los pacientes (7/13; 53,8%) presentaron algún EA, siendo la mayoría de carácter leve. Cinco (5/13; 38,4%) refirieron xeroftalmia y conjuntivitis, bien toleradas con medidas sintomáticas, y 2 (2/13; 13,4%) presentaron una reacción en la zona de inyección.
El tralokinumab demostró eficacia y seguridad en la DA moderada-grave en ensayos clínicos (ECZTRA 1, ECZTRA 2, ECZTRA 3)8,9. Existen pocos estudios a largo plazo de su uso en práctica clínica (tabla 2), cuyos resultados son equiparables a los observados en nuestro estudio5–7. La mayoría de los pacientes respondieron en 16 semanas, manteniéndose hasta la semana 24. Solo un 15% requirió suspender el tralokinumab por ineficacia. La tolerancia fue adecuada, con la mitad presentando EA leves principalmente oculares, siendo manejados sintomáticamente. Un único caso requirió de la suspensión del tratamiento por una reacción en el lugar de inyección.
Eficacia y seguridad visualizada en estudios de experiencia en vida real de tralokinumab para dermatitis atópica moderada-grave publicados hasta la fecha
| Estudio | N | Eficacia media | Seguridad | ||
|---|---|---|---|---|---|
| Basal | Primera evaluación | Segunda evaluación | |||
| Pezzolo y Naldi1 | 12 | Media (rango)EASI 27,58 (20-35) | Semana 12:EASI 4,67 (0-13) ➔ reducción media 80%EASI 75: 100% | No evaluado | No EA observados |
| PP-NRS 8,42 (7-10) | PP-NRS 2,92 (0-5) ➔ reducción media 60% | ||||
| S-NRS 7 (3-10) | S-NRS 1,92 (0-5) ➔ reducción media 70% | ||||
| Moennig y Traidl2 | 1 | EASI 9,4 | Semana 12:EASI 3,5 (65% reducción) | Semana 38:EASI 2,3 (75,5% reducción) | Exacerbación DA tras vacuna COVID-19 en semana 18No alteraciones tras infección por COVID-19 |
| SCORAD 34,5 | SCORAD 15,8 | SCORAD 15 | |||
| DLQI 34 | DLQI 16 | DLQI 3 | |||
| IGA 4 | IGA 2 | IGA 2 | |||
| Schlösser et al.3 | 37 | Mediana (RI)IGA 2 (1-4)Respondedores: 2 (1-4)No respondedores: 3 (2-4) | Última visita (entre semanas 12-24)IGA 2 (1-4)Respondedores: IGA 2 (1-3)No respondedores IGA 2 (2-4) | Recogidos todos los datos juntos como «último registro médico de última visita», todas ellas entre semanas 16-24 | Conjuntivitis 24%, controlados con tratamiento sintomáticoPérdida de pelo 5%Dermatitis cuero cabelludo 3%Reacción inyección 2,35% ➔ suspensiónMonoartritis 2,35% ➔ suspensiónBlefaritis anterior 2,35% ➔ suspensiónSuspensión por ineficacia 32,4%Suspensión por EA 8,10% |
| PP-NRS 6 (1-10)Respondedores: 5 (1-8)No respondedores 7 (4-10) | PP-NRS 5 (3-10)Respondedores: PP-NRS 2 (0-8)No respondedores PP-NRS 8 (3-10) | ||||
| De Greef et al.4 | 21 | Mediana (±RI)EASI 71,6 (±15,9) | Semana 16:Mediana (±RI)EASI 1,8 (±6,1) ➔ reducción mediana −85% (±19,2)EASI 50: 76,2%EASI 75: 66,7%EASI 90: 28,6%EASI 75 pacientes sin tratamiento adicional: 52% | No evaluado | Al menos un EA: 52,4%Brotes de eccema 23,8%Reacción sitio de inyección 19%Discontinuación tratamiento 19%: 9,5% ineficacia y 9,5% reacción inyecciónConjuntivitis 0%EA graves: 0% |
| SCORAD 58,9 (±21,8) | SCORAD 25,1 (±18,8) ➔ reducción mediana −64,7% (±37,3)SCORAD 50: 47,6%SCORAD 75: 23,8%SCORAD 90: 0% | ||||
| DLQI 12 (±10) | DLQI 2 (±9) ➔ reducción mediana −75% (±73,3) | ||||
| PP-NRS 8 (±1) | PP-NRS 3 (±4) ➔ reducción mediana −57,1% (±50) | ||||
| Gargiulo et al.5 | 10 | Mediana (±RI)EASI 20 (±8) | Semana 16:Mediana (±RI)EASI 3,1 (±3,35)EASI 50: 100%EASI 75: 70% | No evaluado | No EA graves10% nasofaringitisNo discontinuaciones derivadas de EA |
| PP-NRS 9 (±1,5) | PP-NRS 4,5 (±3) ➔ reducción en≥4 puntos: 70% | ||||
| S-NRS 7 (±1,1) | S-NRS 2 (±4) ➔ reducción en≥4 puntos: 50% | ||||
| ADCT 16 (±2,75) | ADCT 5,5 (±2) ➔ reducción a puntuación≤7: 80% | ||||
| IGA≥3: 100% | IGA 0/1: 30% | ||||
| Pezzolo et al.6 | 107 | MediaEASI 24 | Semana 32:MediaEASI 1,6 ➔ reducción media del 93,4%EASI 50: 100%EASI 75: 95,1%EASI 90: 73,8% | Semana 52:MediaEASI 1,1➔ reducción media del 95,5%EASI 50: 100%EASI 75: 95,4%EASI 90: 95,4% | Reacción punto de inyección 2,9%Psoriasis 1,2% (suspensión)Conjuntivitis 1,7% y 0,6% suspensión temporalVirus herpes 0,6%Eritrodermia 0,6%Ineficacia y suspensión 1,17%Suspensión por mejoría 0,6%Suspensión por embarazo 0,6% |
| PP-NRS 7,7 | PP-NRS 1,6 ➔ reducción media del 79,2% | PP-NRS 1,3 ➔ reducción media del 83,1% | |||
| S-NRS 6,1 | S-NRS 0,7 ➔ reducción media del 88,5% | S-NRS 0,8 ➔ reducción media del 86,8% | |||
| DLQI 13,2 | DLQI 2,4 ➔ reducción media del 81,8% | DLQI 1,5 ➔ reducción media del 88,6% | |||
| Pezzolo et al.7 | 17 | Fenotipo tipo prurigo nodular-likeMedia (rango)EASI 27,2 (16-45) | Fenotipo tipo prurigo nodular-likeSemana 12:EASI 50: 100%EASI 75: 100% | Fenotipo tipo prurigo nodular-likeSemana 32:EASI 1,7EASI 50: 100%EASI 75: 100%EASI 90: 100% | Conjuntivitis leve 12%Reacción inyección localUrticaria localizadaEstomatitis herpética suave |
| IGA 3,7 (3-4) | IGA 0/1: 47% | IGA 0/1 70% | |||
| PP-NRS 9,8 (8-10) | Reducción media del 60% | Reducción media del 95% | |||
| S-NRS 8,9 (6-10) | Reducción media del 85% | Reducción media del 95% | |||
| DLQI 16,3 (14-24) | Reducción media del 70% | Reducción media del 85% | |||
| García Castro et al.8 | 15 | Media (rango)EASI 22 (1-45) | Semana 16:EASI 75: 60%EASI 90: 27%EASI 100: 6,67% | No evaluado | Ojo seco leve 7%Blefaroconjuntivitis 7% |
| IGA basal no conocido | IGA 0/1: 33% | ||||
| PP-NRS basal no conocido | PP-NRS mejoría en al menos 4 puntos: 33% | ||||
| Pereyra-Rodríguez et al.9 | 85 | Media (±DE)EASI 25,4 (±8,1)Pacientes naive tratamientos biológicos: EASI 24,6Pacientes no naive: EASI 27,2 | Semana 16:Media (±DE)EASI 7,5 (±6,9) ➔ reducción media del 70%EASI 50: 82%EASI 75: 58%EASI 90: 21%Pacientes naive de terapia con biológicos:EASI 6,3EASI 75: 67%Pacientes no naive de terapia con biológicos:EASI 10,2EASI 75: 41% | No evaluado | Conjuntivitis 6% ➔ 1,17% suspendió tratamientoCara roja 6%Empeoramiento lesiones DA 4%Reacción inyección local 2,35%Depresión/ansiedad 2,35%Artralgia 1,17%Herpes corneal 1,17%Dolor menstrual 1,17%Infección vías altas 1,17%Episodios sincopales 1,17% |
| SCORAD 55,8 (±13,3) | SCORAD 20,0 (±14,78) ➔ reducción media del 64% | ||||
| DLQI 15,8 (±5,4) | DLQI reducción media −64% | ||||
| PP-NRS 8,1 (±1,8) | PP-NRS 3,5 (±2,4) ➔ reducción media del 57% | ||||
| IGA 4: 55% de los pacientes | IGA 0/1: 19% | ||||
| De Greef et al.10 | 14 | Estudio adolescentesMediana (±RI)EASI 24,3 (±8,4) | Estudio adolescentesSemana 12-16EASI 50: 71,4%EASI 75: 28,6% | No evaluado | Brotes de dermatitis atópica 50%Reacción punto inyección 14,3% ➔ 6,66% suspensión por dicho motivo6,66% suspensión por ineficacia |
| PP-NRS 8,0 (±2,0) | PP-NRS mejoría en al menos 4 puntos: 42,8% | ||||
| Estudio actual | 14 | Media (rango)SCORAD 56 (21-72) | Semana 16:SCORAD 75: 84,6%SCORAD 90: 23,1% | Semana 24:SCORAD 75: 71,4%SCORAD 90: 28,6% | Xeroftalmia y prurito ocular 38,4%Reacción punto de inyección 13,4% (7,7% motivo de suspensión fármaco)Falta eficacia y suspensión 14,5% |
| IGA 4 4 (1-4) | IGA 0/1 84,6% | IGA 0/1 71,4% | |||
| Aclaramiento total 0% | Aclaramiento total 7,7% | Aclaramiento total 28,6% | |||
Presentamos los diferentes estudios en práctica de vida real de tralokinumab disponibles tras realizar búsqueda bibliografía en PubMed bajo los criterios de «Tralokinumab» y «Real life» o «Clinical practice». Los estudios realizados en práctica de vida real cuyos objetivos principales fueron la valoración de respuesta de conjuntivitis derivada de dupilimab tras cambio a tralokinumab no fueron incluidos. Los objetivos de cada estudio, las características de los pacientes y su modo de evaluación difieren, complicando la comparación entre los mismos. Sin embargo, se puede visualizar una eficacia similar en todos ellos, con buen perfil de seguridad para tralokinumab en el uso de DA moderada-grave.
ADCT: Atopic Dermatitis Control Tool; DE: desviación estándar de la media; DLQI: Dermatology Life Quality Index; EA: efecto adverso; EASI: Eczema Area and Severity Index; IGA: Investigator's Global Assessment; PP-NRS: Peak Pruritus Numerical Rating Scale; RI: rango intercuartílico; SCORAD: SCORing Atopic Dermatitis; S-NRS: Sleep-Numerical Rating Scale.
Referencias de la tabla:
Pezzolo E, Naldi L. Tralokinumab in the treatment of resistant atopic dermatitis: An open-label, retrospective case series study. J Eur Acad Dermatol Venereol. 2023;37:e644-e645.
Moennig E, Traidl S. Real-world experience with tralokinumab in a patient with recalcitrant atopic dermatitis: A case report. Clin Cosmet Investig Dermatol. 2022;15:2825-2830.
Schlösser AR, Shareef M, Olydam J, et al. Tralokinumab treatment for patients with moderate-to-severe atopic dermatitis in daily practice. Clin Exp Dermatol. 2023;48:510-517.
De Greef A, Ghislain PD, Bulinckx A, et al. Real-life experience of tralokinumab for the treatment of adult patients with severe atopic dermatitis: A multicentric prospective study. Clin Drug Investig. 2023;43:299-306.
Gargiulo L, Ibba L, Vignoli CA, et al. Tralokinumab rapidly improves subjective symptoms and quality of life in patients with moderate-to-severe atopic dermatitis: A real-life 16-week experience. J Dermatolog Treat. 2023;34:2216815.
Pezzolo E, Schena D, Gambardella A, et al. Survival, efficacy and safety of tralokinumab after 32 and 52 weeks of treatment for moderate-to-severe atopic dermatitis in adults: A multicentre real-world study. J Eur Acad Dermatol Venereol. 2024;38:e11-e13.
Pezzolo E, Gambardella A, Guanti M, et al. Tralokinumab shows clinical improvement in patients with prurigo nodularis-like phenotype atopic dermatitis: A multicenter, prospective, open-label case series study. J Am Acad Dermatol. 2023;89:430-432.
García Castro R, Heras Mendaza F, Santiago Sánchez-Mateos DI, et al. First short-term effectiveness and security data of tralokinumab in severe atopic dermatitis in real clinical practice [published online ahead of print, 2023 May 2]. Dermatitis. 2023. doi: 10.1089/derm.2023.0030.
El valor que aporta este estudio se fundamenta en la necesidad de datos en la práctica clínica del tralokinumab en DA moderada-grave, siendo el segundo más grande en realizarse en nuestro país y el de mayor tiempo de valoración de respuesta, evaluando a pacientes hasta la semana 24 de tratamiento10. Las limitaciones de nuestro estudio radican en el pequeño tamaño muestral. Futuros estudios deberán evaluar la respuesta de tralokinumab en la práctica clínica con una población más amplia y periodos de seguimiento más prolongados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.